БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 15. ПЕНТОЗОФОСФАТНЫЙ ПУТЬ И ГЛЮКОНЕОГЕНЕЗ
15.20. Субстратные циклы амплифицируют метаболические сигналы и образование тепла
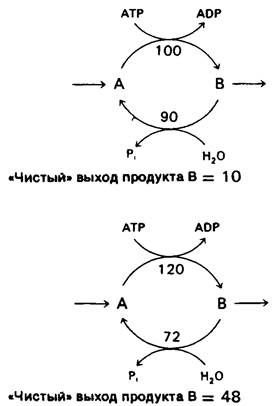
Пара реакций, таких, как фосфорилирование фруктозо-6-фосфата во фруктозо-1,6- бисфосфат и обратный гидролиз последнего до фруктозо-6-фосфата, называется субстратным циклом. Как уже упоминалось, в большинстве клеток эти реакции никогда не осуществляются с максимально возможной скоростью одновременно в силу реципрокного аллостерического контроля. Однако исследования с применением изотопной метки показали, что в ходе глюконеогенеза имеет место фосфорилирование фруктозо-6-фосфата во фруктозо-1,6-бис-фосфат. Ограниченное функционирование таких циклов обнаружено и в случае других пар противоположно направленных необратимых реакций. Наличие таких циклов объясняли несовершенством метаболической регуляции, и субстратные циклы называли иногда бесполезными, или холостыми, циклами. Однако в настоящее время представляется более вероятным, что субстратные циклы имеют определенное биологическое значение. Одна из возможностей состоит в том, что эти циклы амплифицируют биологические сигналы. Предположим, что скорость превращения А в В равняется 100, а В в А-90, так что начальный «чистый» выход реакции составляет 10. Примем, что аллостерический эффектор повышает скорость реакции А → В на 20% (до 120) и реципрокно снижает скорость реакции В → А на 20% (до 72). Новый «чистый выход» равен 48. Таким образом, изменение на 20% скоростей противоположно направленных реакций приводит к повышению «чистого выхода» процесса на 480%. В примере, представленном рис. 15.7, такая амплификация достигается путем гидролиза АТР.
Рис. 15.7. Пример стимулированного АТР субстратного цикла, функционирующего с двумя различными скоростями. Небольшое изменение скоростей двух противоположно направленных реакций приводит к значительному изменению чистого выхода продукта В
Другая потенциальная биологическая роль субстратных циклов состоит в том, чтобы генерировать тепло, продуцируемое при гидролизе АТР. Ярким примером такого феномена служат шмели, которым для полета необходимо поддерживать температуру грудного отдела около 30°С. Шмели способны поддерживать такую высокую температуру грудного отдела и осуществлять поиск пищи даже при температуре всего 10°С, потому что их летательная мышца обладает высокой активностью и фосфофруктокиназы, и фруктозобисфосфатазы. Поскольку эта фруктозобисфосфатаза не ингибируется АМР, есть основание думать, что данный фермент специально предназначен для генерирования тепла. В летательной мышце медоносной пчелы в отличие от мышцы шмеля фруктозобисфосфатазная активность почти отсутствует, и в соответствии с этим пчела не может летать при низкой окружающей температуре. Слишком большая скорость цикла фруктозо-6-фосфат фруктозо-1,6-бисфос- фат может вызывать избыточное образование тепла. Такое состояние, называемое злокачественной гипертермией, вызывается анестетиком галотаном у чувствительной к нему линии свиней.
15.21. Лактат, образованный сокращающейся мышцей, превращается в печени в глюкозу
Основным сырьем для глюконеогенеза является лактат, образованный активной скелетной мышцей. В сокращающейся скелетной мышце при анаэробных условиях скорость образования пирувата в ходе гликолиза превышает скорость его окисления в цикле трикарбоновых кислот. Более того, скорость образования NADH при гликолизе выше, чем скорость его окисления в дыхательной цепи. Продолжение гликолиза зависит от наличия NAD+ для окисления глицеральдегид-3-фосфата, а генерирование NАD+ осуществляется лактат-дегидрогеназой, которая, восстанавливая пиру ват в лактат, окисляет NADH в NАD+.
Лактат-это тупик в метаболизме. Для дальнейших метаболических превращений он должен быть сначала снова превращен в пируват.
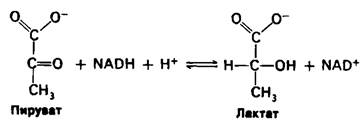
Единственная цель восстановления пирувата в лактат-это регенерирование NАD+, необходимого для осуществления гликолиза в активной скелетной мышце. Образование лактата занимает время и перекладывает часть метаболической нагрузки с мышц на печень.
Плазматические мембраны большинства клеток обладают высокой проницаемостью для лактата и пирувата. Оба соединения диффундируют из активной склетной мышцы в кровь и переносятся в печень. При этом переносится значительно больше лактата, чем пирувата, из-за высокого значения отношения [NADH]/[NAD+] в сокращающейся скелетной мышце. Лактат, поступивший в печень, окисляется в пируват, чему благоприятствует низкое отношение [NADH]/[NAD+] в цитозоле печени, Пируват затем превращается в печени в глюкозу по пути глюконеогенеза. Глюкоза поступает далее в кровь и поглощается скелетными мышцами. Таким образом печень снабжает глюкозой сокращающиеся мышцы, которые получают АТР в результате гликолитического превращения глюкозы в лактат. Затем происходит синтез глюкозы из лактата в печени. Эти превращения составляют цикл Кори (рис. 15.8).
Рис. 15.8. Цикл Кори. Лактат, образованный активной мышцей, превращается в печени в глюкозу. Этот цикл передает часть метаболического «груза» активной мышцы в печень
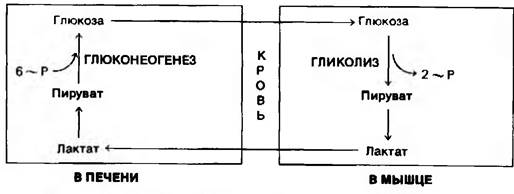
[NADH]/[NAD+] в сокращающейся скелетной мышце. Лактат, поступивший в печень, окисляется в пируват, чему благоприятствует низкое отношение [NADH]/[NAD+] в цитозоле печени, Пируват затем превращается в печени в глюкозу по пути глюконеогенеза. Глюкоза поступает далее в кровь и поглощается скелетными мышцами. Таким образом печень снабжает глюкозой сокращающиеся мышцы, которые получают АТР в результате гликолитического превращения глюкозы в лактат. Затем происходит синтез глюкозы из лактата в печени. Эти превращения составляют цикл Кори (рис. 15.8).
Описанные процессы облегчаются различиями в каталитических свойствах лактатдегидрогеназ в мышцах и печени. Лактатдегидрогеназа представляет собою тетрамер из субъединиц мол. массой 35 кДа. Существуют два вида полипептидных цепей, обозначаемых М и Н, которые могут образовывать пять типов тетрамеров: М4, М3Н, М2Н2, М1Н3 и Н4. Эти формы называются изоферментами (или изозимами). Изофермент М4 обладает значительно большим сродством к пирувату, чем изофермент Н4, остальные изоферменты имеют промежуточную активность. Изоферменты лактат-дегидрогеназы подвергались интенсивному изучению, однако причина существования множественных форм фермента до сих пор является загадкой.