БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 16. ГЛИКОГЕН И ОБМЕН ДИСАХАРИДОВ
16.11. Фосфорилаза активируется путем фосфорилирования специфического остатка серина
Фосфорилаза скелетных мышц существует в двух взаимопревращающихся формах: активная фосфорилаза а и обычно неак тивная фосфорилаза b (рис. 16.5). Фермент представляет собою димер, мол. масса субъединиц которого равна 92 кДал. Фосфорилаза b превращается в фосфорилазу а путем фосфорилирования одного остатка серина (серина-14) в каждой субъединице. Эта ковалентная модификация катализируется специфическим ферментом киназой фосфорилазы, который был открыт Эдмондом Фишером (Edmond Fischer) и Эдвином Кребсом (Edwin Krebs). Фосфорилаза а инактивируется специфической фосфатазой, гидролизующей фосфорильную группу, присоединенную к серину-14.
Рис. 16.5. Схематическое изображение регуляции гликоген-фосфори- лазы в скелетных мышцах. Фермент может принимать каталитически неактивную Т (напряженную) конформацию или активную R (релаксированную) конформацию. Равновесие R ⇄ T для фосфорилазы а сдвинуто далеко в сторону активного R-coстояния, В противоположность этому фосфорилаза b находится преимущественно в неактивном Т-состоянии, исключая случаи, когда содержание АМР находится на высоком уровне, а содержание АТР и глюкозо-6-фосфата - на низком. При большинстве физиологических состояний доля активного фермента определяется скоростями фосфорилирования и дефосфорилирования
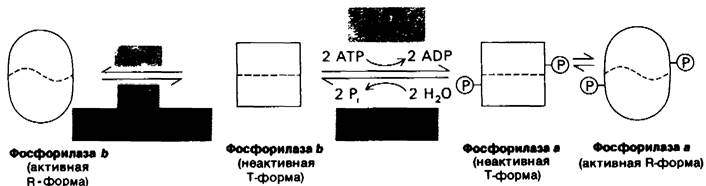
Мышечная фосфорилаза b активна только в присутствии высоких концентраций АМР, действующих аллостерически. АМР связывается с центром связывания нуклеотида и изменяет конформацию фосфорилазы b. АТР действует как отрицательный аллостерический эффектор, конкурируя с АМР. Глюкозо-6-фосфат также ингибирует фосфорилазу bпреимущественно путем связывания с другим активным центром. При большинстве физиологических состояний фосфорилаза b неактивна вследствие ингибирующего действия АТР и глюкозо-6-фосфата. В противоположность этому фосфорилаза а полностью активна независимо от содержания АМР, АТР и глюкозо-6-фосфата. Доля активного фермента определяется прежде всего скоростями фосфорилирования и дефосфорилирования. В неработающей мышце почти весь
фермент находится в неактивной b-форме. Как будет указано в следующем разделе, повышенное содержание адреналина и электростимуляция мышцы приводят к образованию активной а-формы.
16.12. Трехмерная структура гликоген-фосфорилазы
Рентгенокристаллографические исследования а- и b-форм гликоген-фосфорилазы значительно облегчили изучение каталитических и регуляторных механизмов этого ключевого фермента метаболизма. 841 аминокислотный остаток мономерной субъединицы компактно упакованы в три структурных домена (рис. 16.6): аминокон-
цевой домен (310 остатков), гликоген-связывающии домен (160 остатков) и карбокси- концевой домен (371 остаток). Каталитический центр локализован в глубокой щели, образованной остатками аминокислот каждого из этих трех доменов. Такая защита активного центра от водной среды должна, очевидно, благоприятствовать преобладанию фосфоролиза над гидролизом. Пиридоксальфосфат (витамин В6), который необходим для действия фермента, связывается вблизи участка присоединения глюкозо-1-фосфата. Альдегидная группа этого кофактора образует шиффово основание с лизиновой боковой цепью С-концевого домена. Сохранение ферментативной активности после восстановления шиффова основания боргидридом говорит о том, что в данном случае альдегидная группа в отличие от таковой в случае других пиридоксалевых ферментов не участвует в катализе. В то же время фосфорильная группа пиридоксальфосфата, по-видимому, принимает прямое участие в катализе. В молекуле фосфорилазы имеется также участок связывания гликогена, отстоящий от каталитического центра на 30 А. Этот участок имеет важное значение для присоединения фермента к частице гликогена. Благодаря такому большому расстоянию между местом связывания гликогена и каталитическим центром фермент может осуществлять фосфоролиз многих концевых остатков, не претерпевая диссоциации и реассоциации после каждого каталитического цикла.
Рис. 16.6. Схематическое изображение α-углеродного остова фосфо- рилазы а. Показана локализация каталитически активного центра, а также участков связывания частицы гликогена, аллостерических центров и участков фосфорилирования
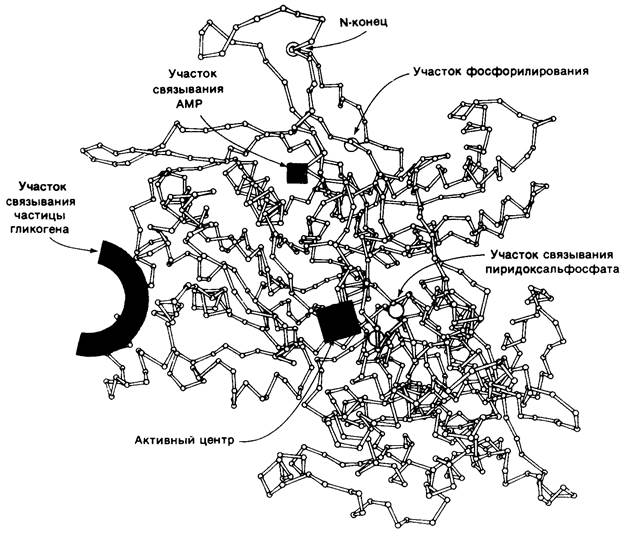
Помимо этого, фосфорилаза содержит по меньшей мере два аллостерических участка контроля. Глюкоза и нуклеозиды, являющиеся аллостерическими ингибиторами печеночнойфосфорилазы а (разд. 16.18), связываются вблизи каталитического центра. АМР, аллостерический активатор фосфорилазы b, связывается рядом с границей между субъединицами, далеко от каталитического центра и участка связывания гликогена. Серин-14, место фосфорилирования при превращении фосфорилазы b в фосфорилазу a, также локализован вблизи границы между субъединицами. Эта фосфорильная группа в фосфорилазе а соединена водородной связью с боковой цепью аргинина-69. В то же время область, охватывающая 19 N-концевых остатков в фосфорилазе b, не имеет строго определенной структуры. Эта область b-формы напоминает по гибкости очень подвижный активационный домен в трипсиногене, который принимает строго упорядоченную конформацию при превращении в трипсин (разд. 8.11). Детальные исследования структурных изменений, вызываемых фосфорилированием и аллостерическими эффекторами, находятся в процессе развития. Но уже сейчас ясно, что гликоген-фосфорилаза представляет собою утонченный интегратор информации об энергетическом метаболизме клетки.
16.13. Киназа фосфорилазы также активируется путем фосфорилирования
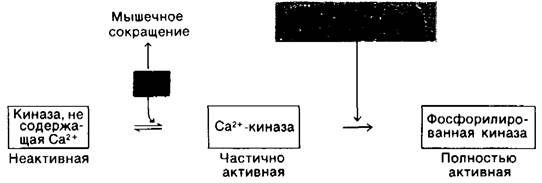
Активность киназы фосфорилазы также регулируется путем ковалентной модификации. Киназа фосфорилазы, подобно фосфорилазе, превращается из формы с низкой активностью в высокоактивную форму в результате фосфорилирования. Фермент, катализирующий эту активацию, является компонентом системы гормон—циклический АМР, которую мы рассмотрим несколько позднее. Киназа фосфорилазы может быть частично активирована и другим путем, под действием Са2 + в концентрациях порядка 10-7 М. Этот механизм активации имеет для биологических процессов важное значение, поскольку мышечное сокращение запускается высвобождением Са2+ (гл, 34), Таким образом, расщепление гликогена и мышечное сокращение связаны преходящим увеличением содержания Са2 + в цитоплазме.