БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 18. РАЗРУШЕНИЕ АМИНОКИСЛОТ И ЦИКЛ МОЧЕВИНЫ
18.12. Ферменты, содержащие в качестве простетической группы кобаламнн (витамин В12), катализируют процессы перегруппировки и метилирования
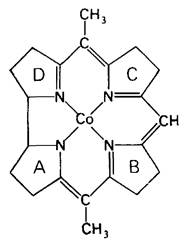
Кобаламин (витамин В12) привлекает к себе большой интерес биохимиков и врачей с тех пор, как в 1926 г. Георг Мино (George Minot) и Виллиам Мерфи (William Murphy) открыли, что пернициозную анемию можно лечить введением в рацион больных больших количеств печени. Кобаламин был получен в очищенном виде и кристаллизован в 1948 г. Его сложную трехмерную структуру раскрыла Дороти Ходжкин (Dorothy Hodgkin) в 1956 г. Ядро кобаламина состоит из корринового кольца с центрально расположенным атомом кобальта (рис. 18.12). Корриновое кольцо, подобно порфирину, имеет четыре пиррольных кольца. Два из них (кольца А и D) прямо связаны друг с другом, а другие соединяются при помощи метиленовых мостиков, как это имеет место в пор- фиринах. Заместителями в пиррольных кольцах являются метильная, пропионамидная и ацетамидная группы.
Рис. 18.12. Корриновое ядро кобаламина. Заместители при пирролах и двух других кобальтовых лигандах на этой схеме не показаны
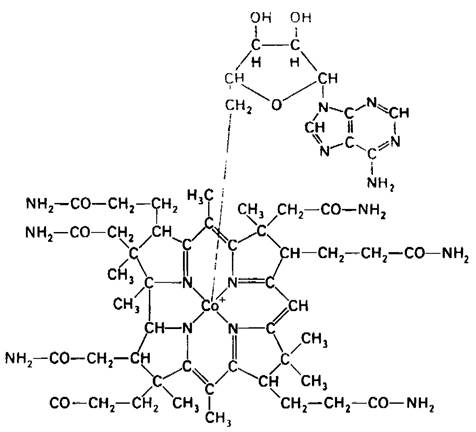
Атом кобальта связан с четырьмя атомами азота пиррольных колец. Пятый заместитель (на рис. 18.13, расположенный ниже плоскости коррина) представляет собою производное диметилбензимидазола, содержащее рибозо-3-фосфат и аминоизопропанол. Один из атомов азота диметилбензимидазола связан с кобальтом. Аминогруппа аминоизопропанола связана амидной связью с боковой цепью кольца D. Шестой заместитель при атоме кобальта (на рис. 18.13 расположенный над плоскостью коррина) может быть представлен CN-, -СН3, ОН- или дезоксиаденозилом. Присутствие цианид-иона в шестом координационном положении цианкобаламина, наиболее обычной среди получаемых в промышленном масштабе форм витамина, является результатом процедуры его выделения. In vivo цианид не связан с кобаламином.
Рис. 18.13. Структура 5'-дезоксиадено- зилкобаламина
Атом кобальта в кобаламине может находиться в степени окисления + 1, +2 или + 3. В гидроксокобаламине (в котором шестое координационное положение занимает ОН-) атом кобальта находится в степени окисления + 3. Эта форма, В12n (Со3+), восстанавливается до двухвалентного состояния, называемого В12г (Со2+), под действием флавопротеин-редуктазы. В12г восстанавливается второй флавопротеин -редуктазой в В12S (Со+). Восстановителем в обеих реакциях служит NADH. Форма В12з представляет собою субстрат для последней ферментативной реакции, приводящей к образованию активного кофермента, 5'-дезоксиаденозильная группа переносится с АТР на витамин B12s (Со+), образуя 5'-дезоксиадеиозилкобаламин, являющийся коферментом метилмалонил-СоА - мутазы (рис. 18.13).
В12s (СO3 +) → В12г (СO2 +) → B12s(Со+) → 5'-дезоксиаденозилкобаламин.
Рис. 18.14. 5'-углеродный атом 5'-дезоксиаденозина находится в координационной связи с атомом кобальта 5'-дезоксиаденозилкобаламина. Это - единственный известный пример связи углерод - металл в биомолекуле
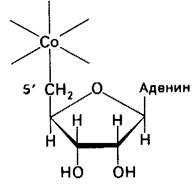
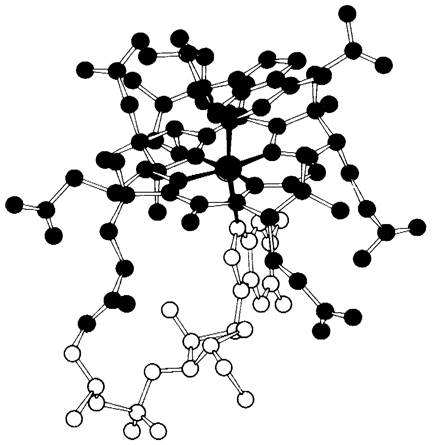
Рис. 18.15. Модель 5'-дезоксиаденозилко- баламина. Атом кобальта показан зеленым цветом, корриновый компонент-красным, дезоксиаденозильный компонент-голубым и бензимидазольный-желтым цветами
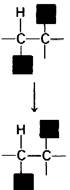
Кобаламиновые ферменты катализируют реакции двух типов: 1) реакции перегруппировки, например, превращение L-метилмалонил-СоА в сукцинил-СоА, и 2) реакции метилирования, например, синтез метионина (разд. 21.7). Перегруппировка представляет собою взаимообмен двух групп, присоединенных к соседним углеродным атомам (рис. 18.16). Атом водорода мигрирует от одного атома углерода к следующему, а группа R одновременно перемещается в противоположном направлении. При этих внутримолекулярных перестройках разрушается связь углерод—кобальт в 5' -дезоксиаденозилкобаламине. Углеродный атом субстрата, отдающий свой атом водорода, оказывается временно связанным с кобальтом.
Рис. 18.16. Реакция перестройки, катализируемая кобаламиновыми ферментами. Группа R может быть аминогруппой, гидроксильной группой или любым углеродсодержащим заместителем
18.13. При пернициозной анемии нарушается всасывание кобаламнна
Всасывание кобаламина осуществляется специализированной системой транспорта. Желудок секретирует гликопротеин, называемый внутренним фактором, который связывает кобаламин в просвете кишечника. Образовавшийся комплекс связывается специфическим рецептором на внутренней поверхности подвздошной кишки. Комплекс кобаламина и внутреннего фактора далее диссоциирует под действием высвобождающего фактора (рилизинг-фактора) и с помощью механизма активного транспорта переносится через мембрану подвздошной кишки в кровоток. Пернициозная анемия вызывается недостаточностью внутреннего фактора, приводящей к нарушению всасывания кобаламина. Это заболевание было впервые вылечено скармливанием больным больших количеств печени, богатого источника кобаламина, так что достаточное количество витамина могло всасываться даже в отсутствие внутреннего фактора. Наиболее надежная терапия состоит во внутримышечном введении кобаламина с месячными интервалами.
Животные и растения неспособны синтезировать кобаламин. Этот витамин уникален в том плане, что он, по-видимому, синтезируется только микроорганизмами, в особенности анаэробными бактериями. Для человека в норме требуется менее 10 мкг кобаламина в день. Недостаточное содержание кобаламина в пище наблюдается редко, потому что этот витамин присутствует практически во всех животных тканях.
18.14. Известно несколько наследственных дефектов обмена метилмалонил-кофермента А
Недавно было охарактеризовано несколько наследственных нарушений обмена метил- малопил-СоА. Эти нарушения обычно проявляются в течение первого года жизни; при этом наиболее характерным симптомом является ацидоз. pH артериальной крови у таких людей равен примерно 7, тогда как в норме кровь имеет pH 7,4. В моче появляются большие количества метилмалоната. В норме человек выделяет в день менее 5 мг метилмалоната, в то время как у больного с нарушенным обменом метил- малонил-CоА эта величина может достигать 1 г и более. Примерно у половины больных с метилмалоновой ацидурией наступает заметное улучшение при парантеральном введении больших доз кобаламина. pH артериальной крови возвращается к нормальному значению, экскреция метл- малоната значительно снижается. У таких реактивных больных обычно имеет место дефект трансферазы, катализирующий синтез дезоксиаденозилкобаламина:
В12s(Со+) → Дезоксиаденозилкобаламин
Однако не у всех больных с нарушенным обменом метилмалонил-СоА наблюдается улучшение при введении больших доз кобаламина. У некоторых из таких больных может иметь место дефект апофермента метилмалонил-СоА—мутазы. Эта форма метилмалоновой ацидурии часто приводит к летальному исходу.