Структура и функционирование белков. Применение методов биоинформатики - Джон Ригден 2014
Предсказание функции белка по свойствам его поверхности
Взаимодействие лиганда с белком
Предсказание расположения активного центра
Единственное, что, похоже, действительно является общим для всех лиганд-связывающих сайтов белка, - это наличие карманов, содержащих в себе эти сайты. Когда одна молекула меньше другой, самым простым путем обеспечения обширного контакта является окружение лиганда карманом. Кроме того, в случае ферментов это выгодно еще и потому, что субстрат изолируется от раствора и, таким образом, снижается высокая энергия переупорядочивания, связанная с реакциями в растворе (Yadav et al. 1991). Существует два основных подхода для определения свойств поверхности белка, геометрический и энергетический; эти два подхода описаны в последующих разделах.
7.4.2.1. Геометрическое определение центров связывания лиганда
Основная идея, лежащая в основе геометрического подхода, состоит в том, что небольшие молекулы предпочитают связываться с самым большим углублением на поверхности белка (Laskowski et al. 1996). Есть много различных методов для определения этих углублений (Laurie and Jackson 2006), некоторые из них описаны в этом разделе. Простейшие методы сначала окружают структуру белка пространственной решеткой. В программе Pocket (Levitt and Banaszak 1992) узлы решетки располагаются вдоль осей х, у, z, а углубления определяются как пустое пространство, окруженное атомами белка. Программа LIGSITE (Hendlich et al. 1997) делает этот подход менее чувствительным к ориентации белка, проводя поиск углублений не только вдоль осей кубической решетки, но и вдоль диагоналей. Повторно этот же прием был реализован в веб-сервисе Pocket-Finder (Laurie and Jackson 2005). В программе PASS (Brady and Stouten 2000) узлы решетки располагаются в каждой точке белка, где они могут примыкать к трем атомам белка, но не пересекаться с ними. Эти узлы покрывают фактически всю поверхность белка, и отбираются в зависимости от числа атомов белка в пределах заданного расстояния от них - узлы, оказавшиеся в углублениях, будут иметь больше атомов белка поблизости, чем те узлы, которые оказались вне углублений. Такие циклы размещения и отбора узлов решетки в конечном счете приведут к заполнению ими всего объема углублений.
В программе SurfNet (Laskowski 1995) сферы размещаются между парами атомов в белке, причем диаметр сфер уменьшается до тех пор, пока не будет устранено перекрывание с остальными атомами белка (это не всегда возможно, и в этом случае сфера удаляется). Оставшиеся сферы оказываются собранными в полостях белка. Эти полости можно увидеть в реальном времени для любого структуру из PDB, используя опцию “Clefts” в программе PDBsum (Laskowski et al. 2005). В программе CASTp (Binkowski et al. 2003) внешняя поверхность атомов определяется с помощью так называемого представления Делоне. Это геометрический подход, который присваивает каждому атому в молекуле многогранник максимально возможного объема. Грани возникают при соприкосновении атомов, и если в каком-то направлении такую грань построить не удается, то значит в этом направлении у атома нет соседей и он является атомом поверхности. Соединение центров таких атомов дает поверхность, ограничивающую многогранник с треугольными гранями. Часть этих граней может быть сокращена с использованием теории дискретного потока (см. Рис. 7.3), а результирующий центральный многогранник определяет полость в белке.
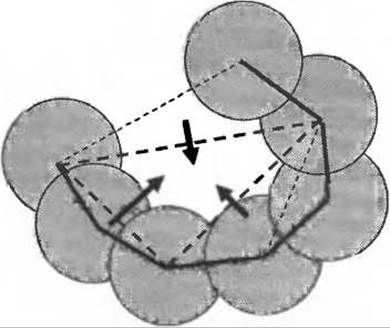
Рис. 7.3. Схематичное изображение теории дискретного потока. Один треугольник Делоне действует как сток для потока. В программе CASTp считается, что это истинный карман
Общей процедурой, принятой во всех этих методах, является определение границы между карманом и остальной поверхностью белка. Кроме того, должна быть определена и дополнительная граница - между карманом и пространством, окружающим белок. В некоторых геометрических определениях эти границы зависят от структуры белка и объем предсказанных сайтов связывания имеет тенденцию расти с увеличением размера белка. При определении сайта связывания с помощью энергетических характеристик (см.ниже) его объем оказывается примерно равным размеру лиганда независимо от размера всего белка, что согласуется с предположением, что размер кармана для связывания лиганда соответствует размеру последнего и не зависит от размеров белка (Laurie and Jackson 2005).
7.4.2.2. Энергетическое определение активного центра
Помимо геометрического подхода возможно использовать энергетический подход, при котором карманы определяются как области, наиболее предпочтительные для взаимодействия с другими молекулами (Laurie and Jackson 2005). В программе Q-SiteFinder белки, во-первых, окружаются пространственной решеткой, во все непересекающиеся с белком узлы которой помещается пробная метальная (-СН3) группа для оценки взаимодействий.
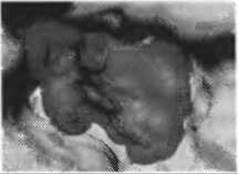
Рис.7.4. (Цветную версию рисунка см. на вклейке.) Предсказание сайтов связывания лигандов с помощью программы Q-SiteFinder. Приведен пример активного сайта молекулярной поверхности ацетилхолинстеразы (код PDB 1EVE), где сайт связывания небольшой лекарственной молекулы - ингибитора этого фермента - арисепта, хорошо определяется наилучшим предсказанием (прозрачная серая поверхность)
Оценочная функция узлов рассчитывается как потенциальная энергия ван-дер-Ваальсова взаимодействия этой группы в каждом узле. Те узлы решетки, которые получили достаточно высокую оценку, оставляются для дальнейшей кластеризации, а полученные кластеры затем ранжируются, причем предполагается, что карманы с наиболее подходящей энергией (обычно самой большой) и являются сайтами связывания лигандов. Так было установлено, что 90% рассмотренных реальных сайтов связывания оказывались в числе трех наиболее вероятных карманов, полученных предсказанием (см. рис.7.4).
7.4.2.3. Теоретические кривые микроскопического титрования
Электростатические свойства поверхности белка влияют на поведение ионизируемых групп в её окрестности. Во многих случаях ионизируемые боковые цепи, тесно вовлеченные в процессы химического катализа, имеют окружение, которое значительно влияет на их состояние ионизации. Например, они зачастую оказываются способными поддерживать конкретное частично протонированное состояние в аномально большом диапазоне изменения pH. В результате получающиеся значения константы кислотности рКа и кривые титрования изменяются, соответственно, по величине и форме от средних значений для тех же остатков. Поскольку электростатические свойства и состояния ионизации белка могут быть вычислены, то можно предсказывать остатки каталитического центра на основе их аномальных теоретических кривых микроскопического титрования (например, Antosiewicz et al. 1994; Elcock, 2001). Применение этого метода, называемого THEMATICS (англ. theoretical microscopic titration curves, теоретические кривые микроскопического титрования), позволило успешно идентифицировать остатки каталитического центра в семи структурах различных ферментов с небольшой долей ложно-положительных предсказаний, но не выявило каталитической активности в некаталитических белках, используемых в качестве контроля. С тех пор этот метод был улучшен за счет разработки статистических показателей для классификации теоретических кривых титрования (Ко et al. 2005) и внедрения метода опорных векторов для повышения чувствительности предсказаний (Tong et al. 2008). Совсем недавно было показано, что производительность метода слегка снижается, если анализируются апо-структуры вместо голо-структур (которые имеют существенные различия в конформации) (Murga et al. 2008). Наряду с тем, что сильной стороной этого метода служит его независимость от наличия или отсутствия гомологичных последовательностей, следует подчеркнуть, что он подходит только для предсказания каталитических сайтов, а не активных центров в целом.