Структура и функционирование белков. Применение методов биоинформатики - Джон Ригден 2014
Сравнительное моделирование структуры белков
Эффективность методов сравнительного моделирования
Ошибки в сравнительных моделях
Общая точность сравнительных моделей варьирует в широких пределах. Вблизи нижнего предела находятся модели низкого разрешения, для которых единственным надежно определенным свойством является лишь их тип укладки. У верхнего предела расположены модели, точность которых сравнима со средним разрешением кристаллографических структур (Baker and Sali 2001). При рассмотрении биологических проблем часто полезны даже модели низкого разрешения, поскольку функции можно предсказать на основе грубых структурных свойств, как показано в последующих главах этой книги.
Ошибки, встречающиеся в сравнительных моделях, можно разделить на пять категорий: 1) ошибки в упаковке боковых цепей; 2) искажения или изменения области, для которой получено правильное выравнивание относительно структуры шаблона; 3) искажения или изменения области, которая не имеет соответствующих сегментов ни в одном из структурных шаблонов; 4) искажения или изменения области, для которой получено неправильное выравнивание относительно структур шаблонов; 5) неправильная упаковка структуры, полученная в результате использования неподходящего шаблона. Для решения каждой из этих проблем необходимы существенные методологические улучшения.
Ошибки 3-5 довольно редко встречаются при моделировании последовательностей, для которых идентичность с шаблоном составляет более 40%. Так, в подобных случаях для 90% атомов главной цепи СКО при моделировании будет составлять, вероятно, около 1 Å (Sanchez and Sali 1998). В этом диапазоне сходства структур проще всего построить структурное выравнивание: разрывов немного, а структурные отличия между белками обычно ограничиваются петлями и боковыми цепями. Когда идентичность последовательностей составляет 30-40%, структурные различия становятся более выраженными, пропуски в выравниваниях встречаются чаще и имеют более крупные размеры, и основными проблемами становятся неправильные выравнивания и вставки в последовательность мишени. В результате СКО главной цепи возрастает примерно до 1,5 Å примерно для 80% остатков. Моделирование остальных остатков осуществляется с большими ошибками, поскольку методы в целом не способны моделировать структурные искажения и изменение твердых тел, а также преодолеть проблему использования неверных выравниваний. Когда идентичность последовательностей опускается ниже 30%, главной проблемой становится определение близких шаблонов и их выравнивание относительно моделируемой последовательности. В целом, можно ожидать, что при таком уровне сходства последовательностей примерно для 20% остатков будет создано неверное выравнивание, что приведет к неправильному моделированию с ошибкой более 3 А. Такие неверные выравнивания представляют собой серьезное препятствие для сравнительного моделирования, поскольку, как оказывается, большинство структурно связанных белковых пар имеют менее 30% идентичности последовательностей (Rost 1999).
Чтобы оценить ошибки в сравнительных моделях в перспективе, приведем различия в структурах одного и того же белка, полученных экспериментально. Точность 1 Å положения атомов главной цепи характерна для рентгеновской структуры с низким разрешением - около 2,5 А - и фактором достоверности около 25% (Ohlendorf 1994), а также для структур среднего разрешения, полученных методом ЯМР с 10 ограничениями межпротонного расстояния на остаток (рис. 3.4). Аналогичным образом, различия между рентгеновскими структурами и ЯМР-структурами высокого разрешения для одного и того же белка, как правило, составляют около 1 Å (Clore et al. 1993). Изменения окружающей среды (например, олигомерное состояние, кристаллическая упаковка, растворитель, лиганды) также могут оказывать существенное влияние на структуру (Faber and Matthews 1990). В целом, сравнительное моделирование последовательностей, для которых идентичность с шаблоном составляет более 40%, позволяет получать модели почти такого же качества, что и экспериментальные структуры среднего разрешения, просто потому, что белки с таким уровнем сходства с высокой вероятностью похожи друг на друга так же, как и структуры одного белка, определенные различными экспериментальными методами в разных условиях. Тем не менее, потенциальный риск при сравнительном моделировании белков состоит в том, что некоторые области, главным образом петли и боковые цепи, могут содержать более существенные ошибки.
Производительность методов сравнительного моделирования иногда может быть завышенной. Это связано с тем, что показатели, обычно обсуждаемые в литературе, - это значения отклонений основной цепи. Тем не менее, одиночные ошибки в определенных остатках, важных для выполнения функций белка, даже при общем СКО основной цепи менее 1 Å, все же могут быть достаточно велики, что не позволит сделать достоверные выводы относительно механизма действия, функций белка и разработки лекарственных препаратов.
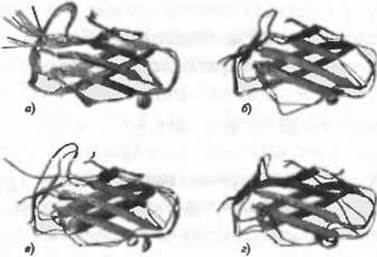
Рис. 3.4. (Цветную версию рисунка см. на вклейке.) Демонстрация точности структурных моделей, полученных различными экспериментальными и вычислительными методами для одного и того же белка-аллергена Der Р 2. а) Наложение десяти различных структур Der Р 2, полученных методом ЯМР (код PDB 1A9V); усредненное СКО = 0,97 Å. б) Наложение структур, полученных методом рентгеновской кристаллографии, двух изоформ белка Der Р 2, имеющих 87% идентичности последовательности: 2F08 (разрешение 2,20Å) и 1KTJ (разрешение 2,15 А). СКО = 1,33 Å. в) наложение ЯМР- и рентгеновской структур белка Der Р 2 (1A9V и 1KTJ). СКО = 2,2 Å. г) Наложение сравнительной модели, построенной для белка 1NEP с использованием 1KTJ в качестве шаблона, и рентгеновской структуры 1NEP. Структуры 1NEP и 1KTJ имеют идентичнные на 28% последовательности и представляют собой типичный пример объекта, сложного для моделирования. СКО = 1.66 А. Все значения СКО относятся к наложению атомов Са