Структура и функционирование белков. Применение методов биоинформатики - Джон Ригден 2014
Методы биоинформатики для изучения структуры и функций неупорядоченных белков
Предсказание неупорядоченности
Предсказание на основе потенциалов контакта
В основе работы некоторых методов предсказания лежит уникальный, отличный от описанных выше принцип. В соответствии с ним, БПН не могут сворачиваться в упорядоченные структуры, поскольку аминокислотные остатки в их последовательности взаимодействуют недостаточно для преодоления невыгодного уменьшения энтропии, сопровождающего процесс сворачивания. На этом принципе основано несколько методов предсказания, в которых применяются простые статистические закономерности (FoldUnfold (Galzitskaya et al. 2006)), сравнение потенциалов парных взаимодействий (Ucon (Schlessinger et al. 2007)) или оценка общей энергии взаимодействия между остатками цепи (IUPred (Dosztanyi et al. 2005a, b)). Опишем последний метод более подробно.
Для оценки общей энергии парных взаимодействий, имеющих место в полипептидной цепи, в IUPred используются силовые поля низкого разрешения (статистические потенциалы), полученные для глобулярных белков. Основная идея состоит в том, что вклад отдельного остатка в общую энергию определяется не только типом самого остатка, но и другими аминокислотными остатками, т.е. потенциальными партнерами, в последовательности. Поскольку вероятностное описание потенциальных взаимодействий всех остатков со всеми остальными остатками обработать сложно, проблему упрощают посредством введения квадратичного выражения для аминокислотного состава. Вклад отдельного аминокислотного остатка аппроксимируют матрицей предсказания энергии, которая связывает энергетический вклад аминокислотных остатков і и j. Параметры матрицы определяют выравниванием по методу наименьших квадратов относительно глобулярных белков. При использовании такого подхода средний уровень энергии, получаемый для неупорядоченных белков, (-0,07 условных единиц) является невыгодным по сравнению с аналогичным значением для глобулярных белков (-0,81 условных единиц). Это свидетельствует о том, что обсуждаемый подход является информативным в тех случаях, когда исследуемые белки по своему структурному статусу принадлежат к числу макроскопических (рис. 5.3). В случаях, когда в вычислениях рассматриваются лишь предопределенные локальные соседние аминокислотные остатки последовательности, с помощью обсуждаемого подхода можно получить специфическую для последовательности информацию о неупорядоченности структуры, что составляет основу алгоритма IUPred (Dosztanyi et al. 2005a, b).
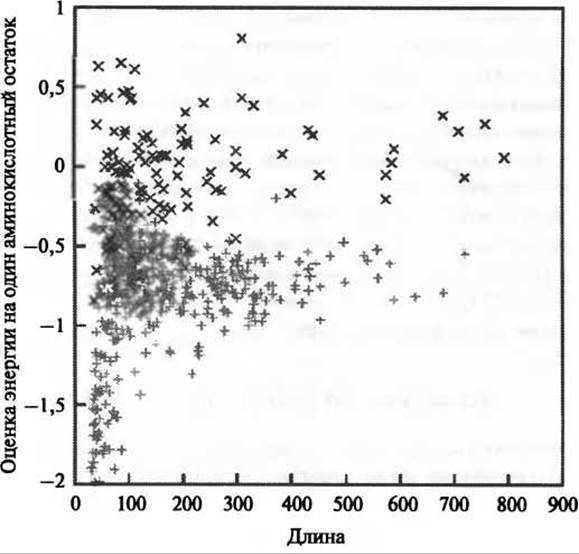
Рис. 5.3. Оценочные энергии парного взаимодействия глобулярных белков и БПН. Общие парные энергии взаимодействия глобулярных белков (показаны серыми +) и неупорядоченных белков (показаны черными х) были оценены на основе их аминокислотного состава и приведены в зависимости от длины их последовательностей. Отрицательное направление соответствует увеличению стабильности благодаря парным аминокислотным взаимодействиям. Средние значения, выраженные в условных единицах энергии предполагают большую стабильность в случае глобулярных белков (-0,81 единицы), чем БПН (-0,07 единицы) (перепечатано из Dosztanyi et al. 2005b с разрешения Elsevier)