Структура и функционирование белков. Применение методов биоинформатики - Джон Ригден 2014
Функциональное разнообразие в элементах упаковки и надсемействах
Разнообразие функций гомологичных белков
Дивергенция функций в ходе эволюции белков
Традиционный подход при описании белка с неизвестной функцией состоит в поиске гомологии между этим исследуемым белком и другими белками, функции которых хорошо изучены, с тем, чтобы затем перенести функциональные аннотации последних на первый, предполагая, что белки, которые произошли от общего предка, должны обладать определенном функциональным сходством (Whisstock and Lesk 2003). Однако на сегодняшний день однозначно установлено, что этот подход предрасполагает к возникновению ошибок и его неосторожное применение приводит к неуправляемому распространению ошибочных аннотаций в базах данных (Devos and Valencia 2001).
Основной источник ошибок в этом процессе - предположение о том, какие гомологичные белки имеют сходные функции, которое часто является неточным (Devos and Valencia 2000). В настоящее время известно множество примеров близких белков, обладающих совершенно разными функциями. Так, лизоцим белка куриных яиц и а-лактальбумин млекопитающих имеют более 35% идентичности последовательности и весьма схожие структуры. Тем не менее, разумно предположить, что чем больше эволюционное расстояние между двумя гомологичными белками, тем меньше вероятность того, что эти белки будут обладать одной и той же функцией. В ряде исследований предпринимались попытки определить отсечки идентичности последовательностей, применение которых явилось бы гарантией сохранения функции для пары гомологов, однако полученные результаты оказались противоречивы, и проблема все еще находится в стадии обсуждения (Todd et al. 2001; Rost 2002; Tian and Skolnick 2003; Sangar et al. 2007). Одно из возможных объяснений сложности получения универсальных отсечек состоит в том, что, как уже упоминалось выше, образцы последовательностей и характер дивергенции функций для разных надсемейств очень сильно отличаются. Таким образом, многие последние исследования сосредоточены на анализе связей между последовательностью, структурой и функцией в рамках отдельных надсемейств или их подмножеств. Такой подход может оказаться полезным при выявлении закономерностей, которые определяют, каким образом вариации в последовательности и структуре связаны с вариациями функций.
В следующем разделе вариации функций в пределах надсемейств будут описаны более подробно, при этом особое внимание будет уделено механизмам, которые считаются причиной, вызывающий функциональные изменения.
6.3.3.1. Разнообразие функций на уровне надсемейств
Последовательности белков, принадлежащих к одному и тому же семейству, иногда настолько далеко дивергируют в ходе эволюции, что связь между ними невозможно установить с помощью стандартных методов выравнивания последовательностей. Несмотря на то, что пространственные структуры, как правило, считаются гораздо более консервативными, чем последовательности, структуры отдаленных гомологов все же весьма значительно отличаются друг от друга. Такие структурные различия, вероятно, являются следствием вставок/делеций (инделов, от “insertion/deletion”) крупных элементов вторичной структуры или даже их сочетаний. Недавнее исследование инделов гомологичных структур показало, что нередко вставки вторичной структуры, которые впоследствии оказываются удачными в ходе эволюции, располагаются в одних и тех же местах белковой укладки, т.е., формируются так называемые встроенные инделы (Jiang and Blouin 2007). Другое исследование вставок в надсемействах САТН показало, что встроенные элементы вторичной структуры обычно не только занимают одно и то же положение в определенных участках белковой укладки, но также формируют элементы, которые располагаются вблизи функционально важных областей, таких как каталитические участки ферментов или области контактов при белок-белковых взаимодействиях (Reeves et al. 2006). Эти данные указывают на связь между структурными и функциональными изменениями.
Вставка новых элементов вторичной структуры вблизи активного центра, скорее всего, приведет к изменению функции, однако более тонкие изменения, такие как аминокислотные замены остатков, важных для осуществления катализа, также приведут к возникновению функциональных различий, хотя на уровне надсемейства, обсуждаемом здесь, вероятность определить близкие гомологи выше, чем та же вероятность для отдаленных гомологов. Изменения на уровне домена могут также привести к радикальным изменениям роли белков, так, что, даже если какой-либо аспект молекулярной функции остается неизменным, о белках нельзя сказать, что они выполняют одну и ту же функцию (Hegyi and Gerstein 2001; Todd et al. 2001). Примером такой ситуации служат РВР-подобные домены глутаматных рецепторов эу- и прокариот, которые связываются с одним и тем же лигандом в одном и том же месте топологии, но значительно отличаются по своим функциям, выполняемым на уровне клетки (см. рис. 6.2).
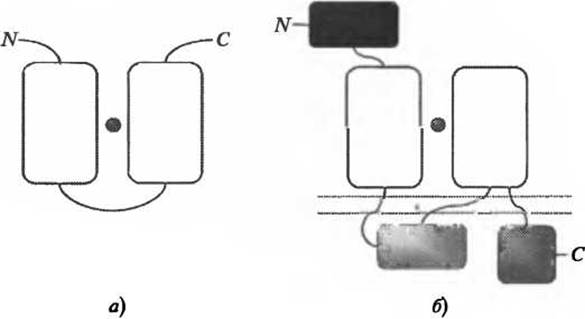
Рис. 6.2. Мультидоменная архитектура (а) периллазматического глутамат-связывающего белка грамотрицательных бактерий и (б) субъединицы NR2 глутаматного рецептора [NMDA] крысы. Отдельные домены показаны в виде прямоугольников. N- и С-концы показаны заглавными буквами “N” и “С” соответственно. Лиганд L-глутамат показан в виде сферы. Клеточная мембрана (б) показана двойной пунктирной линией. Домены, между которыми связывается L-глутамат, окрашены в белый цвет. Они гомологичны как между собой, так и для двух рассматриваемых белков (надсемейство САТН 3.40.190.10). Приведенные два белка выполняют совершенно разные функции что отражено в из совершенно разной мультидоменной архитектуре, а) Бактериальный периплазматический глутамат-связывающий белок. Он содержит всего два домена, которые участвуют в связывании глутамата и свободно перемещают последний через периплазму (Takahashi et al. 2004). б) Рецептор глутамата [NMDA] (субъединица NR2) является частью трансмембранного канала, который играет важную роль в передаче возбуждающих нервных импульсов. Он содержит пять глобулярных доменов. Его связывание с L-глутаматом является частью процесса открывания канала для потока катионов (Furukawa et al. 2005). Несмотря на то, что пара доменов этих двух белков, показанная белым цветом, гомологична и имеет общую способность связывать L-глутамат в одной и той же области структуры, домены, вне всяких сомнений, выполняют очень разные функции
Существует множество длительных эволюционных процессов, в ходе которых функция дивергирует в разных гомологах. Дать им всеобъемлющее описание довольно сложно. Тем не менее, Бэштон и Чотиа в своем последнем исследовании описали и привели примеры множество таких процессов, попытавшись понять, как функция гомологичных доменов может меняться в зависимости от того, является ли домен единственным в белке или составляет часть мультидоменного белка (Bashton and Chothia 2007). К числу описанных процессов принадлежат случаи, когда функция домена изменяется при его комбинации с другими доменами, изменяющими субстратную специфичность белка, а также случаи мультифункциональных белков, в которых каждый домен отвечает за определенную функцию.
Вышеупомянутые структурные изменения, часто встречающиеся вблизи функциональных областей, указывают на разнообразие функций, которого можно ожидать от членов отдельного надсемейства. И действительно, результаты некоторых исследований свидетельствуют о том, что отдаленные гомологи в пределах надсемейств часто выполняют очень разные функции (Todd et al. 2001). В большинстве случаев эти исследования направлены на изучение эволюции функций в пределах надсемейств, которые, как правило, демонстрируют исключительное функциональное многообразие. К числу известных примеров принадлежат дегалогеназы галогенокисл от (Burroughs et al. 2006), дегидрогеназы/редуктазы с короткой цепью (Favia et al. 2008), енолазы (Gerlt and Babbitt 2001), домены HUP (Aravind et al. 2002) и флавопротеины с доменами, связывающими два динуклеотида (tDBDF, от ““Two dinucleotide binding domains” flavoproteins”) (Ojha et al. 2007). При исследовании этих различных групп белков было выявлено большое количество различных процессов, посредством которых функция дивергирует среди родственных белков. Эти процессы и соответствующие примеры будут рассмотрены отдельно.
Разнообразие механизмов в надсемействах
Совокупность хорошо изученных надсемейств составляет основную массу сведений в базе данных SFLD (Pegg et al. 2006). Несмотря на функциональное разнообразие, согласно критериям включения в SFLD (см. раздел 6.3.1.2), все члены надсемейств обладают общими свойствами механизма действия в различных реакциях, которые они катализируют.
По сути, база SFLD создана специально для описания таких надсемейств ферментов с различиями в механизме действия. Она обеспечивает классификацию эволюционно связанных ферментов, в основе которой лежит сходство их механизмов функционирования. Так, семейство дегалогеназ галогенокислот из базы SFLD составляют ферменты, которые могут катализировать реакции с огромным количеством разнообразных субстратов, но всегда действуют через образование промежуточного фермент-субстратного соединения, в котором компоненты связаны ковалентно в области консервативного аспартата (Glasner et al. 2006), и последующего расщепления связей С-С1, Р-С или Р-О.
Надсемейство дегалогеназ галогенокислот содежит 1285 уникальных аминокислотных последовательностей, которые относятся к 20 семействам, каждое из которых катализирует уникальную реакцию (например, фосфатазы гистидинола, номер КФ 3.1.3.15, или фосфатазы трегалозы, номер КФ 3.1.3.12). Некоторые семейства объединены в подгруппы, которые представляют собой удобный промежуточный уровень классификации, определение которого варьирует от одного надсемейства к другому.
В настоящее время в SFLD содержится лишь шесть надсемейств. Однако общность черт каталитической реакции весьма распространена в пределах надсемейств и наблюдается в 22 из 31 надсемейства ферментов, изученных Тоддом и соавт. (2001). Субстратная специфичность, напротив, не сохранялась в 20 из этих надсемейств (см. ниже).
Распространенность общего шага в механизме реакции семейств, весьма разнообразных в отношении механизма, свидетельствует о том, что ферменты этих надсемейств сохранили аспекты каталитического механизма в ходе эволюционной диверсификации. Такие ситуации дают основание предполагать такой сценарий эволюции, при котором ферменты приобретают новые функции за счет дупликации и увеличения численности при частичном сохранении механизмов реакции (а не субстратной специфичности, см. ниже), что в итоге привело к разнообразию механизмов реакций в надсемействах, которое наблюдается в наши дни (Gerlt and Babbitt 2001).
Разнообразие специфичности в надсемействах
Иной сценарий для дивергентной эволюции функций ферментов в пределах надсемейств представляет собой последовательность событий, при которой предковые формы ферментов проходят через процесс дупликации, и появившиеся копии потомков адаптируются к связыванию более специфичных субстратов. При таком сценарии субстратная специфичность - доминирующий фактор эволюции функции в надсемействах. В ходе детального анализа надсемейств ферментов Тодд и соавт. (2001) показали, что в большинстве случаев среди гомологичных ферментов механизмы реакций были более консевативны, чем субстратная специфичность. Из 28 надсемейств, среди которых проводили сравнение процесса связывания с субстратом, десять не обладали субстратной специфичностью ни при каких условиях и еще для десяти наблюдалось весьма широкое разнообразие субстратов, которые обладали лишь незначительным сходством химического строения, таким, например, как пептидная связь (Todd et al. 2001).
Предположение о том, что субстратная специфичность для гомологичных ферментов в пределах надсемейства, вероятнее всего, сохраняется, вытекает из предложенной Хоровицем гипотезы об обратной эволюции метаболических путей (Horowitz 1945). Согласно этой гипотезе, в случае недостатка субстрата для данного фермента преимущество при отборе по сравнению с другими будет иметь тот организм, у которого есть новый фермент, способный производить необходимый субстрат из имеющегося в наличии предшественника. Такой новый фермент закрепляется в эволюции, тем самым давая начало первичному двухступенчатому метаболическом пути. Аналогичный эволюционный процесс может иметь место и для других ступеней существующего пути. Согласно этому сценарию, эволюция метаболического пути идет в обратном направлении по отношению к направлению метаболического потока (Rison and Thornton 2002). Поскольку исходный фермент способен связываться с молекулой субстрата, которая является продуктом в реакции, катализируемой новым ферментом, полагают, что описанное свойство лежит в основе появления в процессе эволюции новых ферментов. Следуя этой идее, все ферменты в пределах одного метаболического пути должны быть гомологами, а фермент, катализирующий последнюю ступень пути, - наиболее древним. Кроме того, движущим фактором эволюции ферментов в этом случае должна быть избирательность по отношению к субстрату. В конечном счете это привело бы к появлению общих черт в субстратной специфичности существующих надсемейств. Существует ряд исследований, в которых были собраны и систематизированы возможные примеры обратной эволюции ферментов, в том числе путь биосинтеза триптофана, в котором некоторые ферменты, катализирующие последовательные шаги, обладают ярко выраженной гомологией (Todd et al. 2001; Gerlt and Babbitt 2001).
Однако результаты нескольких исследований позволяют предположить, что этот гипотетический процесс в действительности играл незначительную роль в эволюции метаболизма, который, на самом деле, скорее мог бы возникнуть из химически обусловленного распределения ферментов между метаболическими путями (Rison and Thornton 2002). Действительно, надсемейства, в которых консервативна селективность к субстрату, кажутся более редкими по сравнению с теми, где консервативен каталитический механизм. Интересно, что надсемейство фосфоенолпируват-связывающих ферментов TIM-бочонков, которое являлось единственным надсемейством с абсолютно консервативной специфичностью к субстрату по данным Тодда с сотр. (Todd et al., 2001), оказалось в числе надсемейств с максимально широким спектром лигандов в более позднем исследовании (Bashton et al. 2006), позволяя предположить, что полученное в раннем анализе ложное заключении имеет своей причиной малочисленность использованных данных.
База данных PROCOGNATE (Bashton et al. 2008) является очень полезным средством для анализа разнообразия лигандов, связанных с различными ферментами внутри надсемейства. Эта база данных картирует ферменты по известным для них лигандам, т.е. лигандам, которые ферменты связывают in vivo. Действительно, данные о лигандах, содержащихся в структурах PDB, имеют один недостаток: зачастую в активных центрах ферментов связываются неспецифические лиганды, мимикрируя таким образом под истинные лиганды, связывающиеся in vivo (Dessailly et al. 2008). Эти примеси делают затруднительным автоматическое изучение разнообразия лигандов в белках с известной структурой, поскольку неочевидно, как отличать их от биологических лигандов. PROCOGNATE предназначена для работы с надсемействами (по классификации САТН, SCOP или PFAM), к которым принадлежат ферменты, и, таким образом, полезна для определения разнообразия лигандов в любом интересующем семействе. Например, поиск в структурно неоднородном надсемействе дегалогеназ галогенокислот (код в САТН 3.40.50.1000) возвращает список из 57 известных лигандов из PDB и 17 известных соединений из KEGG, которые связываются с ферментами этого надсемейства. Древнее и разнородное надсемейство HUP-домена (код в САТН 3.40.50.620) ассоциировано в PROCOGNATE с 92 лигандами в PDB и 29 лигандами из KEGG. Эти 29 лигандов показаны на рис. 6.3. и иллюстрируют разнообразие молекул, которые могут связываться с эволюционно родственными белками.
Изменения функции, вызванные изменением в окружении
Функциональные изменения между дуплицированными копиями белка также могут появиться не столько из-за изменений в самих белках, сколько из-за изменений условий окружающей среды, в которых эти копии активны. Например, распространение белка в новые области организма может теоретически привести к встрече этого белка с низкомолекулярными соединениями, не характерными для исходной окружающей среды белка-предка, и новый белок может проявить неожиданную активность в связывании этих новых лигандов. Кроме того, молекулярная функция белка может измениться, если другие белки в его окружении претерпевают мутации, которые делают возможными новые взаимодействия или, напротив, какие-то белок-белковые взаимодействия становятся далее невозможными.
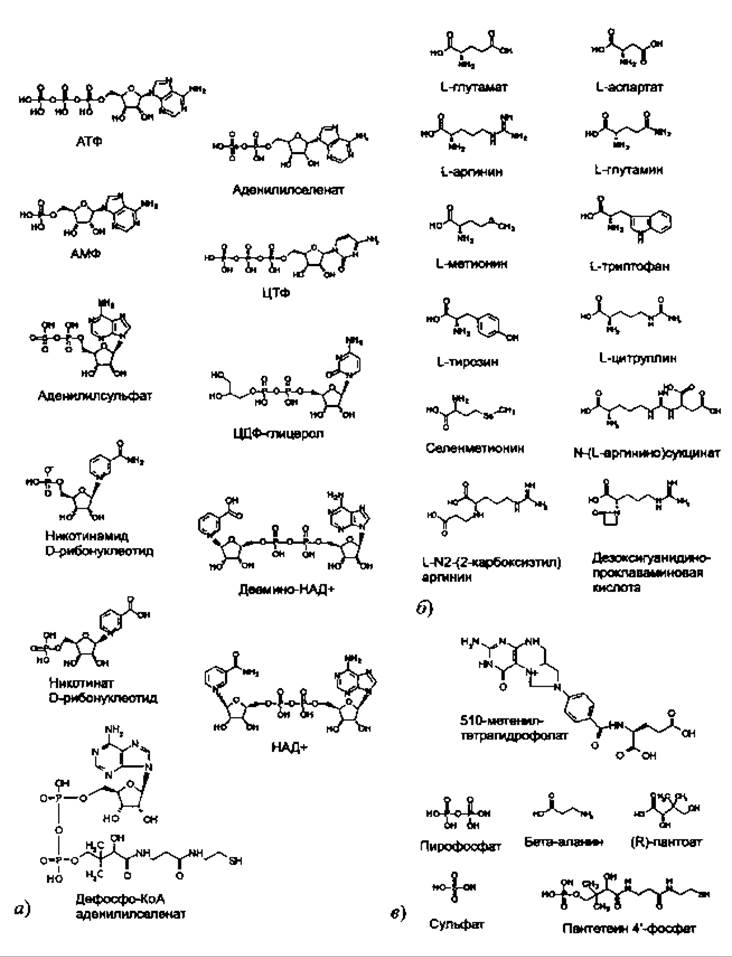
Рис. 6.3. Лиганды из базы данных KEGQ распознанные с помощью PROCOGNATE как связывающиеся с HUP-доменами (суперсемейство САТН 3.40.50.620). Для ясности лиганды разбиты на три основных категории: а) аденин-содержащие лиганды и их производные; б) аминокислоты и их производные; в) различные лиганды, которые не относятся ни к одной из двух обозначенных выше категорий. Гораздо большее количество молекул (92), связывающихся с доменами HUP, было обнаружено в базе данных PDB, однако на рисунке они не приведены. Рисунок иллюстрирует идею о том, что эволюционно близкие домены способны связывать широкий круг молекул
Известный пример функциональных изменений гомологичных ферментов, т.е., изменений, связанных с изменениями в окружающей среде, описан в литературе для “связывающих два динуклеотида доменов” флавопротеинов. Диверсификация функции внутри семейства в данном случае стала результатом большого количества различных белковых молекул-партнеров, обладающих свойствами акцепторов электронов, белок-белковые взаимодействия с которыми носят консервативный характер (Ojha et al. 2007).
Ферменты и молекулы, не обладающие ферментативной активностью
Одним из источников функционального разнообразия надсемейств, который редко обсуждается в литературе, является утрата/приобретение каталитических свойств гомологами. Действительно, анализ белков неферментной природы - более сложная задача, чем анализ ферментов, для которых существуют системы аннотации и инструменты анализа (например, КФ, KEGG и CSA, см. раздел 6.1) (таблица 6.1). Тем не менее, белки неферментной природы часто обнаруживаются в так называемых ферментых семействах. Процессы, в ходе которых происходит утрата каталитических свойств, довольно просты: замена лишь одного аминокислотного остатка, имеющего решающее значение для проявления каталитических свойств, обычно приводит к утрате ферментативной активности (Todd et al. 2002). Надсемейство доменов HUP (код САТН 3.40.50.620) состоит в основном из ферментов, но содержит несколько отдельных примеров белков, для которых каталитическая активность не выявлена. Так, субъединицы электронтранспортных флавопротеинов составляют отдельное функциональное семейство, которое значительно отличается от других членов надсемейства по последовательности, структуре и функциям (Aravind et al. 2002). Пример другого уровня в пределах этого надсемейства - криптохром DASH. Он имеет не ферментную природу и демонстрирует поразительное сходство с эволюционно близкими фотолиазами репарации ДНК при связывании с ДНК и выполнении редокс-зависимой функции, однако имеет также существенные отличия, в основном в активном центре (Brudler et al. 2003). Существуют также примеры надсемейств, в которых преобладают молекулы неферментной природы. Так, домены, схожие с периплазматическим связывающим белком, (код САТН 3.40.190.10) - надсемейство, в котором принадлежность ко многим функциональным семействам определяется на уровне молекул, с которыми связываются члены семейства, или на уровне функций, которые они выполняют в клетке (например, транспортеры или поверхностные рецепторы).
Особые примеры функционально разнообразных надсемейств
Из приведенного выше обсуждения надсемейств, разнообразных с точки зрения механизмов реакции и специфичности, следует, что для большинства надсемейств, несмотря на их дивергенцию, характерно сохранение определенной степени функциональной общности членов. Этого можно ожидать, поскольку, согласно определению, надсемейства образованы белками, которые эволюционно связаны друг с другом. Исходя из правил экономии, разумно предположить, что гомологичные белки в ходе эволюции могут сохранять по крайней мере некоторые аспекты функции. Тем не менее, известны примеры надсемейств, для которых такие функциональные общности до сих пор не выявлены. Так, в уже упоминавшемся ранее исследовании многочисленных и разнобразных надсемейств, проведенном Тоддом и соавт., члены одного надсемейства - белки из повторяющихся гексапептидов - не имели общих черт ни в отношении механизма катализа, ни в отношении субстратной специфичности (Todd et al. 2001). Другой пример надсемейства, для членов которого не выявлены общие функциональные свойства, - домены HUP. На рис. 6.4 приведены обобщенная схема, отражающая функциональное разнообразие этого надсемейства, а также типичные структуры функциональных групп. Тем не менее, вполне вероятно, что общие функциональные свойства этих весьма разнообразных надсемейств, не очевидные в настоящее время в силу крайней сложности изучения функций, будут установлены по мере накопления и изучения большего количества данных.
6.3.3.2. Функциональное разнообразие близких гомологов
В предыдущих разделах при описании функционального разнообразия белковых надсемейств внимание акцентировалось на отдаленных гомологах. Однако разнообразие функций также наблюдается среди близких гомологов (например, между лизоцимом белка куриных яиц и а-лакталь- бумином млекопитающих, см. раздел 6.3.3), а иногда даже между совершенно идентичными белками, если рассматривать их в различных контекстах. Обычно такие белки приобретают совершенно новые функции в связи с существованием в новой среде. Хорошо известным примером таких белков являются кристаллины хрусталика глаза утки, которые идентичны по последовательности енолазе и лактатдегидрогеназе печени (Piatigorsky et al. 1994; Whisstock and Lesk 2003). На сегодняшний день описано несколько случаев такого поведения, а сами молекулы получили общее название “белки-совместители” (Jeffery 2003). Более того, все больше данных указывают на то, что ферменты потенциально способны к функциональным изменениям. Суть этой способности заключается в том, что ферменты могут катализировать самые различные реакции в дополнение к основной, которая, как правило, является весьма специфичной (Khersonsky et al. 2006). Эти исключительные случаи функционального разнообразия белков, которые характеризуются весьма незначительными различиями в последовательности и структуре или полным их отсутствием, приведены здесь для того, чтобы подчеркнуть, что связь между последовательностью, структурой и функциями носит комплексный характер, а значит, разработать простые и надежные правила прогнозирования функций на основе последовательности и структуры довольно сложно.
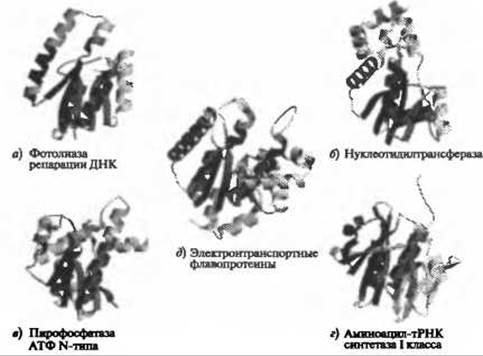
Рис. 6.4. (Цветную версию рисунка см. на вклейке.) Разнообразные структуры и функции надсемейства доменов HUP (код САТН 3.40.50.620). Для доменов HUP характерен способ укладки, близкий к укладке Россмана. Показано, что домены HUP - очень древние белки (Aravind et al. 2002). Вместе они образуют большое семейство и выполняют множество различных функций. На рисунке схематично представлены репрезентативные структуры основных функциональных групп семейства. Структуры подверглись множественному выравниванию с помощью алгоритма CORA (Orengo 1999). Также множественное выравнивание использовалось для получения общего ядра домена. Во всех структурах остатки, входящие в состав ядра, окрашены красным. В качестве типичных представителей основных функциональных групп были использованы следующие домены САТН: a) 1dnpA01 для фотолиаз репарации ДНК; б) 1ej2A00 для нуклеотидилтрансфераз; в) 1gpmA02 для пирофосфатаз АТФ N-типа; г) 1n31А01 для аминоацил-тРНК синтетаз I класса; д) 1o97D01 для электронтранспортных флавопротеинов