Биохимия в таблицах схемах и графиках - С.Д. Жамсаранова 2009
Ферменты
Механизм действия ферментов
Первоначальным событием при действии фермента является его специфическое связывание с лигандом - субстратом (S). Это происходит в области активного центра, который формируется из нескольких специфических R-групп аминокислот, определенным образом ориентированных в пространстве.
Ферментативная реакция - это многостадийный процесс.
На первом этапе устанавливается индуцированное комплементарное соответствие между ферментом и субстратом. В результате образуется фермент-субстратный комплекс (ЕS), в котором далее происходит химическое превращение субстрата, в результате чего образуется продукт, комплементарность снижается. После диссоциации продукта фермент возвращается в исходное состояние.
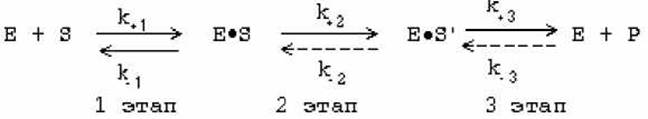
Механизм действия и конформация активного центра пищеварительного фермента эластазы (сериновой протеазы), осуществляющего гидролиз полипептидов
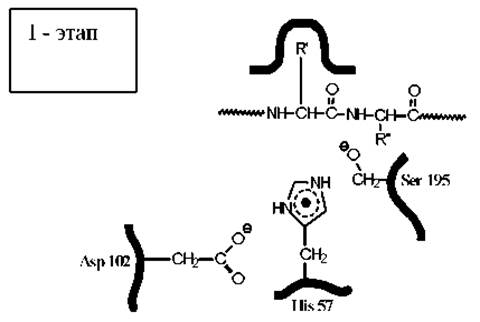
На первой стадии карбонильная группа расщепляемого пептида атакуется кислородом гидроксигруппы серина. Соседство с протонированным имидазольным кольцом гистидина, протонирование которого обеспечивается близким расположением карбоксильной группы остатка аспарагиновой кислоты, существенно повышает стабильность ионизованной формы гидроксила остатка серина (за счет электростатической энергии притяжения зарядов). В значительной части молекул фермента этот гидроксил находится в виде аниона, что резко повышает его нуклеофильную активность.
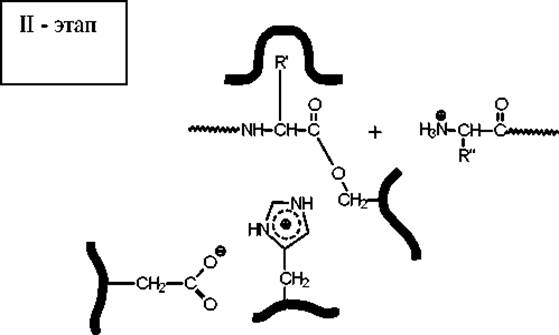
На второй стадии катализа промежуточно образовавшийся сложный эфир гидролизуется при действии воды, и активный центр освобождается для проведения следующего акта катализа.
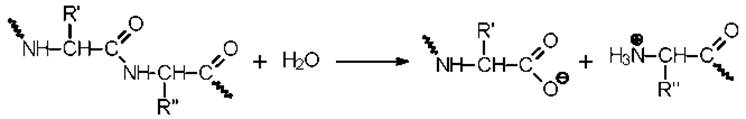
В результате атаки аниона пептидная связь разрывается и одна часть пептида покидает активный центр серинового фермента, а другая переносится на остаток серина с образованием ацилфермента.

КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
МОДЕЛЬ МИХАЭЛИСА-МЕНТОН
Химическое уравнение простейшей односубстратной реакции:
![]()
Здесь S — субстрат, E — фермент, ES — фермент-субстратный комплекс и P — продукт.
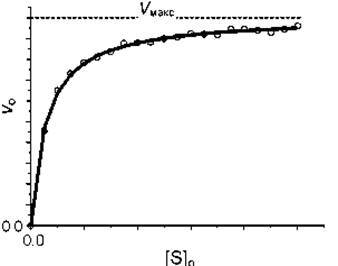
Зависимость начальной скорости ферментативной реакции от концентрации субстрата.
Чем выше [S], тем выше скорость реакции. Эта зависимость гиперболическая. Предельное значение, к которому стремится гипербола - Vmax данной реакции, характеризует максимальную работоспособность фермента:
Vmax - это предел, к которому стремится скорость реакции при бесконечном повышении концентрации субстрата.
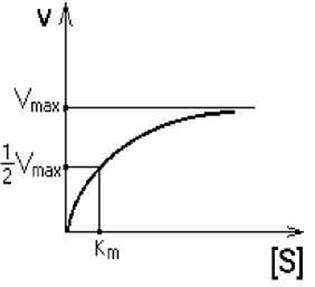
Km - это такая концентрация субстрата, которая необходима для связывания половины имеющегося фермента и достижения половины максимальной скорости.
Кm - КОНСТАНТА МИХАЭЛИСА. Она численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимального значения. Эта реакция описывается уравнением Михаэлиса-Ментон:
![]()
Кm и Vmax - это две кинетические константы, с помощью которых можно характеризовать эффективность работы фермента, в том числе и in vivo.
ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИИ ОТ рН
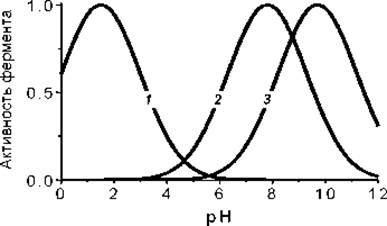
Зависимость активности ферментов (для удобства сравнения приведены активности, нормированные к единице) от рН. 1 — Пепсин, 2 — рибонуклеаза и 3 — аргиназа.