СОВРЕМЕННАЯ БОТАНИКА - П. РЕЙВН - 1990
РАЗДЕЛ II. ЭНЕРГИЯ И ЖИВЫЕ КЛЕТКИ
ГЛАВА 5. ПОТОК ЭНЕРГИИ
Кофакторы ферментативной активности
Как правило, каталитическая активность многих ферментов зависит от структуры белка. Однако многие ферменты могут проявлять свою активность только в присутствии одного или нескольких небелковых компонентов, называемых кофакторами.
Ионы как кофакторы
Ионы являются кофакторами некоторых специфических ферментов. Например, ион магния необходим для большинства ферментативных реакций, в ходе которых осуществляется перенос фосфатных групп между молекулами. Два положительных заряда Мg2+ удерживают в определенном положении отрицательные фосфатные группы. Другие ионы (Nа+ и К+) играют аналогичную роль в иных реакциях. В некоторых случаях ионы способствуют объединению ферментативных белков.
Коферменты и витамины
Иногда важную роль в ферментативных реакциях играют небелковые органические кофакторы, называемые коферментами. Например, в некоторых окислительно-восстановительных процессах электроны передаются молекуле, которая служит акцептором электрона. В любой клетке обнаруживаются несколько различных акцепторов электрона, каждый из которых специфически приспособлен для удержания электрона на определенном энергетическом уровне. Пример — никотинамидадениндинуклеотид (NAD), показанный на рис. 5-8.
Рис. 5-8. Никотинамидадениндинуклеотид в окисленной форме (NAD+) и в восстановленной (NADH) форме
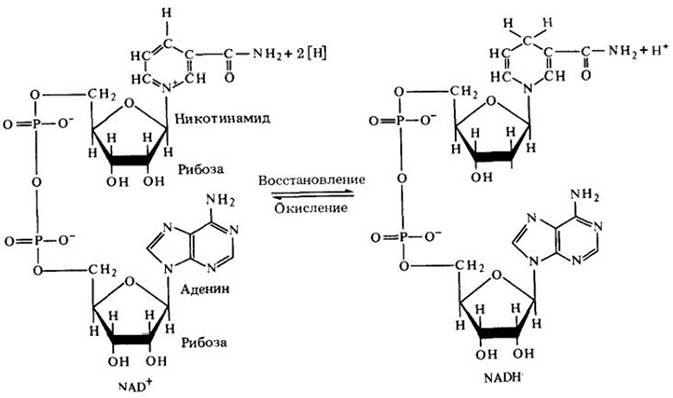
На первый взгляд NAD выглядит сложным и необычным, однако он состоит из довольно известных компонентов биологических молекул. Два пятиуглеродных сахара (рибозы) соединены двумя фосфатными группами. Один из сахаров связан с аденином (азотистым основанием), а второй — с другим азотистым основанием — никотинамидом. (Азотистое основание, связанное с сахаром и фосфатной группой, называется нуклеотидом, а молекула, объединяющая два нуклеотида. — динуклеотидом.) Никотинамидное кольцо — активный конец NAD — присоединяет электроны. Никотинамид — это витамин, называемый ниацином. Витамины представляют собой соединения, которые необходимы в малых количествах многим живым организмам; люди и животные не могут синтезировать витамины и должны получать их с пищей. Клетки человека могут синтезировать NAD, если в пище содержится никотинамид. Многие витамины являются коферментами или частью коферментов.
Никотинамидадениндинуклеотид, подобно многим коферментам, подвергается циклическим превращениям. Так NAD+ регенерирует, когда NADH + Н+ передает свои электроны другому акцептору. Таким образом, наличное число молекул NAD относительно невелико, хотя он участвует во многих клеточных реакциях.
Некоторые ферменты используют кофакторы, которые находятся в комплексе с белком. К ним относятся так называемые простетические группы, например, железо-серосодержащая группа ферредоксинов (с. 100) или пиридоксаль- фосфат (витамин В2) трансаминаз.
Ферментативные пути
Работа ферментов происходит упорядоченно, сериями этапов, называемыми метаболическими путями. В живых организмах поэтому химическая деятельность проходит с удивительной эффективностью. Во-первых, ненужных продуктов накапливается очень мало, поскольку каждый продукт одной реакции используется в следующей и так по всему пути. Второе преимущество последовательно идущих реакций становится понятным, если учесть, что химические реакции могут идти в любом направлении, т. е. они обратимы. Если каждый продукт отдельной реакции по мере образования незамедлительно вступает в следующую, то тенденция к обратимости реакции будет минимальна. Более того, если возможный конечный метаболит будет использоваться также быстро, то целая серия реакций будет двигаться к завершению. Другое преимущество состоит в том, что группы ферментов, участвующих в общих метаболических путях, могут объединяться внутри клетки. Некоторые обнаружены в небольших везикулах (мембранных пузырьках) цитоплазмы. Другие связываются с мембранами специализированных органелл, таких, как митохондрии или хлоропласты.
Регуляция ферментативной активности
Удивительной особенностью клеточного метаболизма является тот факт, что каждая клетка регулирует синтез продуктов, необходимых для ее нормального существования, производя их в нужном количестве и с соответствующей скоростью. В то же время клетка избегает перепроизводства, которое привело бы к напрасной трате энергии и материалов. Доступность исходных молекул субстрата или коферментов — основной лимитирующий фактор, и по этой причине большинство ферментов работает со скоростью, далекой от максимальной.
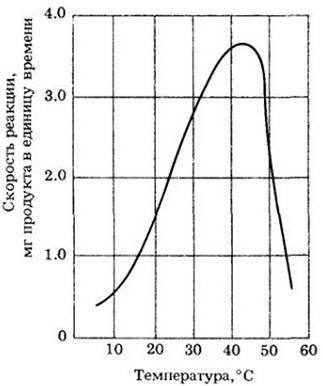
Температура тоже влияет на скорость ферментативных реакций. Повышение температуры увеличивает скорость ферментативных реакций, но до определенного предела. Как видно из рис. 5-9, скорость большинства ферментативных реакций удваивается при подъеме температуры на каждые 10°С, но около 40°С падает очень быстро. Увеличение скорости реакций происходит за счет повышения энергии реагирующих компонентов; уменьшение скорости связано с тем, что в самой молекуле фермента начинается вибрация, которая разрушает водородные связи и нарушает другие, относительно слабые взаимодействия, удерживавшие молекулу в определенном состоянии.
Рис. 5-9. Действие температуры на скорость реакции, катализируемой ферментом. Концентрации фермента и субстрата оставались постоянными. Скорость реакции, как и в большинстве химических реакций, удваивалась с повышением температуры на каждые 10°С до 40°С. Далее по мере повышения температуры скорость уменьшалась, и при 60°С реакция останавливалась в основном из-за денатурации фермента
На активность фермента влияет и величина pH окружающего раствора. Конформация фермента зависит от притяжения и отталкивания между отрицательно (кислыми) и положительно (основными) заряженными группами аминокислот. При изменении pH эти заряды меняются, что приводит к изменению структурной организации фермента, иногда настолько, что он не может функционировать. Возможно, наиболее существенную роль играет изменение зарядов активного центра и субстрата, что сказывается на способности образовывать связи. Иногда некоторые ферменты могут работать при величине pH, далекой от оптимума. Предполагают, что это противоречие является не «оплошностью» процесса эволюции, а способом регуляции активности фермента.
Живые системы имеют механизмы включения и ингибирования активности фермента. Некоторые ферменты образуются в неактивной форме, по мере надобности они активируются, обычно другим ферментом. Эти специфические механизмы будут обсуждаться в гл. 8.
Энергетический фактор: АТР
Все процессы биосинтеза в клетке требуют энергии (так же, как и многие другие процессы). Большая доля этой энергии обеспечивается молекулой аденозинтрифосфата (АТР),которая является основной энергетической «валютой» клетки. Глюкозу, гликоген и крахмал можно уподобить деньгам, лежащим в банке. АТР — «разменная монета» в вашем кармане.
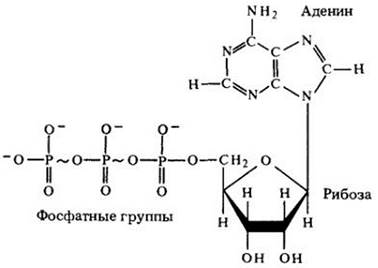
На первый взгляд АТР — сложная молекула, однако, как и у NAD, ее компоненты довольно обычны. В состав АТР входит аденин, 5-углеродный сахар (рибоза) и три фосфатных группы. Эти ковалентно связанные друг с другом группы несут сильно отрицательные заряды; все это важно для энергетической деятельности АТР.
Чтобы понять роль АТР, необходимо кратко остановиться на концепции химических и энергетических связей. Химические связи удерживают атомы в молекуле. Поскольку они имеют постоянную конфигурацию, необходимо приложить энергию, чтобы разорвать их и образовать новые. Эта энергия представляет собой энергию активации. Ферменты значительно уменьшают необходимую энергию активации, поэтому реакции, лежащие в основе жизнедеятельности, протекают с соответствующими скоростями. Однако есть важный ограничивающий момент для химических реакций, происходящих в живых системах: энергия связей в продуктах реакции должна быть меньше энергии связей исходных компонентов. Если следовать этой логике, то можно прийти к заключению, что биосинтетические реакции не могли бы осуществляться. В действительности это не так. Клетки преодолевают подобную трудность путем сопряжения реакций, требующих притока энергии, с реакциями, в которых энергия выделяется. При этом наиболее часто в сопряженных реакциях участвует АТР. Благодаря своей структуре молекула АТР хорошо справляется с этой ролью в живых системах. Когда одна фосфатная группа при гидролизе отщепляется от молекулы АТР, образуется молекула ADP (аденозиндифосфата) и выделяется энергия:
АТР + Н2О —> ADP + Рi1.
1Рi обозначает неорганический фосфат. — Прим. ред.
В ходе этой реакции выделяется 7,3 ккал/моль АТР в виде химической энергии. Удаление второй фосфатной группы приводит к выделению эквивалентного количества энергии и образованию аденозинмонофосфата (АМР):
ADP + Н2O —> АМР + Рi.
Ковалентные связи, содержащие большое количество энергии и связывающие две фосфатные группы, называют высокоэнергетическими (рис. 5-10). Впрочем, это название не отражает существо дела, поскольку энергия, выделяющаяся в результате данных реакций, не происходит целиком из этих связей. Разница в энергии между исходным компонентом и продуктом реакции только частично обусловлена энергией этих связей. Она зависит и от перестройки орбиталей электронов в молекулах АТР и ADP. Фосфатные группы несут отрицательный заряд, и поэтому они отталкиваются друг от друга. Когда фосфатная группа отщепляется, в молекуле меняется расположение электронов и возникает структура с меньшей энергией.
Рис. 5-10. Аденозинтрифосфат (АТР) — это главная энергетическая «валюта» клетки. Связи между тремя фосфатными группами в молекуле АТР играют важную роль в осуществлении его функции. Символ ~ означает высокоэнергетическую связь
В большинстве реакций, происходящих в клетке, концевая фосфатная группа молекулы АТР не просто отщепляется, а переносится на другую молекулу. Этот перенос фосфатной группы называется фосфорилированием, а фермент, который осуществляет его, — киназой. В результате фосфорилирования энергия в виде высокоэнергетических фосфатных связей переносится на соединение, которое в свою очередь становится энергизованным и может участвовать в других реакциях.
Рассмотрим, например, синтез сахарозы в сахарном тростнике, который происходит при участии АТР. Сахароза образуется из моносахаридов — глюкозы и фруктозы; в стандартных термодинамических условиях это эндергоническая реакция; для образования одной молекулы сахарозы требуется 5,5 ккал:
Глюкоза + Фруктоза Сахароза + Н2О.
Однако синтез сахарозы в сахарном тростнике сопряжен с расщеплением АТР, и это — экзергоническая реакция.
Образование сахарозы происходит в результате определенной последовательности реакций: фосфатные группы переносятся на молекулу глюкозы и молекулу фруктозы, энергизуя каждую из них, поэтому общее уравнение следующее:
Глюкоза + Фруктоза + 2 АТР —> Сахароза + 2 ADP + 2 Рi + Н2O.
В этой реакции 5,5 ккал используется для синтеза сахарозы, но общая разница энергии исходных компонентов и субстратов составляет 8,5 ккал. Таким образом, синтез сахарозы в сахарном тростнике сопряжен с расщеплением двух молекул АТР, которые необходимы для образования ковалентной связи между глюкозой и фруктозой.
Где образуется АТР? Энергия, которая выделяется в катаболических реакциях клетки, например, при гидролизе глюкозы, используется для «подзарядки» молекулы ADP. Конечно, эта энергия изначально поступает от солнца в виде энергии радиации, которая в процессе фотосинтеза преобразуется в химическую. Часть химической энергии запасается в виде высокоэнергетических связей АТР, которые затем используются для образования химических связей в органических молекулах. Таким образом, система ATP/ADP служит универсальным механизмом энергообмена между эндергоническими и экзергоническими реакциями.