БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
6. ФИЗИОЛОГИЯ ОБМЕНА ВЕЩЕСТВ
6.5. Фотосинтез: пути ассимиляции углерода
В процессе ассимиляции углерода СO2 преобразуется в углеводы (СH2O)n. Образование одной молекулы гексозы можно представить в виде уравнения фотосинтеза:
6СO2 + 12Н2O —> С6Н12O6 + 6H2O + 6O2.
Эта реакция идет с большими затратами энергии (∆G0 = 2 862 кДж моль-1, что соответствует 477 кДж моль1 на фиксацию одной молекулы СO2). Кислород образуется из воды (см. 6.4.4: Фотоокисление воды). Формально углерод при этом восстанавливается от СO2 в степени окисления +IV до (СН2O)n в степени окисления 0. Следовательно, на восстановление одного атома С нужно затратить 4 электрона, которые поступают от образованного в результате световых реакций фотосинтеза НАДФН + H+ (у некоторых бактерий соответственно HАДH + H+ — см. 6.4.10). Дополнительно в реакциях ассимиляции углерода используется энергия в форме АТФ, которая также образуется в результате световых реакций фотосинтеза (см. 6.4.4). Синтез одной молекулы гексозы из 6 СO2 можно представить в виде следующей реакции:
6СO2 + 12 HАДФН + 12 H+ + 18АТФ —> С6Н12O6 + 12НАДФ+ + 18АДФ + 18ФН + 6H2O.
Она протекает в строме хлоропластов (у фотосинтезирующих прокариот соответственно в цитоплазме) и часто называется темновой фазой фотосинтеза, так как не
зависит от света напрямую. Принципиально, при наличии НАДФН и АТФ данные реакции могли бы протекать без света. Тем не менее в клетке ассимиляция СO2 происходит исключительно на свету, ибо только при таких условиях образуются НАДФН и АТФ. Кроме того, реакции темновой фазы фотосинтеза активируются на свету и инактивируется в темноте (см. 6.5.5). Последовательность реакций темновой фазы сложна и включает большое число промежуточных реакций, катализируемых ферментами и образующих циклический процесс, который был назван циклом Кальвина в честь открывшего его ученого. М. Кальвин в течение нескольких секунд на свету воздействовал на водоросли (позже — на изолированные хлоропласты) радиоактивным 14СO2, затем экстрагировал продукты реакции при помощи горячего этанола и разделял их методом двухмерной бумажной хроматографии. Разделенные продукты реакции с радиоактивной меткой можно было увидеть на радиоавтограмме и идентифицировать, сравнивая положение радиоактивных пятен на хроматограмме с положением пятен веществ известной химической структуры (стандартов).
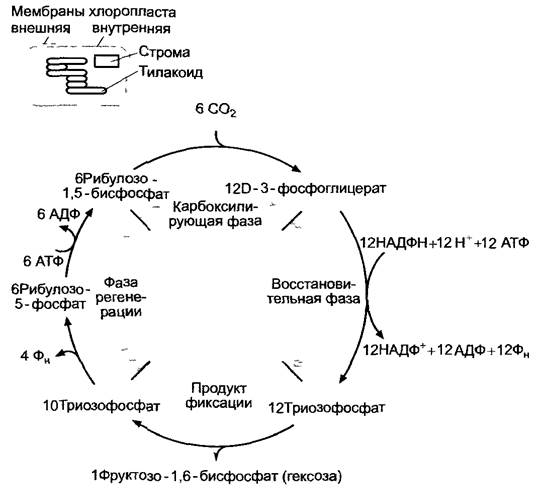
Цикл Кальвина (рис. 6.67) можно разделить на три фазы: карбоксилирование, восстановление и регенерацию.
Данную последовательность реакций можно назвать также восстановительным пентозофосфатным циклом, так как она представляет собой обращенную последовательность реакций окислительного пентозофосфатного цикла (см. 6.10.3.5). Таким образом, многие ферменты, принимающие участие в цикле Кальвина, характерны не только для фотосинтеза.
Рис. 6.67. Общая схема трех фаз цикла Кальвина, образование одной молекулы гексозы из 6 молекул фиксированного диоксида углерода (СO2)
6.5.1. Карбоксилирующая фаза цикла Кальвина
Первым продуктом реакции в цикле Кальвина является D-З-фосфоглицерат. Он появляется в результате карбоксилирования акцептора СO2 рибулозо-1,5-бисфосфата (РуБф). На рис. 6.68 представлена реакция, которая катализируется рибулозо- 1,5-бисфосфаткарбоксилазой/оксигеназой (RubisCO). Окислительную функцию фермента мы рассмотрим позже (см. 6.5.6: Фотодыхание).
Реакция идет с выделением большого количества энергии (∆G0,= -35 кДж • моль-1) и поэтому протекает самопроизвольно. Рибулозо-1,5-бисфосфат теряет свою ендиоловую форму в результате присоединения растворенного в воде СO2. Непосредственный продукт реакции, 2-карбокси-З-кето- D-арабинит-1,5-бифосфат, очень нестабилен и под действием воды быстро расщепляется на 2 молекулы D-3-фосфоглицера- та. Продукт дефосфорилирования в пятом положении и гидрирования аддукта СO2 — 2-карбокси-D-арабинит-1-фосфат — является эффективным ингибитором реакции карбоксилирования. Он должен принимать участие в регуляции in vivo активности RubisCO. Только что фиксированный углерод появляется в карбоксильной группе одной из двух молекул D-3-фосфоглице- рата (см. рис. 6.68).
RubisCO присоединяет СO2, а не преобладающий в водном растворе ион НСО3-. В щелочной среде стромы освещенных хлоропластов (pH 8) равновесие еще больше смещено в сторону гндрокарбоната. Установление равновесия в реакции СO2 + Н2O ⇄ НСО3- + Н+ катализируется ферментом карбоангидразой, однако нет прямых доказательств того, что активность этого фермента в темновой фазе фотосинтеза может определять скорость реакций.
Рибулозо-1,5-бисфосфаткарбоксилаза/ оксигеназа хлоропластов является одним из специфичных ферментов фотосинтеза. Он представляет собой гексадекамер из 8 больших и 8 малых субъединиц и активен только в этой форме. Большая субъединица (51 — 58 кД) кодируется ДНК пластид (см. 7.2.1.2) и транслируется на 70S-рибо- сомах пластид при помощи их мРНК. Малая субъединица (12 — 18 кД), кодируемая ядерной ДНК, синтезируется на 80S-рибосомах в цитоплазме. На предварительном этапе у нее имеется сигнальная последовательность на N-конце, которая способствует транспортировке малой субъединицы RubisCO в хлоропласт (см. 7.3.1.4). Объединение субъединиц в цельный фермент протекает с участием шаперонов (см. 7.3.1.2).
Рис. 6.68. Процесс фиксации СO2в цикле Кальвина. Реакция катализируется ферментом рибулозо- 1,5-бисфосфаткарбоксилазой (RubisСО). Сильным ингибитором фермента является 2-карбокси-D-арабинит-1-фосфат, аналог гидратированной формы 2-карбокси-3-кето-D-арабинит-1,5-бисфосфата
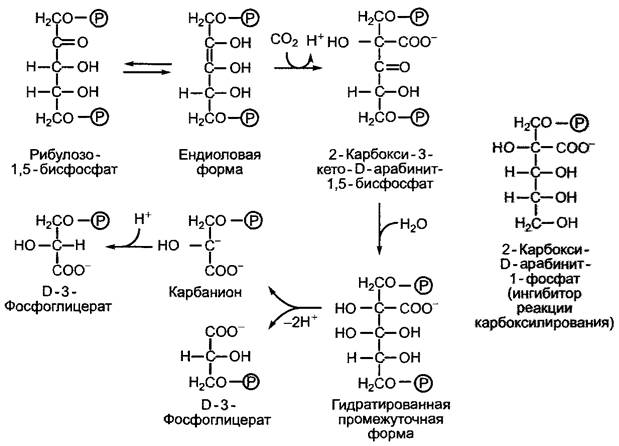
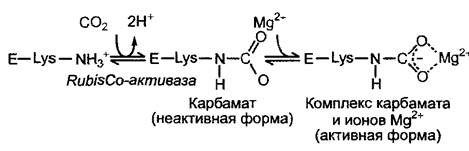
Рис. 6.69. Активация рибулозо-1,5-бис- фосфат-карбоксилазы (RubisCO) ионами Мg2+ и СO2
Каталитический центр является составной частью большой субъединицы. У некоторых пурпурных бактерий фермент имеет некоторые отклонения в строении и представляет собой димер двух больших субъединиц.
Хотя значение Кm (см. 6.1.6.3) RubisCO для СO2 составляет около 10 — 15 мкмоль и таким образом приблизительно соответствует концентрации растворенного в воде СO2(концентрация СO2 в атмосфере 350 — 360 ppm1 соответствует равновесной концентрации СO2 в водном растворе 10 мкмоль), катализ протекает не слишком интенсивно: обменное число фермента составляет лишь 3,3 с-1 на каталитическую субъединицу (для сравнения: карбоангидраза проводит около 105 катализов в секунду). Поэтому для эффективного катализа требуется очень большое количество фермента: количество RubisСО может составлять до 50 % от общего количества белка в листе. RubisСО является наиболее часто встречаемым ферментом биосферы.
1 ppm — part per million, миллионная часть; 350 ppm соответствует 0,035 %. — Примеч. ред.
СO2 является не только субстратом. Он играет также роль аллостерического активатора RubisСО: вместе со специальным лизином большой субъединицы СO2 образует карбаматный комплекс, после присоединения, к которому, иона Мg2+ фермент становится активным (рис. 6.69). Карбамоилирование лизина катализируется ферментом RubisСО-активазой, при этом затрачивается энергия АТФ. Концентрация Мg2+ в строме на свету повышается, поэтому АТФ-зависимое карбамоилирование и присоединение Мg2+являются эффективными механизмами, которые гарантируют то, что фиксация СO2 будет происходить только при наличии всех необходимых компонентов.
6.5.2. Восстановительная фаза цикла Кальвина
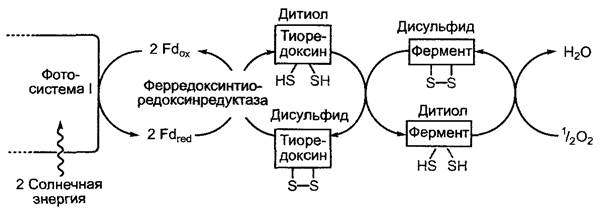
Первичный продукт фиксации СO2 D- 3-фосфоглицерат на втором этапе цикла Кальвина восстанавливается до D-З-фосфоглицеринового альдегида. Реакция идет с большими затратами энергии, источником которой является АТФ. Восстановителем в этой реакции служит НАДФН + Н+. Как АТФ, так и НАДФ являются продуктами световой стации фотосинтеза (рис. 6.70). В процессе реакции D-З-фосфогли- церат под воздействием фермента фосфо- глицераткиназы преобразуется в 1,3-ди- фосфоглицерат, который потом восстанавливается до D-З-фосфоглицеринового альдегида в результате отщепления фосфатного остатка с помощью глицеральдегид- фосфатдегидрогеназы (ГАФДГ). Изоформы двух вышеупомянутых ферментов имеются также в цитоплазме (гликолиз/глюко- неогенез), однако пластидная ГАФДГ является НАДФН/НАДФ+-специфичной, в то время как цитоплазматический изофермент использует НАДН/НАД+. НАДФ-глицеральдегидфосфатдегидрогеназа преобразуется в дитиоловую форму под воздействием ферредоксин/тиоредоксиновой системы (рис. 6.71) и поэтому активируется только на свету. С подобной активацией светом мы уже познакомились на примере АТФ-синтазы (см. 6.4.9). По тому же принципу регулируется активность многих других ферментов цикла Кальвина (см. 6.5.3).
D-З-фосфоглицериновый альдегид находится в равновесии с дигидроксиацетон- фосфатом. Это равновесие поддерживается ферментом триозофосфатизомеразой. D- 3-фосфоглицериновый альдегид и дигидроксиацетонфосфат называют также три- озофосфатами, они уже являются углеводами (триозами). Ряд реакций присоединения служит для:
✵ синтеза последующих углеводов (например, гексоз) из триозофосфатов в качестве конечного продукта фотосинтеза;
✵ регенерации акцептора СO2 рибулозо-1,5-бисфосфата.
6.5.3. Фаза регенерации цикла Кальвина
Для бесперебойной фиксации и восстановления СO2 акцептор СO2 — рибулозо-1,5- бифосфат (РуБФ) — должен постоянно регенерировать. Из 6 молекул РуБФ и 6 молекул СO2образуется 12 молекул трио- зофосфата (см. рис. 6.67). Две молекулы из них идут на синтез одной молекулы гексозы (сначала появляется фруктозо-1,6-бифосфат), 10 оставшихся молекул триозофосфата используются для регенерации шести молекул РуБФ. Так происходит циклический процесс (см. рис. 6.67). Некоторые реакции этого процесса представлены на рис. 6.70. Для регенерации акцептора СO2 непосредственно из рибулозо- 1,5-бифосфата требуется АТФ. Таким образом, на фиксацию одной молекулы СO2 в цикле Кальвина в целом затрачиваются две молекулы НАДФН + Н+и три молекулы АТФ (две в фосфоглицераткиназной реакции, одна в рибулозо-5-фосфат-1-киназной реакции).
Ферменты, катализирующие необратимые реакции восстановительной фазы, рибулозо-5-фосфат-1 -киназа, фруктозо-1.6- бисфосфат-1 -фосфатаза и седогептуло- зо-1,7-бисфосфат-1-фосфатаза активируются на свету ферредоксин/тиоредоксиновой системой (см. рис. 6.71) так же, как и НАДФ-глицеральдегидфосфатдегидрогеназа (см. 6.5.2). Кроме того, обе фосфатазы подобно RubisСО активируются Мg2+ и имеют рН-оптимум около 8,0. Так как благодаря транспорту ионов водорода в люмен тилакоидов на свету значение pH в строме хлоропласта повышается с 7,2 до 8,0, а концентрация ионов и восстановленного тиоредоксина также возрастает, зависимость этих ключевых ферментов цикла Кальвина от pH, Мg2+ и тиреодок- сина представляет собой высокоэффективную систему активации светом (и торможения в темноте) всех процессов темновой фазы.
6.5.4. Переработка первичных продуктов ассимиляции углерода
В качестве конечного продукта реакций фиксации и восстановления СO2 появляется триозофосфат (см. рис. 6.70; рис. 6.72). Некоторая его часть экспортируется из хлоропластов и идет на синтез гексозы в цитоплазме. Из гексозы синтезируется важнейший транспортный сахар — сахароза (тростниковый сахар). Неизрасходованный на синтез сахарозы или регенерацию РуБФ «излишек» триозофосфата (до 30 % от общей продукции фотосинтеза) используется в хлоропластах для синтеза крахмала. Таким образом, восстановленный углерод сохраняется в осмотически неактивной форме. Ассимиляционный крахмал (также называемый транзитным) в темноте преобразуется в глюкозу и триозофосфаты, которые транспортируются в цитоплазму и используются для синтеза сахарозы. Наряду с сахарозой в процессе фотосинтеза интенсивно образуются и другие органические соединения, особенно некоторые дополнительные углеводы и аминокислоты. Эти ассимиляты покидают клетку и по флоэме доставляются к органам-потребителям растения.
Рис. 6.70. Общий процесс цикла Кальвина. Из соображений наглядности представлена только последовательность реакций, в результате которых из трех молекул СO2 образуется одна молекула триозофосфата. Серыми стрелками отмечены необратимые реакции. Они являются основными местами воздействия со стороны механизмов регуляции (также представлены серым цветом). Многочисленные стрелки показывают, сколько молекул реагирует в каждом случае образования из трех молекул СO2 одной молекулы триозофосфата в качестве продукта фиксации. Для образования одной молекулы гексозы из 6 молекул СO2(см. рис. 6.67) представленный здесь процесс должен повториться два раза
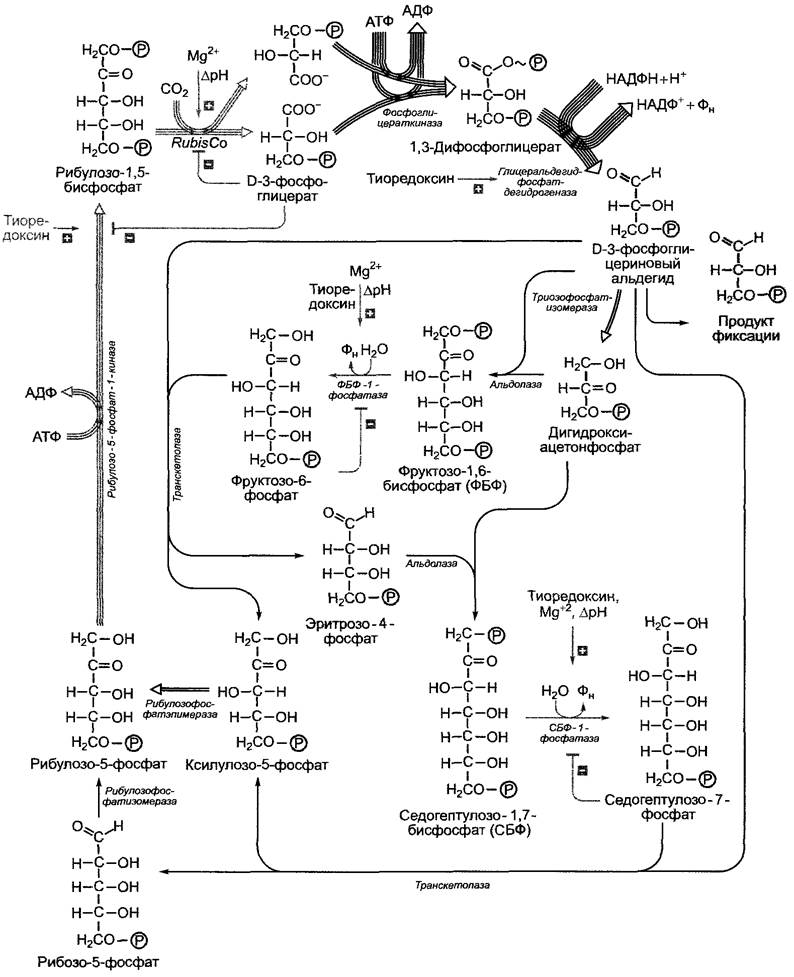
Рис. 6.71. Светозависимая регуляция ферментативной активности посредством дисульфид-дитиоловой конверсии с помощью тиоредоксина. В темноте происходит окисление тиоловых групп с образованием дисульфидных мостиков под действием молекулярного кислорода
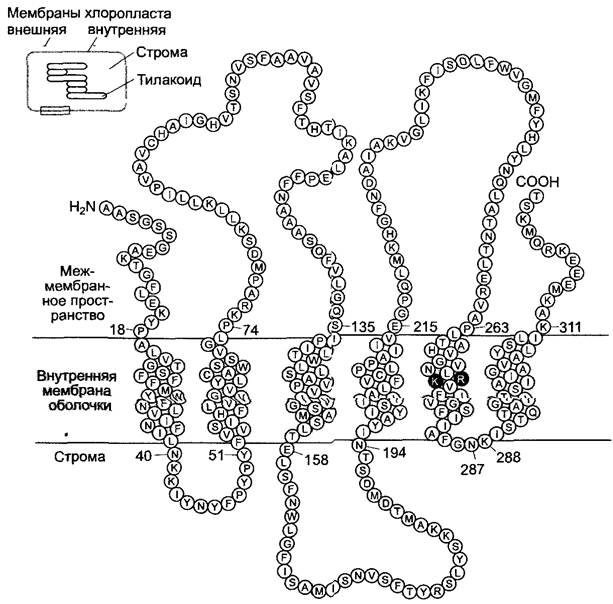
Обмен триозофосфатами между цитоплазмой и хлоропластом обеспечивает пассивный переносчик триозофосфат-транслокатор, который осуществляет взаимный обмен фосфат-ионами, т.е. осуществляется антипорт. Таким образом предотвращается нехватка фосфатов в хлоропласте из- за экспорта триозофосфатов и обеспечивается постоянный синтез АТФ. Триозо- фосфат-транслокатор, вероятно, является гомодимером, мономеры которого имеют молекулярную массу около 30 кДа, и представляет собой самый распространенный белок внутренней мембраны хлоропласта (15 % от всего количества белка этой мембраны). Он кодируется в ядре клетки и в виде предшественника с транзитным пептидом на N-конце и импортируется в хлоропласт, приобретая при этом окончательную конформацию (см. 7.3.1.4). Мономер пересекает внутреннюю мембрану оболочки, предположительно, 6 раз при помощи гидрофобных α-спиралей. Две положительно заряженные аминокислоты в пятом α- спиральном домене — аргинин (R) и лизин (К) — представляют собой «посадочные места» для отрицательно заряженного субстрата (рис. 6.73).
Синтез сахарозы протекает в цитоплазме. Начинается он с фруктозо-6-фосфата и уридиндифосфоглюкозы (УДФГ). Сначала образуется сахарозофосфат (сахарозо- фосфатсинтазная реакция), который де- фосфорилируется под действием сахарозо- фосфат-фосфатазы с образованием сахарозы. Этот последний этап необратим и обеспечивает эффективный синтез сахарозы. Синтезированная сахароза транспортируется к местам использования и запасания по флоэме (см. 6.8: Транспорт ассимилятов). Являясь сахаром трегалозного типа, сахароза не имеет восстанавливающего конца и химически инертна. Поэтому она представляет собой подходящий транспортный метаболит, в отличие от свободных гексоз, которые из-за их карбонильной группы химически активны, их полуацетальные формы изомеризуются в водном растворе (мутаротация, см. 1.4.1; рис. 1.18). УДФГ возникает из УТФ и глюкозо-1-фосфата (УДФ-глюкозопирофосфорилазная реакция). Глюкозо-1-фосфат находится в состоянии равновесия реакции с фруктозо-6-фосфатом, который со своей стороны получается в результате необратимой реакции дефосфорилирования фруктозо- 1,6-бисфосфата (фруктозо-1,6-бисфосфат-1-фосфатазная реакция). Затем происходит присоединение триозофосфатов, так как фруктозо-1,6-бисфосфат и триозофосфат пребывают в равновесных отношениях (альдолазная реакция) (см. рис. 6.70; 6.72).
Рис. 6.72. Метаболизм и транспорт углеводов в фотосинтезирующих и запасающих тканях
Рис. 6.73. Модель расположения полипептидной цепи мономерного триозофосфатного транслокатора во внутренней мембране хлоропласта.
Аминокислоты, показанные темно-серым цветом, лизин (К)-273 и аргинин (R)-274, соединяются с субстратом (однобуквенный код, см. рис. 1.11). Вероятно, природный транслокатор находится в мембране в виде димера
Пластидные изоформы цитоплазматических ферментов катализируют в строме хлоропластов синтез гексозофосфатов из триозофосфатов. Кроме того, для синтеза крахмала, который подробнее рассмотрен в разделе 6.17.1.2, используется активированная глюкоза, в данном случае аденозиндифосфоглюкоза (АДФГ), которая получается из АТФ и глюкозо-1-фосфата в результате реакции, катализируемой ферментом АДФ-глюкозопирофосфорилазой. В темноте ассимиляционный крахмал преобразуется либо в глюкозу под воздействием амилазы и мальтазы (гидролиз), либо в глюкозо-1-фосфат в результате фосфорилирования (фосфорилаза крахмала) (см. 6.17.1.2).
И глюкоза, и глюкозо-1-фосфат используются в синтезе сахарозы. Для этого глюкоза транспортируется в цитоплазму с помощью транслокатора, а глюкозо-1-фосфат преобразуется в строме в триозофосфат, который доставляется в цитоплазму посредством триозофосфатного транслокатора (см. рис. 6.72). Реакцию образования фруктозо-1,6-бисфосфата из фруктозо-6- фосфата катализирует свой собственный фермент фруктозо-6-фосфат-1 -киназа, так как реакция с вышеупомянутым ферментом фруктозо-1,6-бисфосфат-1 -фосфатазой протекает с выделением большого количества энергии, она не может свободно идти в обратном направлении. Дальнейшую судьбу продуктов фотосинтеза рассмотрим позже (см. 6.8; 6.10 — 6.17).
6.5.5. Механизмы регуляции синтеза и распределения углеводов
Регуляционные процессы мы уже упоминали в связи с регуляцией светом цикла Кальвина. Ферменты, которые катализируют необратимые реакции цикла Кальвина, дополнительно ингибируются конечным продуктом (см. рис. 6.70). Благодаря такой точной регуляции удается избежать накопления ненужных в данный момент промежуточных продуктов обмена веществ. Все же согласование активности обмена веществ в хлоропластах и цитоплазме во время световой и темновой фаз фотосинтеза требует дополнительного контроля, который служит в основном для того, чтобы распределить триозофосфаты в соответствии с потребностями клетки. Так, слишком интенсивный расход триозофосфата из цикла Кальвина для синтеза крахмала или сахарозы может повредить регенерации акцептора СО2 — рибулозо-1,5-бисфосфата, и привести в итоге к прерыванию самого цикла. Контрольными точками регуляции здесь являются прежде всего те ферменты, которые катализируют необратимые реакции: в синтезе сахарозы — цитоплазматическая фруктозо-1,6-бисфосфатфосфатаза, а в синтезе крахмала — пластидная АДФ-глюкозофосфорилаза. Механизмы регуляции в цитоплазме направлены в первую очередь на сахарозофосфат- синтазу, а в хлоропластах — на фосфорилазу крахмала.
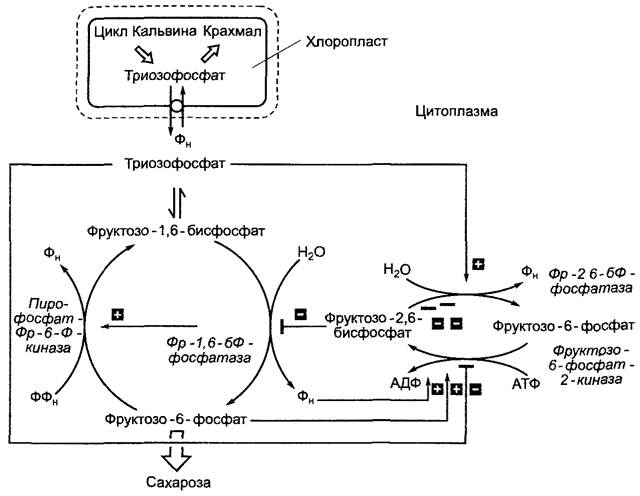
Точный контроль расхода триозофосфата на синтез сахарозы осуществляется посредством изменения концентраций фрук- тозо-6-фосфата, фосфата и триозофосфата (рис. 6.74). Высокие концентрации фосфата и фруктозо-6-фосфата активируют фруктозо-6-фосфат-2-киназу. Она способствует синтезу фруктозо-2,6-бисфосфата (Фр-2,6-бФ), сильного ингибитора фруктозо- 1,6-бисфосфатфосфатазы. Фр-2,6-бФ. Одновременно активирует пирофосфатза- висимую Фр-6-Ф-киназу, т.е. концентрация фруктозо-6-фосфата уменьшается, а концентрация триозофосфата увеличивается. Последний ингибирует фруктозо-6- фосфат-2-киназу и активирует Фр-2,6-бФ- фосфатазу, снижая концентрацию фруктозо-2,6-бисфосфата и повышая использование фруктозо-1,6-бисфосфата. Таким Образом осуществляется очень точно согласованный метаболический контроль использования триозофосфата (см. рис. 6.74). Сюда же относят повышение активности сахарозофосфатсинтазы посредством глюкозо-6-фосфата (индикатора нехватки гексозы в цитоплазме).
Рис. 6.74. Регуляция использования триозофосфатов в цитоплазме при помощи метаболитного контроля фруктозо-2,6-бисфосфатной системы
Менее понятна регуляция синтеза крахмала в хлоропластах. Активность АДФ- глюкозопирофосфорилазы повышается D- 3-фосфоглицератом. Увеличение концентрации фосфоглицерата в строме — показатель того, что фиксируется больше СO2, чем требуется в форме продукта реакции D-З-фосфоглицерата для экспорта в цитоплазму и обеспечения цикла Кальвина. Фосфат ингибирует АДФ-глюкозопиро- фосфорилазу. Увеличение его концентрации происходит преимущественно вовремя темновой фазы фотосинтеза, когда не идет фотофосфорилирование. При этом отсутствует также активатор АДФ-глюкозо- лирофосфорилазы — D-З-фосфоглицерат. Фосфат активирует фосфорилазу крахмала и наряду с крахмалом одновременно служит ей субстратом, поэтому регуляция синтеза и расщепления крахмала посредством изменения концентрации фосфата ведет к эффективной мобилизации транзитного крахмала
В специфической побочной реакции RubisСО катализирует фиксацию одной молекулы O2 вместо СO2, при этом акцептором служит также рибулозо-1,5-бисфос- фат. В отличие от карбоксилирования ок- сигеназная реакция производит только одну молекулу D-З-фосфоглицерата и одно двухуглеродное соединение, 2-фосфогли- колат (рис. 6.75). При интенсивном освещении оксигеназная активность RubisСО составляет около 20 — 30% всех реакций при высоких температурах, достигая даже
50 %. Причина такой зависимости от температуры в том, что сродство RubisСО к СO2 падает с повышением температуры и одновременно сильно уменьшается растворимость СO2 в воде по сравнению с O2. Растение испытывает сильную потребность снова получить из 2-фосфогликолата изъятый из цикла Кальвина углерод (см. рис 6.75). При этом идет потребление кислорода и выделение СO2, поэтому процесс по формальной аналогии с клеточным дыханием называют фотодыханием.
Рис. 6.75. Последовательность реакций и компартментация фотодыхания. Для синтеза серина используются две молекулы глицина: рибулозо-1,5-бисфосфатоксигеназная реакция и синтез глицина из 2-фосфоглико- лата идут 2 раза (на сером фоне): (1) — фосфогликолатфосфатаза; (2) — гликолатоксидаза; (3) — каталаза; (4) — серинглиоксилатаминотран- сфераза и глутаматглиоксилатаминотрансфераза; (5) — глициндекарбоксилазный комплекс; (6) — гидроксипируватредуктаза; (7) — глицерат- киназа; (8) — глутаматсинтаза/глутаминсинтетазный цикл (см. 6. 6. 1); (9) — глицератгликолат-транслокатор; (10) — аминокислотный транслокатор; (11) — малатглутамат-транслокатор; (12) — малат-2-оксоглутарат-транслокатор
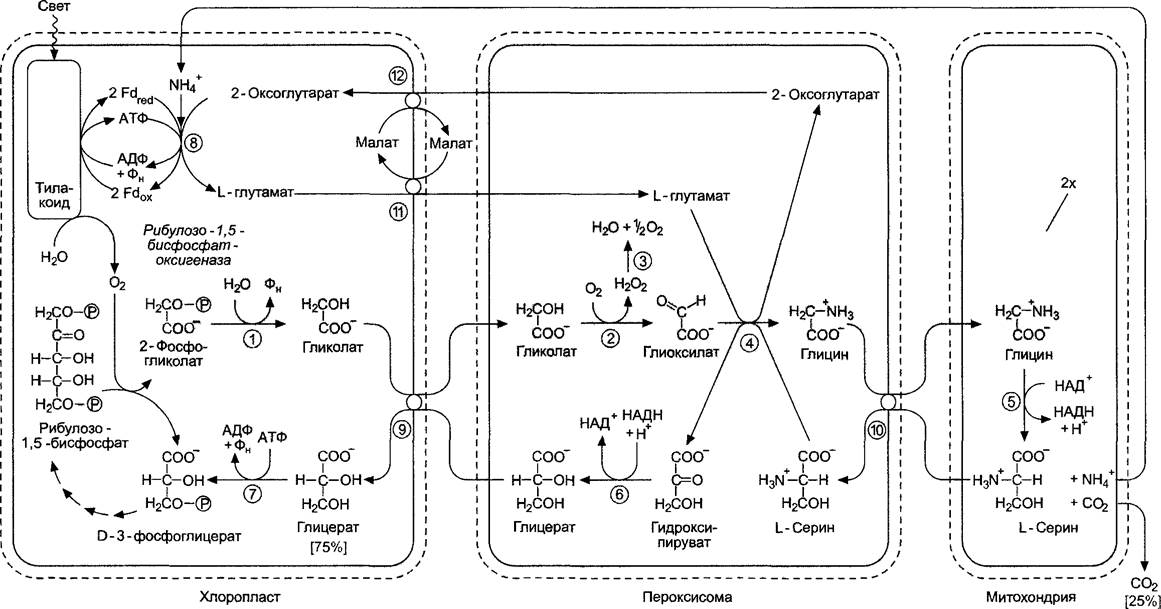
✵ Очень часто, когда говорят об оксигеназ- ной активности RubisСО, упоминают о том, что она недостаточно четко различает субстраты На ранних этапах эволюции фермента способность различать O2 и СO2 не имела значения из-за отсутствия молекулярного кислорода, вследствие чего не подвергалась естественному отбору Только с появлением окислительного фотосинтеза атмосфера постепенно насытилась кислородом Хотя с тех пор прошло почти 1,5 млрд лет, очевидно, что эволюционная оптимизация каталитического центра RubisСО невозможна, поэтому при участии трех клеточных органелл должен был развиться сложный биохимическии механизм устранения вреда (потеря углерода), причиняемого оксигеназной активностью RubisСО. Наряду с этим обсуждают вопрос возможного участия фотодыхания в механизме дополнительной защиты от вредного окислительного действия фотосистем. Последний должен быть задействован в том случае, когда при недостатке воды и, следовательно, закрытых устьицах потребляется меньше СO2, тогда как сильное световое излучение способствует интенсификации синтеза АТФ и НАДФ, а парциальное давление O2 высокое (фотоокисление воды!). Фотодыхание устраняет O2, АТФ и НАДФН1, а также способствует внутреннему высвобождению СO2, чем обеспечивает нормальный ход цикла Кальвина.
1 Указание на использование НАДФН в хлоропласте при фотодыхании ошибочно: сравните с рис. 6.75. — Примеч. ред.
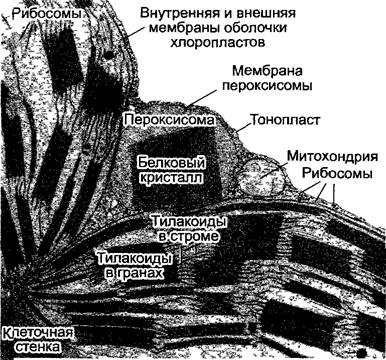
Реакции фотодыхания протекают в хлоропластах, пероксисомах и митохондриях. Пероксисомы, как и глиоксисомы, относятся (см. 6.12) к микротельцам (см. 2.2.6.6). В клетках мезофилла пероксисомы, хлоропласта и митохондрии очень часто располагаются рядом (рис. 6.76), что является доказательством интенсивного обмена веществ между этими органеллами.
Рис.6.76. Органеллы в клетках мезофильногоста табака (срез, 17 000х)
Последовательность реакций фогодыха- ния представлена на рис. 6.75. В результате 2 молекулы фосфогликолата (2 раза по 2 атома С) преобразуются в одну молекулу D-З-фосфоглицерата, который идет на нужды цикла Кальвина. Следовательно, возвращается 75 % углерода, изъятого из цикла в виде 2-фосфогликолата (3 из 4 атомов С), четверть углерода высвобождается в виде СO2 при образовании L-серина из 2 молекул глицина в митохондриях. Синтезированный в результате глициндекарбоксилазной реакции ион NH4+очень эффективно заново фиксируется в хлоропластах с образованием глутамата1. Эта реакция будет подробнее рассмотрена в разделе 6.6. Глициндекарбоксилаза представляет собой мультиэнзимный комплекс, сходный с митохондриальной пируватдегидрогеназой, и в зеленых частях растения может составлять до 30 —50 % от общего количества белка в матриксе митохондрий, тогда как в незеленых частях растения этого фермента либо совсем нет, либо он присутствует в очень малых количествах. Это объясняет те огромные затраты вещества и энергии, которые растение несет в процессе фотодыхания. Кроме того, в пероксисомах в больших количествах содержится каталаза, их основной фермент. Некоторые видимые при электронной микроскопии кристаллические включения в пероксисомах состоят из каталазы. Фермент катализирует реакцию диспропорционирования перекиси водорода (Н2О2), появляющейся в результате гликолатоксидазной реакции, до Н2О + 1/2O2 и таким образом защищает клетки от сильных окислителей.
1 По современным данным, фиксация NH+4 может происходить в цитоплазме и митохондриях. Транспорт токсичного аммония из митохондрии в хлоропласт маловероятен. — Примеч. ред.
Обмен метаболитами между участвующими в фотодыхании компартментами осуществляется транслокаторами во внутренней мембране хлоропластов или митохондрий, обмен веществ происходит благодаря простым норинам в мембране пероксисом, которые представляют собой интегральные порообразующие мембранные белки, выполняющие прямой неселективный перенос низкомолекулярных соединений.
Фотодыхание требует намного больше энергии, чем фиксация СO2. На СO2 в цикле Кальвина тратится в общем 3 молекулы АТФ и 2 НАДФН (см. 6.5.3). Чтобы достичь полного углеродного баланса (т.е. не потерять углерод в процессе оксигеназной реакции), метаболиты, появившиеся в результате двух оксигеназных циклов, — два 2-фосфогликолата и два D-3- фосфоглицерата — должны быть переработаны, а получившийся в итоге СО2 должен заново фиксироваться RubisCO. Так как из двух молекул 2-фосфогликолата образуется одна молекула D-3-фосфоглицерата, в результате цикла Кальвина три молекулы фосфоглицерата должны преобразоваться в три молекулы триозофос- фата, восстановиться тремя РуБФ, т.е. фиксируется 1 молекула СО2, а также компенсируются издержки фотодыхания (1 АТФ: глицерат- киназа, 1 АТФ и 2 Fdred соответствует 1 НАДФН: на повторную фиксацию NH+4)1. Итого, на 2 молекулы О2 тратится 10,5 АТФ и 6 НАДФ (т.е. чуть более 5 АТФ и 3 НАДФ на одну молекулу О2) только для того, чтобы восстановить углеродный баланс2. Отношение карбоксилирования к оксигенированию в листе составляет промежуточное значение между 2:1 и 4:1, поэтому фотодыхание забирает около 50 % АТФ и НАДФ. Итак, около трети полученной от антенных комплексов световой энергии идет на нужды этой побочной реакции.
1 Эту часть можно не учитывать при расчетах, если считать, что повторная фиксация NН+4 идет в митохондриях с использованием НАДН, образовавшегося в реакции 5 (см. рис. 6.75). — Примеч. ред.
2 Энергетические издержки фотодыхания явно преувеличены. Часто перед растением не стоит задача полностью замкнуть цикл фотодыхания. Так, этот процесс может использоваться для образования глицина или серина, необходимых для синтеза белка. При сильной засухе замкнуть цикл фотодыхания принципиально невозможно: происходит потеря СО2 в результате диффузии, и «затраты на повторную фиксацию» не реализуются. — Примеч. ред.
6.5.7. Поглощение СО2 растением
Естественная концентрация СО2 в атмосфере на данный момент составляет около 0,036 — 0,037 об. % (360 — 370 ppm). В середине 60-х гг. XX в. это значение составляло около 320 ppm. С тех пор средняя концентрация СО2 почти линейно возросла до нынешнего значения. Градиент концентрации между окружающим и внутриклеточным воздухом очень невысок, его не хватает на то, чтобы провести СО2 через диффузионный барьер кутикулы и эпидермиса при закрытых устьицах. Совершенно иначе это происходит в процессе дыхания в случае с поглощением О2: высокий градиент концентрации между наружным воздухом (около 21 об. %, 210 000 ррm) и дышащими митохондриями (близко к 0 %) обеспечивает диффузионную норму, которая позволяет покрывать потребность в O2 oрганов растения малого объема даже при закрытых устьицах. СO2 попадает в растение только через открытые устьица, поэтому степень открытости устьиц оказывает решающее влияние на фотосинтез. Так как из-за высокого сродства RubisСо к СO2 (10—15 мкмоль, см. 6.5.1) естественная концентрация СO2 (и концентрация находящегося с ним в равновесных отношениях СO2, растворенного в воде: при 25 °С — около 10 мкмоль) расположена ниже оптимального для фермента уровня, необходимо наименьшее сопротивление диффузии со стороны устьиц (наибольшая ширина устьичных щелей) в процессе фотосинтеза для эффективного снабжения хлоропластов СО2. Из-за того что это одновременно ведет к сильной потере воды в результате транспирации, обеспеченность растения водой также важна для нормального течения фотосинтеза. Как уже было сказано (см. 6.3.4, уравнение 6.38), транспирационный коэффициент на средней листовой поверхности составляет около 200 — 800 (количество граммов транспирированной воды на количество граммов фиксированного СО2). Это значит, что с каждой молекулой фиксированного СО2 испаряется 500—2 000 молекул воды. Данные цифры показывают, насколько критичным является для растения оптимальный контроль над функциями устьиц. Кроме концентрации СО2 и обеспеченности растения водой, степень открытости устьиц регулируется также светом и температурой. Устьица (см. 3.2.2.1; 6.3.4; 8.3.2.5) функционируют как регулируемые вентили, управляемые тургором (рис. 6.77). Непосредственным толчком к открыванию устьичной щели служит изменение тургора в замыкающих клетках и клетках, граничащих с ними, которые составляют устьичный комплекс, так как обладают особым морфологическим строением (см. 3.2.2.1). Повышение тургора в замыкающих клетках по сравнению с его нормой в окружающих клетках ведет к открыванию устьиц, снижение тургора — к замыканию устьичной щели. Регулируемое изменение тургора в замыкающих клетках происходит в результате изменения осмотического потенциала в клетках, которое основано на изменениях концентраций ионов калия (К+) и хлора (СI-) и/или ионов малата (малат2-) в качестве противоионов. Они контролируются несколькими взаимосвязанными процессами ионного обмена, в которых замыкающие клетки функционируют как регулируемые осмотические ячейки.
Рис. 6.77. Упрощенная схема системы обратной связи в регуляции работы устьиц:
![]() — водный потенциал; АБК — абсцизовая кислота. Температурная регуляция не показана. Объяснения в тексте
— водный потенциал; АБК — абсцизовая кислота. Температурная регуляция не показана. Объяснения в тексте
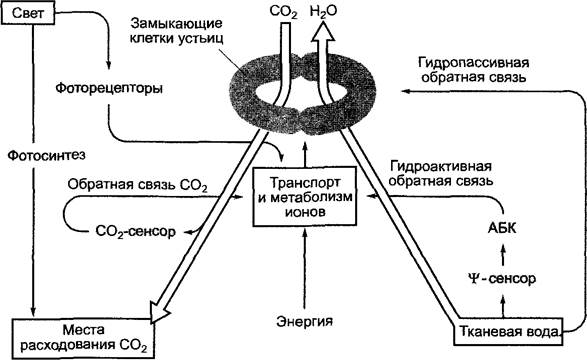
Во-первых, осмотический потенциал замыкающих клеток регулируется имеющейся в тканях водой. Природа сенсора водного потенциала![]() -сенсор) неизвестна. При достижении определенной пороговой величины водного потенциала (от -0,7 до -1,8 МПа в листе) выделяется фитогормон абсцизовая кислота (АБК, англ, abscisic acid, ABA, см. 7.6.4), которая в течение нескольких минут вызывает замыкание устьичной щели. Наряду с этой гидроактивной обратной связью устьица могут реагировать и гидропассивно, т.е. без изменения своего осмотического потенциала. В данном случае замыкающие и соседние клетки теряют или поглощают разные объемы воды.
-сенсор) неизвестна. При достижении определенной пороговой величины водного потенциала (от -0,7 до -1,8 МПа в листе) выделяется фитогормон абсцизовая кислота (АБК, англ, abscisic acid, ABA, см. 7.6.4), которая в течение нескольких минут вызывает замыкание устьичной щели. Наряду с этой гидроактивной обратной связью устьица могут реагировать и гидропассивно, т.е. без изменения своего осмотического потенциала. В данном случае замыкающие и соседние клетки теряют или поглощают разные объемы воды.
Так, например, во время дождя клетки эпидермиса страдающего от недостатка воды растения поглощают воду быстрее, чем замыкающие клетки. Повысившийся таким образом тургор клеток эпидермиса по сравнению с его нормой в замыкающих клетках ведет к гидропассивному замыканию устьичной щели.
Замыкающие клетки реагируют на концентрацию СO2 внутри листа. Сенсорный механизм, вероятно, локализован в замыкающих клетках, его природа еще не изучена. Снижение концентрации СO2 в замыкающих клетках ведет к повышению их осмотического потенциала, последующему проникновению воды в клетки, объем которых увеличивается, и, наконец, к открыванию устьиц. При повышении концентрации СO2 в замыкающих клетках осмотический потенциал снова снижается, устьичные щели закрываются.
Свет, с одной стороны, оказывает на замыкающие клетки прямое воздействие (предположительно, посредством рецепторов синей части спектра)1 и приводит к
повышению их осмотического потенциала, следовательно, к открыванию устьичных щелей. Однако свет также открывает устьица опосредованно. При освещении запускается фотосинтез, снижается концентрация СO2 в межклетниках, а затем и в замыкающих клетках.
В целом температурная зависимость открывания устьичной щели соответствует таковой фотосинтеза. У растения, хорошо обеспеченного водой, при высоких температурах зависимость открывания устьиц от СO2 может исчезнуть. Это экологически целесообразно, так как при высоких температурах транспирационное охлаждение препятствует перегреву листа и максимально приближает его температуру к уровню, оптимальному для фотосинтеза
Степень открытости устьиц может колебаться на одном и том же листе. Замыкающие клетки реагируют на локальные условия. Это позволяет растению достичь значительной оптимизации газообмена.
Механизм движения устьиц и его контроль, как и особенности регуляции газообмена у растений с дополнительными механизмами фотосинтеза (см. 6.5.8 и 6.5.9), рассмотрены в разделе 8.3.2.5.
Поглощение СO2 растением можно описать уравнением, выведенным из первого закона диффузии Фикса (см. уравнение 6.30):
![]()
Диффузионный поток СO2 (JС02) прямо пропорционален разности концентраций углекислоты (∆ССО2) и обратно пропорционален сопротивлению диффузии г, которая равна сумме отдельных сопротивлений диффузии каждой устьичной щели (рис. 6.78). В воздухе СО2 (как и О2) может диффундировать быстрее, чем в воде, примерно в 105 раз (СО2 в газовой фазе — 1 см с-1, в водной — 10-5 см с1). Поэтому для растения основная задача состоит преимущество в том, чтобы по возможности доставлять обменные газы к местам реакций в газовой фазе. Для этого служит система межклетников (см. 3.2.1, рис. 3.7).
1 По последним данным, кроме криптохрома в рецепции светового сигнала участвует фитохром (рецептор красного света) — Примеч. ред.
К преградам, которые встречает на своем пути к фотосинтезирующим хлоропластам наземных растений СO2(см. рис. 6.78), причисляют пограничный слой, т.е. воздушный слой, прилегающий к листу, сопротивление которого пропорционально толщине, либо слою воды, окружающий листья водных растений. В этом слое не протекают конвекционные процессы. Толщина воздушного слоя может составлять несколько миллиметров, при сильном ветре или течении этот слой может полностью исчезнуть. Толщина и устойчивость пограничного слоя зависят также от строения листа (например, от наличия волосков). При высоком сопротивлении пограничного слоя СO2 из него попадает внутрь листа быстрее, чем поступает в него снаружи, таким образом прилегающий к листу воздушный слой обедняется углекислым газом. Практически непреодолимо сопротивление кутикулы, однако СO2 проникает через устьица с помощью диффузии. Устьичное диффузионное сопротивление регулируется физиологическим состоянием растения и колеблется в широких пределах. При открытых устьицах оно в 4 — 5 раз меньше сопротивления мезофилла, которое складывается из диффузионного сопротивления в системе межклетников, сопротивления поверхностного натяжения при переходе в жидкую фазу в клеточных стенках (например, в палисадных клетках) и диффузионного сопротивления внутри цитоплазмы и хлоропластов. Поскольку величина градиента СO2 в последнюю очередь определяется активностью карбоксилирующих ферментов, говорят еще и о так называемом «карбоксилирующем сопротивлении», которое не является диффузионным.
Рис. 6.78. Разность концентраций СО2 и транспортное сопротивление в листе С3-растения с устьицами только на нижней стороне в процессе фотосинтеза
Концентрация СО2 в наружном воздухе (Са) и воздухе в межклетниках (С1) становится минимальной в том месте, где проходит карбокси- лирование (Сс). В систему межклетников СО2поступает не только снаружи, но и в результате дыхания митохондрий (Сm) и фотодыхания в пероксисомах (Ср).1 В качестве транспортного сопротивления работают* сопротивление пограничного слоя га, регулируемое сопротивление устьиц rs, диффузионное сопротивление в межклетниках г1, сопротивление при растворении и транспорте СO2 в жидкой фазе клеточной стенки rwи протоплазме гр, гх — «сопротивление карбоксилирования»
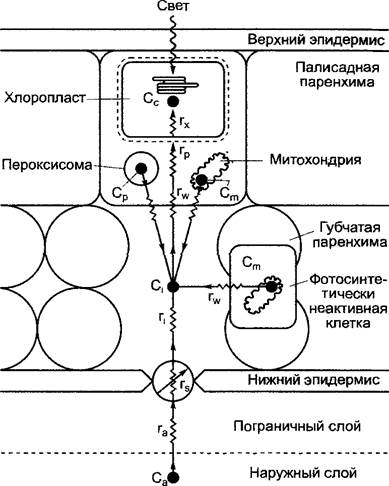
1 В процессе фотодыхания высвобождение СO2 идет не в пероксисомах, а в митохондриях (ср рис. 6.75), т.е. эта часть схемы неверна. — Примеч. ред.
В дальнейшем растение поддерживает концентрацию СО2 в межклетниках на постоянном уровне при помощи изменения устьичного диффузионного сопротивления, пока на пути этой регуляции не возникнут какие-нибудь «помехи» (например, дефицит воды см. 8.3.2.5).
Многие растения аридных и теплых областей, так называемые С4-растения (см. 6.5.8) и САМ-растения (см. 6.5.9), развили дополнительные механизмы, которые обеспечивают повышенную эффективность использования воды и дают растениям возможность иметь транспирационные коэффициенты от 200 (С4-растения) до соответственно 30 (некоторые САМ-растения) (см. 6.3.4.1). Этого удалось достичь благодаря механизму предварительной фиксации СО2, который так компартментализирован, что может служить «СО2-насосом» для цикла Кальвина. Компартментация у С4-растений достигается пространственным разграничением, а у САМ-растений — временным. В результате во время световой фазы С4-растения могут держать свои устьица более закрытыми, чем С3-растения, и снижать таким образом потребность в воде. САМ-растения переносят предварительную фиксацию СО2на темновое время суток, чем уменьшают транспирацию. Данные процессы подробнее рассмотрим в двух следующих разделах.
Рис. 6.79. Реакции, связанные с карбоксилированием фосфоенол- пирувата в процессе фотосинтеза у С4-растений
В дополнение к отдельным реакциям различных типов С4-фотосин- теза см табл 6 20 и текст КО — клетки обкладки проводящих пучков, КМ — клетки мезофилла
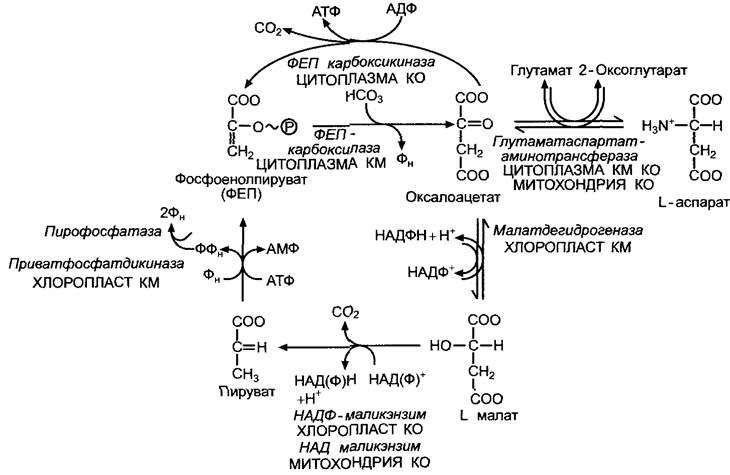
6.5.8. Предварительная фиксация СО2 у С4-растений
В отличие от С3-растений первичным продуктом фотосинтеза у С4-растений является не трехуглеродное соединение D- 3-фосфоглицерат, а четырехуглеродное. Сначала появляется оксалоацетат, который, как показали эксперименты с меченым 14СO2 (рис. 6.80), очень быстро преобразуется в малат или аспартат (рис. 6.79); фосфоглицерат появляется позднее.
С4-растения отличаются особой анатомией листьев (кранц-анатомией): проводящие пучки имеют форму венца1, они окружены слоем крупных клеток (клеток обкладки проводящего пучка), хлоропласта которых отличаются от пластид клеток мезофилла своим размером. Если С4-растение синтезирует малат, то в хлоропластах клеток обкладки отсутствуют граны и обильно синтезируется крахмал (диморфизм хлоропластов, рис. 6.81; 6.82). Мезофилл обычно окружает клетки обкладки проводящего пучка и не дифференцирован на губчатую и палисадную паренхиму.
1 Термин «кранц-анатомия» восходит к нем. Kranz — венец, корона. Здесь описаны анатомические особенности, характерные для злаков. — Примеч. ред.
Клетки мезофилла и клетки обкладки обладают высокой степенью функциональной специализации, которая определяется различным количеством важнейших ферментов в том и другом типе клеток (табл. 6.19). Оба типа связаны между собой многочисленными плазмодесмами. Часто, но все же не всегда, апопластическому обмену веществ препятствует непроницаемый субериновый слой в клеточной стенке, который отделяет клетки мезофилла от клеток обкладки проводящего пучка.
Рис. 6.80. Накопление радиоактивной метки 14С в органические соединения у С4-растений после фотосинтеза различной продолжительности с применением 14СO2
А — листья сахарного тростника в условиях «steady-state»-фотосинтеза (те при постоянном поступлении 14СO2), В — листья сорго в условиях «pulse-chase-labeling» (кратковременная экспозиция в меченом 14СO2) Листья ассимилировали 15 с, поглощая 14СO2, затем снабжались нерадиоактивным 12СO2. В обоих случаях радиоактивные атомы углерода очень короткое время находились в основном в С4-кислотах и только затем оказывались в D-3-фосфоглицерате и, наконец, в сахарозе или крахмале (α-глюкане)
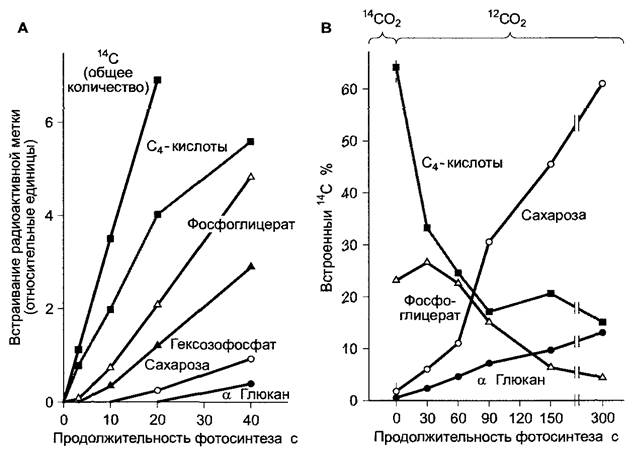
Рис. 6.81. Кранц-анатомия С4-растения (Zea mays) (с любезного разрешения I Эцгг). Клетки обкладки проводящего пучка на поперечном срезе листа окружают проводящий пучок кольцом и четко отличаются от клеток мезофилла. Хлоропласты клеток обкладки проводящего пучка заметно крупнее, чем таковые в клетках мезофилла
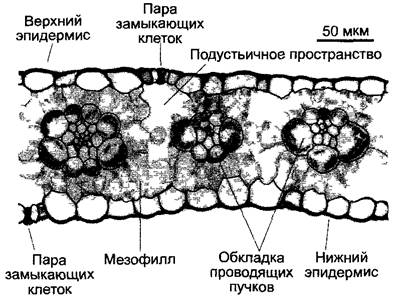
Рис. 6.82. Срез через клетки мезофилла и клетки обкладки проводящего пучка (фрагменты) листа кукурузы. Косо проходящая на рисунке клеточная стенка содержит пробковый слой (стрелки), который окружает каждую клетку обкладки и, помимо всего прочего, сильно уменьшает диффузию СО2 из клеток обкладки. Обмен веществами между клетками осуществляется только посредством плазмодесм (12 000х)
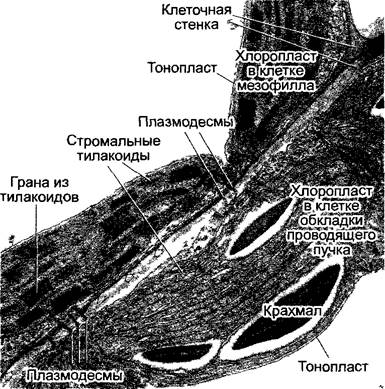
Таблица 6.19. Локализация некоторых ферментов в двух типах хлоропластов у С4-растений
Хлоропласты мезофилла |
Хлоропласты клеток обкладки |
ФЕП-карбоксилаза |
РБФ-карбоксилаза (RubisCO) |
НАДФ-малатдегидрогеназа* |
Маликэнзим |
Глутаматаспартатаминотрансфераза* |
Альдолаза |
Пируватфосфатдикиназа |
Синтаза крахмала |
НАДФ-глицеральдегидфосфатдегидрогеназа |
РуБФ-киназа |
— |
НАДФ -глицеральдегидфосфатдегидрогеназа |
* Хлоропласты с высоким содержанием малатдегидрогеназы обладают низкой активностью аминотрансферазы и наоборот.
Четырехуглеродные соединения образуются в мезофилле из фосфоенолпирувата и НСО3. Гидрокарбонат-ион находится в равновесии с диффундирующим СО2: СО2 + Н2О ⇄НСОз- + Н+. Эта реакция катализируется карбоангидразой, см. 6.5.1. На первом этапе возникает оксалацетат (см. рис. 6.79). Реакция катализируется ферментом фосфоенолпируваткарбоксилазой (ФЕП-карбоксилазой). Ее сродство к НСОз- (Кm = 10 мкмоль/л) не слишком отличается от сродства RubisСО к СO2 (Кm) 10—15 мкмоль/л). Так как RubisСО не синтезируется в хлоропластах клеток мезофилла, конкуренции ферментов за субстрат СO2 удается избежать. В процессе синтеза малата (рис. 6.83) у С4-растений, к которым относятся такие важные культурные растения, как кукуруза, сахарный тростник и просо, сразу же происходит преобразование полученного оксалоацетата в L-малат. Эту реакцию катализирует находящаяся в хлоропластах НАДФ-зависимая малатдегидрогеназа. При помощи транслокатора малат экспортируется из хлоропластов в цитоплазму клеток мезофилла и по плазмодесмам поступает в клетки обкладки проводящего пучка. Там снова при участии специфического транслокатора он поступает в хлоропласты, где распадается на пируват и СO2. Эта реакция катализируется маликэнзимом1 с образованием НАДФН + Н+ (см. рис. 6.79; 6.83). Благодаря высокой концентрации малата в строме клеток обкладки концентрация свободного СO2 в строме достигает значения около 70 мкмоль/л. Это обеспечивает его эффективную фиксацию при помощи рибулозо-1,5-бисфосфаткарбоксилазы (RubisСО). Накопившийся пируват транспортируется обратно в клетки мезофилла, где посредством пируватфосфатдикиназы (см. рис. 6.79; 6.83) в хлоропластах преобразуется в фосфоенолпируват, который в свою очередь при помощи триозофосфат-транслокатора транспортируется в цитоплазму в обмен на фосфат и играет там роль субстрата в следующей реакции фиксации СO2 (см. рис. 6.83).2
1 Маликэнзим — это сокращенное название декарбоксилирующей малатдегидрогеназы. — Примеч. ред.
2 Этот цикл превращений назван по имени первооткрывателей циклом Хэтча—Слэка. Одновременно с ними С4-путь был исследован Карпиловым. — Примеч. ред.
Рис. 6.83. Реакции обмена в клетках мезофилла и обкладки проводящего пучка, и обмен веществами между этими клетками в листе С4-растения малатного типа
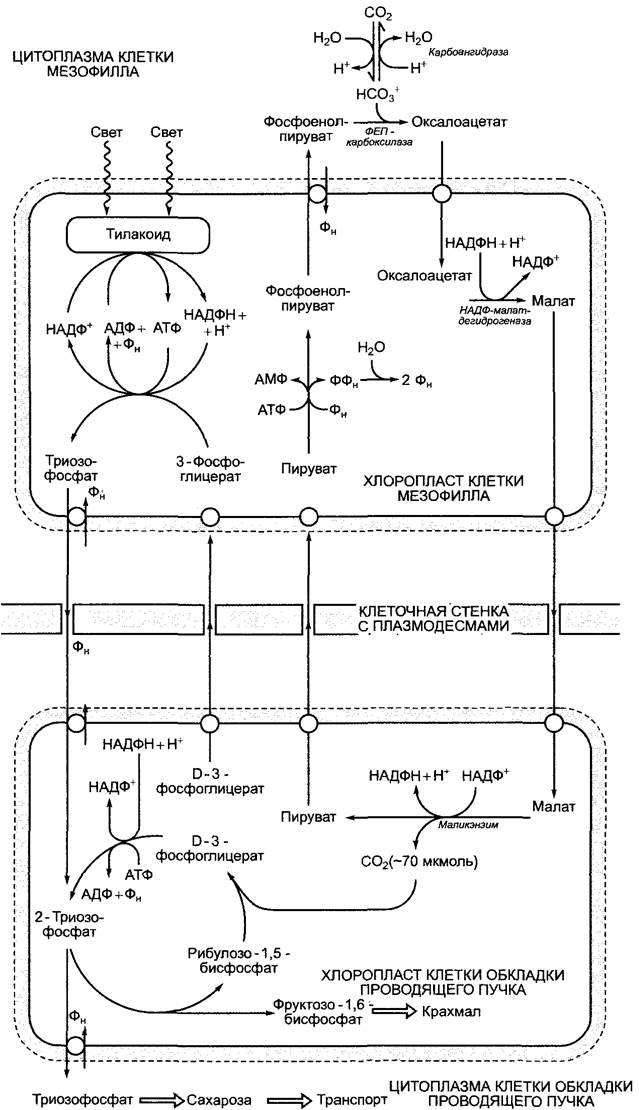
В отличие от клеток мезофилла в клетках обкладки проводящего пучка протекает полный цикл Кальвина. Так как в этих хлоропластах отсутствуют граны, активность фотосистемы II весьма невысока, и на свету в тилакоидах происходит циклический транспорт электронов с участием фотосистемы I и цитохром-b6/f комплекса. Это приводит к синтезу АТФ без образования НАДФН + Н+ (см. 6.4.7). Потребность цикла Кальвина в НАДФН наполовину покрывается маликэнзимом. Таким образом, малат транспортирует как СO2, так и его восстановительный эквивалент (один НАДФН-эквивалент на одну молекулу СO2) из хлоропластов мезофилла в хлоропласты клеток обкладки. Тем не менее на одну фиксированную молекулу СO2 требуется 2НАДФН + 2Н+ (см. 6.5.2). Считается, что половина синтезированного D-З-фосфоглицерата покидает хлоропласты клеток обкладки и восстанавливается в хлоропластах мезофилла до триозофосфата, который при участии триозофосфат-транслокатора снова
поступает в хлоропласты клеток обкладки (см. рис. 6.83).
Следствием недостаточной активности фотосистемы II в хлоропластах клеток обкладки является сильное сокращение фотоокисления воды. Низкая концентрация кислорода в строме в сочетании с повышенной концентрацией СO2 тормозят оксигеназную реакцию RubisСО. Благодаря этому значительно подавляется фотодыхание. Поэтому С4-растения отличаются повышенной продуктивностью фотосинтеза по сравнению с Сз-растениями.
В процессе фотосинтеза С4-растения, образующие малат, нуждаются не в 3 молекулах АТФ и 2НАДФН + 2Н+ на одну молекулу СO2, подобно С3-растениям, а в 4АТФ и 3 НАДФН + ЗН+, точнее в 2 АТФ + + 2НАДФН + 2Н+ в хлоропластах мезофилла и в 2АТФ + 1 НАДФН + Н+ в хлоропластах клеток обкладки. Тем не менее у С4-растений устраняется перерасход энергии на фотодыхание, так что в итоге С3- и С4- растения тратят на фотосинтез примерно одинаковое количество энергии. При низких температурах и соответственно неактивном фотодыхании С3-растения имеют преимущество перед С4-растениями1, при высоких температурах (>25 °С) из-за активации оксигеназной реакции RubisСО в выигрыше С4-растения. Здесь следует добавить, что благодаря механизму концентрирования СO2 у С4-растений RubisСО может обеспечить реакцию с субстратом даже в случае нехватки воды, а, следовательно, при закрытых для снижения транспирации устьицах или при интенсивном освещении, когда устьица полностью открыты, а СO2 не хватает. Эффективность механизма предварительной фиксации СO2 при помощи ФЕП-карбоксилазы заключается не в высоком сродстве фермента к субстрату, а в том, что в строме освещенных хлоропластов (pH 8) отношение НСO-3:СO2 составляет приблизительно 50:1. Таким образом, ФЕП-карбоксилаза2, в отличие от RubisСО, может присоединять доминирующую в этой равновесной реакции форму углекислоты и результативно проводить фиксацию СO2, даже если при полузакрытых устьицах концентрация растворенного в воде СO2 упадет ниже уровня, приемлемого для RubisСО
1 Распространение С4-растений на север ограничено линией изотермы июля +12 °С. При температурах ниже +4 °С нарушается транспорт по плазмодесмам, мезофилл и обкладка не могут обмениваться метаболитами. — Примеч. ред.
2 Это рассуждение противоречит данным о локализации ферментов в клетке ФЕП-карбоксилаза работает в цитозоле, а не в строме. Поэтому обсуждать pH стромы и реакции в этом компартменте в связи с активностью ФЕП-карбоксилазы некорректно — Примеч. ред.
Из всего сказанного следует, что С4-ра- стения при недостатке воды, высоких температурах и интенсивном солнечном излучении имеют преимущество перед С3-растениями. Они прежде всего произрастают в теплых, засушливых областях3 с повышенной инсоляцией. В калифорнийской Долине Смерти 70 % всех видов, растущих относятся к С4-растениям. Подсчитано, что около 17 % всех посевных площадей заселено С4-растениями и они осуществляют около 30 % глобального фотосинтеза.
3 Речь идет об умеренно-аридных условиях (вода есть, но ее не всегда хватает). В экстрааридных условиях преобладают САМ-расте- ния — Примеч. ред.
Принцип «СO2-насоса» и связанные с ним экофизиологические преимущества относятся также и к С4-растениям, синтезирующим аспартат. От синтезирующих манат они отличаются по структуре и некоторым ферментам (табл 6 20) По реакциям высвобождения СO2 среди синтезирующих аспартат различают НАД-малатдегирогеназный и ФЕП-карбоксикиназный типы В обоих случаях аспартат образуется при помощи глутаматаспартатаминотрансферазы в цитоплазме клеток мезофилла Аспартат симпласти- чески по плазмодесмам поступает в клетки обкладки проводящего пучка У С4-растений НАД- малатдегидрогеназного типа он через аминокислотный транслокатор транспортируется в митохондрии, где преобразуется в оксалоацетат под действием изоформы глутаматаспартатамино- трансферазы Оксалоацетат превращается в ма- лат и разлагается на пируват и СO2.
Малатдегидрогеназа (маликэнзим) НАД- специфична Освобожденный СO2 диффундирует из митохондрий в хлоропласты и фиксируется посредством RubisСО. Пируват преобразуется в аланин, который экспортируется из митохондрий клеток обкладки проводящего пучка (задействован аминокислотный транслокатор) в цитоплазму клеток мезофилла, где снова превращается в пируват. В обратимой реакции превращения пирувата в аланин принимают участие две изоформы аланинглутаматаминотрансферазы. Пируват, как это происходит и у C4-растений, синтезирующих малат, снова преобразуется в фосфоенолпируват
У ФЕП-карбоксикиназного типа C4-метаболизма часть освобожденного в клетках обкладки СO2 поставляется оксалоацетатом, который превращается в фосфоенолпируват с помощью ФЕП-карбоксикиназы и АТФ. Результатом реакции является высвобождение СO2. Оксалоацетат у этих растений синтезируется из L-аспартата (см рис 6 79) Реакции протекают в цитоплазме клеток обкладки. Меньшая часть СO2 освобождается при участии митохондриальной изоформы НАД-маликэнзима. Клетки мезофилла также синтезируют и поставляют малат в митохондрии (см синтез маната на рис 6 83) За перенос малата в митохондрию отвечает транслокатор дикарбоновых кислот.
Обмен веществ по С4-типу запускается на свету У ФЕП-карбоксилазы при действии света фосфорилируется остаток серина, таким образом она активируется. В этой форме фермент ингибируется только высокими концентрациями малата. В темноте дефосфорилированный фермент малоактивен и даже очень низкие концентрации малата могут затормозить его действие НАДФ-зависимая малатдегидрогеназа активируется на свету тиоредоксином (см рис. 6.71), у пируватфосфатдикиназы на свету дефосфорилируется остаток треонина, что и придает ей каталитически активную конформацию.
Виды растений с фотосинтезом С4-типа могут принадлежать к самым разным систематическим группам, при этом в некоторых таксонах они встречаются в большом количестве, например, среди Роасеае. Сюда относятся как важнейшие культурные растения, такие, как кукуруза, сахарный тростник и просо, так и распространенные сорняки вроде бермудской травы (свинороя). Многие С4-виды можно найти также среди Аmaranthасеае (бывшие Сhenopodiасеае) В этом семействе в роде Аtriplex встречаются и С3- и С4-виды С4-виды относятся к галофитам и на соленых почвах страдают также от (физиологической) нехватки воды.
Таблица 6.20 Классификация подгрупп С4-растений по первичному продукту фиксации СO2 и способу декарбоксилирования
Первичный про дукт фиксации СO2 (синтезируется в КМ, переносится в КО) |
Декарбокси лирующий фермент |
Восстановительные эквиваленты или АТФ, образующиеся при декарбо- ксилировании |
Основное вещество, переносимое из КО в КМ |
Цитологические особенности КО (у злаков) |
Вид (примеры) |
Малат |
НАДФ-Mаликэнзим |
Образование 1 НАДФ на СO2 |
Пируват |
Наличие субериновой пластинки, хлоропласты с редуцированными гранами, кото рые расположены центро- бежно |
Zea mays, Saccharum officinarum, Sorghum bicolor, Digitana sanguinahs |
Аспартат |
НАД-маликэнзим |
Образование 1 НАД на СО2 |
Аланин/ Пируват |
Субериновая пластинка отсутствует, хлоропласты с гранами, которые расположены центростремительно |
Amaranthusf retroflexus, Portulaca1 * * olerácea, Pamcum mihaceum |
Аспартат |
ФЕП-карбоксиназа |
Использование 1 АТФ на СO2 |
ФЕП/ аланин |
Наличие субериновой пластинки, хлоропласты с гранами, которые расположены беспорядочно либо центро- бежно |
Pamcum máximum, Chlons gayana |
1 Приведенные примеры не относятся к злакам и имеют иные анатомические особенности по сравнению с указанными в таблице — Примеч. ред.
КМ — клетки мезофилла, КО — клетки обкладки
Для идентификации С4-растений используют метод определения первичных продуктов фотосинтеза (после кратковременной фиксации меченого 14СO2), метод определения углекислотной компенсации точки фотосинтеза (т е определение такой концентрации СO2 во внешнем воздухе, при которой не происходит продуктивной фиксации СО2, следовательно, фо- тосинтетическая фиксация СО2 и высвобождение СО2 при дыхании компенсируются) Изучают также анатомию листа и проверяют уровень фотодыхания (низкий, совсем отсутствует). И наконец, определяют соотношение изотопов углерода 13С 12С в растении. Последний метод основан на том, что растения во время фотосинтеза поглощают природные изотопы углерода в разных количествах (в атмосферном СО2 содержится 98,89% 12С и 1,11% 13С) растения отдают предпочтение 12СО2, в меньшей степени поглощают 13СО2 и в еще меньшей степени — 14СО2. Дискриминация 13СО2 более выражена при РБФ-карбоксилазной фиксации СО2, чем при ФЕП-карбоксилазной. У С4-растений RubisСО реализует практически весь предварительно зафиксированный ФЕП-карбоксилазой СO2, поэтому процент 13С в С4-растении соответствует продукту ФЕП-карбоксилазной реакции, в то время как С3-растение определяется по соотношению изотопов, характерному для RubisСо. Соответственно, С4-растения содержат относительно более высокий процент 23С, углеводы, выделенные из С4-растений, тяжелее, чем сахара из С3-растений
Соотношение 13С 12С определяется масс-спектрометрическими методами и выражается значением δ13С
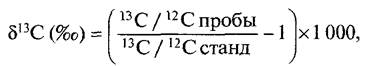
где стандартом является контрольный образец известняка. Чем более отрицательным получается значение δ13С, тем меньше содержание изотопа 13С. У С4-растений значение δ13С составляет около -14 ‰, у С3-растений — около -28 ‰. Поскольку сахарный тростник является С4-растением, а сахарная свекла — С3-растением, по содержанию изотопа 13С можно масс-спектро- метрически определить происхождение сахарозы. Таким способом можно, например, отличить настоящий ром (приготовленный из сахарного тростника) от купажированного (с добавкой сахара, приготовленного из свеклы).
6.5.9. Предварительная фиксация СO2 у САМ-растений
У многих суккулентов — растений, которые имеют ткань, способную запасать воду, предварительная фиксация СO2 до малата и проходящая отдельно от нее окончательная фиксация СO2 посредством RubisCO представляют собой последовательность реакций, аналогичную циклу у С4-растений, синтезирующих малат. Правда, эти процессы разделены не в пространстве, а во времени. Характерным для данной последовательности реакций (рис. 6.84) является запасание в вакуолях большого количества первичного продукта фиксации СO2 — малата, которое происходит ночью (повышение осмотического давления в вакуоли, возможно, связано с суккулентностью). Днем малат высвобождается и перерабатывается. Кислотность клеток колеблется в определенном ритме при смене дня и ночи, что и дало название этому явлению — суточный (циркадный) кислотный ритм.Этот процесс сначала был открыт у Crassulaceae (толстянковые), поэтому его называют кислотным метаболизмом Crassulaceae, или САМ (от англ. crassulacean acid metabolism).
Рис. 6.84. Характерные для кислотного метаболизма Crassulaceae реакции (САМ) в темное (черные стрелки) и светлое время суток (серые стрелки) и их компартментация. Характерные ферменты: (1) — ФЕП-карбоксилаза; (2) — НАД-малатдегидрогеназа; (3) — маликэнзим; (4) — пируватфосфатдикиназа. Серое поле: ФЕП-карбоксилаза ночью активна (фосфорилированная форма, ФЕПК-Ф). Эта форма очень слабо ингибируется малатом. Днем появляется сверхчувствительный к малату дефосфорилированный фермент (ФЕПК). Активация осуществляется специфической киназой ФЕП-карбоксилазы (ФЕПК-киназой), которая присутствует только ночью. К1 — константа ингибирования (представляет собой такую концентрацию ингибитора, которая требуется для ингибирования фермента на 50 %)
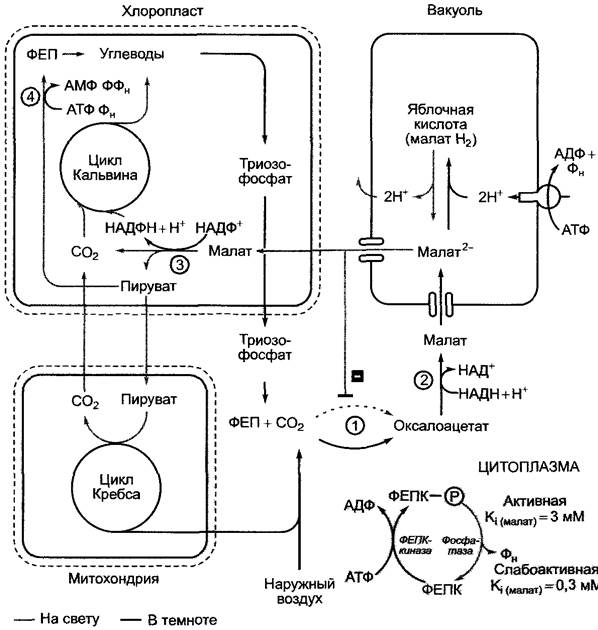
У всех CAM-растений ФЕП синтезируется ночью из крахмала через триозофос- фат путем гликолиза, а затем происходит фиксация СO2 ФЕП-карбоксилазой (субстратом является HCO3-) и образование оксалоацетата. Малат, полученный из него при помощи цитоплазматической НАД- зависимой малатдегидрогеназы, транспортируется в вакуоль по малатному каналу (см. рис. 6.5). Транспорт малата против градиента концентрации происходит благодаря трансмембранной протонной силе, которая возникает в тонопласте при работе Н+-АТФазы, одновременно доставляющей противоионы к аниону малата. Поскольку значение pH содержимого вакуолей падает со временем, малат ночью должен находиться в основном в форме протонироранной яблочной кислоты. По сравнению с анионом малат2- она лучше проникает через мембрану тонопласта, поэтому растущая концентрация ионов водорода ограничивает способность вакуолей запасать малат. Повышение содержания малата в цитоплазме ингибирует ФЕП-карбоксилазу. Этот принцип отрицательной обратной связи в конце концов лимитирует фиксацию СО2 при удлинении темнового периода.
Запасенный в течение ночи малат днем не совсем понятным образом экспортируется из вакуоли по малатному каналу. В дневном декарбоксилировании, как и у С4-растений, можно выделить 3 типа: НАДФ-маликэнзимный (например, Саctасеае, Аgavасеае), НАД-маликэнзимный (Сгаssulасеае) и ФЕП-карбоксикиназный (Асlepiасеае, Вгоmeliасеае, Liliасеае). Повторная фиксация СO2 (освобожденного на свету при помощи одного из этих трех ферментов) ФЕП-карбоксилазой вместо RubisСО предотвращается, поскольку ФЕП-карбоксилаза на свету из активной (фосфорилированной) «ночной формы» с низкой чувствительностью к малату (50%-е ингибирование при приблизительно 3 ммоль/л малата) переводится в очень малоактивную (дефосфорилированную) «дневную форму» с высокой чувствительностью к малату (50%-е ингибирование при 0,3 ммоль/л малата). Следовательно, днем экспортированный из вакуолей малат ингибирует и без того каталитически слабый фермент так сильно, что он не может провести фиксацию СO2, поэтому полученный из малата СО2 поступает в распоряжение RubisСО.
Как и у С4-растений, у САМ-растений также происходит фосфорилирование остатка серина ФЕП-карбоксилазы (см. 6.5.8). Отвечающий за это фермент киназа ФЕП- карбоксилазы подлежит строгому контролю со стороны биологических часов и обнаруживает циркадную ритмичность (см, 7.7.2.3). Киназа ФЕП-карбоксилазы быстро распадается, поэтому количество фермента в клетке определяется интенсивностью транскрипции гена (см. 7.2.2.3 — Транскрипционный контроль). Эта интенсивность высока ночью и исчезающе мала днем. В постоянных условиях освещения (в постоянной темноте соответственно тоже) эта ритмичность сохраняется, что является показателем ее эндогенной природы (ср. 7.7.2.3).
Экологическое преимущество САМ- растений состоит в том, что поступление СO2 в открытые ночью устьица приводит к сильному снижению потерь воды по сравнению с дневным временем. Это возможно благодаря очень низким ночным температурам в местах обитания этих растений и соответственно высокой относительной влажности воздуха. В условиях хорошего водоснабжения САМ-растения не только фиксируют освобожденный в процессе разложения маната СO2, но и открывают устьица, чтобы после исчерпания запасов малата фиксировать с помощью RubisСо наружный СO2. Во время засухи, к которой эти растения, собственно, и адаптированы, они наоборот прикрывают устьица и тем самым сильно сокращают фиксацию наружного СO2 в течение светового времени суток по сравнению с темным. Транспирационный коэффициент при этом составляет от 30 до 150 (фиксация С02 происходит преимущественно ночью, см. 6.3.4.1), т.е. потребность в воде САМ-растений составляет лишь малую долю таковой С3-растений. Однако ввиду ограниченной способности вакуолей запасать малат при возможности фиксировать СO2 исключительно в темноте ежедневный прирост биомассы весьма невелик. Исходя из этого, САМ-растения конкурентоспособны прежде всего в сухих местах произрастания, где холодные ночи способствуют синтезу и запасанию малата, а случайные, очень редкие, но все же обильные осадки дают возможность пополнить запасы воды. Некоторые САМ-растения, например, виды рода Mesembryanthemum, при избыточном водоснабжении переходят на обычный С3- фотосинтез. Недостаток воды или засоление индуцируют синтез ферментов САМ. В экстремальных условиях пустынные растения (например, кактусы) при сильной нехватке воды держат устьица закрытыми и ночью, заново фиксируя освобожденный в процессе дыхания СO2.
Способность к САМ-фотосинтезу свойственна в основном суккулентам: известно около 300 видов растений, которые используют данный способ дополнительной фиксации СO2, например, Aizoaceae, Аросупасеае (бывшие Asclepiada- ceae), Asteraceae, Cactaceae, Crassulaceae, Didieraceae, Euphorbiaceae, Portulacaceae, Vitaceae, Agavaceae, Bromeliaceae (например, ананас), Liliaceae, Orchidaceae (например, ваниль); кроме того, САМ обнаружен, например, у похожего на лишайник эпифита Tillandsia usneoides из сем. Bromeliaceae и у некоторых тропических эпифитных папоротников ( Руггоsia piloselloides, P. longifolia). Важным отличием САМ-растений наряду с ферментным составом является не столько строение органов, сколько специфика клеточных структур (наличие крупных объемных вакуолей в клетках, содержащих хлоропласты: «сочность на уровне клетки»).
В отношении дискриминации изотопов можно сказать, что вовремя темновой фиксации и дальнейшей переработки СO2 на свету САМ- растения ведут себя подобно С4-растениям (меньшая дискриминация 13СO2 по сравнению с 12СO2). Поскольку как в условиях засухи усиливается темновая фиксация (большая часть от общей фиксации), в САМ-растениях содержится больше 13С (как и в С4-растениях). Определение значения δ13С дает возможность констатировать засуху в естественных местах произрастания САМ-растений.
6.5.10. Дополнительное повышение концентрации СО2 посредством гидрокарбонатного насоса
У всех цианобактерий имеется связанный с мембраной гидрокарбонатный насос (НСОз-) для повышения концентрации СО2 в карбоксисомах — местах локализации RubisСО. Таким образом компенсируется низкое сродство фермента к СO2 и подавляется фотодыхание. В функционально похожем механизме концентрирования СO2 у водорослей (а также фикобионтов лишайников) какую-то роль, возможно, играют пиреноиды (см. 2.2.9.1).
6.5.11. Влияние внешних факторов на ассимиляцию углерода
На фотосинтез, как и на все жизненные процессы, довольно сложным образом влияют разные факторы: стадия развития растения, обеспеченность СO2, водой и минеральными веществами, качество и интенсивность освещения, температура. К фотосинтезу, как и ко всем физиологическим процессам, зависящим от целого ряда факторов, применим закон минимума: минимальное воздействие одного-единственного фактора ограничивает продуктивность всего процесса. При недостаточном обеспечении СO2 благоприятные условия освещения, водоснабжения и температурного режима не могут дать положительного результата, и, наоборот, оптимальная концентрация СO2 не гарантирует максимальную продуктивность фотосинтеза, если при этом недостаточна интенсивность освещения. Если все обстоятельства в общем и целом благоприятны, в качестве отправной точки принимают, что каждый квадратный метр зеленой листовой поверхности синтезирует 0,5 —1,5 г глюкозного эквивалента в час. Это приблизительно соответствует использованию 3 м3атмосферного СO2.
Далее рассмотрим по отдельности некоторые факторы и их общее влияние на фотосинтез растений. Об экологической физиологии фотосинтеза см. 13.7.1.
Структура листа (см. 4.3.1.1; рис. 4.64) обеспечивает оптимальное поглощение света. Клетки эпидермиса в разрезе имеют форму линзы. Они фокусируют свет и направляют его на нижележащие клетки палисадной паренхимы, где проходит до 80 % фотосинтеза. Непоглощенные фотоны рассеиваются по пограничным поверхностям клеток губчатой паренхимы, благодаря чему фотоны не устремляются в определенном направлении, путь света через лист удлиняется, и вероятность поглощения квантов повышается.
Интенсивность направленного на лист излучения может измениться за короткий промежуток времени (например, во время затенения при облачной погоде). Хлоропласта многих растений противостоят таким колебаниям, изменяя свое положение относительно падающего на лист света. В так называемом положении слабого освещения линзовидные органеллы подставляют свету свою широкую сторону, в положении сильного освещения — свою узкую сторону. В переориентации органелл (см. 8.2.2) принимают участие кальций- зависимые процессы с участием цитоскелета, предположительно, актина. Благодаря этому изменяется поперечное сечение «световых ловушек», и поглощение квантов света в антенных комплексах стабилизируется в определенных границах независимо от интенсивности поступающего света.
Листья или побеги многих растений (например, люпина, люцерны, фасоли, сои, хлопчатника) следуют за дневным ходом солнца таким образом, чтобы листовые пластинки оставались перпендикулярными к лучам падающего света (англ, sun tracking). Этот положительный фототропизм1 (см. 8.3.1.1) способствует максимально интенсивному освещению листьев и сокращает до минимума потери при отражении2.
1 В русской литературе фототропизмом называют необратимые ростовые процессы. В приведенном примере более корректно говорить о фотонастиях листьев (обратимый процесс). — Примеч. ред.
2 В пустынных регионах с избыточной инсоляцией наблюдается противоположное явление: в результате фотонастии листовые пластинки располагаются ребром к свету. — Примеч. ред.
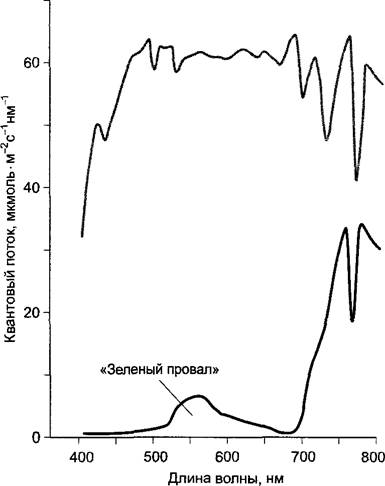
В естественных условиях количество хлорофилла не является фактором, ограничивающим интенсивность фотосинтеза, так как даже при низкой интенсивности освещения листья с пониженным содержанием хлорофилла поглощают так много фотонов, что фотосинтетический аппарат насыщается. Высокое содержание хлорофилла в листьях может играть роль только в том случае, если нужно как можно более полно абсорбировать какую-то небольшую часть спектра, необходимую для фотосинтеза, который выполняют уже другие листья (рис. 6.85). Теневые листья, как правило, содержат более высокую удельную концентрацию хлорофилла на единицу площади листовой поверхности, чем «солнечные». Они имеют также особо крупные граны, в которых может быть уложено до 100 тилакодов. Теневыносливые растения содержат больше пигментных молекул, обслуживающих электрон-транспортную цепь («фотосинтетическая единица»), а следовательно, имеют более крупные антенны и сниженное отношение хлорофиллов а : b (т. е. относительно больше хлорофилла b для лучшего использования зеленой части спектра, где хлорофилл поглощает кванты с низкой вероятностью). Кроме того, в тени в листьях преобладает фотосистема II. Теневые листья часто тоньше «солнечных», благодаря чему уменьшается затенение хлоропластов с нижней стороны (см. рис. 7.73). В регуляции развития листьев принимает участие фоторецепторная система, чувствительная к красной части спектра, фитохром (см. 7.7.2.4).
Рис. 6.85. Спектр распределения энергии над насаждениями пшеницы (серая кривая) и внутри листовой массы насаждений в тени (измерено на расстоянии 80 см от почвы (черная кривая); высота растений — 90—95 см)
При небольшой силе излучения интенсивность фотосинтеза пропорциональна фотонному потоку (бокс 6.2; рис. 6.86), пока остальные факторы не являются лимитирующими. Это верно и при более высокой интенсивности света, поэтому график зависимости наблюдаемого (нетто-) фотосинтеза от интенсивности света идет линейно до тех пор, пока, наконец, в результате дальнейшего повышения интенсивности света интенсивность фотосинтеза больше не увеличивается (наступает фотонасыщение). Как правило, в такой ситуации лимитирующим фактором служит обеспечение растения СO2. Область фотонасыщения для растений, приспособленных к солнечным местам обитания, располагается в пределах от 500— 1500 мкмоль • м-2 • с-1, у теневыносливых растений — в пределах от 100— 500 мкмоль • м-2 • с-1 (кривая фотосинтеза выходит на плато). У С4-растений (см. 6.5.8) в отличие от С3-растений фотонасыщение не происходит даже. При интенсивном освещении вследствие более эффективного снабжения СO2 цикла Кальвина. У С4-растений общий процесс фотосинтеза, как правило, лимитируется освещением, поскольку недостаток воды не может обеспечить достаточное лимитирующее действие СO2, когда устьица закрыты частично или полностью1.
1 Речь идет о засухе в пределах физиологической нормы. При экстремальной засухе продуктивность фотосинтеза у С4-растений также снижается. — Примеч. ред.
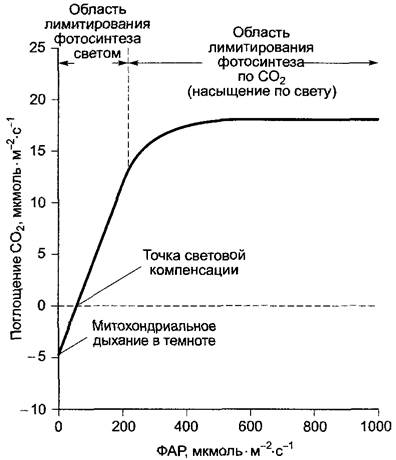
Рис. 6.86. Зависимость нетто-фотосинтеза С3- растения от света. Схематический график, построенный на основании типичных значений поглощения СO2 в зависимости от фотосинтетически активной радиации (400—700 нм, ФАР) при оптимальной температуре
При еще более сильном освещении фотосинтетический аппарат может повреждаться, так что активность фотосинтеза снова падает. В естественных условиях это может произойти в том случае, если растения, адаптированные к условиям затенения, подвергать внезапному освещению солнечными лучами, особенно при низкой температуре, когда ферментативные реакции фиксации СO2 замедлены (механизмы защиты фотосинтеза от ущерба, наносимого светом, см. 6.4.8; 6.5.6).
Бокс 6.2. Основные понятия фотобиологии
Под квантовым (фотонным) потоком (также квантовой, или фотонной, плотностью тока) понимают количество фотонов на определенную площадь и в определенное время (единицы измерения: моль - м-2 • с-1 = Е • m-2 • с-1, 1 Эйнштейн = 1 моль фотонов). Часто при этом рассматривают лишь область от 400 — 700 нм, т. е. область фотосинтетически активной радиации (ФАР, англ. photosynthetically active radiation). При полном солнечном свете, достаточной высоте Солнца и ясном небе ФАР обычно составляет 1 500 — 2 000 мкмоль - м-2 • с-1, в облачную погоду — около 190 — 220, в тени растений — около 25 — 50 (исходные данные) и в сумерках — только 1 мкмоль • м-2 • с-1. В полнолуние при ясном небе можно измерить 3,2 х 10-4 мкмоль • м-2 • с-1, а только лишь звездный свет дает фотонный поток в 1,2 • 10 6 мкмоль х м-2 • с-1. Основной целью измерений является определение не количества молей фотонов, а количества их энергии, что и показывает эквивалентная единица потока энергии (Дж • м-2 • с-1 = Вт • м-2); энергия одного фотона определяется при помощи уравнения 6.41, энергия 1 моля фотона — при помощи уравнения 6.42. Количество фотонов в единицу времени (моль • с-1) называется фотонным потоком. Только для монохроматического света, который, например, используется при поглощении действующих спектров, энергетический и фотонный потоки возможно пересчитывать друг в друга. При излучении, в котором присутствуют фотоны с одной длиной волны, нужно сначала определить спектральное распределение энергии.
А. Основные понятия спектральной фотометрии
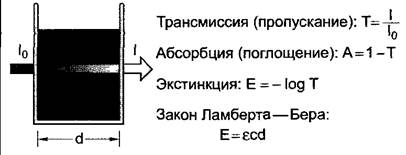
Когда свет пропускают через образец, он абсорбируется в зависимости от структуры образца (рис. А). Под трансмиссией, или пропусканием, (Т) — понимают отношение интенсивности света при выходе из. образца (I) к интенсивности света при входе в образец (In). Трансмиссия показывает, какая часть света покидает образец. Часть света, которая поглощается образцом (абсорбируется), называется абсорбцией (А). Абсорбция и трансмиссия часто выражаются в процентах. Экстинкцию (Е) нельзя путать с абсорбцией. Значения экстинкции часто используются в фотометрии, так как для веществ в растворе при постоянном пути света (d) они пропорциональны концентрации веществ (с) (закон Ламберта—Вера). Коэффициент пропорциональности ε называется молярным коэффициентом экстинкции. Он измеряется в [1 моль-1 • см-1]; концентрация веществ дается в [моль • л-1], а путь света в [см].
Интенсивность света, при которой потребление СO2 (соответственно выработка O2) полностью компенсируется выработкой СO2 при митохондриальном дыхании (соответственно поглощением O2), называется точкой световой компенсации фотосинтеза (см. рис. 6.86), здесь нетто-фото- синтез равен нулю. В «солнечных» листьях (соответственно у светолюбивых растений) точка световой компенсации составляет около 10 — 15 мкмоль • м-2 • с-1, в теневых листьях (у теневыносливых растений) — около 1 — 10 мкмоль • м-2 •с-1. Светолюбивые растения не могут, таким образом, расти под плотным листовым пологом, в то время как теневыносливые даже в густой тени достигают положительного углеродного баланса (см. 13.7.1).
6.5.11.2. Влияние концентрации углекислого газа
Концентрация СO2 в атмосфере в 2000 г. составила 370 ppm (0,037 % по объему); за последние 40 лет она возрастала в среднем на 1 ppm в год (см. 13.7.6). Это связано прежде всего с деятельностью человека: сжигаются ископаемые резервы углерода (в настоящее время около 6 •1012 кг ежегодно, общее количество ископаемого углерода на Земле оценивается в 3 500 • 1012кг). Из-за повышенной концентрации С02 атмосфера поглощает длинноволновое излучение в больших количествах. Возможные воздействия на климат (парниковый эффект), вегетацию, комплексные влияния на внутренние процессы в растениях и на экосистемы (см. 13.7.6) необходимо интенсивно изучать.
У С3-растений фотосинтез при полной инсоляции должен, предположительно, лимитироваться количеством доступного диоксида углерода (см. рис. 6.86). Путем повышения концентрации СO2 в среде можно при прочих равных условиях добиться повышения фотосинтетической активности у этих растений. Это делается при использовании метода «СO2-удобрения» тепличных культур. Концентрацию СO2 в теплицах с огурцами и томатами повышают на 0,1 %, и соответственно урожай возрастает на треть в сезон при условии, что остальные питательные вещества и свет присутствуют в достаточном количестве (экология содержания питательных веществ, см. 13.7.6).
Водным растениям не труднее поглощать СO2, чем наземным, так как в воде при обычной температуре 15 °С СO2 растворяется в том же процентном соотношении, в каком он присутствует в воздухе (10 мкмоль), к тому же медленная диффузия С02 в воде компенсируется движением воды (конвекцией). Подводные растения, у которых отсутствуют устьица и не выражена кутикула, либо поглощают всей поверхностью листьев только растворенный СO2, либо (некоторые виды растений) дополнительно поглощают Са(НСО3)2.
Первичные фотохимические реакции фотосинтеза сильно зависят от температуры. Ферментативные процессы также находятся в существенной температурной зависимости (см. 6.1.6.4), которую можно описать реакцией по правилу Вант-Гоффа: скорость реакции v (см. уравнение 6.26) увеличивается почти вдвое при повышении температуры на 10 °С (значение Q10):
![]()
Отсюда следует, что при низкой интенсивности освещения (лимитирующий фактор — свет) фотосинтез зависит от температуры меньше, чем при высокой интенсивности (лимитирующий фактор — СO2). При повышающейся температуре растущая фотосинтетическая активность отражает прежде всего высокую скорость ферментативных реакций. С другой стороны, идущая на убыль активность фотосинтеза при температуре выше оптимума имеет сложную природу: хотя вместе с температурой повышается активность определяющего скорость реакции фермента RubisСО, его сродство к СO2 снижается; одновременно при высокой температуре СO2 растворяется в воде хуже относительно O2, т. е. фотодыхание с повышением температуры активируется (см. 6.5.6). Таким образом, продуктивность нетто-фотосинтеза уменьшается. При высоких температурах фотосинтетический аппарат разрушается вследствие инактивации ферментов и повреждения мембран. Для растений различных местообитаний температурные границы и температурный оптимум располагаются соответственно в характерных диапазонах (экофизиология — см. 13.7.1).
Растения Земли под воздействием света перерабатывают в целом около 1 875 км3 воды с образованием кислорода. Следовательно, на протяжении почти 8 млн лет фотоокислению было однократно подвергнуто в общем около 1,5 • 109 км3 жидкой воды. С тех пор как существует оксигенный фотосинтез, запасы воды на Земле уже несколько сотен раз подвергались расщеплению. Все же только очень малая часть расходной воды служит растению субстратом для фотосинтетического расщепления (см. 6.4.4).
Недостаток воды не означает нехватку субстрата, он действует косвенно: с одной стороны, вызывает сильную дегидратацию клетки, разрушение ферментов и функциональных структур (например, мембран), с другой стороны, ведет к закрыванию устьиц и сокращению поступления СO2. При закрытых устьицах лист способен повторно ассимилировать только освобожденный при дыхании внутренний СO2.