БОТАНИКА ТОМ 3 - ЭВОЛЮЦИЯ И СИСТЕМАТИКА - 2007
10. ЭВОЛЮЦИЯ
Наша Земля населена огромным числом организмов самой разнообразной формы и образа жизни. Только в царствах растений и грибов в настоящее время известно около 360000 видов и, вероятно, куда большее их число еще не описано. Все это многообразие появилось в результате эволюции после, скорее всего, однократного возникновения жизни более 3,5 млрд лет назад, т. е. благодаря тому, что виды изменялись и одни виды возникали от других. «Ничто в биологии не может быть понято вне эволюционного контекста» — это часто цитируемое высказывание Ф.Добжанского метко отмечает ключевое значение эволюционного процесса для биоло
гии. В этой главе представлены важнейшие аспекты эволюционного процесса.
Очень упрощенно эволюционный процесс представляют следующим образом. Благодаря производству обычно многочисленного потомства каждый вид потенциально способен увеличить свою численность в геометрической прогрессии. Так, например, одно дерево секвойи вечнозеленой (Sequoia sempervirens) в течение своей продолжительной, несколько сотен лет, жизни приносит 109 — 1010 семян. И даже живущий всего несколько недель однолетник, например, мятлик однолетний (Роа annua), к концу своей жизни производит около 100 семян. Этот потенциальный геометрический прирост численности, однако, ограничен биотическими и абиотическими факторами окружающей среды, так что число индивидуумов определенного вида в течение сравнительно короткого геологического промежутка времени остается более или менее постоянным. Из этого следует, что в чреде последовательных поколений статистически один родительский индивидуум заменяется одним потомком. Какие индивидуумы при этом выживут и смогут размножаться, чаще всего зависит не от слепого случая, а от особенностей конкурирующих индивидуумов. Ведь потомство оказывается неидентичным, потому что, благодаря как мутациям, так и связанным с парасексуальным и половым процессами рекомбинациям возникает генетическая и, следовательно, наследственная изменчивость. Различные индивидуумы соответственно своим генетическим свойствам более или менее успешны в условиях данной окружающей среды. Больший «успех» (приспособленность) заключается в сравнительно высокой вероятности выживания и репродукции. Результатом этой дифференциальной выживаемости и репродуктивного успеха различных индивидуумов и является естественный отбор. Следствием совместного действия мутаций, рекомбинаций и естественного отбора может быть изменение генетического состава последующих поколений, а именно эволюция. Кроме названных процессов для эволюции важны и случайные изменения частоты генов.
В настоящее время никто из ученых не оспаривает существования эволюции, она доказана множеством наблюдений. Это и прямые наблюдения изменений видов в природе со временем (самый известный, наверное, пример — изменение относительных частот темной и светлой форм бабочки березовой пяденицы в процессе индустриализации в Великобритании, которая вызвала почернение стволов берез из-за копоти), и обнаружение широкого распространения внутривидовых вариаций и почти непрерывных переходов между многими видами, и наблюдение гомологического сходства между самыми различными организмами по морфологическим и молекулярным признакам, и иерархическая структура этих сходств (т.е. уменьшения сходства в ряду: виды одного рода —> роды одного семейства —> семейства одного отряда и т. д.). и постепенное возникновение ныне существующих организмов, документированное ископаемыми остатками, а также многократно использованные человеком возможности экспериментально изменять виды в результате селекции.
Еще до опубликования в 1859 г. Чарлзом Дарвином своего эпохального труда «Происхождение видов путем естественного отбора...» не раз предполагали, что виды не постоянны, а изменчивы и что все жившие в прошлом и ныне существующие виды произошли от одного общего предка. Заслуга Дарвина состоит прежде всего в том, что ему удалось предложить механизм эволюционного изменения, в целом принимаемый и сегодня. Несмотря на то что феномен эволюции как процесса изменения видов был воспринят быстро, процесс естественного отбора долго оспаривали, вплоть до работ А. Ф.Л.Вейсмана в конце 19-го столетия и даже еще позже Многие принимали, что важную роль в изменении видов играют описанное Ж. Б. Ламарком еще в 1809 г. «внутреннее стремление к совершенству», а также наследование благоприобретенных свойств. Даже Ч. Дарвин признавал значение этих механизмов. Самым большим недостатком эволюционной теории Дарвина было отсутствие убедительной теории наследственности. Основополагающие представления Г. Менделя о механизмах наследственности, описанные в его «Опытах над растительными гибридами» (1866), остались неизвестными Дарвину. Лишь после так называемого переоткрытия менделевских законов наследования Г. М. де Фризом, С. Е. Корренсом и Эдлером фон Чермаком (в случае с де Фризом и Э. Чермаком существует, правда, вполне серьезное сомнение в том, что они открыли заново законы Менделя, не зная его работу) на рубеже столетий началось объединение эволюционной теории и генетики. Сначала, впрочем, ранние генетики, работавшие в основном с сильно различающимися признаками, не признавали предложенную Дарвином модель постепенных превращений и предполагали, что эволюция происходит скорее скачкообразно, путем так называемых макромутаций. В 1918 г. Р. А. Фишер впервые показал, что и непрерывная изменчивость может быть результатом менделевского наследования, а Р.А.Фишер (1930), Дж.Б.С.Холдейн (1932) и С.Райт (1931) показали, что естественный отбор может привести к генетическим изменениям в соответствии с принципами менделевской генетики. Предложенный этими авторами «современный синтез» был продолжен прежде всего в работах Ф. Добжанского (1937), Дж.С.Хаксли (1942), Э.Майра (1942), Дж.Дж. Симпсона (1944) и Дж.Л.Стебинса в области ботаники «Изменчивость и эволюция у растений» (1950), что сделало идеи синтетической эволюции широко доступными научной общественности. С тех пор современная эволюционная теория получает все новые подтверждения, уточнения и дополнения.
10.1. Изменчивость
Почти все признаки растений, такие, например, как форма и величина листьев (рис. 10.1), даже при сравнении их у одного растения или всего у двух индивидуумов в большинстве случаев оказываются вовсе не одинаковыми, а различными, и этим демонстрируют изменчивость. Масса семян фасоли с одного поля (рис. 10.2) варьирует непрерывно, т. е. в определенных интервалах могут быть найдены фактически любые значения массы. Прерывисто (или меристически) варьирует число семян в бобе. Здесь всегда речь идет о целых числах, а не о промежуточных значениях.
Рис. 10.1. Внутри- и межпопуляционная изменчивость прикорневых листьев у 6 популяций калифорнийского сложноцветного Layia gaillardioides. Слева — популяции с влажных внешних, справа — сухих внутренних прибрежных гор. Все растения культивировали в одинаковых условиях; каждый лист принадлежит отдельному индивидууму
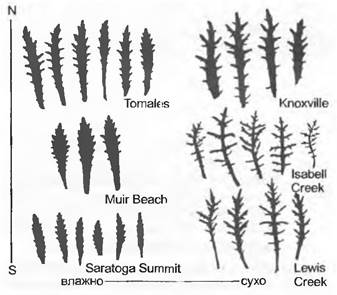
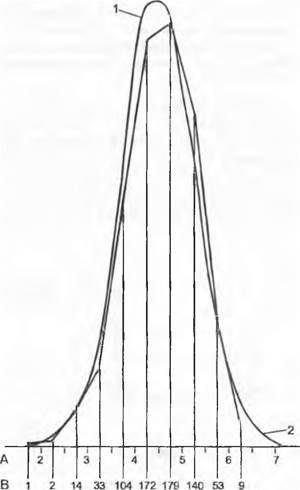
Рис. 10.2. Непрерывная вариационная кривая массы 712 семян фасоли от нескольких генетических одинаковых индивидуумов: А — масса 0,1 г; В — число семян в каждом из весовых классов по 0,05 г; 1 — фактические вариации; 2 — теоретическая кривая случайного распределения. Средние значения встречаются значительно чаще, чем крайние
Особая форма прерывистой изменчивости — слабые, чаше всего качественные проявления признака у одного вида (например, семена с гладкой или бородавчатой поверхностью у торицы полевой (Spergula arvensis), особей с белыми или красными цветками у хохлатки полой (Corydalis cava)). Если такая форма изменчивости удовлетворяет определенным генетическим критериям, то говорят о полиморфизме.
Сравнение признаков и наблюдение таким образом за изменчивостью возможны на весьма различных уровнях организации. Можно сравнивать признаки одного индивидуума (внутриорганизменная изменчивость) или разных индивидуумов (межорганизменная изменчивость), относящихся к одной популяции — группе инди-
видуумов, растущих в одном месте и свободно скрещивающихся между собой (внутрипопуляционная изменчивость), или к различным популяциям одного вида (межпопуляционная изменчивость), а также к разным видам (межвидовая изменчивость) и т. д.
Причиной изменчивости можно, по всей вероятности, считать три фактора. Первый фактор — онтогенетическая изменчивость. В этом случае гомологические структуры в ходе развития индивидуума образуются по-разному. Пример — изменение формы листьев вдоль побега (см. рис. 4.66, 4.68). Второй фактор кроется во взаимодействии генетической конституции индивидуума (генотипа) с окружающей средой. Вследствие этого в зависимости от условий окружающей среды генотип может проявляться в виде различных фенотипов. Если разделить один экземпляр тысячелистника (Achillea millefolium) на две половины и выращивать их, к примеру, на равнине и в горах, то довольно скоро эти генетически идентичные растения станут выглядеть по-разному (рис. 10.3). Такую форму изменчивоc ти называют модификациями, а растения демонстрируют фенотипическую пластичность (см. 12.2). Наконец, наблюдаемые вариации могут определяться и тем, что различные индивидуумы обычно генетически различаются (генетическая изменчивость). В то время как онтогенетические вариации имеют место только в пределах организма, а генетические различия проявляются лишь при сравнении разных индивидуумов, часть модификаций представляет собой внутриорганизменную изменчивость, а часть — межорганизменную.
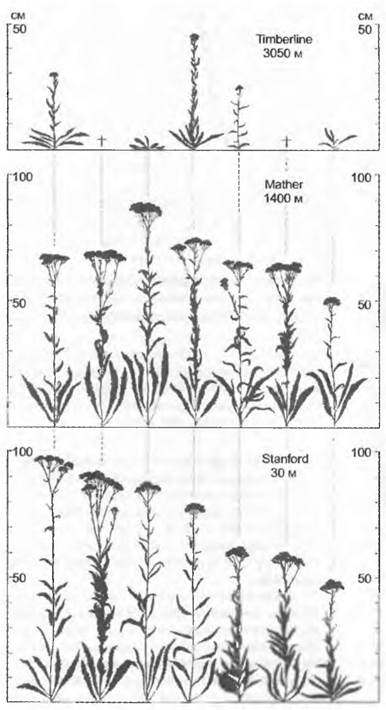
Рис. 10.3. Экспериментально полученные модификации у калифорнийского тысячелистника. Вегетативно размноженные части (клоны) 7 индивидуумов из одной горной популяции в Сьерра-Неваде (Mather), выращенные в трех экспериментальных садах: Stanford (30 м над уровнем моря), Mather (1400 м над уровнем моря) и Timberline (3 050 м над уровнем моря). Наследственные различия между индивидуумами, в том числе различная норма реакции каждого индивидуума, на разной высоте над уровнем моря
10.1.1. Онтогенетическая изменчивость и фенотипическая пластичность
Онтогенетическая изменчивость — результат различного развития гомологичных структур у одного организма в зависимости от внутренних и/или внешних условий. Впечатляющие примеры онтогенетической изменчивости демонстрируют изменение формы плесневых грибов или образование листьев различной формы в индивидуальном развитии семенных растений (см. рис. 4.68).
Плющ (Hederá helix) образует в период вегетативного развития характерные лопастные листья, а с начала репродуктивного периода — цельные. Если использовать для вегетативного размножения участок побега с цельными листьями, то возврата к лопастным листьям не происходит.
Изменение формы в ходе чередования поколений (гаметофита и спорофита) можно также рассматривать как онтогенетическую изменчивость, хотя здесь имеется не один индивидуум, а много генетически очень сходных, сменяющих друг друга индивидуумов. Изменение формы в ходе чередования поколений привело, например, к тому, что гаметофит и спорофит некоторых бурых водорослей были описаны как самостоятельные роды.
Фенотипическая пластичность означает, что генотип (т. е. индивидуум определенной генетической конституции1) в зависимости от условий среды может образовать различные фенотипы. Поскольку модификации возникают в ходе развития организма, то очевидно, что фенотипическую пластичность нелегко бывает отделить от онтогенетической изменчивости. Последняя имеет место только тогда, когда онтогенетические вариации являются результатом осуществления программы развития, регулируемой исключительно эндогенно. Но чаще и онтогенетическая изменчивость зависит от восприятия сигналов из окружающей среды. Комплексное совместное действие генотипа и влияния среды на образование конкретного фенотипа показывает, что генотип определяет в конечном счете не признаки, а скорее различные возможности реализации фенотипа в некоторых границах, т. е. норму реакции.
1Генотип — это наследственная информация, содержащаяся в ДНК (редко — в РНК). Его никак нельзя отождествлять с индивидуумом. — Примеч. ред.
Важное различие между генотипом и фенотипом было установлено датским ботаником В.Л.Иогансеном. Ученый работал с семенами от полученных инбридингом гомозиготных индивидуумов фасоли обыкновенной (Phaseolus vulgaris). Из различных по массе семян одного индивидуума он отбирал для следующей генерации самые легкие и самые тяжелые. Так как средняя масса семян от полученных подобным образом растений второго поколения была идентичной, Иогансен сделал вывод, что различие в массе семян, образованных одним индивидуумом, должно быть результатом влияния условий среды. Обнаруженные различия в средней массе семян от индивидуумов, происходящих от разных родителей, он отнес на счет генетических различий этих индивидуумов. Таким образом, изменчивость массы семян одного индивидуума чисто модификационная, тогда как вариабельность массы семян двух генетически различных индивидуумов является и генетической.
Фенотипическую пластичность легко обнаружить экспериментально, если, например, полученные вегетативным размножением и, соответственно, генетически идентичные индивидуумы выращивать в различных условиях (см. рис. 10.3). Если вегетативное размножение невозможно (как, например, у многих однолетних видов), приходится работать с генетически близкими индивидуумами, например, с сестринскими экземплярами. В такой ситуации, конечно, учитывают, что наблюдаемые различия могут иметь (хотя и малый) генетический компонент.
Многочисленные эксперименты привели к следующим общим выводам о фенотипической пластичности.
✵ Модификации не наследственны. Если, к примеру, потомство очень маленького, выросшего в плохих условиях, растения выращивают в хороших условиях, то потомки станут не маленькими, а крупными в пределах нормы реакции.
✵ Разные признаки одного растения проявляют разную степень фенотипической пластичности и не коррелируют друг с другом. В целом вегетативные структуры (например, высота растения, форма и размер листьев) пластичнее, чем репродуктивные (к примеру, размер цветков, масса семян). Правда, отмечены существенная пластичность и репродуктивных структур. Таково, например, образование клейстогамных цветков у фиалки душистой (Viola odorata) в конце вегетационного периода или образование коричневых, или черных семян в зависимости от длины дня у видов сведы (Suaeda).
Фенотипическая пластичность не ограничивается морфолого-анатомическими признаками, она может проявляться также и в физиологических и биохимических признаках.
✵ Модифицирующее влияние окружающей среды может вызывать различия между одинаковыми органами одного индивидуума. У бука лесного (Fagus sylvatica) слабая освещенность приводит к образованию теневых листьев (см. рис. 7.73). Если условия освещенности изменятся, то на том же побеге за теневыми листьями развиваются световые.
✵ Разные модификации вызваны своими специфическими влияниями среды. У хлопчатника, например, число междоузлий коррелирует с обеспеченностью азотом и не зависит от водообеспеченности, однако длина междоузлий зависит от обеспеченности водой.
✵ Индивидуумы одного вида могут различаться по степени фенотипической пластичности анализируемого признака. Экспериментальное культивирование восьми клонов 192 генотипов костра мягкого (Вгоmus hordeaceus) в различных условиях состава почвы, удобрений и фотопериода показало, что, к примеру, степень пластичности признаков длительности развития и величины соцветия соответствует нормальному распределению, т. е. относительно немногие из 192 генотипов проявляют малую или высокую пластичность наблюдаемых признаков, а большинство генотипов показывают среднюю пластичность. Точно так же можно наблюдать различия в пластичности гомологичных признаков между разными популяциями одного вида (и еще более выраженные — между разными видами).
✵ Степень пластичности признака наследственна и поддается отбору.
Два последних результата подтверждают, что способность к фенотипической пластичности имеет генетическую основу.
Фенотипическая пластичность вносит свой вклад как во внутриорганизменную, так и в межорганизменную изменчивость. Так, одно и то же растение лютика водного (Ranunculusaquatilis) образует в зависимости от длины дня и расположения листового зачатка под или над поверхностью воды листья разной формы: под водой сильно рассеченные, а плавающие по поверхности воды и надводные листья обычно только лопастные (см. рис. 4.68). Если сравнивать листья двух индивидуумов лютика водного, занимающих одинаковое положение на побеге, то может оказаться, что у одного растения такой лист тонко рассеченный (если он начал развиваться под водой при соответствующей длине дня), а у другого — только лопастной.
10.1.2. Генетическая изменчивость
Хотя онтогенетическая изменчивость и вариабельность в результате фенотипической пластичности важны для приспособления генотипа1 к окружающей среде и потому имеют определенное эволюционное значение, наибольшую значимость для эволюционных преобразований имеет генетическая изменчивость. Генетические вариации фенотипов индивидуумов, к примеру, одной популяции или вида, можно обнаружить, если выращивать их в идентичных условиях и сравнивать онтогенетически гомологичные структуры или иные свойства. Только таким путем можно узнать. каков вклад генетических различий в наблюдаемые различия. Главный источник генетической изменчивости — мутации и рекомбинации.
1 К среде приспособлены организмы, т.е. реализованные в фенотипах генотипы, а не непосредственно генотипы. — Примеч. ред.
Мутация как спонтанное (или индуцированное экспериментально) изменение наследственного материала может произойти на самых различных уровнях и во всех геномах растительной клетки. Так, могут измениться последовательность нуклеотидов ДНК одного гена (генная мутация), структура хромосомы (хромосомная мутация) и, наконец, весь геном (геномная мутация). Следует четко знать, что все мутации случайны, т. е. нет никакой возможности предсказать их вид и место, и что они ненаправленны и не связаны с условиями отбора, которому подвергался индивидуум.
Один из примеров ненаправленного характера мутаций — эволюция устойчивости растений к гербицидам. Многие гербициды применяют в различных частях Земли (например, в Европе и Северной Америке) примерно с одного и того же времени и приблизительно в одинаковых концентрациях. Несмотря на эти сходные условия отбора (по крайней мере в отношении этого фактора), можно видеть, что один и тот же вид в одной области выработал устойчивые к гербицидам генотипы, а в другой — нет. Например, повсеместно распространенная пастушья сумка обыкновенная (Сарsеllа bursа-раstoris) приобрела устойчивость к гербицидам в Польше с 1984 г., но больше нигде. В Северной Америке ежовник обыкновенный (Есhinochiоа сrus-galli) стал устойчивым к гербицидам благодаря мутации пластидного генома, а в Европе — благодаря, очевидно, мутации ядерного генома. Это доказывает, что сходное давление отбора совсем не обязательно приводит к сходным мутациям.
10.1.2.1. Генные мутации
Генные мутации бывают точковыми, нарушениями рамки считывания, либо возникают вследствие активности подвижных генетических элементов, так называемых транспозонов (рис. 10.4). В случае точковой мутации один нуклеотид заменяется другим. Если при этом пуриновый нуклеотид заменяется на пуриновый или пиримидиновый на пиримидиновый, то говорят о транзиции, если пуриновый нуклеотид заменяется пиримидиновым или наоборот, такой обмен называют трансверсией. При нарушении рамки считывания в существующую последовательность вставляется один или несколько нуклеотидов (инсерция) или нуклеотиды утрачиваются (деле- ция). Следствием инсерции или делении оказывается сдвиг триплетов в последующем участке ДНК и совершенно иное ее прочтение. Причиной такого рода мутаций бывают случайные ошибки в репликации ДНК при отсутствии ее репарации.
Рис. 10.4. Точковая мутация (А) и нарушение рамки считывания (В). А — замена отмеченного в цепочке нуклеотида (G вместо А), приводящая к встраиванию другой аминокислоты (метионина (Met) вместо изолейцина (IIе); В — потеря (делеция) отмеченного нуклеотида, изменяющая порядок считывания последующих триплетов и, соответственно, последовательность аминокислот. Появление стоп-кодона в новом порядке прочтения, вызывает обрыв белкового синтеза

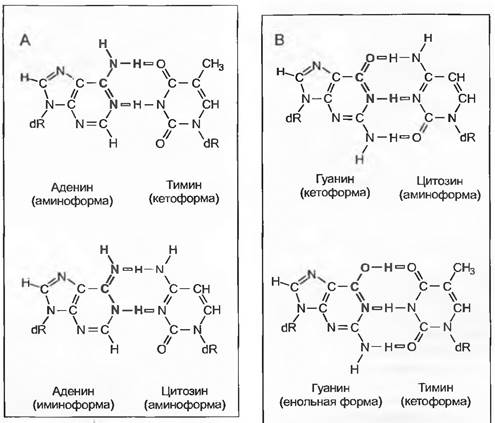
Транзиции могут происходить потому, что вместо обычных аминных форм аденина или цитозина в последовательность встраиваются весьма редкие таутомерные иминные формы, а вместо кетонных форм гуанина и тимина — еще более редкие енольные формы (рис. 10.5). Так, например, иминоформа аденина может связываться с цитозином вместо тимина, а енольная форма гуанина — с тимином вместо цитозина. Трансверсии могут встречаться в тех случаях, если из-за потери нуклеотидов (депуринизация, депиримидинизация) возникают пропуски в нуклеотидной последовательности. Когда пропуск возникает из-за утраты гуанина, в это место обычно встраивается аденин. Если пропуск в цепочке, потерявшей гуанин, заполняется тимином, комплементарным аленину, то результатом будет трансверсия от GС к АТ (см. рис. 10.4, рис. 10.5). Мутации ошибки считывания накапливаются в таких участках нуклеотидной цепочки, где несколько одинаковых нуклеотидов следуют друг за другом. «Ошибки» ДНК-полимеразы могут во время синтеза ДНК привести к пропуску одного нуклеотида в кодирующей цепочке ДНК. В результате в следующем цикле репликации соответствующий нуклеотид выпадает, т. е. происходит делеция. Может также случиться, что во вновь синтезируемую цепочку ДНК встраивается дополнительный нуклеотид, благодаря чему возникает инсерция.
Рис. 10.5. Амино- и иминоформы аденина (А) и кетоформа и енольная форма гуанина (В). Редкая иминоформа аденина спаривается с цитозином вместо тимина, редкая енольная форма гуанина соединяется с тимином вместо цитозина
Транспозоны — генетические элементы, автономно размножающиеся и способные менять местоположение в геноме. Эта способность достигается благодаря тому, что транспозоны содержат генетическую информацию для фермента (транспозазы), который может узнавать, как целевую последовательность в геноме, так и конец транспозона и вырезать его. К тому же транспозоны в состоянии использовать ферменты клетки, необходимые для репликации. Когда транспозон встраивается в ген, он может нарушить его функцию и таким образом привести к возникновению мутации.
Благодаря мутациям генов возникают аллели, которые можно определить, как возникшие одна из другой различающиеся формы гена. Если диплоидный индивидуум (имеющий по паре гомологичных хромосом) содержит два одинаковых аллеля, то по рассматриваемому гену он гомозиготен. Если два аллеля неодинаковы, он гетерозиготен. В то время как в диплоидном индивидууме может быть только два аллеля одного гена, популяция может содержать несколько аллелей (множественные аллели). Аллели одного гена бывают полностью доминантными (такой аллель определяет фенотип) или рецессивными (такой аллель фенотипически не проявляется1), а также возможно их неполное доминирование(проявление в фенотипе в различном соотношении обоих аллелей), причем промежуточные свойства фенотипа по наблюдаемому признаку являются особым случаем неполного доминирования. Кодоминантность (полное проявление обоих аллелей в фенотипе) чаще всего обнаруживают на уровне белков.
1 Рецессивный аллель не проявляется фенотипически только в гетерозиготном состоянии. — Примеч. ред.
В старой литературе гены и их аллели часто обозначали буквами. При этом прописными буквами отмечали доминантность аллеля, а строчными — рецессивность. Так, аллель доминантного красного цвета лепестков львиного зева (Antirrhinum majus) обозначали буквой R, а рецессивного белого — r. В новой литературе чаще используют трехбуквенное сокращение для обозначения гена и его аллелей. Независимо от доминантности и рецессивности прописными буквами обозначают аллели дикого типа, а строчными — мутантные аллели. В любом случае для обозначения генов и аллелей используют курсив.
Считается, что у эукариот средняя частота мутирования гена составляет I мутацию на ген, приходящуюся на 105 — 106 гамет. Однако при точном изучении отдельного признака можно обнаружить изменчивость частоты его мутирования. У кукурузы (Zea mays) ферменты биосинтеза антоциана мутируют с частотой в 4,92 х 10-4 гамет, но при образовании морщинистых семянок вместо гладких частота мутаций 1,2х 10-6. При этом оказывается, что фенотипически наблюдаемые мутации генетически совершенно не обязательно гомологичны, следовательно, необязательно изменен один и тот же участок ДНК одинаковым образом. Эти данные о частоте мутирования, величина которой сильно зависит также от примененных методов наблюдения, относятся к так называемым спонтанным мутациям, для которых невозможно установить какие-либо внешние причины. Более высокие частоты мутирования можно вызвать, к примеру, ионизирующим излучением, ультрафиолетовым светом и различными мутагенными веществами.
Частоту фенотипически проявляющихся мутаций можно определить путем скрещивания индивидуума, гомозиготного по доминантному гену, с индивидуумом, гомозиготным по тому же рецессивному гену (АА х аа). В отсутствие мутаций следует ожидать, что все гибридные индивидуумы будут иметь генетическую конституцию Аа, а по фенотипу соответствовать гомозиготному доминантному родителю. Если все же обнаружатся индивидуумы с фенотипом гомозиготного рецессивного родителя, то их появление следует объяснить слиянием мутантной гаметы (A —> a) гомозиготного доминантного родителя с гаметой гомозиготного рецессивного родителя. Частота таких рецессивных фенотипов позволяет рассчитать частоту мутирования.
Исходя из средней частоты мутирования 1 х 10-5 и принимая во внимание, что высшие растения согласно лучшим для резушки Таля (Агаbidopsis thaliana) оценкам имеют около 25 500 генов (см бокс 7.1, см. рис. 7.4), можно сделать вывод, что около 20% гамет являются носителями мутаций. Это значение, как бы сильно оно ни менялось для различных генов, отчетливо показывает, что мутационная генетическая изменчивость — самое обычное явление. Вероятность мутирования не одинакова для любого участка ДНК; имеются зоны, более и менее часто мутирующие. По-видимому, это обусловлено тем, что вероятность мутирования нуклеотида зависит от его окружения.
Поскольку точковые мутации и нарушения рамки считывания в основном зависят от точности репликации ДНК и эффективности механизмов ее репарации, сама частота мутаций находится под генетическим контролем. Мутации в ферментах-репликаторах ДНК и ферментах-репараторах могут влиять на частоту мутирования. Соответственно гены этих ферментов и названы генами-мутаторами.
Частота мутаций в пластидных и митохондриальных геномах меньше, чем в ядерном геноме. Замена нуклеотида, измеряемая как субституция в одной позиции в год, в ядерном геноме происходит с частотой в среднем (5 — 30)10-9, в пластидном — (1 — 3)109 и в митохондриальном геноме — (0,2 — 1)109.
Эффект мутаций на кодируемый геном продукт бывает весьма различным. Скрытые мутации вследствие вырожденности генетического кода не вызывают замены аминокислоты и, соответственно, не производят никакого эффекта. То же присуще нейтральным мутациям, когда замена аминокислоты хотя и происходит, но не изменяет функцию затронутого белка. Если же замена аминокислоты влияет на функцию продукта данного гена, то говорят о смысловой мутации. Сильный эффект на продукт гена оказывают, к примеру, такие мутации, когда кодирующий аминокислоту триплет мутирует в стоп-кодон (бессмысленная мутация) или возникает нарушение порядка считывания, при котором в результате мутации получается совершенно другой продукт гена. В обоих случаях образуется нефункционирующий генный продукт.
Проявятся ли мутации через воздействие на продукт гена также и в фенотипе растения (рис. 10.6), зависит от того, находится ли мутантный ген в гаплоидном или диплоидном состоянии. В диплоидной спорофитной генерации многие мутации фенотипически не проявляются, потому что они рецессивны. Это можно объяснить тем, что в диплоидном организме каждый ген представлен дважды. После мутации одного гена из такой пары немутированный аллель может образовать неизмененный генный продукт.
Рис. 10.6. Генные мутанты львиного зева большого (Antirrhinum majus). Общее развитие растения: А — нормальное; В — карликовое; С — рано цветущее. Форма цветков: D — нормальная зигоморфная; Е — радиальная; F — со шпорцем
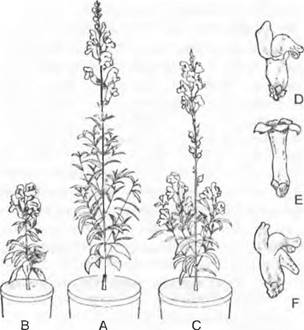
Эффект мутаций зависит и от того, какие функции имеет ген в иерархической организации, к примеру, обмена веществ или процесса развития. Если ген осуществляет регуляторную функцию на высоком уровне, то эффект мутации может быть драматическим.
Хорошо исследованный в последние годы преимущественно на резушке Таля (Arabidopsis thaliana) и львином зеве большом (Antirrhinum majus) пример такого эффекта показал ген, определяющий идентичность частей цветка. Мутации гена, кодирующего факторы транскрипции и этим вмешивающегося в функции подчиненных генов, могут привести к тому, что вместо нормальной последовательности органов цветка (чашечка, венчик, тычинки, пестик) получаются цветки с нарушенной последовательностью частей, например, пестики, тычинки, тычинки, пестики или чашечка, чашечка, пестики, пестики (см. 7.4.3).
Как иерархическая организация генома и связанное с этим существование цепей генного действия и цепей биосинтеза, так и распределение продукта гена по различным структурам растения приводит к тому, что один ген может влиять на несколько признаков фенотипа (плейотропия). Примером этого служит действие гена окраски цветков левкоя седого (Matthiola incana) на характер опушения растения (гомозиготность рецессивного аллеля, приводящего к выпадению биосинтеза красящего вещества (пигмента) приводит и к отсутствию волосков на растении), а также действие гена антоциана гороха на окраску цветков, бобов, семян и прилистников. И наоборот, часто на признаки влияют несколько генов (полигения). Наконец, есть взаимодействия различного рода между негомологичными генами, которые объединены под понятием «эпистаз».
Очень большое число мутаций имеет негативный эффект, т. е. снижает приспособленность мутантов. Это понятно, ведь структура гена является результатом долгой адаптивной эволюции, так что вероятность его улучшения благодаря случайным и ненаправленным мутациям мала.
Хорошо известная мутация пластидного генома с большим фенотипическим эффектом определяет механизм устойчивости к гербицидам. Триазиновые гербициды воздействуют на растения, связывая белок (QB) фотосистемы II и тем самым прерывая фотосинтетический транспорт электронов. Резистентность к гербицидам возникла, к примеру, у мари белой (Chenopodium album) и мятлика однолетнего (Роа annua) благодаря точковой мутации в пластидном гене psb-А, где произошла замена аминокислоты (глицин вместо серина) в позиции 264 белка QB, что резко снизило связывание гербицида с этим белком.
Мутации митохондриального генома могут быть причиной, часто встречающейся у растений спонтанной стерильности пыльцы. При этих мутациях, правда, имеют место не изменения генов, а перестройки всего митохондриального генома.
Транспозонная мутация ответственна за наблюдавшиеся Г. Менделем и генетически проанализированные им различия между гладкими и морщинистыми семенами у гороха посевного (Pisum sativum). Здесь из-за внедрения транспозона был поврежден ген. кодирующий разветвленность молекул крахмала и тем самым содержание воды в семенах. Более высокое содержание воды в семенах мутантных индивидуумов приводило к более сильному усыханию и сморщиванию поверхности созревающих семян. Точно так же результатом транспозонных мутаций являются светлые цветки с красными секторами у львиного зева. Красные сектора возникают в тех участках лепестков, где восстанавливается биосинтез вследствие потери транспозона ТаmЗ, нарушающего этот биосинтез. Последний пример ясно показывает, что транспозонные мутации могут приводить к генетической изменчивости тканей одного индивидуума. Таким образом, даже неизменность генотипа внутри одного индивидуума оказывается относительной.
10.1.2.2. Хромосомные мутации
Причиной хромосомных мутаций являются разрывы хромосом, возникающие спонтанно и благодаря активности транспозонов. Как и в случае генных мутаций, частоту хромосомных мутаций можно повысить экспериментально. В зависимости от числа встречающихся разрывов и поведения возникших таким путем хромосомных фрагментов различают следующие типы хромосомных мутаций (рис. 10.7).
Рис. 10.7. Хромосомные мутации: А — делеция: потеря концевого участка хромосомы (от h до к); В — нехватка: потеря промежуточного участка хромосомы (от е до g). У гетерозиготного индивидуума по этому признаку нехватка проявляется в петлеобразном выпячивании соответствующего участка немутантной хромосомы; С — дупликация: удвоение промежуточного участка хромосомы (от g до ¡). У гетерозиготного организма по этому признаку дупликация различима благодаря петлеобразному выпячиванию участка мутантной хромосомы; D — инверсия: встраивание промежуточного участка хромосомы (от с до f в противоположной ориентации. У гетерозиготного индивидуума по инверсии это приводит к образованию инверсионной петли; Е— транслокация: реципрокный перенос концевого участка хромосомы (f и соответственно х — z) в негомологичные хромосомы. У гетерозиготного по реципрокной транслокации индивидуума при мейозе возникает крестообразная фигура конъюгирующих хромосом
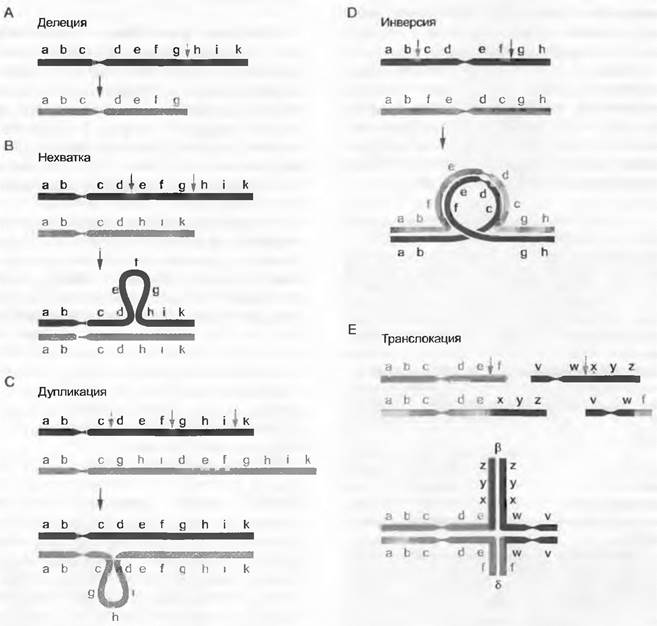
• Делецией называют потерю концевого участка хромосомы. Следствием потери теломеры оказывается слияние измененными концами сестринских хроматид, образовавшихся после репликации мутантной хромосомы. В итоге возникает хромосома с двумя центромерами, которая при следующем клеточном делении разрывается. Продолжение этого процесса слияния и разрыва известно, как цикл «разрыв — слияние — мост». В результате к стабильному изменению структуры хромосом делеции чаще всего не ведут.
✵ Если в хромосоме происходят два разрыва и теряется участок между ними, то говорят о нехватке (дефиции). У гетерозиготного по этой мутации индивидуума (имеющего одну мутантную и одну неизмененную хромосому) можно распознать нехватку определенной величины в бивалентах мейотических хромосом вследствие образования петлеобразного выпячивания одной из них. Эта петля содержит участок неизмененной хромосомы, утраченный в мутантной хромосоме, которому теперь не с чем конъюгировать.
✵ Если хромосомный фрагмент, возникший после двух разрывов, не теряется, как при дефиции, а встраивается в другую хромосому в месте ее одинарного разрыва, то получается дупликация (удвоение). При этом фрагмент может встроиться не только в гомологичную хромосому, но и в негомологичную. Если дуплицированные области в гомологичной хромосоме следуют непосредственно друг за другом, то они могут иметь либо одинаковую (тандемная дупликация), либо противоположную ориентацию (инвертированная дупликация). Дупликации также возможно распознать у гетерозиготного индивидуума (при встраивании в гомологичную хромосому) при мейотической конъюгации хромосом по образованию петлевидного выпячивания.
• Инверсией называют хромосомную мутацию, при которой хромосомный фрагмент, возникший вследствие двух разрывов, вновь встраивается в то же место, но ориентирован противоположно. В случае перицентрической инверсии центромера он оказывается частью инвертированной области, при парацентрической инверсии это не случается. Инверсия у гетерозиготного индивидуума проявляется в мейозе как характерная инверсионная петля.
✵ При транслокациях хромосомный фрагмент переносится в другую, негомологичную, хромосому. Если транслокация реципрокна, т. е. между двумя негомологичными хромосомами произошел обмен фрагментами, у гетерозиготного индивидуума в мейозе образуются крестообразные фигуры при конъюгации четырех хромосом. Особый случай транслокации — слияние двух акроцентрических хромосом (робертсоновская транслокация).
Непосредственный фенотипический эффект хромосомных мутаций может быть весьма различным. Делеции и дефиции в зависимости от функции затронутого ими гена приводят к образованию либо нежизнеспособных гамет, либо нежизнеспособного диплоидного организма, гомозиготного по мутантной хромосоме. При гетерозиготности по мутантной хромосоме не только делеция и нехватка [дефиция], но и дупликация генетической информации могут привести к нарушению генного баланса.
Уровни экспрессии генов одного генома тонко сбалансированы между собой. Так как количество генного продукта пропорционально числу копий гена и аллелей, то следствием уменьшения или увеличения их числа бывает нарушение этого баланса.
Наконец, бывает и так, что экспрессия гена зависит от его положения в геноме. Изменение положения в результате хромосомной мутации может повлиять на фенотип как эффект положения, если экспрессия гена нарушена, например, из-за нового соседства с гетерохроматиновыми участками хромосомы.
Кроме непосредственного фенотипического проявления в мутантном организме хромосомные мутации имеют и далеко идущие эволюционные последствия. Дупликация генов может привести к возникновению семейств генов. Семейства генов, с одной стороны, могут облегчить синтез большого количества генного продукта, а с другой стороны, делают возможной диверсификацию функций кодируемых белков.
Пример большой потребности в продукте — запасные белки в семенах. Почти половина их у кукурузы (Zea mays) — это зеин. Зеин состоит, помимо прочего, из полипептидов с молекулярной массой 19000 или 22000. Вероятно, что не менее 54 генных копий кодируют меньший полипептид и 24 генных копий — больший. Эти гены распределены по меньшей мере по трем хромосомам. У многочисленных генов, составляющих семейство белков, связывающихся с хлорофиллами а или b. обнаружена сильная диверсификация функции связывания пигментов. Дивергенция последовательностей нуклеотидов в кодирующих участках этих генов может составлять 55 %.
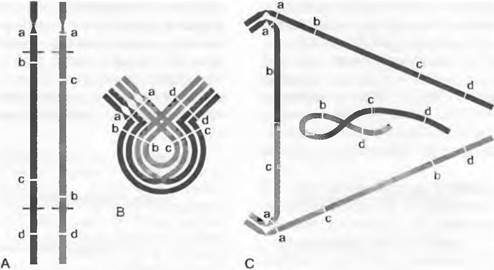
Изменение пространственного расположения генов путем хромосомных мутаций влияет различным образом на дальнейшую рекомбинацию генов. Так, функционально связанные гены могут благодаря хромосомным мутациям попасть в непосредственное соседство, что снижает вероятность их рекомбинации. Пример этого — локус самонесовместимости у гетероморфных примул, который фактически содержит три гена (см. 10.1.3.1). Рекомбинационные возможности ограничены, например, когда индивидуум гетерозиготен по перицентрической инверсии. Если в этом случае в области инверсионной петли происходит кроссинговер, возникают одна ацентрическая и одна дицентрическая хромосомы, которые затем обе утрачиваются в дальнейшем ходе мейоза. Поскольку таким путем возникают хромосомно несбалансированные и, вероятно, нежизнеспособные гаметы, инвертированный участок хромосомы в результате оказывается защищенным от рекомбинации (рис. 10.8).
Рис. 10.8. Барьерный эффект хромосомной мутации: инверсия: А — схема измененной пары хромосом (исходная форма — черная, мутантная — серая) с некоторыми нанесенными генами-маркерами (а, b, с, d), местами разрывов и разворотом поврежденного участка хромосомы; В — мейоз в F1: конъюгация различных по структуре хромосом и кроссинговер в инвертированном участке; С — возникновение в анафазе I моста с двумя центромерами и фрагмента без центромеры. Обе структуры элиминируются, жизнеспособны только гаметы с неизмененными хромосомами исходной формы или мутанты
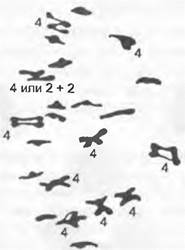
Ограничение рекомбинации благодаря хромосомным мутациям, а именно транслокациям, находят и у некоторых ослинников (Oenothera): вследствие многочисленных транслокаций, затрагивающих все хромосомы, возникают такие хромосомы, которые при гетерозиготности в мейозе не образуют бивалентов, а напротив, из- за гомологии концевых участков различных хромосом располагаются цепочками (рис. 10.9). Таким образом возникают гаметы либо только с материнским, либо только с отцовским набором хромосом. Эта перманентная комплексная гетерозиготность поддерживается благодаря тому, что встреча гамет с одинаковой хромосомной конфигурацией приводит к нежизнеспособным зиготам в результате действия летальных факторов.
Рис. 10.9. Перманентная комплексная гетерозиготность. У некоторых ослинников (Oenothera) благодаря многочисленным охватывающим все хромосомы транслокациям возникают хромосомы, которые при гетерозиготности в мейозе не образуют бивалентов, а располагаются цепочками вследствие гомологии концевых участков различных хромосом. Так возникают гаметы либо только с материнским, либо только с отцовским набором хромосом

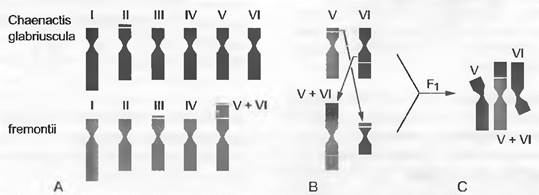
Наконец, хромосомные мутации (особенно транслокации) могут стать причиной изменения числа хромосом (рис. 10.10). Этот механизм изменения числа хромосом называют также дисплоидией.
Рис. 10.10. Изменение числа хромосом путем хромосомной мутации: А — гаплоидные кариограммы двух близкородственных видов Сhaenactis (Аstегасеае) с 2n = 12 и 2n = 10; В — схема дифференцирующей реципрокной транслокации и выпадения фрагмента; С — мейотическая конъюгация хромосом в F1
Частота хромосомных мутаций, по-видимому, весьма различается в разных таксонах. Сравнение по молекулярным признакам установленных генетических карт сцепления показывает, что хромосомы пшеницы, ячменя и ржи в высшей степени колинеарны, т. е. линейное расположение генов в них мало изменено и почти одинаково. В противоположность этому два близкородственных вида подсолнечника различаются уже десятью хромосомными мутациями.
Хромосомные мутации известны не только в ядерном геноме, но и в геномах органелл. В то время как в геномах пластид они сравнительно редки и по этой причине обычно хорошо маркируют таксоны, перестройки в митохондриальном геноме чрезвычайно часты. Причина этого в том, что митохондриальный геном в отличие от пластидного содержит очень много последовательностей в нескольких копиях. Это обеспечивает конъюгацию и тем самым рекомбинацию внутри митохондриального генома.
10.1.2.3. Геномные мутации
Изменение числа хромосом благодаря механизмам, отличным от вышеописанной дисплоидии, называют геномными мутациями. Чаще всего они возникают при митотическом или мейотическом делении ядра, когда нарушается распределение хроматид или хромосом по дочерним клеткам. Если при этом затронут не весь геном, а только какая-либо одна или немногие хромосомы, говорят об анеуплоидии. Например, если в мейозе II не происходит разделения хроматид одной хромосомы («non-disjunction»), то в результате одна гаплоидная клетка содержит лишнюю хромосому, отсутствующую во второй гаплоидной клетке (рис. 10.10).
Этот механизм может привести к изменению числа хромосом у вида. Чтобы различить дисплоидию и анеуплоидию, вызвавшие изменение числа хромосом, необходимо изучить конъюгацию хромосом в мейозе подходящего гибридного индивидуума.
Если все хромосомы не расходятся при клеточном делении, то происходит эуплоидное изменение их числа. Самая обычная форма эуплоидных геномных мутаций — полиплоидия.
Гаплоидное число хромосом организма принято обозначать как х. Диплоидные индивидуумы соответственно имеют 2х хромосом, а полиплоидные — 4х (тетраплоиды), 6х (гексаплоиды), 8х (октоплоиды) и т.д. Кратное четное увеличение числа хромосом называют ортоплондией. Конечно, возможно возникновение анортоплоидного генома с числом хромосом Зх (триплоиды), 5х (пентаплоиды) и т. д. Геном тетраплоидного организма с основным гаплоидным числом хромосом х = 7 обычно обозначают 2n = 4х = 28. Таким образом показывают, что мейоз у этого организма протекает нормально и в нем можно наблюдать только биваленты.
Соматическая полиплоидия имеет место в том случае, если при митозе клетки хромосомы реплицируются, но деления ядра и клетки не происходит. Это приводит к образованию реституционных ядер с удвоенным числом хромосом.
Данный феномен может быть вызван и экспериментально путем применения, например, колхицина — алкалоида безвременника осеннего. Колхицин подавляет образование веретена деления, но не удвоение хромосом.
Соматическая полиплоидия может привести и к образованию эндополиплоидной ткани у индивидуума. Пример — тапетум пыльников, который обычно эндополиплоиден и клетки которого могут содержать многочисленные наборы хромосом. Если хроматины хромосомы не расходятся, возникают так называемые политенные (гигантские) хромосомы.Такие структуры обычные, например, у двукрылых (Díptera), бывают иногда и в клетках зародышевого мешка растений.
Эволюционное значение соматическая полиплоидия приобретает тогда, когда полиплоидизированные ткани участвуют в развитии репродуктивных органов, что может привести к образованию гамет с удвоенным числом хромосом.
Это было обнаружено у Prímula х kewensis, стерильного гибрида между Р. verticillata и Р. floribunda. Причиной спонтанного образования фертильного соцветия на остальном стерильном индивидууме этого гибрида была как раз соматическая полиплоидизация.
В случае генеративной полиплоидии происходит слияние нередуцированных гамет. Такие гаметы из-за ошибок в мейозе оказываются диплоидными и встречаются у всех растений с малой частотой (в среднем у исследованных видов 0,57 %; частота диплоидных пыльцевых зерен и яйцеклеток, по всей видимости, не различается). У некоторых сортов кукурузы (Zea mays) нередуцированные пыльцевые зерна наблюдали с частотой по крайней мере 3,5 %. При этом частота образования диплоидных гамет контролируется как генетически, так и условиями внешней среды. Например, высокие или низкие температуры, а также недостаток питательных веществ приводят к возрастанию этой частоты. При слиянии двух нередуцированных гамет сразу возникает тетраплоидный организм. Чаще всего из-за малой частоты появления нередуцированных гамет генеративная полиплоидизация проходит в два этапа. На первом этапе возникает триплоидный (Зх) индивидуум благодаря слиянию нормальной редуцированной (гаплоидной х) гаметы с нередуцированной (2х). При этом нередуцированной чаще оказывается яйцеклетка. Если триплоидная гамета такого организма сольется с нормальной редуцированной гаметой, то возникнет тетраплоидный (4х) индивидуум.
Частота образования нередуцированных триплоидных гамет у триплоидных растений значительно выше (около 5 %), чем частота образования нередуцированных гамет у диплоидных индивидуумов. Однако триплоидные растения образуют также и гаплоидные, и диплоидные гаметы, так что большое число их гамет содержит больше или меньше половины трипло- идного набора хромосом.
Различают несколько форм полиплоидии в зависимости от уровня гомологии комбинирующихся геномов полиплоидного индивидуума. Если скомбинированные геномы гомологичны, говорят об аутополиплоидии, если же геномы различны, речь идет об аллополипловдии (см. 10.3.3.4).
Аутополиплоидия и аллополиплоидия — крайние формы непрерывного ряда сходства генома, а не объективные категории. В то время как возникновение полиплоидного потомства благодаря соматической полиплоидии, самооплодотворению или скрещиванию двух индивидуумов одной популяции однозначно попадает в категорию аутополиплоидии, некоторая дивергенция геномов наблюдается уже при сравнении индивидуумов разных популяций одного вида, еще более выражена она у двух индивидуумов различных подвидов и т.д. Учитывая невозможность объективно разграничить ауто- и аллополиплоидию, целесообразно установить различия между ними на видовых границах. Тогда полиплоидия внутри одного вида будет аутополиплоидией, а полиплоидия вследствие скрещивания индивидуумов разных видов — аллополиплоидией. Однако в действительности проблема остается нерешенной, так, как и сами виды объективно не определимы и биологически не эквивалентны (см. 10.3.1). Иногда используют понятие «сегментарной аллополиплоидии» как промежуточную категорию между ауто- и аллополиплоидией.
Относительная частота образования полиплоидов путем прямого слияния двух нередуцированных гамет или через промежуточную триплоидную фазу может быть различной при ауто- и аллополиплоидии. В то время как путь к аутополиплоидии, пожалуй, чаще всего идет через промежуточную триплоидную фазу, путь к аллополиплоидии чаще всего, вероятно, должен быть прямым. Это объясняют обычно тем, что частота образования нередуцированных гамет у гибридов значительно выше (в среднем около 27 %), чем частота образования нередуцированных гамет у негибридных индивидуумов (0,57 %).
В принципе возможно не только увеличение, но и гаплоидизация генома. Это бывает благодаря тому, что яйцеклетка может развиваться партеногенетически, т. е. без оплодотворения (см. 10.1.3.3). Случается, что у диплоидного растения появляется гаплоидное потомство. Если этот процесс происходит у полиплоидного растения, то получается полигаплоидное потомство. И хотя у нормально размножающихся половым путем видов часто наблюдают появление гаплоидного или полиплоидного потомства, неясно, каково возможное значение таких геномных мутаций для эволюции растений.
Обычно наблюдаемый непосредственный эффект полиплоидизации — увеличение всех частей растения. Этот так называемый эффект гигантизма вызван тем, что увеличение числа хромосом приводит к увеличению ядра клетки, а величина ядра, в свою очередь, коррелирует с величиной клетки (рис. 10.11). Так, полиплоидные растения обычно имеют более толстые листья и лепестки, чем их диплоидные предки, однако часто они менее ветвисты и отличаются удлиненным сроком развития. Большое эволюционное значение имеет тот факт, что у аутополиплоидных растений велика доля различных нарушений мейоза. Они возникают благодаря тому, что гомологичные хромосомы имеются теперь не в двойном, а в четверном числе, например, у тетраплоидов. Это приводит к тому, что в мейозе образуются не только биваленты, но и мультиваленты из нескольких гомологичных хромосом, а отдельные хромосомы остаются без пары — униваленты (рис. 10.12). И тогда в результате расхождения хромосом в мейозе образуются недостаточно жизнеспособные или даже вообще стерильные гаметы с лишними или недостающими хромосомами. Таким образом, фертильность аутоплоидных растений чаще всего понижена.
Рис. 10.11. Эффект гигантизма. Полиплоидизация может привести к увеличению клеточного ядра, клеток и всего растения. Устьица, пыльцевые зерна и хромосомы диплоидного и тетраплоидного Antirrhinum majus
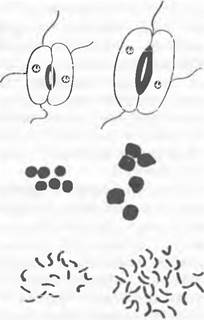
Рис. 10.12. Образование тетравалентов у ауто- тетраплоидной Nasturtium officinale
Вследствие наличия у аутополиплоидного растения в наборах по четыре гомологичные хромосомы процесс наследования проходит иначе, чем у диплоидного индивидуума. Обнаружение тетрасомической вместо дисомической наследственности часто используют в качестве критерия для интерпретации вида как ауто- или аллополиплоидного.
Мейотический эффект при аллополиплоидии другой. Здесь диплоидные гибриды обычно имеют пониженную фертильность из-за недостатка гомологичных хромосом в геноме, полученном от родительских видов. Благодаря полиплоидии, однако, возникают гомологичные хромосомы, и фертильность восстанавливается (см. 10.3.3.4).
Частоту полиплоидии оценивают в зависимости от того, какое число хромосом признают полиплоидным. Если в качестве полиплоидов рассматривать только те виды,
у которых обнаружено число хромосом, кратное самому малому из известных для представителей рода, то среди цветковых растений 30 — 35 % видов полиплоидны. Если же принять, что и самое малое число хромосом, встречающееся в каком-либо роде, уже может быть полиплоидным, и исходить из того, что все гаплоидные числа х> 9 полиплоидны, то доля полиплоидных цветковых растений возрастет до 70 — 80 %. В любом случае очевидно, что полиплоидия у цветковых растений — широко распространенное явление и потому полиплоидизация — важный эволюционный процесс. У папоротников и родственных им растений доля полиплоидов оценивается даже в 95 %, в то время как среди нецветковых семенных растений встречается всего около 5% полиплоидов.
Хотя аутополиплоидные индивидуумы возникают, очевидно, чаще, чем аллополиплоидные, выявить их значительно труднее вследствие нерегулярности мейоза. Кроме того, благодаря гибридному происхождению аллополиплоиды характеризуются большей генетической изменчивостью (см. 10.3.3.4), поэтому обычно принято считать, что преобладающая часть полиплоидных растений возникает путем аллополиплоидии и соответственно восходит к аллополиплоидным предкам. С другой стороны, аутополиплоидия хорошо документирована, например, для подорожника среднего (Plantago media), ежи сборной (Dactylis glome rata) или видов рода Heuchera.
10.1.2.4. Рекомбинация
Генетическая изменчивость возникает вследствие не только мутаций, но и перемешивания наследственного материала различных индивидуумов. Этот процесс, названный рекомбинацией, связан у эукариотических организмов с половым процессом. Рекомбинация родительского наследственного материала происходит, с одной стороны, из-за случайности слияния половых клеток (сингамии), а с другой стороны, благодаря процессу мейотического деления при образовании гамет следующего поколения.
Несмотря на отсутствие полового процесса у бактерий и архей, у этих форм существует возможность генетического обмена и таким путем рекомбинации наследственного материала. Обмен ДНК может осуществляться при прямом контакте клеток (конъюгация), путем переноса ДНК бактериофагами (трансдукция) или переноса свободной ДНК (трансформация).Эти процессы объединяют под общим названием «парасексуальность».
Процессы рекомбинации можно выявить в закономерностях наследования.
В 1866 г. Грегор Мендель в «Опытах над растительными гибридами» впервые количественно сформулировал закономерности наследственности. Достижения Менделя, чрезвычайно важные не только для генетики, но и для эволюционной биологии, в то время остались незамеченными. Лишь после так называемого переоткрытия установленных им правил наследования Г. М. де Фризом, С. Е. Корренсом и А. Эдлером фон Чермаком в 1900 г. началось стремительное развитие генетики. Основным объектом исследования Менделя был горох посевной (Pisiim sativum), наличие многочисленных сортов которого, четко различающихся по многим признакам и к тому же гомозиготных благодаря постоянному самоопылению, позволило ученому получить наглядные и количественно интерпретируемые результаты.
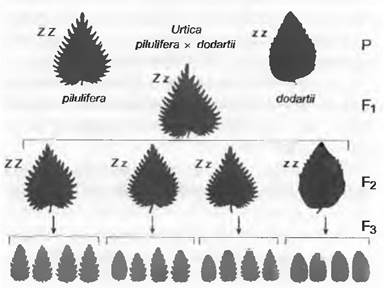
Следующие эксперименты привели Г. Менделя к постулированию известных закономерностей, которые сейчас называют обычно законами Менделя. При скрещивании двух индивидуумов (Р), различающихся между собой только по одному признаку (моногибридное скрещивание), первое дочернее поколение (F1) оказывается единообразным. В представленном на рис. 10.13 примере с ночной красавицей (Mirabilis jalapa) родительские индивидуумы имеют красные или белые цветки, а все потомки F1проявляют промежуточное состояние признака — у них цветки розовые. Окажется ли F1 промежуточным по исследуемому признаку или похожим на одного из родителей, как при скрещивании двух индивидуумов крапивы шариконосной (Urtica pilulifera) с зубчатыми и цельнокрайними листьями (рис. 10.14), зависит от экспрессии аллелей этого признака. В случае доминантности/рецессивности аллелей F1 окажется подобным родителю с доминантным аллелем, а в случае неполного доминирования F1может оказаться промежуточным. Сходство всех потомков первого поколения (F1) описано в первом законе Менделя — законе единообразия F1. Правда, его можно наблюдать только тогда, когда родительские индивидуумы гомозиготны по рассматриваемому гену. Единообразие F1 при выполнении этой предпосылки проявляется независимо от направления скрещивания: неважно, какой из генотипов используется как материнский, а какой — как отцовский1. Если у ночной красавицы затем скрещивают два индивидуума из F1, то получают второе дочернее поколение (F2), в котором индивидуумы с белыми, розовыми и красными цветками встречаются в соотношении 1:2:1. В результате скрещивания между собой индивидуумов F1 у Urtica pilulifera получается F2, в котором индивидуумы с зубчатыми и цельнокрайными листьями встречаются в соотношении 3:1. В обоих случаях наблюдается расщепление признака в F2, из-за чего это явление известно, как второй закон Менделя — закон расщепления в F2. Для объяснения соответствующих результатов при скрещивании различных сортов гороха, к примеру, с гладкими и морщинистыми или желтыми и зелеными семенами, Г. Мендель высказал предположение, что каждый исследованный признак определяется двумя наследственными факторами, которые сегодня называют аллелями одного гена. В случае с ночной красавицей результат скрещивания RR (красные цветки; каждый диплоидный индивидуум содержит два аллеля одного гена, гаплоидные гаметы получают один аллель R) x rr (белые цветки; гаплоидные гаметы содержат аллель г) проявляется в единообразии F1при аллельном составе Rr.Каждый индивидуум F1 образует одинаковое число гамет с R и г. Случайный процесс оплодотворения приводит к тому, что в F2встречаются три различных генотипа (RR, Rr, гг) в соотношении 1:2:1. У Urtica при скрещивании ZZ x zz в F1содержат генотипы Zz, а в F2— генотипы ZZ, Zz и zz в соотношении 1:2:1, но из-за полного доминирования Z соответствующие фенотипы встречаются в соотношении 3 (листья с зубчатым краем):1 (цельнокрайные листья). Встречаемость родительских гено- и фенотипов в F2 ясно показывает, что наследственные факторы дискретны, т.е. в F1они хотя и комбинируются, но не смешиваются.
1 Скрещивать возможно не генотипы, а организмы с определенными генотипами. — Примеч. ред.
Рис. 10.13. Дисомическое наследование окраски цветков у ночной красавицы (Mirabilis jalapa). Моногибридное скрещивание родительских растений (Р) с белыми и красными цветками; три поколения их потомства (F1, F2, F3), гетерозиготные индивидуумы с промежуточной (розовой) окраской цветков. Приведена аллельная конституция (г — белые. R — красные) диплоидных растений и гаплоидных гамет
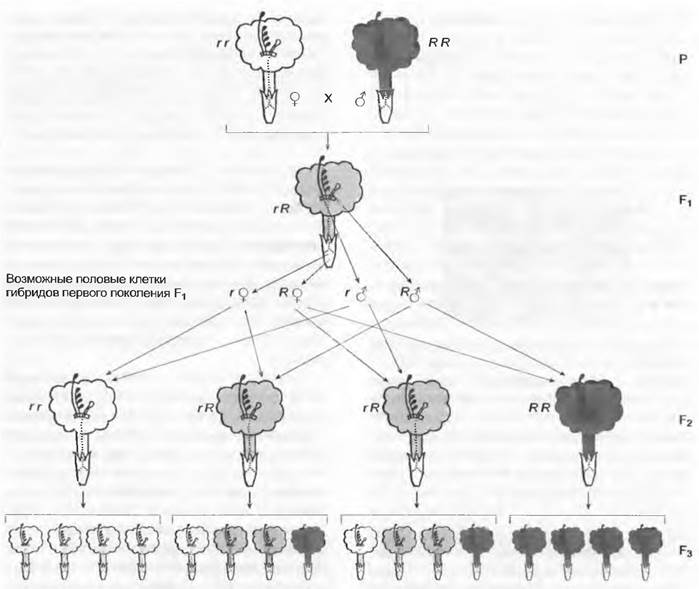
Рис. 10.14. Наследование зубчатости края листа у Urtica pilulifera. Моногибридное скрещивание родительских растений (Р) с острозубчатым (pilulifera) или почти ровным (dodartii)краем листа; их потомки трех поколений (F1, F2, F3). Показана аллельная конституция (Z — острозубчатые листья; z — почти цельнокрайные листья) диплоидных растений
Выявление дискретности наследственных факторов стало значительным шагом вперед по сравнению с представлениями Ч. Дарвина, предполагавшего, что наследственные факторы смешиваются («blending inheritance»). Это было самым слабым местом в теории эволюции Дарвина, что понимали уже его современники, поскольку полезные мутации вряд ли тогда могли бы сохраняться из-за постоянного «разбавления» в скрещиваниях с немутантными индивидами.
В названных примерах наблюдался процесс наследования у динлоидного спорофитного поколения исследуемого объекта. Такое наследование называют диплогенотипическим. Применительно к организмам вроде зеленой водоросли Chlamydomanas, у которой митозы, вегетативное размножение и дифференцировка признаков происходят в гаплоидной фазе, а диплоидна только зигота, говорят о гаплогеногипическом наследовании.
Генотипические различия идентичных по фенотипу индивидуумов F2 с зубчатым краем листа Urtica (ZZ: Zz в соотношении 1:2) можно выявить, получив от каждого из них следующее поколение F3 путем самоопыления или скрещивания каждого индивидуума F2 с гомозиготным рецессивным родительским организмом (zz), т. е. провести реципрокное (анализирующее) скрещивание. В случае скрещивания Zzx zz индивиды реципрокного поколения (R) с зубчатыми (Zz) и цельнокрайними (zz) листьями оказываются в соотношении 1:1, в то время как при скрещивании ZZxzz все индивиды имеют зубчатые (Zz) листья.
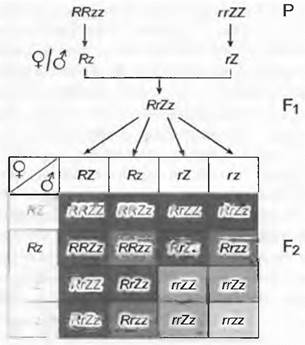
Индивидуумы могут различаться не по одному, а по двум или большему числу признаков (дигибридные или полигибридные скрещивания). Тогда можно наблюдать и другую закономерность. Скрещивание сортов львиного зева большого Antirrhinum majus с красными и актиноморфными цветками (RRzz) и с белыми и зигоморфными цветками (rrZZ) (рис. 10.15) приводит и здесь к проявлению первого правила Менделя о единообразии F1 — все растения оказываются с красными и зигоморфными цветками. Если скрестить два индивидуума из F1, то в F2 встречаются фенотипы: цветки красные и зигоморфные, красные и актиноморфные, белые и зигоморфные, а также белые и актиноморфные в соотношении 9:3:3:1. Эти данные можно объяснить тем, что красный цвет (R) и зигоморфная форма (Z) доминантны и что единообразное первое поколение с генотипом RгZzобразует четыре различных типа гамет. Случайные комбинации этих четырех типов гамет RZ, Rz, rZ и rz образуют 16 возможных сочетаний (число возможных комбинаций можно рассчитать, как комбинационное число 4n, где n — число исследуемых генов, среди которых имеется 9 генотипов (1 х RRZZ, 2 х RRZz, 2 х RrZZ, 4 х RгZz, 1 х RRzz, 2 х Rrzz, 1 х ггZZ, 2 х rrZz, 1 х rrzz). Согласно правилу доминирования, в исследованном примере эти девять генотипов попадают в четыре фенотипических класса (RRZZ, RRZz, RrZZ, RrZz — красные зигоморфные; RRzz, Rrzz — красные актиноморфные; rrZZ, rrZz — белые зигоморфные; rrzz — белые актиноморфные). Примечательно, что в этом случае в поколении F2встречаются комбинации признаков, которых не было ни у родительского поколения, ни в F1. На уровне фенотипов — это красные зигоморфные и белые актиноморфные цветки, а на уровне генотипов — все комбинации, отличающиеся от RRzz, rrZZ и RrZz. Таким образом, очевидно, что генетическая рекомбинация способствует возникновению генетической изменчивости. Наследственные задатки двух анализируемых признаков не остаются в сочетаниях, свойственных родителям, а образуют комбинации между собой независимо. Эти данные соответствуют третьему закону Менделя — закону независимой комбинации разных наследственных задатков.
Рис. 10.15. Схема дигибридного скрещивания у Antirrhinum majus. Родительские растения с красными актиноморфными и белыми зигоморфными цветками; их потомки в F1 и F2; ♂ и ♀гаметы. Гены (каждый с двумя аллелями, доминанты обозначены заглавными буквами, рецессивные — строчными), определяющие окраску цветков (R — красные, г — белые) и форму цветков (Z — зигоморфные, z — актиноморфные) находятся в разных хромосомах (и соответственно не сцеплены). 9 генотипов F2 (RRZZ, RRZz, RrZZ, RrZz, RRzz, Rrzz, rrZZ, rrZz, rrzz) попадают в 4 фенотипических класса (RRZZ, RRZz, RrZZ, RrZz — красные зигоморфные; RRzz, Rrzz — красные актиноморфные; rrZZ, rrZz — белые зигоморфные; rrzz — белые актиноморфные
Только что описанная независимая комбинация наследственных задатков во многих случаях, однако, не проявляется. При скрещивании растений гороха с прямыми зелеными бобами и с изогнутыми восковожелтыми бобами во втором поколении не обнаруживается ожидаемое расщепление в соотношении 9:3:3:1, а комбинации признаков родительских форм наблюдаются значительно чаще, чем новые комбинации. Таким образом, два рассматриваемых гена, определяющих форму плода и его окраску, не независимы друг от друга, а сцеплены.
Все до сих пор описанные процессы наследования, включая и последнее отклонение от третьего закона Менделя, можно объяснить процессами слияния гамет и мейозом, а также организацией генов в клеточном ядре. Единообразие первого поколения гибридов F1 возникает благодаря тому, что в диплоидном организме каждая хромосома имеется в двойном числе и соответственно каждый ген представлен двумя аллелями. Потомство (F1) гомозиготных родителей оказывается однотипным — гетерозиготным. Так как в мейозе число хромосом уменьшается вдвое, образующиеся гаметы несут только один аллель. Их случайное объединение при слиянии половых клеток при моногибридном скрещивании приводит во втором поколении (F2) к образованию трех различных генотипов в соотношении 1:2; 1, т. е. наблюдается расщепление в F2. Описываемое третьим законом Менделя независимое комбинирование наследственных задатков обнаруживается в случаях, если анализируемые гены находятся в разных хромосомах. Их независимость определяется тем, что в первом делении мейоза располагающиеся попарно бивалентами гомологичные хромосомы родителей, как правило, расходятся случайным образом, так что не все хромосомы одного родителя попадают в одну дочернюю клетку, а другого — в другую. Таким образом, благодаря случайной ориентации бивалентов возникает перемешивание родительских хромосом. Этот процесс называют также интерхромосомной рекомбинацией, потому что перемешивание родительских хромосом хотя и происходит, но сами хромосомы остаются интактными. Отклонения от независимого комбинирования наследственных задатков встречаются, когда анализируемые гены находятся в одной и той же хромосоме и физически связаны друг с другом. Наблюдение того, что такие гены не всегда остаются вместе, а с различной частотой оказываются отделены друг от друга, объясняется тем, что родительские хромосомы в мейозе могут обмениваться участками благодаря кроссинговеру. Так возникают хромосомы, состоящие из отцовской и материнской частей. В результате гены одной хромосомы могут происходить соответственно от отца и от матери. Этот второй процесс рекомбинации называют интрахромосомной рекомбинацией.
Масштаб интер- и интрахромосомных рекомбинаций сильно зависит от свойственного виду числа хромосом и их размера. Более высокое хромосомное число увеличивает возможности комбинирования материнских и отцовских хромосом, а частота кроссинговера выше в более крупных хромосомах, чем в мелких, из-за чисто пространственных соотношений.
Частота, с которой расположенные в одной хромосоме гены отделяются друг от друга, зависит от расстояния между ними. Большое расстояние чаще приводит к разделению, так как вероятность кроссинговера между генами в этих случаях велика. Если же два гена расположены по соседству, то они разделяются редко, потому что кроссинговер на очень коротком участке хромосомы маловероятен.
Частоту рекомбинаций можно использовать для составления генетических карт сцепления (рис. 10.16), на которых представлено линейное расположение генов в хромосоме. Правда, частота рекомбинаций далеко расположенных генов всегда ниже значения, которое получается суммированием рекомбинационных частот генов, расположенных между ними. Это можно объяснить тем, что при очень больших расстояниях частота рекомбинации вновь падает вследствие двойного или многократного кроссинговера. Место гена на генетической карте сцепления называется локусом.
Рис. 10.16. Положение некоторых генов (ср, ten др и т.д.) в хромосоме V гороха посевного (Pisum sativum). Слева — фенотип при нормальном или мутантном состоянии гена; частичное проявление только при совместном действии с другими генами (например, с А — основным геном для образования антоциана). Справа — частоты рекомбинаций

До сих пор были использованы примеры. в которых один признак кодируется одним геном с двумя аллелями. Примеры, когда очень многие и в особенности непрерывно варьирующие признаки, такие, как высота растения или длина листовой пластинки, не расщепляются в F2 на дискретные классы признаков, а скорее характеризуются непрерывным вариационным рядом, приводят нас к заключению, что эти признаки, вероятно, полигенны, т. е. кодируются многими генами. Распознавание дискретных классов признака в расщепляющемся поколении может быть дополнительно затруднено и тем, что на экспрессию гена влияет окружающая среда, которая затушевывает имеющиеся дискретные классы признака. Процесс наследования количественных признаков невозможно анализировать методами менделевской генетики, его исследуют методами количественной генетики (см. рис. 10.16).
В последнее время доступность молекулярных методов позволила применить новые подходы в генетическом анализе количественных признаков. При этом на первом этапе составляют генетические карты сцепления молекулярных признаков. На втором этапе пытаются найти сходное расщепление молекулярных и фенoпипических признаков. Если, к примеру, какой-то фенотипический признак индивидуумов расшепляюшегося второго поколения (F2) статистически достоверно коррелирует с определенным молекулярным признаком (это называют косегрегацией), то делают вывод, что определяющий фенотип ген расположен по соседству с геном молекулярного признака. Таким путем можно оценить число генов, влияющих на какой-то признак, их положение в геноме и их относительный эффект. Эти методы известны как QTL-картирование (Quantitative Trait Loci).
Генетическая рекомбинация потенциально ведет к возникновению крайне большого числа новых генотипов. Число генотипов (g) в поколении F2рассчитывают, как g = Зn, где n — число независимо сегрегирующих генов, каждый из которых имеет два аллеля. В группе индивидуумов, в которой имеется не два, а несколько аллелей, число новых генотипов для F2рассчитывают по формуле
g = (г (г+ 1)/2)n, (10.1)
где г — число аллелей гена; n — число независимо сегрегирующих генов. Только для пяти генов с четырьмя аллелями каждый возможно 100 000 комбинаций. Правда, при таких расчетах следует учитывать, что не все гены могут свободно комбинироваться, поскольку они иногда расположены в одной хромосоме. Тем не менее такая количественная оценка показывает, сколь велико возникновение новых генотипов при рекомбинации.
10.1.2.5. Внеядерное наследование
Пластиды и митохондрии (органеллы растительных клеток) благодаря своему симбиотическому происхождению имеют собственный геном, соответственно пластидный и митохондриальный. Наследование признаков, кодируемых этими геномами, не подчиняется законам Менделя. Особенность такого внеядерного (экстрахромосомного) наследованияобъясняют тем, что зигота получает свои органеллы чаще всего не от обоих родителей, а только от материнского организма (материнское наследование) и что слияние органелл как первая предпосылка рекомбинации наследственного материала встречается редко. Слияние пластид наблюдали у Сhlamydomonas, а митохондрий — у дрожжей.
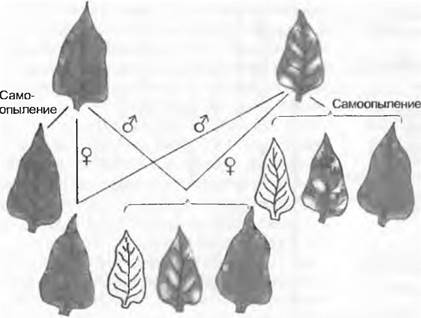
Типичный для пластид ход наследования можно наблюдать у ночной красавицы (Mirabilis jalapa) (рис. 10. 17). Здесь имеются, как и у многих других видов, индивидуумы с нормальными зелеными листьями и с пятнистыми бело-зелеными. Белые участки в ткани листа возникают благодаря тому, что клетки в них имеют только бесцветные пластиды из-за дефекта в образовании хлорофилла. Скрещивание нормального зеленого индивидуума ночной красавицы с пятнистым приводит в зависимости от направления скрещивания к различным результатам, существенно отличающимся от менделевских правил. Если зеленое растение используют как материнское, то все потомки оказываются зелеными. Если же в качестве материнского берут пятнистое растение, большинство потомков имеют пятнистые листья. Эти результаты объясняются тем, что у ночной красавицы пластиды наследуются только через яйцеклетку, поэтому потомки имеют пластидные признаки только женского родителя. Случаи, когда при использовании пятнистого растения в качестве женского родителя, а также при самоопылении пятнистого растения встречаются и нормальные зеленые потомки, обусловлены тем, что, либо какая-то яйцеклетка случайно содержит только нормальные пластиды, либо во время развития эмбриона из зиготы с нормальными и дефектными пластидами имеет место такое случайное распределение пластид, что в клетки листьев попадают лишь нормальные пластиды.
Рис. 10.17. Внехромосомное наследование зелено-белой пятнистости. Материнское наследование у ночной красавицы Mirabilis jalapa
При материнском наследовании пластиды исключаются из мужских половых клеток во время развития пыльцы, созревания спермиев или только при оплодотворении, или же пластиды, полученные от мужских половых клеток, дегенерируют. Хотя у цветковых растений закономерно наследование пластид по материнской линии, у них известно и бипарентальное наследование пластид, например, у Pelargonium и Hypericum. Наследование пластид по отцовской линии описано для некоторых хвойных, например, у сосны (Pinus) и лиственницы (Larix), но также и у киви (Actinidia). Митохондрии наследуются чаще всего по материнской линии, но и для этих органелл известны случаи бипарентального и отцовского наследования.
10.1.3. Рекомбинативная система
Из формулы (10.1) расчета числа возможных рекомбинаций в зависимости от числа исследуемых генов и аллелей (см. 10.1.2.4) следует, что при отсутствии аллельных вариаций (г = 1; гомозиготность по каждому гену) новые рекомбинации не возникают. Хотя клеточные механизмы рекомбинаций имеют место и здесь, скрещивание генетически идентичных индивидуумов не приводит к генетическим новообразованиям в потомстве. Мера генетических рекомбинаций, способствующих возникновению генетических вариаций, зависит от того, насколько велико генетическое сходство скрещиваемых индивидуумов. Генетическое сходство индивидуумов репродуктивного сообщества определяется системой оплодотворения (самооплодотворение/перекрестное оплодотворение и опыление), системой размножения (половое/бесполое),
жизненной формой, дальностью разноса пыльцы и соответственно семян или плодов (поток генов). Совокупность этих факторов можно назвать рекомбинативной системой вида.
10.1.3.1. Система оплодотворения
Двудомность и другие половые типы
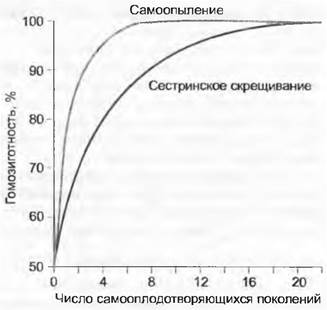
Большинство цветковых растений имеет обоеполые (гермафродитные) цветки, в строении которых заложена возможность самоопыления и самооплодотворения. Постоянное скрещивание индивидуума самого с собой и последующее самооплодотворение увеличивают гомозиготность потомства (рис. 10.18), соответственно уменьшая генетическую изменчивость. Повышение уровня гомозиготности приводит к тому, что рецессивные аллели, став гомозиготными, проявляют свои часто негативные качества. Связанные с этим фенотипические особенности, ухудшающие физическое состояние потомства, называют депрессией инбридинга (англ. inbreeding depression). Самая простая возможность воспрепятствовать самооплодотворению — двудомность, т. е. развитие однополых цветков на разных индивидуумах. В то время как эта форма разделения полов встречается у множества животных, для цветковых растений она большая редкость и встречается только у 5 % видов. Двудомные виды чаще встречаются, например, среди тропических древесных растений и на океанических островах.
Рис. 10.18. Инбридинг и гомозиготизация. Самоопыление и сестринское скрещивание приводят за несколько поколений к полной гомозиготности
Так, на Гавайских островах двудомны около 15 % видов. Определение пола у двудомных цветковых растений первично диплогенотипическое, т.е. генетическая конституция спорофитов является решающим фактором для образования или только мужских, или только женских гаметофитов в цветках конкретного индивидуума. Например, у смолевки обыкновенной (Silene latifolia) половые хромосомы есть (рис. 10.19).
Рис. 10.19. Половые хромосомы и диплогенетическое определение пола (А, В — 1 800х; из К. Belar; С — из W. Schumacher). Мейоз (метафаза 1) в материнской клетке пыльцевого зерна (А) и материнской клетке зародышевого мешка (В) у двудомного растения Silene latifolia; С — схема диплогенетического определения пола; X, Y — половые хромосомы
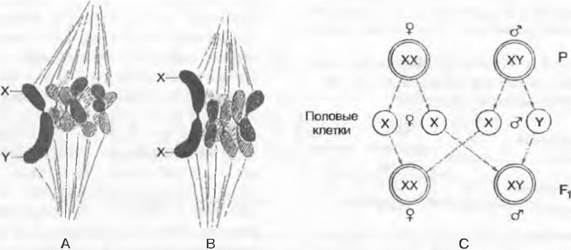
Половые хромосомы противопоставляются как гетеросомы остальным хромосомам генома — аутосомам. В данном случае мужские растения имеют хромосомную Конституцию XY и характеризуются как гетерогаметные, поскольку их гаметы получают X- или Y-хромосому, а женские растения имеют хромосомную конституцию XX и как гомогаметные образуют гаметы только одного типа. У большинства растений, как и у многих животных, мужские организмы гетерогаметны, а женские — гомогаметны. При скрещивании женских и мужских индивидуумов это приводит к образованию мужского и женского потомства в соотношении 1: 1 (см. рис. 10.19). Однако у большинства видов растений обнаружены отклонения от этого численного соотношения. Это означает, что определение пола может быть обусловлено не только генотипически, но и модификационно (фенотипически). Такие факторы, как температура, длина светового дня или доступность воды, оказывают экспериментально доказанное влияние на определение пола у двудомных растений. У двудомной конопли (Cannabis sativa) определение пола может быть изменено использованием абсцизовой кислоты, ауксина, гиббереллина, цитокинина, высокой концентрации бора, моноокиси углерода (СО) или выращиванием при длинном световом дне и повреждением растения.
Бокс 10.1. Учет и анализ фенотипической и генетической изменчивости
Генетическую изменчивость вида можно наблюдать на разных уровнях различными методами. Изменчивость фенотипа имеет как генетическую, так и модификационную компоненту (см. 10.1.1). Так как модификационную компоненту полностью исключить нельзя, для определения доли генетической изменчивости используют результаты экспериментов, в которых все анализируемые генотипы исследуют в одинаковых условиях среды. Для этого растительный материал различного происхождения выращивают из семян в достаточном для статистического анализа количестве при единообразии условий среды. В таком сравнительном эксперименте в культуре (англ. common garden trial) можно распознать, в какой мере представители одного вида отличаются друг от друга генетически, поскольку сохраняющиеся в культуре при одинаковых условиях различия можно объяснить только генетическими отличиями. При этом можно наблюдать все признаки фенотипа — морфологические, анатомические, физиологические или экологические особенности. Следует иметь в виду, что из-за фенотипической пластичности признаков генетические различия вовсе не всегда проявляются при специфических условиях культивирования и что случайно могут встретиться и такие свойства, которые не характерны для вида в естественных условиях произрастания. Сравнительное культивирование при различных условиях и сравнение вариаций в эксперименте с вариациями, наблюдаемыми в природе, позволяют распознать такие случаи. Изменчивость фенотипических особенностей обычно соответствует нормальному распределению.При этом малые и высокие значения признака редки, значительно преобладают средние значения (см. рис. 10.2). Для описания изменчивости используют важные статистические величины, такие, как среднее значение, дисперсия и стандартное отклонение. При этом среднее значение х рассчитывают как частное от деления суммы Σх всех измеряемых показателей на число n этих показателей![]()
Дисперсия и стандартное отклонение — это меры для описания разброса данных, который не отражает среднее значение. Данные различных распределений могут иметь одинаковые средние значения (рис. А). Дисперсиюs2 рассчитывают, как частное от деления суммы квадратов отклонений каждого измеряемого
показателя от среднего значения Σ (х - х)1 на число измеряемых показателей минус 1( n - 1). Таким образом, дисперсия
![]()
Рис. А. Две популяции (А и В) с различным распределением мерных признаков могут иметь одинаковые средние значения в популяциях
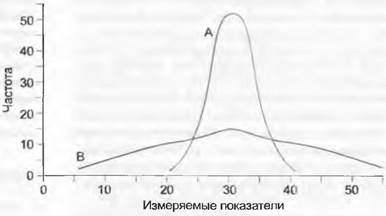
И наконец, стандартное отклонение в — это корень квадратный из дисперсии![]() В эволюционно-биологических задачах обычно важно сравнить, например, изменчивость какого-либо признака в двух популяциях, чтобы выяснить отсутствие или наличие статистически достоверных различий. Для этого можно воспользоваться анализом дисперсий. Проверяют, достоверно ли больше дисперсия между популяциями, чем дисперсии внутри популяций. Если хотят исследовать не один, а несколько признаков, то используют методы многомерной статистики.
В эволюционно-биологических задачах обычно важно сравнить, например, изменчивость какого-либо признака в двух популяциях, чтобы выяснить отсутствие или наличие статистически достоверных различий. Для этого можно воспользоваться анализом дисперсий. Проверяют, достоверно ли больше дисперсия между популяциями, чем дисперсии внутри популяций. Если хотят исследовать не один, а несколько признаков, то используют методы многомерной статистики.
В биологическом материале обычны отклонения от нормального распределения — положительно или отрицательно смешенные распределения, в которых высокие или низкие значения измеряемых величин встречаются чаше, чем средние.
Генетическую изменчивость можно обнаружить и на уровне белков и ДНК. Для характеристики внутривидовой изменчивости из белков обычно исследуют алло- или изоэнзимы. При этом чаще имеют дело с самыми обычными энзимами первичного метаболизма растений. Энзимы, кодируемые одним генетическим локусом с различными аллелями, — это аллоэнзимы. Если, для энзима, имеется несколько локусов, говорят об изоэнзимах. Аллели одного локуса или разных локусов одной ферментной системы можно обнаружить благодаря тому, что они разделяются при электрофорезе из-за различий в их электрических зарядах и впоследствии могут быть окрашены специальными методами1.
1 Разные заряды имеют белковые продукты разных аллелей; их, а не сами аллели, разделяют и выявляют при электрофорезе. — Примеч. ред.
Большое преимущество алло- и изоэнзимов, объединяемых под понятием «изозимы», состоит в том, что оба аллеля одного локуса чаще всего экспрессируются кодоминантно, т.е. оба образуют белок. Это позволяет распознать гетерозиготные индивидуумы без проведения скрещиваний.
Часто используемые для внутривидовых анализов методы анализа ДНК можно объединить в так называемый метод отпечатков. Примерами могут служить методы RAPD (RandomAmplified Polymorphic DNAs), AFLP (Amplified Fragment Length Polymorphism), ISSR (Inter Simple Sequence Repeats) и анализы мини- и микросаттелитной ДНК (VNTRs: Variable NumberTandem Repeats). Эти техники основаны на полимеразной цепной реакции (PCR: Polymerase Chain Reaction) и/или рестрикционном анализе (RFLP: Restriction Fragment LengthPolymorphism).
В описании генетической изменчивости по таким признакам, которые позволяют распознать генные локусы и их аллели, указывают обычно различные количественные величины, разрешающие сравнивать виды с различными свойствами, например, процентное соотношение полиморфных локусов и число аллелей на локус. Локус считают полиморфным в том случае, если в исследуемом материале обнаружено более одного аллеля или если для самого обычного аллеля показана частота менее 0,99. Другая важная величина — средний уровень гетерозиготности. Для отдельного локуса среднюю гетерозиготность й рассчитывают по формуле
![]()
где х1 — частота 1-го аллеля; m - число аллелей. Средняя гетерозиготность Н всех локусов — среднее значение всех h. В дальнейшем анализе структуры генетической изменчивости внутри вида общую вариабельность Нт можно расчленить на две составляющие. Из них Нs описывает изменчивость внутри популяций, а Сst или Fst — изменчивость между популяциями.
Гетерогаметный женский пол известен, к примеру, у Fragaria, Potetitilla и Cotula. Половые хроомосомы содержат регуляторные гены, которые влияют на образование мужских и женских органов цветка. Однако гены, отвечающие за структуру этих органов, локализованы и в ауто сомах. Причиной возникновения половых хромосом скорее всего было то, что обычно полная стерильность, сопровождающая рекомбинацию морфологически различных хромосом, случайно оказалась подавленной. Половые хромосомы наблюдали далеко не у всех двудомных видов.
Если роль двудомности как препятствия самооплодотворению очевидна, то ее возникновение в результате отбора на перекрестное опыление часто вызывает сомнения. Альтернативная гипотеза состоит в том, что при отсутствии мужских органов в цветке можно вкладывать больше ресурсов в семена и плоды. Это могло бы объяснить, почему двудомность нередко коррелирует с образованием мясистых и потому требующих «больших затрат» плодов.
Двудомность, вероятно, чаще всего возникает через гинодиецию, когда на одном растении есть только женские цветки, а на другом — обоеполые. Двудомность и гинодиеция — не единственные варианты распределения половых функций между разными цветками и индивидуумами. Кроме того, имеются однодомность, гиномоноеция, андромоноеция, возможно, андродиеция и полигамия (табл. 10.1).
Таблица 10.1. Приблизительные частоты различных форм распределения полов у покрытосеменных растений
Распределение полов |
Пол цветка |
Пол индивидуума |
Прибл. частота, % |
Гермафродитизм |
♂ и ♀ |
♂ и ♀ |
71 |
Однодомность |
♂ или ♀ |
♂ и ♀ |
5 |
Гиномоноеция |
♂ и ♀/♀ |
♂ и ♀ |
2,8 |
Андромоноеция |
♂ и ♀/♂ |
♂ и ♀ |
1,7 |
Двудомность |
♂ или ♀ |
♂ и ♀ |
5 |
Гинодиеция |
♂ и ♀/♀ |
♂ и ♀/♀ |
7 |
Андродиеция |
♂ и ♀/♂ |
♂ и ♀/♂ |
0 |
Полигамия |
♂ и ♀/♂/♀ |
♂ и ♀/♂/♀ |
3,6 |
Среди других групп семенных растений двудомны Ginkgo, все Cycadopsida и большинство Gnetopsida. Половые хромосомы можно найти и у некоторых их представителей. Среди Coniferopsida двудомность весьма редка. В европейской флоре, например, двудомны тис ягодный (Taxus baccata) и можжевельник обыкновенный (Juni- perns communis). Среди споровых растений раздельнополость присуща лишь гаметофитам, но не спорофитам. У папоротников и родственных им растений разнополые гаметофиты встречаются почти у одних только разноспоровых таксонов. Однако гаметофиты разного пола всегда образованы одним и тем же спорофитом. У равноспоровых папоротников однополые гаметофиты могут возникать благодаря модификаци- онному определению пола. Гаметофиты либо мужского, либо женского пола известны у мхов и водорослей, а печеночник Sphaerocarposимеет также и половые хромосомы.
Система несовместимости
Самонесовместимость позволяет избежать самооплодотворения в обоеполых цветках (рис. 10.19): оплодотворение спермиями собственной пыльцы невозможно. Независимо от того как функционируют конкретные системы несовместимости, генетический принцип, лежащий в их основе, всегда один и тот же. Если в пыльцевом зерне или мужском гаметофите и на рыльце экспрессируется один и тот же аллель самонесовместимости (S), то оплодотворения не происходит. В зависимости от детерминации поведения пыльцы генотипом самого мужского гаметофита или генотипом образовавшего его спорофита, а также в зависимости от морфологии цветка, связанной с системой самонесовместимости, можно выделить три системы самонесовместимости: гаметофитную (ГС) гомоморфную, спорофитную (СС) гомоморфную и гетероморфную.
При ГС реакция пыльцы определяется генотипом пыльцевого зерна, т. е. образованные гетерозиготным индивидуумом пыльцевые зерна попадают в два реакционных класса в соответствии с содержащимся в них аллелем S, а экспрессия двух аллелей 5 в столбике кодоминантна. При самоопылении индивидуума с аллельной конституцией (и при скрещивании двух индивидуумов с обоими этими аллелями) ни пыльца S1, ни пыльца S2 не приводят к оплодотворению (рис. 10.20), так как оба аллеля экспрессированы и на рыльце. При скрещивании S1S3 (материнское растение) хS1S2 (отцовское растение) пыльца S2 осуществляет оплодотворение, так как аллель S2 отсутствует в пестике. При скрещивании S3S4 х S1S2 оба типа пыльцевых зерен могут осуществить оплодотворение.
ГС с одним геном S известна во многих семействах растений, например, у Papaveraceae, Rosaceae, Solanaceae и Scrophulariaceae. Число различных аллелей гена S колеблется от 20 до 70. ГС с двумя генами (S и Z) отмечена у злаков (Роасеае). Здесь реакция несовместимости проявляется в том случае, если аллели обоих генов идентичны как в пыльце, так и в пестике. Три гена самонесовместимости обнаружены у лютика едкого (Ranunculus acris), а четыре — у сахарной свеклы (Beta vulgaris).
При СС реакция пыльцевого зерна определяется не его собственным аллелем, а генотипом образовавшего его индивидуума. В этом случае все пыльцевые зерна одного индивидуума показывают одинаковую реакцию, хотя и содержат различные аллели.
При СС следует ожидать большой изменчивости в экспрессии аллелей в пыльце и пестике. Чаще всего (см. рис. 10.20) один из аллелей доминантен в реакции пыльцы, а два аллеля кодоминантны в пестике.
При скрещивании S1, S2 (материнское растение) xS1S3 (отцовское растение) в случае СС при доминантности S1 проявляется полная реакция самонесовместимости в отличие от отношений при ГС (при ГС пыльца Sз осуществляет оплодотворение), так как S1 определяет реакцию и пыльцы, и пестика при кодоминантной экспрессии (см. рис. 10.20). В случае доминантности в пыльце реакция самонесовместимости вообще не возникнет, и пыльца с аллелем S1 может обеспечить оплодотворение, поскольку реакция пыльцы всецело определена аллелем S3.
Рис. 10.20. Несовместимость при опылении и оплодотворении у покрытосеменных. S-аллели (S1, S2, S3, S4) пыльцевых зерен на рыльце (сверху) и в материнской ткани столбика и завязи (снизу), пыльцевые зерна и пыльцевые трубки (обозначены светлыми линиями). При гаметофитной самонесовместимости реакция зависит от генотипа гаплоидных пыльцевых зерен. При спорофитной самонесовместимости решающим оказывается генотип индивидуума, образующего пыльцу (в скобках). (Генотипы S1S3 и S3S4 проявляются в пестике, а не в пыльце. — Примеч. пер.)
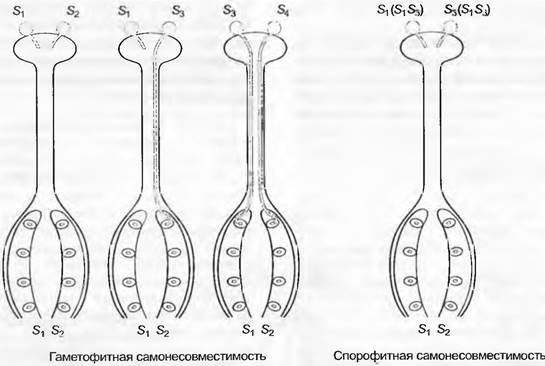
СС лучше всего изучена у Аsterасеае и Вгаssicасеае, а вообще известна в восьми семействах. Число аллелей гена S почти такое же, как и при ГС.
Разумеется, пыльца как мужской гаметофит семенных растений имеет признаки, управляемые собственным гаплоидным геномом. Случаи, когда некоторые признаки пыльцы зависят от генотипа образовавшего ее родительского индивидуума, можно объяснить тем, что тапетум пыльника участвует в образовании оболочки пыльцевого зерна. Эффектный и рано исследованный пример — это форма пыльцевых зерен у гороха (Pi um sativum). Когда скрещивают его индивидуум с удлиненными пыльцевыми зернами (LL) с индивидуумами с округлыми пыльцевыми зернами (II), то гетерозиготное (LI) F1 образует только удлиненные пыльцевые зерна, хотя половина пыльцы содержит аллель круглых пыльцевых зерен I. Напротив, наличие или отсутствие крахмала в пыльце кукурузы (Zea mays) является чисто гаметофитным признаком. Гетерозиготные индивидуумы, полученные от скрещивания «крахмалоносных» и «бескрахмальных» растений, образуют в соотношении 1 : 1 пыльцевые зерна с крахмалом и без него.
Гомоморфные ГС и СС в большинстве случаев коррелируют с определенными другими признаками. При ГС пыльца к моменту опыления чаще всего двухклеточная, кутикула рыльца разорванная и рыльце влажное, а процессу самооплодотворения препятствует остановка роста пыльцевой трубки в столбике. В противоположность этому при СС пыльца в процессе опыления чаще всего трехклеточная, кутикула рыльца сплошная и рыльце сухое, так что пыльцевая трубка просто не может внедриться в рыльце. Исключение пред ставляет ГС злаков, морфологически соответствующая СС.
При гетероморфоной самонесовместимости генетически детерминированные типы скрещивания проявляются и в морфологии. Примером может служить примула (Primula). У большинства видов этого рода находят два типа цветков (рис. 10.21). Так, есть индивидуум с длинным столбиком и низко сидящими в трубке венчика
пыльниками и индивидуум с короткими столбиками и высоко сидящими пыльниками. Обе эти формы различаются также величиной сосочков рыльца и пыльцевыми зернами. Этот феномен назван дистилией или, более общо, гетеростилией.
Рис. 10.21. Гетеростилия у Primula sinensis. Рыльца (G) и пыльники (S) располагаются на разной высоте: А — цветок с длинным столбиком и крупными сосочками на рыльце (N) и мелкими пыльцевыми зернами (р); В — цветок с коротким столбиком, маленькими сосочками рыльца (n) и крупными зернами пыльцы (Р)
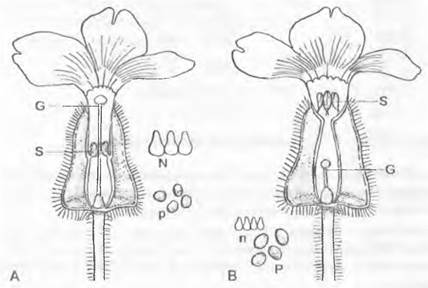
Гетероморфии сходного типа известны примерно в 25 семействах цветковых растений и 155 родах. В одном только Rubiaceae имеется 91 гетероморфный род. К морфологической дифференцировке типов цветков можно отнести дополнительно или альтернативно к названным признакам также опушение столбика (например, у Oxalis) и его окраску (например, у Eichhomid), размер пыльников (к примеру, у Lithospermum, Pulmonaria) или скульптуру экзины (например, у Armería, Limonium. Linurri). Не только две. но и три формы цветка (тристилия) находят, например, у дербенника иволистного (Lythmm salicaria), в роде Eichhornia (Pontederiaceae) и у Narcissus (см. рис. 10.21).
Гетеростилия связана с генетической самонесовместимостью. У Primula индивидуумы с короткими столбиками гетерозиготны по Ss, а формы с длинными столбиками гомозиготны по ss. При доминировании S и спорофитной реакции самонесовместимости успешное оплодотворение возможно только между двумя этими морфами цветка. Оплодотворения внутри цветка или между цветками одного морфотипа не происходит.
Если бы S был не доминантным, а кодоминантным с s, то пыльца индивидуумов с длинными столбиками не могла бы прорастать на рыльце цветка с коротким столбиком (Ss), так как оба растения содержали бы один и тот же аллель. Если бы реакция самонесовместимости была гаметофитной, то при доминантности S было бы возможно самооплодотворение индивидуумов с короткими столбиками, так как половина их пыльцы содержит аллель s, который не проявляется в рыльце.
В противоположность ГС и гомоморфной СС ген S при гетероморфной системе имеет только два аллеля. Соответственно в популяции статистически успешно только каждое второе скрещивание, так как в идеальном случае обе формы цветка встречаются в соотношении 1:1. При очень большом числе аллелей в случаях ГС и СС процент успешных скрещиваний в популяции значительно выше.
Функция гетероморфности, дополнительная к осуществлению генетической самонесовместимости, состоит, вероятно, в том, чтобы уменьшить частоту иллегитимного опыления (внутри одного цветка или между двумя цветками одинакового строения). У Primula пыльца прилипает к брюшку насекомого-опылителя при посещении им цветка с коротким столбиком. Эта пыльца с большей вероятностью попадет на рыльце цветка с длинным столбиком, нежели с коротким. При иллегитимном опылении рыльце может оказаться заблокированным для легитимной пыльцы или иллегитимная пыльца может замедлить прорастание легитимной пыльцы. Вопрос об эволюционной последовательности возникновения гетероморфности и генетической системы несовместимости остается спорным.
Ген S у Primula — это в действительности не единичный ген, а группа из трех очень тесно сцепленных генов. Первый ген (G/g) кодирует длину столбика, величину сосочков рыльца и реакцию несовместимости столбика; второй (Р/р) кодирует величину пыльцевого зерна и его реакцию несовместимости; третий (A/а) кодирует положение пыльников. Редкая рекомбинация внутри этого комплекса генов в гетерозиготных индивидуумах с короткими столбиками в определенных скрещиваниях может привести к потомству с низко расположенными пыльниками и коротким столбиком или высоко расположенными пыльниками и длинным столбиком. Оба этих гомоморфных рекомбинантов самосовместимы и вследствие взаимного расположения пыльников и рыльца могут легко самоопыляться. Этот генный комплекс у Primula — пример того, как возникшее, вероятно, благодаря хромосомным мутациям тесное сцепление трех генов может привести к ослаблению генетической рекомбинации. В этом примере таким путем отчетливо снижена частота разрывов внутри функционального генного комплекса.
В дополнение к уже описанным системам самонесовместимости иногда признают еще как особую систему отсроченной самонесовместимости. При всех различиях в деталях общее для этих явлений то, что реакция несовместимости проявляется лишь после прорастания пыльцевой трубки через столбик и чаще всего выражается в отмирании семязачатков.
Лежащие в основе реакций самонесовместимости биохимические процессы должны быть, по-видимому, очень разными в различных системах. В то время как при ГС, возможно, гликопротеины с рибонуклеазной активностью узнают аллелеспецифичную пыльцевую РНК и разрушают ее, для СС у Вгаssicасеае известно, что в реакции самонесовместимости участвует взаимодействие выделенных пыльцой гликопротеинов и рецепторных протеинкиназ.
Из всех исследованных цветковых растений около 50 % самонесовместимы. Распределение различных систем самонесовместимости по системе, а также сравнение их функций на биохимическом уровне позволяют думать, что три описанные системы возникли независимо друг от друга. Далее можно принять, что ГС и гетероморфная спорофитная самонесовместимость возникали многократно параллельно, чаще всего, возможно, от самосовместимых предков. Это подразумевает, что спорофитная реакция пыльцы в гегероморфных таксонах не гомологична спорофитной реакции пыльцы при ГС. Вопрос о том, возникала ли широко распространенная ГС многократно или нет, остается открытым. Сравнение нуклеотидных последовательностей гликопротеинов с рибонуклеазной активностью, оперирующих в этой системе, пока не дало окончательного ответа на этот вопрос. Вопреки ранним предположениям в настоящее время преобладает мнение, что первые покрытосеменные растения были самосовместимыми. Нередок, правда, и вторичный переход от самонесовместимости к самосовместимости (см. 10.1.3.2).
В селекции растений система совместимости вида имеет большое практическое значение. Так, для скрещивания самосовместимых и сильно самоопыляющихся видов требуется применение особых методов, а у самонесовместимых видов создание «чистых» инцухтных линий обходится дорого.
10.1.3.2. Опыление
Самосовместимые гермафродитные цветки не обязательно должны быть самооплодотворяющимися. Воспрепятствовать самооплодотворению (автогамии) и стимулировать оплодотворение чужеродными гаметами (аллогамию) возможно, затруднив или полностью исключив самоопыление. Этого можно достичь либо разделением по времени созревания тычинок и плодолистиков, либо их пространственным разделением в цветке. При временном разделении (дихогамия; рис. 10.22) либо андроцей созревает раньше гинецея (протерандрия, или протандрия, например, у Аstегасеае), либо гинецей — раньше андроцея (см. рис. 10.22) (протерогиния, или протогиния, например, у многих Ranunculасеае).
В то время как более редкая протогиния обычно бывает связана с самосовместимостью, протандрию часто находят в самонесовместимых цветках. Здесь функция протандрии состоит, возможно, в том, чтобы препятствовать блокированию рыльца собственной пыльцой или чтобы уменьшить невыгодное для чужой пыльцы взаимодействие с собственной пыльцой.
При пространственном разделении (геркогамия) тычинки и плодолистики расположены в цветке так, что самоопыления не происходит.
Примером могут служить цветки ириса (Iris; рис. 10.22), в которых каждое рыльце, расположенное над тычинкой, прикрыто выростом лепестковидной лопасти столбика. Когда нагруженное пыльцой насекомое покидает цветок, эта лопасть прижимается к поверхности столбика и прикрывает рыльце. При посещении насекомым следующего цветка такая же лопасть счищает с него пыльцу, которая теперь может попасть на рыльце пестика.
Рис. 10.22. Дихогамия (А, В) и геркогамия (С — Е). Протерандрия у Ерilobium angustifolium. Цветок в мужской (А) и женской (В) стадиях развития (в натуральную величину). В цветках Iris pseudacorus пыльники и рыльце пространственно отделены друг от друга и рыльце (n) прикрыто листовидной лопастью рыльца (С — общий вид; D — продольный срез цветка; Е — схематический поперечный срез в области пыльников)
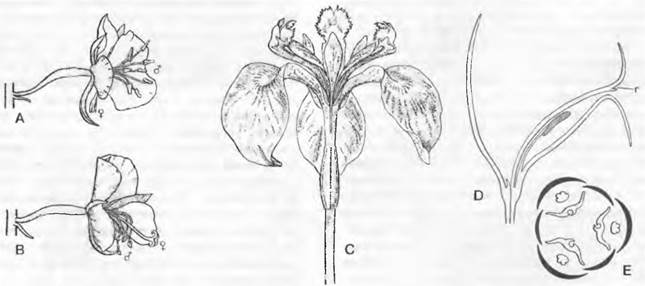
Хотя дихогамия и геркогамия могут эффективно препятствовать самоопылению в отдельном цветке, они не могут исключить опыления между цветками одного соцветия. Опыление между цветками одного индивидуума (гейтоногамия) генетически точно так же является самоопылением.
Если последовательность расцветания цветков в соцветии (например, снизувверх) и перемещение по нему опылителя (например, снизувверх) жестко детерминированы, то опылитель передвигается главным образом от функционально женских цветков к функционально мужским. В результате дихогамия по типу протерандрии может препятствовать гейтоногамии.
Поскольку большинство видов цветковых растений имеют гермафродитные цветки, а генетическая система самонесовместимости свойственна немногим из них и механизмы биологии цветения не всегда могут воспрепятствовать самоопылению или опылению между цветками одного индивидуума, приходится признать, что самоопыление и самооплодотворение у растений — обычное явление. Подсчитано, что в мире около 40 % цветковых растений способны к самоопылению и самооплодотворению. Указывают даже, что во флорах умеренного климата (например, Британских островов) около 2/3 видов имеют эту возможность. Так как эффект продолжительного самооплодотворения негативен (потеря генетического разнообразия, или депрессия инбридинга), требуется найти объяснение для столь немалой частоты самооплодотворяющихся видов. Утрата генетической изменчивости вследствие возрастания гомозиготности уменьшается благодаря тому, что популяция самооплодотворяющегося вида обычно не только состоит из потомства одного индивидуума, но и содержит многочисленные, отличающиеся друг от друга, самооплодотворяющиеся генотипы1. Кроме того, даже низкая частота перекрестного оплодотворения эффективно препятствует полной гомозиготизации. Если, к примеру, только каждое десятое оплодотворение перекрестное, то после нескольких самооплодотворяющихся поколений аллель А, исходно встречавшийся в популяции с частотой 0,5 (50 % всех имевшихся в популяции аллелей одного гена принадлежали к А), сохраняется тем не менее в равновесной частоте «0,1 (10 % А). Депрессия инбридинга может быть преодолена благодаря тому, что в течение немногих поколений генотипы с гомозиготными рецессивными аллелями, обладающими неблагоприятным эффектом, элиминируются отбором. Возможное преимущество самооплодотворения заключается в повышенной эффективности размножения и ускорении развития.
1 Самооплодотворяться могут растения, а не генотипы. — Примеч. ред.
Например, в роде Leavenuvorthia (Вrassicaceae) в самонесовместимых популяциях развиваются в семена 52 — 62 % семязачатков, а в самосовме
стимых популяциях — 73 — 9Д%. При рассмотрении множества видов эти показатели составляют около 22 % для самонесовместимых и 75 % для самосовместимых популяций.
Эффективность репродукции может быть нарушена просто из-за отсутствия опылителя или партнера для скрещивания. Нехватка опылителей обычно имеет место в экстремальных условиях, например, в постоянно холодных и сырых местообитаниях. Для видов, однократно цветущих в своей жизни, существует опасность, что в этот обычно короткий промежуток времени опылителей окажется мало или не будет вовсе. С проблемой отсутствия партнера для скрещивания особенно часто сталкиваются виды-колонизаторы. Если, например, заселяется оставленное под паром поле, то развитие на нем популяций вселяющихся видов обычно начинается с появления только одного индивидуума. Успех колонизации гарантирован, если этот индивидуум может оплодотворить себя сам. Соответственно многие сорняки, колонизирующие нарушенные человеком местообитания, в массе своей — самооплодотворяющиеся растения. Так как обычное самооплодотворение и отсутствие необходимости привлекать опылителей приводят у многих сорняков к уменьшению размера цветков, сокращению производства нектара и снижению количества пыльцы, развитие этих растений ускоряется путем укорочения репродуктивной фазы жизни. Это повышает их успех в колонизации, в частности, благодаря тому, что за один вегетационный период они могут образовать несколько поколений. Повышенная скорость развития, однако, может потребоваться и в условиях очень короткого вегетационного периода.
10.1.3.3. Система размножения
Растения, как и многие другие организмы, способны не только к половому воспроизведению, но и к бесполому размножению. О размножении говорят тогда, когда число индивидуумов в последовательных поколениях возрастает. Размножение и воспроизведение почти всегда связаны между собой. Так как при бесполом раз
множении возникает потомство, генетически идентичное своим родителям, генетическая изменчивость вида или популяции в значительной мере зависит от относительной частоты бесполого размножения. Бесполое размножение, которое также называют апомиксисом, может быть или вегетативным, или семенным (благодаря агамоспермии — образованию семян без полового процесса).
Вегетативное размножение заключается в образовании потомства из соматических тканей при полном отсутствии каких- либо элементов полового процесса. Потомство возникает исключительно благодаря митотическим делениям клеток и потому без изменения ядерной фазы. Это обычный феномен у грибов, водорослей, мхов, папоротников и покрытосеменных растений. У голосеменных растений вегетативное размножение встречается редко. Для флоры цветковых растений Британских островов показано, что около 46 % видов обладают способностью к вегетативному размножению. При этом речь идет чаще всего о многолетних травах, но иногда и о кустарниках. Одно- и двулетние растения не могут размножаться вегетативно, а у деревьев способность к вегетативному размножению встречается редко. Примеры такой способности — тополя (Populus), вязы (Ulrnus), а также растения рода Prunus. Особенно выражена способность к вегетативному размножению, например, у злаков и водных растений. Произошедшие в результате вегетативного размножения и больше не связанные физически с материнским растением индивидуумы называют также раметами. Совокупность рамет, возникших от одного генетически индивидуума (генеты), составляет клон.
У сосудистых растений органами вегетативного размножения чаще всего являются побеги или модифицированные побеги. Это может быть простая фрагментация обычного надземного (например, отделение после укоренения верхушки побега у Rubus) или водного побега (например, у Elodea), уса (например, у Fragaria) и корневища (у многих злаков). Но бывает, что образуются особые многоклеточные выводковые тела. Это, к примеру, выводковые почки (бульбочки у наземных растений, например, у Allium, Polygonum viviparum,турионы — зимующие почки водных растений, к примеру, у Elodea, Hydrocharis), корневые клубни (например, у Ranunculus fîcaria), клубни на подземных столонах (например, у картофеля), луковички (например, у Galanthus) или выводковые почки на месте колосков (например, у Роа alpina и P. bulbosd). Выводковые тела могут образовываться также и у водорослей, лишайников и мхов. Образование побегов на корнях с последующей фрагментацией корней — самый обычный механизм вегетативного размножения у деревьев (корневая поросль). В некоторых случаях и листья могут образовать «детки» для вегетативного размножения (например, у Asplénium. Kalanchoe', см. рис. 4.32). У водорослей, лишайников и мхов важнейшими механизмами вегетативного размножения являются деление и почкование клеток (например, у дрожжей), распадение на отдельные клетки или фрагментация таллома, а также образование особых выводковых телец.
Вклад вегетативного размножения в поддержание популяции может быть значительным. Так, например, подсчитано, что более 99 % индивидуумов в популяции лютика ползучего (Ranunculus repens) произошли благодаря вегетативному размножению. В ходе вегетативного размножения генетические индивидуумы — генеты — могут достигать значительной величины и иногда неожиданно большого возраста.
Использование методов молекулярной генетики для определения генетической идентичности индивидуумов при исследовании, к примеру, североамериканского вида тополя (Populustremuloides) показало, что один клон занимает 43 га и в целом объединяет около 47 000 рамет. Но и у травянистых растений вроде овсяницы красной (Festuca rubra) было обнаружено, что индивидуумы одного клона могут расти на расстоянии до 220 м друг от друга. При наблюдении современного темпа роста этого вида можно рассчитать, что один такой клон достигает возраста от нескольких сотен до примерно 1 000 лет. Эти результаты показывают, что в популяции число генетических индивидуумов может быть намного меньше, чем число физически независимых индивидуумов. Очевидно, что это сильно затрагивает масштаб генетической изменчивости в популяции.
Агамоспермией называют образование семян без участия полового процесса. Этот феномен известен для представителей около 34 семейств и особенно часто встречается у Asteraceae, Роасеае и Rosaceae. Так как мнения о разграничении агамоспермных видов очень различны, невозможно сделать надежные выводы об их числе. Механизмы образования агамоспермных семян весьма различны. У представителей родов Citrus, Opuntia или Nigritella агамо- спермные зародыши возникают в ткани семязачатка без образования зародышевого мешка. При этой так называемой адвентивной эмбрионии (= спорофитная агамоспермия) образованию зародыша не препятствует половой процесс. Так, и половые, и агамоспермные зародыши бывают на одном растении, иногда даже в одном семени. В этом случае агамоспермия факультативна. Однако несмотря на отсутствие полового процесса для образования семян, как правило, необходимы опыление и оплодотворение (псевдогамия), запускающие процесс образования эндосперма. При гаметофитной агамоспермии в семязачатке образуется зародышевый мешок со спорофитным, т. е. нередуцированным, числом хромосом. Если этот зародышевый мешок возникает независимо от наличия обычного гаплоидного зародышевого мешка, то мы имеем дело с апоспорией. Если же такой зародышевый мешок замещает обычный зародышевый мешок, то говорят о диплоспории. Оба эти механизма агамоспермии чаще всего сочетаются с полиплоидией. Зародыш в обоих случаях может развиться или из неоплодотворенной яйцеклетки с нередуцированным числом хромосом (партеногенез), или из какой-либо другой клетки нередуцированного зародышевого мешка (апогамия)1.Апоспорические виды вроде мятлика лугового (Роа pratensis), лапчатки Неймана (Potentilla neumanniana) или лютика золотистого (Ranunculus auricomus), как и виды с адвентивной эмбрионией, факультативно агамоспермны, так как у них существует возможность образования ти пичного зародышевого мешка. Здесь также чаще всего необходимы опыление и оплодотворение для образования эндосперма. В противоположность этому диплоспорические виды, например, ястребинки (Hieracium), одуванчики (Taraxacum), вейники (Calamagrostis) или белоус (Nardus), чаще всего облигатно агамоспермны, так как у них при образовании зародышей бесполым путем есть ткань, подобная той, из которой у видов с половым процессом возникает зародышевый мешок. При диплоспории для развития эндосперма псевдогамия чаще всего не требуется.
1 В России обычно используют название «апогаметия», этимологически более правильное. — Примеч. ред.
Разные механизмы агамоспермии возможно четко различить по цитологическим процессам. Но так как различные механизмы могут встречаться у близкородственных форм (например, Hieracium подрод Hiemciunr диплоспория, подрод Pilosella: апоспория), можно предположить, что все они тесно связаны по генезису.
Методически трудно выявить генетическую основу агамоспермии. У агамоспермных видов, с одной стороны, иногда имеет место половой процесс, с другой — существование близкородственных половых видов с той же плоидностью, с которыми они могут скрещиваться. Адвентивная эмбриония, по-видимому, регулируется только одним-единственным генетическим покусом. В случае апоспории и диплоспории достоверно участвуют по крайней мере два гена. У Taraxacum, например, один ген обусловливает подавление мейоза при развитии зародышевого мешка, а другой ген индуцирует партеногенетическое развитие яйцеклетки. У различных злаков (например, родов Panicum, Brachiaria, Tripsacum) гаме- тофитная агамоспермия регулируется только одним геном. Правда, картирование генома показало, что за этим «геном», возможно, скрывается более крупный участок хромосомы, который отличается сильно сниженной рекомбинационной способностью или ее совершенным отсутствием. Еще не ясно, как много генов фактически содержатся в этом участке и принимают участие в регуляции агамоспермии.
Ожидаемого полного отсутствия генетической изменчивости у агамоспермных видов нет. Наблюдаемые у них генетические вариации могут иметь разные причины.
✵ Агамоспермия редко строго облигатна и по меньшей мере случайный половой процесс может вызывать изменчивость.
✵ Образование нередуцированного зародышевого мешка у диплоспорических видов может начинаться с мейоза, но не проходит до конца, и в результате образуется нередуцированное так называемое реституционное ядро.
✵ Соматические мутации могут накапливаться в течение нескольких поколений
✵ У агамоспермных видов, вероятно, часто встречаются соматические рекомбинации в виде обусловленных транспозонами хромосомных перестроек в соматических клетках.
Несмотря на эти механизмы возникновения генетической изменчивости, уровень ее у агамоспермных видов сильно снижен по сравнению с их близкими родственниками, характеризующимися наличием полового процесса.
Агамоспермия с обычно сниженной генетической изменчивостью ведет к тому, что и самые мелкие различия признаков остаются более или менее постоянными в череде поколений. Так как постоянство различий признаков является основой для разграничения видов при использовании морфологической концепции вида (см. 10.3.1), у агамоспермных форм можно признать большое число агамных видов (микровиды). Например, в центральноевропейской флоре, по мнению некоторых авторов, роды Taraxacum и Hieracium включают около 250 и 190 таких микровидов.
10.1.3.4. Поток генов и жизненная форма
Генетическое сходство скрещивающихся индивидуумов зависит от расстояния, на которое разносятся пыльца и диаспоры (споры, семена, плоды). Если бы пыльца и диаспоры распространялись, как правило, лишь на очень короткие расстояния, то очень велика вероятность скрещивания между родителями и потомками или потомками одного индивидуума, т.е. между генетически очень сходными индивидуумами. Зато эффект генетических рекомбинаций тогда был бы мал. С увеличением расстояния транспортировки пыльцы и диаспор возрастает вероятность скрещивания генетически различающихся индивидуумов. Так как с пыльцой и диаспорами перемешается и наследственный материал, то в тех случаях, когда опыление приводит к оплодотворению, а диаспоры прорастают и возникшие растения скрещиваются с другими индивидуумами, оба эти явления можно объединить под общим понятием «поток генов». Учитывая многообразие механизмов опыления и распространения диаспор (см. 11.2), трудно прийти к реалистичным опенкам дистанций потока генов.
Для опыления считается твердо установленным факт, что частота опыления пыльцой какого-либо индивидуума с удалением от него экспоненциально уменьшается (рис. 10.23) и что опыление чаще всего происходит между индивидуумами, находящимися на расстоянии от нескольких дециметров до нескольких десятков и значительно реже — нескольких сотен метров. Однако наблюдали опылителей, преодолевших и значительно большие дистанции. Некоторые южноамериканские пчелы совершают перелеты до 23 км, во время которых осуществляют опыление. Галловые осы, опыляющие тропические фикусы, регулярно совершают перелеты от 6 до 14 км, а позвоночные животные (например, птицы и летучие мыши) могут в качестве опылителей преодолевать в среднем большие расстояния, чем насекомые.
Перенос пыльцы можно учитывать непосредственно, например, при зоофилии — наблюдая за передвижениями животных-опылителей, а при опылении ветром (анемофилии) — подсчитывая количество оседающей пыльцы на разном удалении от ее источника. Прямое наблюдение не дает, однако, прямых данных о том, завершилось ли отмеченное опыление оплодотворением. Лучше всего это можно установить путем генетического сравнения родителей с их потомками при знании генетической конституции других потенциальных родителей. Экспериментально созданные популяции губастика (Mimulus) (см. рис. 10.23), в которых была известна генетическая конституция каждого индивидуума, позволили определить отцовство каждого образованного в популяции семени и таким образом максимально подробно проанализировать поток генов с переносимой пыльцой. Исследование этого вида показало, что при опылении животными расстояние генного потока обычно больше, чем дистанция перелета опылителей между двумя индивидуумами. Данные наблюдения можно объяснить тем, что обычно не вся собранная на одном цветке пыльца остается на следующем цветке, часть ее может быть занесена и значительно дальше. Это явление называют «carry over». Наоборот, при опылении ветром дистанция генного потока обычно меньше, чем расстояние разноса пыльцы. И здесь объяснение кроется в методике наблюдений, так как на большом расстоянии от
источника пыльцы ее плотность в воздухе очень мала, а, следовательно, очень мала и вероятность опыления и оплодотворения.
Рис. 10.23. Распределение числа шмелей (Bombus sp.), посещающих Primula veris в Нортумберленде (Англия), в зависимости от расстояния

Детальные знания о дистанциях переноса пыльцы важны при оценке потенциальной опасности от измененных с помощью генной инженерии культурных растений, выращиваемых неподалеку от близкородственных и скрещивающихся с ними дикорастущих видов.
Генетически несходные индивидуумы как партнеры для скрещивания могут оказаться поблизости друг от друга благодаря тому, что диаспоры могут быть перенесены на весьма большие расстояния. Все сказанное о переносе пыльцы в принципе относится и к транспорту диаспор. С удалением от индивидуума плотность производимых им диаспор экспоненциально снижается (рис. 10.24), и расстояния, на которые распространяются семена и плоды цветковых растений, составляют от нескольких дециметров до нескольких сотен метров. При этом есть исключения, имеющие эволюционно-биологическое значение.
Рис. 10.24. Распределение обилия семян Verbascum thapsus в зависимости от дистанции распространения
Так, например, известно, что океанические острова вулканического происхождения (например, Кракатау, Сортсей) сравнительно быстро были заселены растениями. Многочисленные анализы родства в комбинации с датировками, основанными на генетических дистанциях, позволяют предположить, что дальний транспорт диаспор даже между континентами и островами Южного полушария в геологическом масштабе времени — нередкое явление. Факт дальнего распространения, к примеру, между Австралией/Новой Зеландией и Южной Америкой можно считать доказанным для Taraxacum и Gentianella.
В дискуссии о самооплодотворении и перекрестном оплодотворении было показано, что и случайное перекрестное оплодотворение может в значительной мере способствовать поддержанию генетической изменчивости. Аналогично это касается и возможного участия в поддержании или увеличении генетической изменчивости случайного потока генов на большие расстояния в ходе переноса как пыльцы, так и диаспор. Благодаря этому труднонаблюдаемые исключительные случаи переноса пыльцы и диаспор имеют большое значение.
Другим аспектом взаимосвязи между потоком генов и генетической изменчивостью в популяциях является жизненная форма исследуемого вида. Продолжительность жизни как один из аспектов жизненной формы важна, поскольку обмен индивидуумами между популяциями многолетних видов имеет большую вероятность,
чем между популяциями однолетников. Это приводит к существенному возрастанию генетической изменчивости у многолетних видов.
По продолжительности жизни различают однолетники, двулетники и многолетники. Среди однолетников в умеренном климате можно выделить зимующие однолетники и летники (яровые, или не зимующие, однолетники). В то время как цикл развития зимующих однолетников чаше всего начинается осенью и заканчивается с приходом весны или в начале лета (т.е. цикл развития захватывает два календарных года, продолжаясь менее одного года), цикл развития летников укладывается в один вегетационный период. Продолжительность жизни многолетников варьирует к широким пределам — от немногих лет до нескольких тысяч лет. Кроме продолжительности жизни в различие жизненных форм могут внести свой вклад и особенности размножения. Растения, которые независимо от продолжительности жизни размножаются всего один раз. называют монокарпическими, растения с многократной репродукцией — поликарпическими.