ХИРУРГИЯ НОВОРОЖДЕННЫХ - 1976
2. ЧАСТНЫЕ РАЗДЕЛЫ
8. Пороки развития отдельных органов и систем
Мочеполовая система
Неотложные урологические синдромы у новорожденных
К неотложным урологическим синдромам новорожденных относят расстройства мочеотделения и мочеиспускания, кровотечение из органов мочевой системы и симптом пальпируемой опухоли.
Полное прекращение мочеотделения у новорожденных может явиться следствием анурии или острой задержки мочи.
Анурия — прекращение мочевыделительной функции почек — является симптомом многих патологических состояний. Различают преренальную, аренальную, ренальную и субренальную форму анурии (схема 1).
Схема 1. Формы анурии
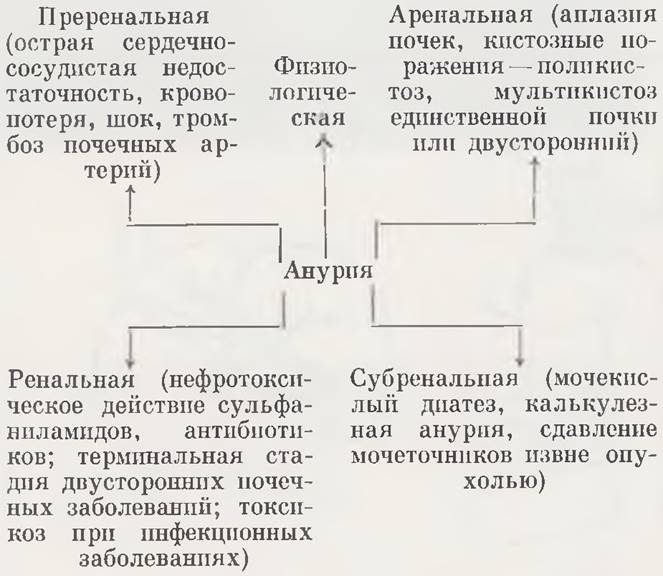
Преренальная анурия обусловлена внепочечнымb причинами. Она развивается в результате гемодиyамических расстройств и ишемии паренхимы почек при острой сердечно-сосудистой недостаточности, кровопотере, тромбозе почечных сосудов, шоке. В зависимости от характера шокогенного фактора выделяют посттравматическую, рефлекторную, гемолитическую, токсическую и инфекционную анурию. Частой причиной острой недостаточности почек у новорожденных являются упорная рвота и длительные поносы, обусловливающие нарушение водно-электролитного баланса, обезвоживание ребенка и уменьшение объема циркулирующей крови.
Аренальная анурия — следствие аплазии почек или тяжелого врожденного заболевания их (поликистоз, мультикистоз единственной почки и др.).
Ренальная анурия связана со специфическим нефротоксическим или нефросенситивным поражением. Такого рода анурия у новорожденных часто возникает на фоне инфекционных болезней, как осложнение пневмонии, гнойновоспалительных процессов, сепсиса. Прямое нефротоксическое действие могут оказать сульфаниламидные препараты и антибиотики. Анурия ренального генеза наблюдается в терминальных стадиях различных заболеваний почек.
Субренальная анурия возникает при нарушении оттока мочи из почки. Наиболее частая ее причина — окклюзия просвета мочеточника или сдавление мочевыводящих путей. Обструктивное поражение может быть локализовано па любом уровне мочевого тракта. Довольно частой причиной субренальной анурии новорожденных является мочекислый диатез, приводящий к закупорке мочеточника солями.
Клиническое течение анурии новорожденных характеризуется развитием симптомов почечной недостаточности, выявление причин которой крайне затруднительно. Поэтому лечение обычно начинают с симптоматической терапии, направленной на стимуляцию функции почек, коррекцию сдвигов водно-электролитного баланса и кислотно-щелочного равновесия. Одновременно проводят мероприятия по ликвидации азотемии, промывание желудка и кишечника 2% содовым раствором или жидкостями, предназначенными для перитонеального диализа. При неэффективности консервативного лечения возникают показания к применению методов внепочечного очищения: перитонеального диализа и гемодиализа.
В детской урологической практике используют фракционный способ перитонеального диализа путем введения в брюшную полость 100 — 150 мл диализирующей жидкости со сменой ее каждые 45 — 60 мин. С этой целью троакаром перфорируют переднюю брюшную стенку, в брюшную полость вводят трубку-кате тер с несколькими отверстиями. Продолжительность процедуры 12 — 24 ч. Рекомендуется диализирующая жидкость следующего состава (из расчета на 20 л): глюкоза — 30 г, NaCl — 160 г, NaHCO3 — 20 г, КСl— 4 г, МgСl2 — 2 г, САСl2 — 2 г, NаН2РO4 — 1 г. К каждому литру раствора добавляют по 1250 ЕД гепарина и 100 000 ЕД пенициллина.
При диализе проводят тщательный контроль за количеством вводимого и выводимого раствора. Задержка жидкости в брюшной полости и ее выход в кровь могут привести к гипергидратации организма и отеку легких. Наиболее частой причиной осложнения является закупорка дренажной трубки воздухом или перекрытие ее просвета кишечными петлями. В таких случаях производится промывание или подтягивание дренажа. Иногда приходится прибегать к его замене.
Перитонеальный диализ позволяет извлечь из крови значительное количество мочевины. Однако при этом удается вывести лишь 12 — 15% токсических веществ (С. Д. Голигорский, Н. Т. Терехов, 1969). Гемодиализ — более эффективный метод. В последние годы он получил довольно широкое распространение при лечении острой почечной недостаточности у детей старшего возраста. В период новорожденности гемодиализ применяется очень редко, в основном из-за трудностей, связанных с подключением больного к аппарату.
Острая задержка мочи у новорожденных детей возникает в результате механических препятствий по ходу нижних мочевых путей. При острой задержке мочи мочевой пузырь бывает переполнен, растянут и контурируется над лобком. Дети беспокойны, кричат. Причины острой задержки мочи у новорожденных в большинстве случаев носят врожденный характер (схема 2).
Схема 2. Причины острой задержки мочи
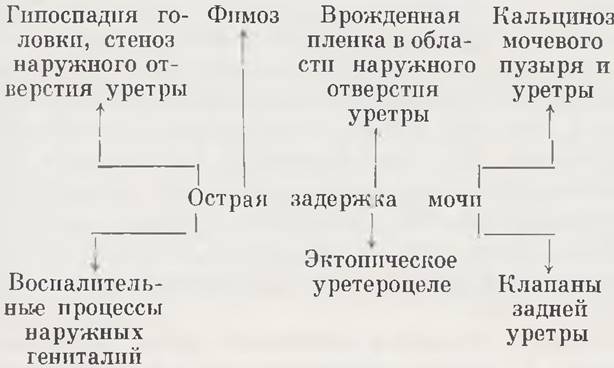
У детей первых часов жизни острая задержка мочи может наступить при наличии тонкой пленки в области orificium uretrae externum, которая легко, без насилия разрывается бужом. Чаще такая пленка наблюдается при гипоспадии головки полового члена. Однако в этом случае острая задержка мочи может возникнуть и при отсутствии пленки и обусловливается резким сужением наружного отверстия уретры, наличие которого обнаруживают лишь при тщательном осмотре в виде еле заметного точечного углубления на вентральной поверхности головки полового члена.
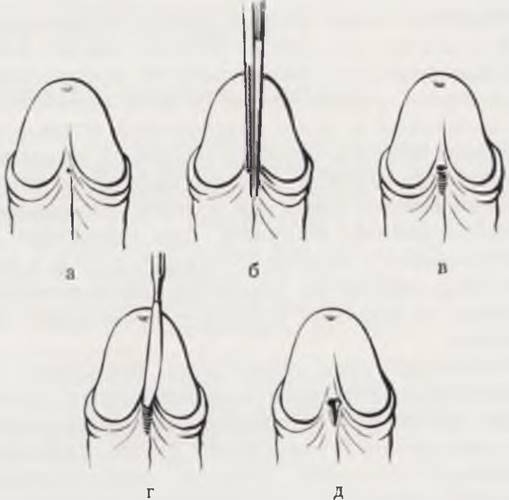
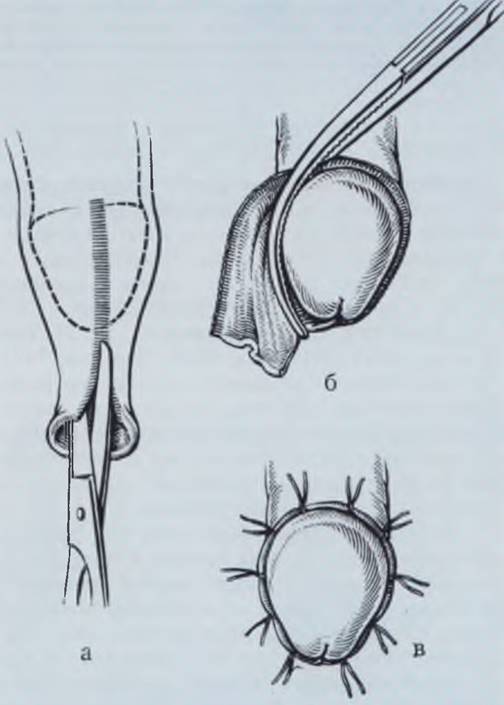
Для ликвидации острой задержки мочи требуется немедленное выполнение меатотомии, обеспечивающей нормальный отток (рис. 96).
Рис. 96. Меатотомия.
а — гипоспадия головки; на вершине головки имеется слепо оканчивающееся углубление; наружное отверстие уретры располагается в области венечной борозды в виде еле заметной точки; б — в стенозированное наружное отверстие введена бранша инструмента на расстояние 2 — 4 мм. Путем сжимания браншей производят раздавливание кожи, формирующей заднюю стенку наружного отверстия; в — определились границы пережатых некротизированных тканей; г — скальпелем производят разрез в зоне сдавления; д — на края слизистой оболочки и кожи наложены кетгутовые швы; стеноз ликвидирован.
Трудные роды в ягодичном предлежании вызывают отек крайней плоти и нарушение нормального мочеиспускания. Фимоз может явиться самостоятельной причиной острой задержки мочи. Другой причиной острой задержки мочи может быть кальциноз мочевого пузыря с расположением кальцификатов в области orificium uretrae internum. Крупные эктопические уретероцеле выпадают в уретру и вызывают острую задержку мочи, а у девочек при наличии широкой и короткой уретры уретероцеле выпадают наружу и при длительном ущемлении могут некротизироваться. Выпадающее уретероцеле симулирует опухоль мочевого пузыря или влагалища.
Инфравезикальная обструкция чаще проявляется симптомом хронической задержки мочи. При клапанах задней уретры возможна и острая задержка.
Воспалительные процессы в области наружных гениталий в виде острых вульвовагинитов у девочек и баланопоститов у мальчиков нередко нарушают нормальный акт мочеиспускания, вызывают острую задержку мочи.
Острая задержка мочи требует принятия срочных мер. Осмотр ребенка и бимануальная пальпация в подавляющем большинстве случаев оказываются достаточными для установления причины задержки. В отдельных случаях с целью выявления этиологического фактора возникает необходимость в дополнительном обследовании, обзорной рентгенографии органов мочевой системы и уретроцистографии.
Ликвидация острой задержки мочи производится путем катетеризации мочевого пузыря. Эта манипуляция достаточно безопасна, надежна и эффективна. В редких случаях, при невозможности введения катетера вследствие непреодолимого препятствия или трудностей обнаружения orificium uretrae externum, прибегают к пункции мочевого пузыря или наложению эпицистостомы. Причина, вызвавшая острую задержку мочи, может быть устранена одномоментно с наложением эпицистостомы или, при технически сложных условиях, последующим этапом операции.
Макрогематурия. Макрогематурия у новорожденных говорит о серьезных нарушениях, происходящих в организме или в органах мочевой системы (схема 3).
Схема 3. Причины макрогематурии
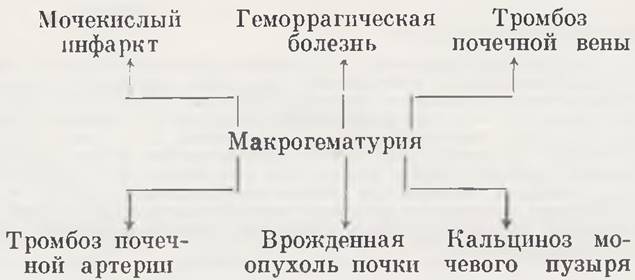
Одной из самых частых причин макрогематурии в первые дни жизни ребенка бывает мочекислый инфаркт, обусловленный повышенным выделением уратов. Окраска мочи приобретает темно-желтый и даже красноватый оттенок, на пеленках нередко остается осадок от выпавших мочекислых солей. Усиленное выделение уратов может явиться причиной смерти новорожденного. По данным Фанкони, при вскрытиях детей, умерших в первые 2 — 5 дней, у 50% в почках обнаруживаются кирпично-красные полосы, идущие от пирамид к коре, — мочекислые инфаркты.
Макрогематурия может быть симптомом геморрагической болезни новорожденных. Основными признаками заболевания являются различные локализации геморрагий (кожа, слизистые оболочки, пуповина, мелена новорожденных и т. д.), включая и кровотечения из мочеполовых органов. Лечебный эффект достигается путем проведения общих мероприятий (инъекции витамина К, переливание крови и т. д.).
Тромбоз почечной вены у новорожденных может возникнуть вследствие гипоксии при тяжелых родах. Некоторые авторы отмечают особую чувствительность детей, родившихся от матерей, страдающих диабетом. Тромбоз почечной вены приводит к геморрагическому инфаркту почки, основными клиническими проявлениями которого являются профузная макрогематурия и азотемия. Резко выражены бледность кожных покровов, снижение уровня гемоглобина, артериального давления, явления дегидратации. При двустороннем процессе быстро нарастает азотемия, присоединяется олигурия. Застойные явления в почке приводят к отеку в поясничной области, увеличению размеров почки. Установлению диагноза помогает сопоставление клинико-лабораторных и рентгенологических показателей. Внутривенная пиелограмма обычно обнаруживает отсутствие функции с больной стороны. При выраженной дегидратации и падении артериального давления возможно угнетение функции не пораженной контралатеральной почки. В сомнительных случаях показано проведение ретроградной пиелографии, которая обнаруживает нормальную картину чашечно-лоханочной системы или наличие дефектов наполнения в полостях почки, заполненных кровяными сгустками. При необходимости выполнения ретроградной пиелограммы соблюдают меры предосторожности, ибо застойная, отечная кровоточащая паренхима почки легко перфорируется катетером и в нее может проникнуть контрастное вещество.
Лечение тромбоза почечной вены консервативное. С целью предотвращения инфицирования назначают антибиотики, корригируют метаболический ацидоз, дегидратацию и анемию. При вовлечении в процесс надпочечника показана стероидная терапия.
Дискутабельным остается вопрос о показаниях к оперативному вмешательству. Сторонники последнего мотивируют необходимость проведения операции риском тромбоза контралатеральной почечной вены. Опыт других (Rickham, 1969) подтверждает правильность консервативной тактики.
Полный двусторонний инфаркт почек на фоне тромбоза почечных вен является состоянием практически инкурабельным.
Тромбоз почечной артерии у новорожденных встречается редко. Основными симптомами являются макрогематурия и сердечная недостаточность. На внутривенной пиелограмме отмечается отсутствие функции с больной стороны. Наибольшую диагностическую ценность при данной патологии приобретает почечная ангиография. Единственным методом лечения является срочная нефрэктомия.
Макрогематурия у новорожденных может быть обусловлена наличием врожденной опухоли.
Макрогематурия из нижних мочевых путей в период новорожденности наблюдается при кальцинозе мочевого пузыря и связана с отторжением кальцификатов. Диагностические мероприятия при этом включают рентгенологические и эндоскопические методы исследования. Тактика обычно консервативная.
Симптом пальпируемой опухоли. Симптом пальпируемой опухоли может явиться следствием пороков развития и заболеваний органов мочевой системы, патологических процессов брюшной полости (опухоль кишки, брыжейки, яичника, удвоение кишки) и забрюшинного пространства (тератома, киста, паранефрит, разрыв надпочечника и др.).
В редких случаях «симптом пальпируемой опухоли» обусловлен у новорожденных блуждающей селезенкой (Daum е. а., 1964), а также наличием овариальных кист, которые способны перекручиваться и разрываться (Ahmed, 1971).
Но данным Е. А. Остропольской (1974), из 82 детей, наблюдаемых в период новорожденности по поводу наличия опухолевидного образования в области живота, у 66 оказались различные формы урологической патологии. При этом ведущее место принадлежит гидронефрозу (23), инфравезикальной обструкции (19), кистозным поражениям (поликистоз — 9, мультикистоз — 5) и опухоли Вильмса (7). Эти данные отражены в схеме 4.
Схема 4. Причины симптома пальпируемой опухоли
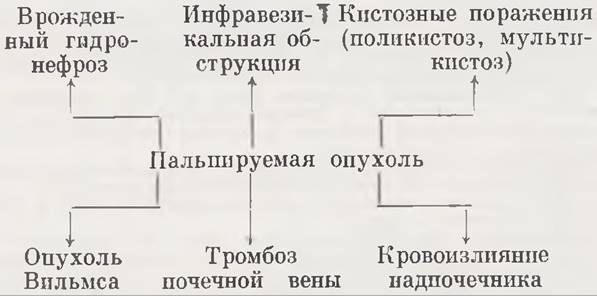
Особенности клинического проявления данного симптома зависят от характера основного заболевания и рассматриваются при описании соответствующей нозологической единицы (врожденный гидронефроз, поликистоз, мультикистоз, инфравезикальная обструкция и др.).
Помимо перечисленных процессов, симптом пальпируемой опухоли у новорожденных может быть следствием массивной надпочечниковой геморрагии. Последняя свойственна периоду новорожденности, когда надпочечниковые железы значительно увеличены в размерах и богато васкуляризованы. Кровотечение возникает в самой железе или вокруг нее и обычно является следствием стрессовых реакций. Появление массивной геморрагии у крупных доношенных детей тотчас после рождения расценивается как результат родовой травмы, у недоношенных детей оно возникает на фоне гипоксии. Кровоизлияние в надпочечник возможно в пренатальном периоде, в этих случаях ребенок рождается с выраженной гематомой.
У таких больных, помимо симптома пальпируемой опухоли с одной или обеих сторон, имеются симптомы внутреннего кровотечения: нарастающая бледность, падение артериального давления, коллаптоидное состояние.
Нередко имеет место сочетание надпочечниковой геморрагии с тромбозом почечной вены, что происходит вследствие широкого анастомозирования двух венозных систем. В этих случаях к приведенной симптоматике присоединяется симптом макрогематурии.
Таким образом, симптом пальпируемой опухоли в поясничной области может явиться следствием самых разнообразных патологических почечных и внепочечных процессов.
Хирургическая тактика определяется характером патологического процесса. При массивной надпочечниковой геморрагии достаточно эффективными оказываются консервативные мероприятия, направленные на восполнение кровопотери, применение кровоостанавливающих средств, стероидной терапии. Операцию рекомендуется производить лишь при прорыве гематомы в брюшную полость.
Аномалии полового развития
Пол человека является результатом взаимодействия комплекса генетических, гормональных, психосексуальных и других факторов. Называют от 4 до 7 показателей для идентификации пола: генетический пол, гонадный, гормональный, морфологический (фенотип), паспортный (социальный), психический пол (А. Гроллман, 1969; Н. Т. Старкова и др., 1971). У здорового индивидуума имеет место соответствие между перечисленными критериями. Отклонение в развитии какого-либо из них приводит к патологии формирования пола. Состояние, при котором имеется «противоречие» между общим внешним видом, наружными половыми органами и гонадами, получило название гермафродитизма. Принято различать истинный гермафродитизм (в гонадах таких индивидуумов имеются и текстикулярные, и овариальные морфологические элементы) и ложный (псевдогермафродитизм). При последнем пол гонад дифференцирован, но ему не соответствуют ни телосложение, ни наружные, пи внутренние половые органы. При женском псевдогермафродитизме гонады представлены яичниками, при мужском — яичками.
Несоответствие между гонадным полом и фенотипом имеет место при половых дисгенезиях и агенезиях.
Информация, устанавливающая пол индивидуума, закодирована в хромосомах. Генетический пол определяется в момент оплодотворения при слиянии яйцеклетки и спермин.
Кариотип мужчины состоит из 22 пар соматических и пары половых хромосом X и У. В кариотипе женщины имеются 22 пары соматических хромосом и две половины Х-хромосомы. Все яйцеклетки содержат по одной Х-хромосоме. Половина сперматозоидов содержит Х-хромосому, вторая половина — У-хромосому. Следовательно, в 50% случаев яйцеклетка может быть оплодотворена спермием, несущим Х-хромосому и в 50% — спермием, содержащим У-хромосому. В первом варианте возникает зигота (оплодотворенная яйцеклетка), содержащая две Х-хромосомы, во втором случае в зиготе имеется одна Х-хромосома и одна У-хромосома. Этот этап формирования пола называют половой детерминацией. Хромосомный набор зиготы, содержащий две Х-хромосомы, детерминирует дифференцировку гонад женского типа (яичников). Набор половых хромосом типа ХУ детерминирует развитие гонад мужского типа — яичек.
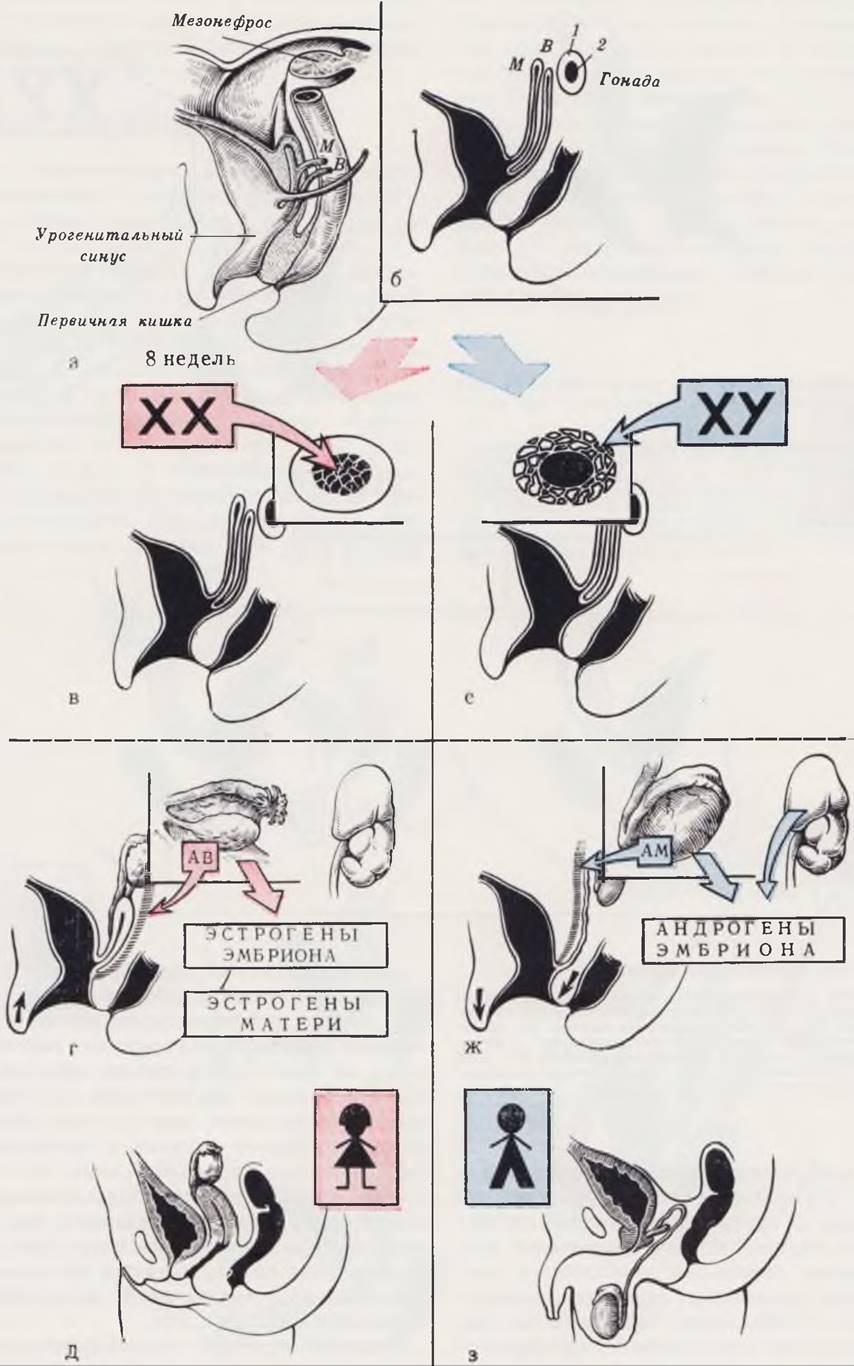
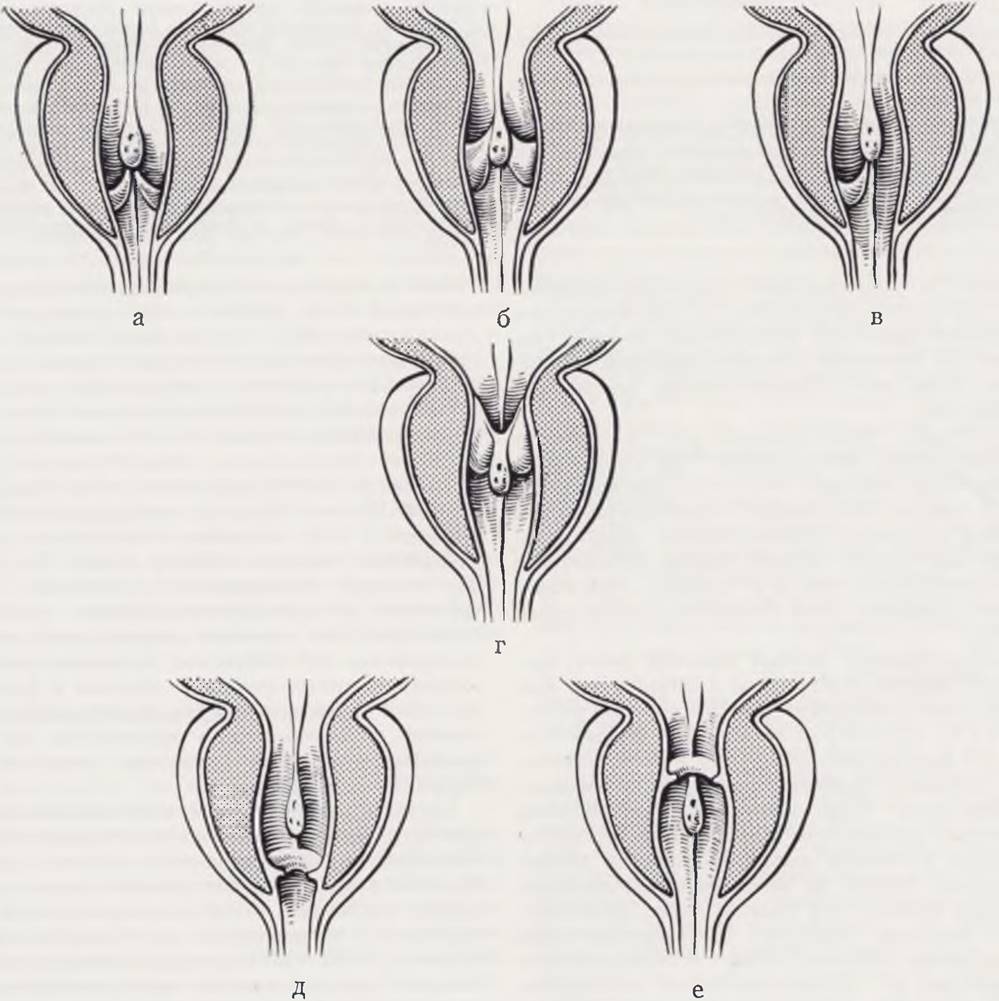
Вначале гонады эмбриона амбисексуальны, т. е. способны развиваться как в мужские, так и в женские органы. До 7 — 8-й недели внутриутробного развития гонады мужского и женского зародышей имеют одинаковое строение и состоят из двух слоев — коркового и мозгового. Анатомические взаимоотношения урогенитального синуса и этапы формирования пола схематически изображены на рис. 97.
Рис. 97. Этапы формирования пола.
а — анатомические взаимоотношения у 8-недельного эмбриона человека: В — вольфов проток; М — мюллеров проток; б — взаимоотношения вольфова, мюллерова протоков и первичной гонады: 1 — корковый слой; 2 — мозговое вещество.
На первом этапе формирования пола происходит половая детерминация. Развитие внутренних гениталий зависит от информации, закодированной в хромосомах.
При формировании женского пола (в) под влиянием информации, заложенной в оплодотворенной яйцеклетке (XX), происходят атрофия мозгового вещества первичной гонады и развитие ее коркового слоя.
При формировании мужского пола (е) под влиянием информации, заложенной в оплодотворенной яйцеклетке (XY), происходят атрофия коркового слоя первичной гонады и развитие ее мозгового вещества.
Дальнейшее формирование пола идет под влиянием гормонов развившейся половой железы эмбриона, фетальной коры надпочечников, гормонов (эстрогенов) матери, обусловливающих автономную тенденцию каждого эмбриона и плода к феминизации.
При формировании женского пола (г, д) яичник выделяет гормоны, которые вместе с эстрогенами матери определяют развитие внутренних и наружных половых органов, Выделяемое при этом яичником «антивольфово» вещество (АВ) обусловливает атрофию вольфова протока.
При формировании мужского пола (ж, з) под влиянием андрогенов тестикул и фетальной коры надпочечников, определяющих устойчивость тканей эмбриона и плода к феминизирующему воздействию гормонов матери, образуются мужские внутренние и наружные половые органы. Выделяемое тестикулами «антимюллерово» вещество (АМ) обусловливает атрофию мюллерова протока.
Формирование наружных гениталий происходит с 12-й по 20-ю неделю. У мальчиков из полового бугорка образуется головка полового члена и пещеристое тело уретры. На нижней поверхности полового бугорка возникает уретральная бороздка, из которой формируется уретральный желобок. По обеим сторонам последнего располагаются половые складки, которые в процессе дифференцировки вытягиваются, срастаются между собой и образуют мочеиспускательный канал. В этот период мочеполовое отверстие открывается у корня полового члена. Позднее, когда из мезенхимы полового бугорка образуется пещеристое тело уретры, мочеполовое отверстие перемещается на головку полового члена. После срастания половых складок соединяющиеся половые валики образуют кожную часть мошонки.
У девочек из полового бугорка образуется клитор; мочеполовой синус остается открытым и превращается в преддверие влагалища, а из половых складок образуются малые половые губы. Из наружных половых складок образуются большие половые губы.
К моменту рождения ребенка у него обычно полностью закончено формирование и внутренних, и наружных половых органов.
Возникновение патологии формировании пола зависит от характера и времени действия патологического (тератогенного) фактора. Такими факторами могут быть радиационное излучение, физические, химические, биологические (инфекционные) агенты или гормональная дискорреляция в организме матери и др. Патологическое воздействие па этапе генетической детерминации пола обусловливает возникновение хромосомной половой аномалии, клиническая картина которой зависит от патологии клеточных хромосом.
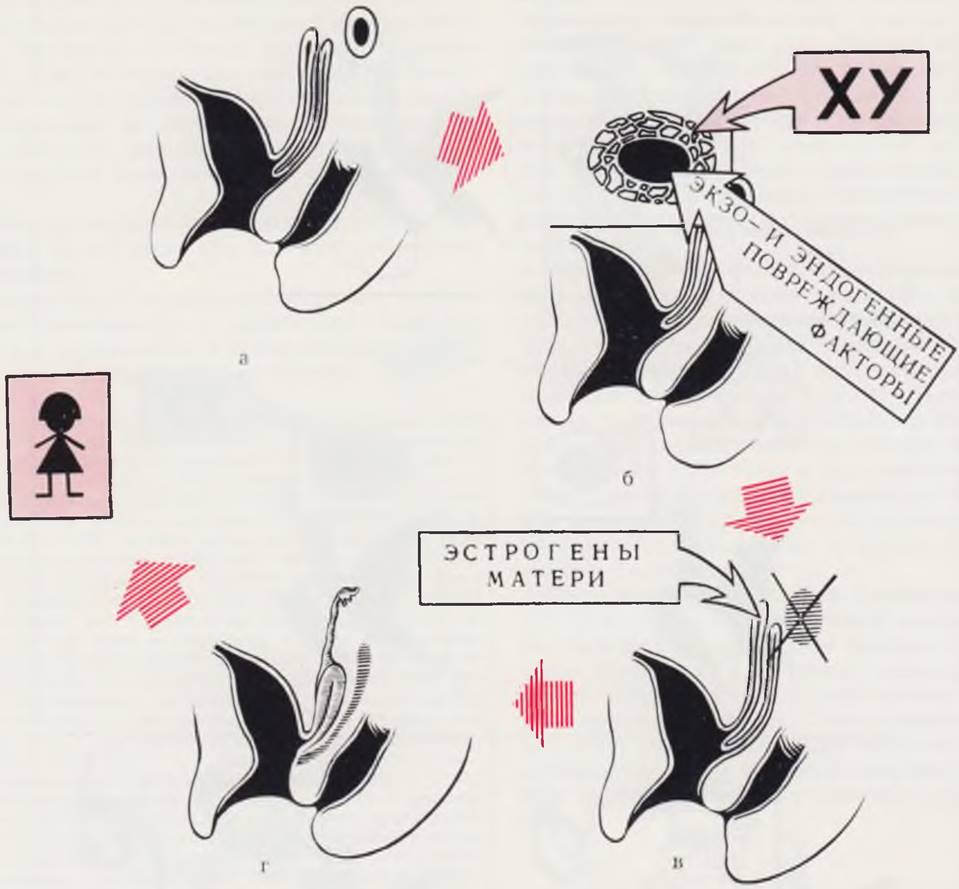
Нарушение половой дифференцировки на этапе формирования половой закладки в зависимости от распространенности поражения обусловливает развитие гонадной бисексуальности (истинный гермафродитизм) или гонадальной дисгенезии и даже агенезии (рис. 98). В последнем случае независимо от генетического пола внутренние и наружные половые органы формируются по женскому типу, в силу автономной тенденции любого плода к феминизации. То же самое происходит при половых дисгенезиях хромосомного происхождения (синдром Шерешевского — Тернера).
Рис. 98. Патогенез гонадального агенеза.
На этапе половой детерминации (а) в результате воздействия экзо- или эндогенных повреждающих факторов (б) гибнет первичная гонада. Под влиянием гормонов матери (в), обусловливающих автономную тенденцию каждого плода к феминизации, развиваются дериваты мюллерова протока (г). При кариотипе 46 XY рождается ребенок фенотипически женского пола — с несоответствием генотипа фенотипу.
На третьем этапе половой дифференцировки (7 — 12-я неделя внутриутробной жизни) в случае действия тератогенного фактора формирование внутренних и наружных половых органов завершают эстрогены матери. Рождается внешне полноценная девочка. Если в подобной ситуации плод имел генетический мужской пол, неполноценность его тестикул приводит к развитию наружных половых органов смешанного типа.
На этапе дифференцировки наружных половых органов (12 — 20-я неделя внутриутробной жизни) гонады и внутренние половые органы сформированы полностью. Для правильного развития наружных гениталий необходимы адекватные количества половых гормонов изосексуального тина. Наибольшую опасность в этот период представляют гормональные дискорреляции в организме матери или пробанда, индуцирующие развитие ложного гермафродитизма.
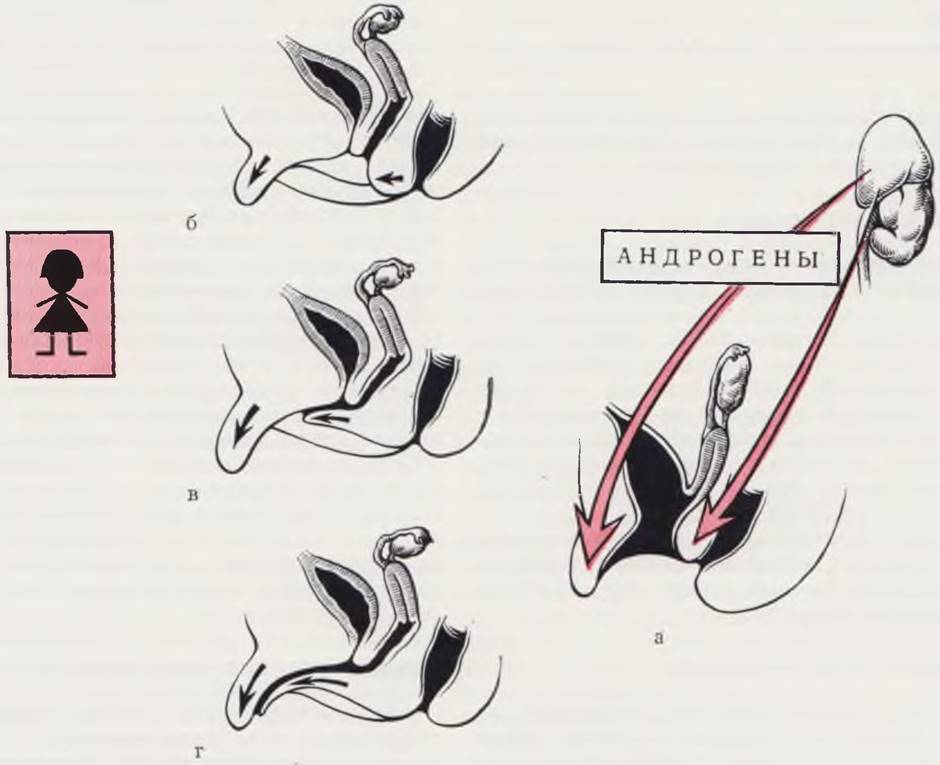
Ложный женский гермафродитизм характеризуется кариотипом с набором половых хромосом XX, вполне дифференцированными яичниками, типично женскими внутренними половыми органами, но вирилизированными наружными половыми органами. Вирилизация наружных половых органов может иметь место при наличии вирилизирующей опухоли в организме матери (андростерома, арренобластома и т. д.), при приеме матерью во время беременности больших доз половых гормонов (замечено, что не только мужские половые гормоны могут быть причиной вирилизации плода, но также прогестерон и эстрогены), при врожденной дисфункции коры надпочечников (рис. 99).
Рис. 99. Вирилизация наружных половых органов у девочек при врожденной дисфункции коры надпочечников.
Степень вирилизации зависит от уровня выбрасываемых надпочечниками андрогенов (а). Гипертрофия клитора. Вульва нормальная (б). Гипертрофия клитора более выражена. Общее мочеполовое отверстие открывается на промежности (в). Клитор выглядит как половой член. На его верхушке открывается общее мочеполовое отверстие. Влагалище впадает в похожий на мочеиспускательный канал урогенитальный синус. Большие половые губы сращены (г).
Ложный мужской гермафродитизм характеризуется набором половых хромосом типа ХY, сформировавшимися, по недостаточно функционально активными тестикулами. Наружные половые органы в этих случаях формируются под влиянием эстрогенов матери. Степень феминизации наружных гениталий зависит от дефицита андрогенов (табл. 19).
Таблица 19. Дифференциальный диагноз пороков пола у новорожденных
Генетический пол (половой хроматин) |
Половые органы |
Экскреция |
Кортиаоновая проба |
|||
Название порока развития |
железы |
внутренние |
наружные |
17-кетостероидов и прегнантриола |
||
Истинный гермафродитизм |
XY (—) |
Нет |
Женские |
Женские |
— |
— |
Гонадальная агенезия |
ХХХУ (+) XX ( + ) |
Неполноценные яичники |
» |
» |
— |
— |
Гонадальная днсгенезия |
XV (—) |
Неполноценные яички (в брюшной полости) |
Смешанные |
Смешанные |
— |
— |
Ложный гермафродитизм мужской |
||||||
Синдром тестикулярной феминизации |
XY (—) |
Яички в паховых каналах пли в больших губах |
Мужские |
Женские |
— |
— |
Внутриутробное повреждение яичек |
ХУ (—) |
То же |
» |
Смешанные (чаще клитор-пенис) |
— |
— |
Ложный гермафродитизм женский |
||||||
Синдром дисфункции коры надпочечников |
XX (+) |
Яичники |
Женские |
Вирилизация (чаще клитор-пенис, мочеполовой синус, сращение больших половых губ) |
Повышена |
Положительная |
Другие виды дисфункции надпочечников |
XX (+) |
» |
» |
То же |
Нормальная |
Отрицательная |
Синдром Шерешевского-Тернера
Синдром Шерешевского — Тернера относится к многосимптомной группе заболеваний, объединенных общим названием — дисгенезия гонад.
При различных формах дисгенезии наблюдаются разнообразные виды патологии половых хромосом, чаще всего ХО или мозаичная структура типа ХО/ХХ, ХО/ХУ, ХО/ХУУ, ХО/ХХХ, ХО/ХХ/ХХХ, ХО/ХУ/ХХУ, а также структурные аберрации Х-хромосомы: дупликация длинного плеча, делеция короткого плеча, кольцевая Х-хромосома. У новорожденного с синдромом Шерешевского — Тернера нередки пренатальная дистрофия, отек кистей рук и стоп. За счет отека кожи затылка шея значительно
утолщена. Отмечается низкая граница роста волос на затылке, дистрофия ногтей и зубов, деформации ушных раковин, уплощенная широкая грудная клетка, микро- и ретрогнатия, узкое твердое небо, иногда синдактилия, укорочение IV пальца кистей или III, IV, V пальцев стоп, положительный метакарпальный симптом, поперечная борозда на ладони. Часто встречаются аномалии сердечно-сосудистой системы, почек, глаз и других органов. Наружные и внутренние половые органы развиты по женскому типу. Гонады дисгенетичны, представлены соединительно-тканными тяжами, зародышевый эпителий отсутствует.
Половой хроматин в ядрах клеток буккального эпителия не определяется. Патогенетической терапии синдрома не существует.
Синдром Клайнфелтера
Новорожденные с синдромом Клайнфелтера фенотипически мальчики, иногда (в 0,1% случаев) у них наблюдается крипторхизм (Н. С. Казей, 1970; Ferguson-Smith, 1966). Характерны сопутствующие аномалии развития сердечно-сосудистой, костно-суставной и других систем. Половой хроматин положительный, с 1 — 2 — 3 и большим количеством телец в зависимости от количества хромосом в кариотипе. Кариотип может быть XXY, XYY, XY/XXY, XXY/XO/XY; XXXXY и т. д.
Синдром Клайнфелтера и синдром трисомии-Х в период новорожденности терапии не требует. Такие больные должны находиться под наблюдением эндокринолога.
Истинный гермафродитизм
Термин «гермафродитизм» происходит от имени одного из древнегреческих богов, ребенка Гермеса и Афродиты, изображавшегося в виде женской фигуры с хорошо развитыми молочными железами и мужскими гениталиями. Термин «истинный гермафродитизм» предполагает наличие у одного индивидуума овариальной и тестикулярной ткани. Тестикулярная и овариальная гонады могут существовать как в виде раздельных органов, так и в виде единого органа. В зависимости от их комбинаций различают гермафродитизм билатеральный (с каждой стороны имеется овотестис или яичник и яичко), унилатеральный (с одной стороны имеется нормальная гонада, а с другой — овотестис) и латеральный (с одной стороны, имеется яичко, а с другой — яичник).
Строение половых путей у таких больных зависит от структуры гонады на соответствующей стороне. При наличии яичка на его стороне может быть эпидидимис и семявыносящий проток, на стороне яичника — труба. Иногда трубу и матку находят в содержимом паховой грыжи и даже в мошонке.
Ложный женский гермафродитизм
Адреногенитальный синдром (врожденная дисфункция коры надпочечников). Заболевание передается по наследству. Генетическая патология индуцирует нарушение ферментных систем 21-гидрокснлазы и 11-гидроксилазы, необходимых для синтеза глюкокортикоидных и минералокортикоидных гормонов коры надпочечников. В результате растормаживается выброс адренокортикотропного гормона гипоталамо-гипофизарной системы (АКТГ), происходит гиперплазия коры надпочечников, повышается синтез и выделение андрогенов, обладающих вирилизирующим эффектом.
Андрогенное влияние секрета надпочечников проявляется с 3-го по 5-й месяц внутриутробного развития. К этому времени гонады и половые протоки уже полностью дифференцированы и начинают формироваться наружные половые органы. Если пробанд — мальчик, повышенное количество андрогенов не мешает правильной дифференцировке наружных гениталий и рождается фенотипически мальчик. Если же воздействию больших доз андрогенов подвергается генетически женский организм, то формируется клиническая картина ложного женского гермафродитизма.
Клиническая картина. Вид наружных половых органов зависит от степени слияния половых губ. Различают несколько типов строения гениталий у таких больных: 1) вульва нормальная; 2) преддверие углублено и напоминает воронку; 3) в промежности имеется разных размеров общее урогенитальное отверстие; 4) урогенитальное отверстие открывается на верхушке клитора. Избыток андрогенов оказывает анаболическое действие, что проявляется ускорением дифференциации костей. Костный возраст такого новорожденного может соответствовать 6-месячному, годовалому и даже 2-летпему.
Дефицит глюкокортикоидных и минералокортикоидных гормонов коры надпочечников таких больных проявляется гипонатриемией, гиперкалиемией, эксикозом, токсикозом, гипотрофией, мышечной адинамией, срыгиваниями и частой рвотой. Наблюдается гиперпигментация кожи наружных гениталий, околососковых кружков и других участков кожи, подвергающихся трению одеждой.
В зависимости от выраженности дефицита стероидных гормонов различают три основные формы заболевания: неосложненную, солетеряющую и гипертоническую. При неосложненной и солетеряющей формах артериальное давление снижено, при гипертонической — повышено.
Лечение. Врожденная гиперплазия коры надпочечников — единственная форма гермафродитизма, для которой существует патогенетически обоснованное лечение. Оно включает заместительную терапию гормонами с глюкокортикоидной и минералокортикоидной активностью (преднизолон, гидрокортизон, ДОКСА и др.) в дозах, достаточных для того, чтобы ликвидировать гипонатриемию, гиперкалиемию, снизить экскрецию 17-кетостероидов до уровня, соответствующего степени тканевой зрелости новорожденного (его «костному» возрасту). Под влиянием названных гормонов у больного прекращаются срыгивания, уменьшается обезвоживание, отмечается нарастание веса. Параллельно с улучшением общего состояния, нормализацией электролитного баланса уменьшаются и симптомы вирилизации. Окончательная коррекция наружных гениталий производится оперативно в постнеонатальном периоде.
Другие формы ложного женского гермафродитизма характеризуются сходным с описанным строением наружных гениталий, но клиническое течение лишено симптомов надпочечной недостаточности. Диагноз устанавливают на основании женского хромосомного пола и исключения адреногенитального синдрома. Наличие яичников подтверждает диагноз и исключает истинный гермафродитизм. Сделаны попытки проведения у новорожденных эндоскопии урогенитального синуса при псевдо-гермафродитизме (Suli, Nicole, 1966). Лечение заключается в корригирующей операции.
Ложный мужской гермафродитизм
Половые железы у новорожденных, страдающих ложным мужским гермафродитизмом, представлены тестикулами. Наружные гениталии — смешанного типа. Существует особая форма ложного мужского гермафродитизма, так называемый синдром тестикулярной феминизации. При этой форме гонады являются вполне дифференцированными тестикулами, но продуцируют гормоны, воспринимаемые тканями как эстрогены. Это приводит к формированию гениталий по женскому типу. У новорожденного синдром тестикулярной феминизации можно заподозрить только в том случае, если в толще больших половых губ или в паховом канале пальпируются тестикулы.
Врачебная тактика и лечение. Пол ребенка должен быть установлен еще в период новорожденности, так как изменение пола после грудного возраста может вызвать тяжелые психические расстройства. Трудности выбора социального пола затруднены отсутствием абсолютных показателей. Даже тип гонад, половой хроматин, число или тип половых хромосом не всегда являются факторами, определяющими иол. Более важными с точки зрения индивидуума и среды, в которой он живет, являются вторичные половые признаки, такие, как телосложение, наружные половые органы, развитие молочных желез, тембр голоса, оволосение лица.
Новорожденную с врожденной дисфункцией коры надпочечников, как бы ни были вирилизированы ее гениталии, следует воспитывать как девочку, так как по мере насыщения организма недостающими гормонами вирилизация уменьшается.
В остальных случаях руководствуются степенью вирилизации наружных половых органов, так как именно этот признак дает возможность предвидеть, в каком плане будет происходить половое созревание. При значительной вирилизации ребенку дают мужское имя и воспитывают его как мальчика.
В сложных случаях гермафродитизма лучше избрать женский пол, так как при таком решении в последующем легче проводить гормональную терапию и оперативное лечение. У больных с ложным мужским гермафродитизмом недостаточно дифференцированные тестикулы рекомендуют удалять во избежание возможного усиления их вирилизирующего действия и злокачественного перерождения. У больных с тестикулярной феминизацией при расположении тестикул в толще больших половых губ вопрос об удалении тестикул можно отложить до более старшего возраста, поскольку эти тестикулы легко пальпируются и риск малигнизации не так велик.
Экстрофические аномалии
Нарушение процесса врастания первичной мезодермы в аллантоис на разных этапах эмбриогенеза приводит к возникновению тяжелых пороков развития нижних отделов мочеполовой системы, которые объединяют общим названием «экстрофические аномалии».
Наиболее частым из них является экстрофия мочевого пузыря в сочетании с эписпадией. Формирование порока по срокам относится к более поздней стадии (16 мм) развития эмбриона. При этом первичный урогенитальный синус вследствие недоразвития абдоминальных мышц оказывается снаружи, не будучи прикрыт передней брюшной стенкой.
В зависимости от степени недоразвития мезодермальной ткани возникают различные по тяжести пороки. Наиболее легкая степень недоразвития выражается эписпадией и верхней расщелиной мочевого пузыря. Самыми тяжелыми формами являются экстрофия клоаки и пузырно-кишечная расщелина.
Экстрофия мочевого пузыря встречается в 1 случае на 30 000 родов, чаще у мальчиков.
Клиническая картина. Порок проявляется отсутствием передней брюшной стенки и передней стенки мочевого пузыря. Слизистая оболочка задней стенки пузыря обнажена и заполняет дефект в надлобковой области. В подавляющем большинстве случаев экстрофия сопровождается полной эписпадией. У мальчиков половой член недоразвит, притянут к животу, при отведении книзу на передней поверхности его хорошо прослеживается бороздка слизистой оболочки уретры, плотно прилегающей к кавернозным телам полового члена. Головка полового члена раздвоена, крайняя плоть прикрывает ее в виде фартука лишь по задней поверхности.
У девочек отмечается расщепление больших и малых половых губ, и головки клитора, между двумя половинками которого прослеживается полоска слизистой оболочки расщепленной уретры. Вагинальное и анальное отверстия обычно смещены кпереди. Экстрофия мочевого пузыря нередко сочетается с аномалиями внутренних половых органов в виде крипторхизма, гипоплазии предстательной железы у мальчиков и удвоения влагалища, наличия двурогой матки у девочек.
При экстрофии мочевого пузыря имеет место значительное расхождение костей лонного сочленения, диастаз между которыми может достигать 6 — 7 см и более.
Размеры экстрофического мочевого пузыря варьируют в довольно широких пределах — от 2 до 6 — 8 см в диаметре — и существенно не изменяются с возрастом. Окружность его ограничена апоневротическим кольцом, диаметр которого нередко значительно уступает диаметру выбухающей слизистой оболочки пузыря.
Для выяснения истинных размеров экстрофического пузыря целесообразно производить его измерение при натуживании и плаче ребенка, когда повышение внутрибрюшного давления обеспечивает максимальное растяжение слизистой оболочки.
При рождении обнаженная слизистая мочевого пузыря гладкая, эластичная, без выраженной гиперемии. Вскоре после рождения характер ее существенно меняется вследствие постоянного раздражения и развития воспалительного процесса. Она становится рыхлой, отечной, гиперемированной, легко кровоточит. Быстро возникает склонность к метаплазии, появляются полипозоподобные разрастания. Окружающая кожа мацерируется, возможно появление пиодермии. Воспалительная реакция не ограничивается внешними проявлениями, процесс, как правило, распространяется на верхние мочевые пути, осложняясь восходящим пиелонефритом.
Уход за детьми с экстрофией мочевого пузыря затруднен. Даже соблюдение правил асептики не гарантирует от развития воспалительных и септических осложнений.
Лечение. Экстрофия мочевого пузыря подлежит оперативному лечению. Операция в период новорожденности весьма сложна, но по мнению отдельных авторов (Г. А. Баиров, 1966; Rickham, 1969), имеет определенные преимущества. Они заключаются в отсутствии вторичных изменений слизистой оболочки и окружающей кожи, которые отрицательно влияют на исход пластики. Немаловажное значение имеет морально-этическая сторона ответственности врача перед ребенком и его родителями.
Реконструктивные операции оправданы лишь при больших размерах экстрофированного мочевого пузыря у девочек. Наличие выраженной дилатации верхних мочевых путей является противопоказанием к вмешательству. У новорожденных целесообразно выполнение пластической операции в два этапа. Первым этапом производят двустороннюю заднюю подвздошную остеотомию в целях нормализации анатомических соотношений тазового кольца, последующим этапом, выполняемым через неделю, осуществляют пластику мочевого пузыря. Большинство авторов откладывают операцию пересадки мочеточников или стенки пузыря с их устьями до 1 года.
Эписпадия относится к более редким проявлениям экстрофических расстройств и возникает вследствие недостаточного развития нижнепупочной мембраны, ограниченного лобковой зоной.
У мальчиков эписпадия встречается в 5 раз чаще, чем у девочек, и, согласно существующей классификации, подразделяется на три формы: головчатую, стволовую и тотальную в зависимости от места расположения уретрального отверстия. Тотальная эписпадия по частоте преобладает над другими формами. У девочек в подавляющем большинстве случаев наблюдается тотальная эписпадия, однако некоторые авторы выделяют по аналогии с мужской эписпадией клиторическую и субсимфизарную формы.
В период новорожденности этот порок представляет интерес в плане своевременной и правильной диагностики. И если у лиц мужского пола одного осмотра достаточно для установления диагноза и определения формы порока, то у девочек это встречает известные трудности.
Клиническая картина. Эписпадия у мальчиков проявляется деформацией полового члена, степень выраженности которой находится в прямой зависимости от формы. Тотальная эписпадия характеризуется расщеплением уретры на всем протяжении; частично захватывается и передний сегмент сфинктера мочевого пузыря. Половой член деформирован и притянут к передней брюшной стенке. Крайняя плоть прикрывает головку лишь по задней поверхности и свисает в виде фартука. При отведении полового члена книзу на передней поверхности его отчетливо прослеживается бороздка слизистой оболочки расщепленной уретры, переходящая у основания в широкое воронкообразное отверстие, ведущее в полость мочевого пузыря. Постоянное выделение мочи в связи с полным недержанием ее быстро вызывает раздражение и мацерацию кожи и требует самого тщательного ухода.
При неполной эписпадии деформация полового члена выражена менее резко, уретра расщеплена не на всем протяжении, расщепление ограничивается зоной головки до венечной борозды (при головчатой форме) или ствола (при стволовой). Контроль над мочеиспусканием при этих формах обычно сохранен, однако нередко отмечается слабость сфинктера, что проявляется умеренным подтеканием мочи при натуживании и плаче ребенка.
У новорожденных девочек первый осмотр не обнаруживает заметных анатомических дефектов и лишь тщательное исследование при разведенных больших половых губах помогает правильной постановке диагноза. Эписпадия у девочек характеризуется расщеплением больших и малых половых губ, расщеплением головки клитора на две обособленные половины и полным расщеплением уретры на всем протяжении. Наружное отверстие уретры перемещено кпереди и представлено широким воронкообразным входом в мочевой пузырь, из него постоянно вытекает моча. Вагинальное отверстие также дистопировано и смещено кпереди. При пальпации области лона отмечается умеренное расхождение лобковых костей.
Лечение. В период новорожденности требуется лишь своевременная и правильная диагностика и организация специального ухода для предохранения кожи от раздражения, мацерации, пиодермии. Наилучший эффект дает открытое ведение со смазыванием кожи окружающих областей индифферентными мазями. Необходима частая смена пеленок, предварительно проглаженным утюгом. Пластические операции, направленные на пластику шейки мочевого пузыря и уретры, производят в более старшем возрасте (3 — 5 лет).
Высокая расщелина мочевого пузыря относится к числу редких пороков. При этом мочевой пузырь имеет внутреннюю полость, прикрыт передней брюшной стенкой, за исключением небольшого участка расщепления ее по белой линии, проекционно соответствующей области верхушки мочевого пузыря. Часть мочевого пузыря, прилегающая к этой зоне, оказывается экстрофической. Уретра и шеечная часть мочевого пузыря со сфинктерным механизмом нормально сформированы, что значительно облегчает выполнение пластической операции, целью которой является закрытие дефекта мочевого пузыря и передней брюшной стенки.
Клоакальная экстрофия, или пузырно-кишечная расщелина, является наиболее тяжелым сочетанным пороком развития из группы экстрофических расстройств. Порок встречается крайне редко и описывается большинством авторов как казуистическое наблюдение. Возникает он при нарушениях раннего периода развития эмбриона (стадия 5 мм) до формирования уроректальной перегородки. Экстрофия клоаки отличается значительной вариабельностью проявлений, по при этом сохраняет основные клинические черты данного порока. Экстрофический мочевой пузырь разделен на две половины проходящей через него в вертикальном направлении кишкой. Слизистая оболочка кишки, подобно пузырной, вывернута, обнаруживается содержимое кишечника. Экстрофический отрезок кишки представляет собой илео-цекальный отдел, при этом верхнее отверстие соответствует терминальному отрезку подвздошной кишки, а нижнее — отрезку толстой кишки, продолжающемуся на 2 — 3 см кпереди от крестца и оканчивающемуся слепо. Непосредственно над экстрофическим пузырем располагается большая эмбриональная пуповинная грыжа, содержащая обычно тонкую кишку и нередко часть печени.
Часто данный порок развития сочетается с аномалиями развития верхних мочевых путей, внутренних половых органов, а также аномалиями других систем и органов.
Тяжесть и обширность поражения обычно делают бесперспективными попытки хирургической коррекции порока в период новорожденности, и в большинстве случаев лечение носит сугубо консервативный характер.
В исключительных случаях при общем хорошем состоянии ребенка, сравнительно небольших размерах эмбриональной грыжи может быть выполнена операция, основными этапами которой являются: 1) пластика эмбриональной грыжи, 2) выделение экстрофированного участка кишки и, в зависимости от местных условий, либо ее сохранение и формирование трубки (при этом терминальный слепой конец толстой кишки мобилизуют и выводят в виде промежностной или абдоминальной колостомы), либо иссечение кишки и наложение илеостомы на проксимальный отрезок ее, 3) пластика мочевого пузыря путем сшивания его половин. Радикально реконструировать порок в период новорожденности обычно не удается, и в случаях выздоровления дети подвергаются повторным вмешательствам в более старшем возрасте.
Аномалии наружных гениталии у девочек
Нарушение нормального развития мюллеровых ходов па ранних этапах формирования зародыша приводит к порокам развития половых органов. Различают три формы порока развития матки и влагалища: полное или частичное отсутствие этих органов, раздвоение их, различные степени недоразвития органов (гипоплазия).
Атрезия вульвы и гимен. Врожденные заращения вульвы являются результатом внутриутробного воспалительного процесса (И. И. Богоров, 1966). Гименальные атрезии в большинстве случаев сочетаются с атрезиями переднего отдела влагалища.
При осмотре гимен выглядит в виде сплошной преграды (hymen imperforatus). Мембрана может располагаться на различном уровне во влагалище, наиболее часто она находится па границе верхней и средней третей.
В результате возникает гидрокольпос, который выявляют после рождения по образованию, располагающемуся по средней линии внизу живота, беспокойному поведению ребенка. Растянутая вагина может препятствовать мочеиспусканию из-за смещения пузыря. Экскреторная урография часто выявляет растяжение верхних мочевых путей.
Мембрану, закрывающую выход из влагалища, иссекают циркулярным разрезом. Влагалище в течение нескольких дней дренируют трубками. Для предотвращения развития стеноза может потребоваться бужирование.
Полип гимена. Гимен у новорожденной под влиянием материнских эстрогенов утолщен и отечен, хорошо виден при осмотре промежности. Иногда в нижнем отделе его обнаруживается полип. Гистологически выбухание состоит из отечной соединительной ткани, покрытой плоским эпителием. Полип может исчезнуть спонтанно.
Вагинальные кисты образуются из остатков гартнеровских ходов, расположенных с обеих сторон в стенке влагалища. Они пролабируют в просвет влагалища, симулируют гидрокольпос. Компрессия уретры влагалищными кистами препятствует мочеиспусканию и вызывает необходимость их раннего иссечения.
Парауретральные кисты. У новорожденных возможно образование кист из парауретральных желез. При осмотре кисты обнаруживаются около наружного отверстия мочеиспускательного канала, напоминая пролабирующее уретероцеле. В дифференциально-диагностическом плане помогает экскреторная урография. Кисты удаляют оперативным путем.
Аномалии наружных гениталий у мальчиков
Врожденная узость крайней плоти (фимоз). Сужение крайней плоти, которую не удается без насилия отодвинуть за головку полового члена, называется фимозом. У новорожденных эпителиальное слипание крайней плоти с головкой представляет физиологическое явление. При резко выраженном фимозе наблюдается затруднение мочеиспускания и вовлечение в патологический процесс вышележащих мочевых путей. Наряду с врожденным фимозом в 0,5 — 1% наблюдений возникает стенозирование крайней плоти в результате воспалительных явлений в области головки полового члена и препуциального мешка (приобретенный фимоз).
Клинически различают две формы фимоза: гипертрофический, когда крайняя плоть удлинена и выдается вперед в виде хоботка, и атрофический, характеризующийся плотно охватывающей головку кожей.
Склеивание листков крайней плоти у новорожденных — явление физиологическое и в лечении не нуждается. Для предупреждения патологического фимоза оттягивают наружный листок крайней плоти кзади настолько, чтобы было обнажено наружное отверстие уретры, и пуговчатым зондом разделяют сращения между головкой и внутренним листком крайней плоти, смазывают головку вазелином, надвигают на нее крайнюю плоть. В редких случаях, при значительном сужении крайней плоти, затруднении мочеиспускания, безуспешности консервативных мероприятий, у новорожденных предпринимают оперативное лечение. Основным методом операции является круговое обрезание крайней плоти (circumcisio) (рис. 100). Крайняя плоть пережимается брашнами зажима. Оставление избытка листков крайней плоти сзади обеспечивает сохранение уздечки полового члена. После снятия зажима проводят разрез через участок раздавленной ткани и полностью ее удаляют. Листки крайней плоти соединяют тонким кетгутом узловыми швами.
Рис. 100. Обрезание крайней плоти при фимозе.
По средней линии крайнюю плоть раздавливают прямым зажимом Кохера до уровня венечной борозды. Обескровленную дорожку рассекают (а). Избыток крайней плоти отсекают после раздавливания кривым зажимом (б). Кетгутовы швы на рану (в).
Инфравезикальная обструкция
Препятствия, расположенные в уретре и шейке мочевого пузыря, объединяют термином «инфравезикальная обструкция». Обструктивные уропатии являются одной из наиболее трудных проблем в хирургии новорожденных.
Почки начинают секретировать мочу у 14-недельного плода, и препятствие к оттоку из мочевого пузыря уже во внутриутробном периоде вызывает растяжение мочевых путей. При инфравезикальной обструкции мочевой пузырь отвечает на стойкое растяжение гипертрофией мышц. Гипертрофия детрузора проявляется трабекулярностью слизистой оболочки, а гипертрофия циркулярных мышц пузырной шейки приводит к сужению ее. В дальнейшем участки гипертрофии мышц сочетаются с участками истончения стенки, придавая пузырю ячеистый характер. Емкость пузыря увеличивается, дно его иногда пальпируется выше пупка, часто образуются дивертикулы. Мочеточники вследствие постоянно повышенного давления в мочевых путях становятся расширенными н извитыми. Повышение давления в пузыре приводит к возникновению пузырно-мочеточникового рефлюкса. Сократительная способность мочеточников сохраняется, но расширенный мочеточник не способен транспортировать мочу в мочевой пузырь, ибо стенки его не соприкасаются друг с другом и движение мочи носит колебательный характер. Увеличение почечной лоханки на фоне значительного гидроуретера не очень выражено, за исключением случаев с сопутствующей обструкцией при- лоханочного отдела, когда увеличение лоханки может быть значительным.
Почечная паренхима истончена, часта кистозная дисплазия. Вскоре после рождения присоединяется инфекция, усугубляющая разрушительный процесс в почках.
Редким, но грозным осложнением инфравезикальной обструкции является мочевой асцит. Моча в брюшной полости у таких больных может быть уже при рождении или асцит развивается в первые дни жизни. У большинства больных обнаруживаются спонтанные разрывы мочевого пузыря или гидронефротической почки, но в ряде случаев не находят сообщения между брюшной полостью и мочевым трактом. Этиология и патогенез этого состояния остаются не выясненными. Очевидно, задняя париетальная брюшина у новорожденного отличается большей проницаемостью, чем брюшина взрослых и детей старшего возраста. Поэтому при наличии у новорожденного асцита и отсутствии патологии со стороны печени все внимание направляют на мочевыводящую систему. Смертность при мочевом асците высокая, достигает 70% (Johnston, 1966; Thompson, 1972).
Наиболее частой причиной инфравезикальной обструкции у новорожденных являются клапаны задней уретры. Клапаны встречаются исключительно у мальчиков. В последние годы этой проблеме уделяется много внимания (А. Я. Пытель, С. Д. Голигорский, 1970; С. Я. Долецкий, И. А. Королькова, Ю. П. Терехов и др., 1971; Williams, 1968; Hendren, 1971).
Происхождение клапанов остается не полностью изученным. Некоторые урологи считают их гипертрофированными складками нормальной уретры, другие относят их к патологическим перерождениям вольфова протока или к остаткам membrana urogenitalis.
В настоящее время большинство урологов придерживаются классификации Young (1929), который разделил клапаны задней уретры на три типа в зависимости от анатомического строения и расположения их в уретре (рис. 101). Клапаны первого типа выглядят в виде двух парусообразных створок, спускающихся от дистального конца семенного бугорка вниз и латерально по стенкам уретры; во время ретроградного проведения катетера они спадаются и не вызывают ощущения препятствия. Когда моча поступает в уретру, створки клапанов смыкаются, создавая обструкцию. Иногда клапаны исходят не из семенного бугорка, а несколько дистальнее, из crista uretralis, а их створки заходят в область наружного сфинктера.
Рис. 101. Клапаны задней уретры (по классификации Юнга).
1-й тип клапанов задней уретры: а — две створки клапанов отходят от дистального конца семенного бугорка и спускаются вниз и латерально по стенкам уретры; б — створки клапанов отходят от семенного бугорка; в — имеется только одна створка клапана.
2-й тип клапанов задней уретры представляет собой складки слизистой оболочки, идущие от проксимального отдела семенного бугорка вверх и латерально к шейке мочевого пузыря (г).
3-й тип представляет собой стенотическое сужение уретры в виде мембраны, которая может располагаться как ниже, так и выше или на уровне семенного бугорка (д, е).
Анатомическое строение клапанов варьирует от тонких прозрачных пленок до плотных фиброзных створок. Клапан может быть выражен, только, с одной стороны. Второй тип — складки слизистой оболочки, идущие от проксимальной части семенного бугорка вверх и латерально к шейке мочевого пузыря. Как самостоятельная причина обструкций этот вид клапанов ставится под сомнение. Считают, что складки образуются в результате расширения задней уретры при клапанах первого и третьего типа.
Третий тип встречается реже, чем первый, и представляет собой стенотическое сужение уретры в виде мембраны. Этот вид обструкции не обладает свойством клапана, так как препятствует как восходящему, так и нисходящему движению по уретре. Клапаны задней уретры являются соединительнотканными пластинками, покрытыми с обеих сторон эпителием.
Клиническая картина. У новорожденных, ведущим проявлением клапана являются симптомы мочевой инфекции. Появляются симптомы общего характера: рвота, понос, гипертермия, судороги, желтуха, геморрагический диатез. При осмотре ребенка обращает на себя внимание, увеличенный в размерах живот, иногда удается пальпировать увеличенные, баллотирующие почки; мочевой пузырь при бимануальном исследовании ощущается в виде плотного образования. Число мочеиспусканий урежено, иногда отмечается капельное недержание мочи. Струя вялая, прерывистая, ребенок при мочеиспускании беспокоен, тужится. Наличие напряженной струи не противоречит диагнозу, так как гипертрофированный детрузор компенсирует имеющееся препятствие, создавая повышенное давление в пузыре. Моча мутная, с большим содержанием белка и гноя. Часто отмечаются тяжелые нарушения водно-электролитного баланса, выраженный метаболический ацидоз. Мочевина и остаточный азот крови обычно повышены, но после ликвидации дегидратации и нарушений электролитного обмена, уменьшения остроты воспалительного процесса они могут снизиться почти до нормальных цифр.
Тяжелое состояние новорожденного диктует необходимость проведения диагностических мероприятий под прикрытием инфузионной и антибактериальной терапии. Производится посев мочи для правильного подбора антибиотиков. Если ребенок поступает в фазе компенсации, без выраженной задержки мочи, от катетеризации мочевого пузыря лучше воздержаться во избежание инфицирования.
Рентгенологическая картина. После выявления и коррекции параметров гомеостаза производят инфузионную пиелографию с высокой дозой контрастного вещества (4 — 5 мл на 1 кг веса ребенка). На рентгеновских снимках отмечается снижение функции почек, определяются расширенные, гидронефротические лоханки и чашечки. Мочеточники обычно контрастируются плохо, мочевой пузырь увеличен в размере.
Цистоуретрограмма является простым и информативным диагностическим методом, позволяющим установить наличие и уровень обструкции. При выраженной почечной недостаточности она является единственным возможным методом исследования. Рентгеновские снимки производят в прямом и косом положении больного в момент мочеиспускания. На цистоуретрограмме виден увеличенный в размерах, часто трабекулярный, с дивертикулоподобными образованиями мочевой пузырь. При наличии рефлюкса прослеживаются широкие и извитые мочеточники. Простатическая уретра расширена, проксимальный отдел ее отделен от бульбарной уретры овальным дефектом наполнения. Иногда выявляется заброс контрастного вещества в семенной проток и в utriculus prostaticus. Часто выявляется сопутствующее увеличение задней губы шейки мочевого пузыря. Обструктивный эффект ее сомнителен, однако предпочитают удаление клапанов сочетать с резекцией шейки.
Цисто- и уретроскопия вследствие технической трудности выполнения у новорожденных не находят широкого применения. Ценные сведения при снижении концентрационной способности почек дают радиоизотопные методы исследования.
Лечение. Необходимый для постановки диагноза объем обследования при правильной организации занимает 1 — 2 сут. Проведение в этом периоде интенсивной антибактериальной терапии позволяет нормализовать водно-электролитный баланс, снизить цифры остаточного азота, уменьшить ацидоз и токсикоз. При выраженной задержке мочи оставляют уретральный катетер.
Консервативные методы лечения дают временный эффект. Постоянное дренирование возможно лишь хирургическим путем — двусторонней уретеростомией. Вмешательство, это минимально по объему и травматичности, позволяет надежно дренировать верхние мочевые пути. При наложении пристеночных подвесных уретеростом мочеточники стремятся выделить возможно выше. В лоханку вводят дренажные трубки на ближайший послеоперационный период; как только стомы сформируются, дренажи удаляют. Послеоперационное дренирование мочевого пузыря и периодическое промывание его антисептическими растворами способствует санации нижних мочевых путей.
Радикальную операцию производят, когда состояние новорожденного улучшится. Клапаны разрушают промежностным способом, трансуретрально через эндоскоп или иссекают надлобковым доступом. При надлобковом доступе не удается достичь уровня клапанов без рассечения костей симфиза, доступ травматичен и сопровождается кровопотерей. Эндоскопический метод требует специального оборудования, сложен технически, так как для проведения уретроскопа у новорожденного необходима уретротомия. Наиболее эффективен промежностный подход (Johnston, 1966) (рис. 102).
Рис. 102. Промежностный доступ при иссечении клапанов уретры.
Разрезом на промежности послойно обнажают уретру, берут ее на держалки, вскрывают и расширяют бужами до прохождения ушного зеркала. При введении зеркала сначала виден семенной бугорок, а затем клапаны, которые, расправляясь, закрывают просвет уретры. Клапаны разрушают электродом. Уретру и кожную рану зашивают послойно. В уретре оставляют катетер примерно на неделю.
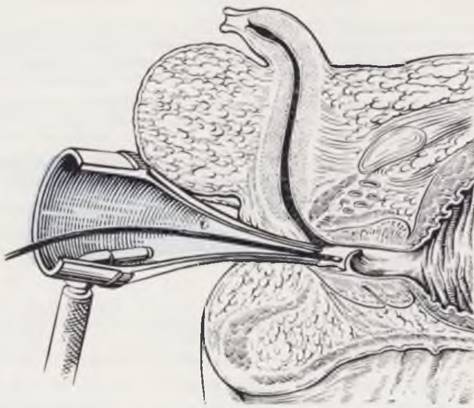
Техника операции. У ребенка, находящегося в положении для литотомии, дугообразным кожным разрезом на промежности обнажают уретру. Над кончиком металлического бужа, введенного в уретру, производят разрез ее задней стенки. На края разреза с захватом слизистой оболочки накладывают держалки. Заднюю уретру расширяют прямыми или слегка изогнутыми бужами до № 13 по Шарьеру. Полученный диаметр 4,75 мм позволяет произвести ушное зеркало в простатическую уретру. К зеркалу присоединяют электрический подсвет. По мере выдвижения зеркала становятся отчетливо видны сначала Семен ной бугорок, а затем клапаны. Клапаны разрушают диатермически изолированным электродом, проведенным через зеркало. Рану уретры ушивают кетгутовыми швами, в уретре на несколько дней оставляют катетер.
Контрольные рентгенограммы после операции показывают, что уретра вскоре принимает нормальные очертания. Дальнейшее лечение зависит от степени декомпенсации верхних мочевых путей и требует индивидуального подхода.
При легких степенях поражения, когда для нормализации пассажа мочи по мочевому тракту достаточно удаления клапанов, диагноз редко ставят в период новорожденности. Как отмечают Williams и Johnston, чем раньше клапаны проявляют себя клинически, тем значительней разрушения верхних мочевых путей. При средних степенях расширения мочеточников и сохранения пузырно-мочеточникового рефлюкса после удаления клапанов показано выполнение антирефлюксной операции, методика которой зависит от анатомического строения и функциональной сохранности устья пораженного мочеточника. При эктопии и расширении его мы предпочитаем антирефлюксную операцию по Политано — Леадбеттеру.
Трудной хирургической проблемой является реконструкция значительно расширенных мочеточников, но она выполняется обычно в более старшем возрасте. В литературе имеются единичные сообщения об оперативном лечении расширенных мочеточников у новорожденных. Hendren (1969 — 1971) описал принцип многоэтапного восстановления декомпенсированной мочевой системы. Автор предлагает раннюю и полную реконструкцию мочевого тракта на всем протяжении, которая включает удаление клапанов, ревизию шейки мочевого пузыря, поэтапное сужение и выпрямление мочеточников с неоимплантацией их в мочевой пузырь. При расширении почечной лоханки производят и ее резекцию. С применением принципа поэтапного выпрямления и сужения мочеточников нами оперировано 3 больных. Ближайшие результаты удовлетворительные (Т. Н. Куликова, 1975).
Реконструктивные операции на мочевом тракте требуют высокой хирургической техники, искусной анестезии и оптимальной антибактериальной терапии. Поэтому для хирургов, не имеющих опыта работы с новорожденными, в лечении детей с выраженной декомпенсацией мочевого тракта методом выбора является высокая кожная уретеростома. Детям с обструктивными уропатиями после операции показано длительное (минимум 1 год) антибактериальное лечение с учетом данных посева мочи.
Кроме клапанов задней уретры, у новорожденных могут быть другие аномалии, создающие препятствие опорожнению мочевого пузыря: стеноз шейки мочевого пузыря, гипертрофия семенного бугорка, фиброэластоз уретры, дивертикул уретры, удвоение уретры, опухоль уретры и воспалительные заболевания ее. Перечисленные заболевания являются редкими находками у новорожденных. Тактика врача в принципе не отличается от таковой при клапанах, т. е. первой задачей является адекватное дренирование мочевого тракта с последующим удалением анатомических и функциональных препятствий. При стенозе шейки пузыря выполняется V-образная пластика ее.
Прогноз. Компенсаторные возможности почек новорожденного при быстром и эффективном дренировании мочевого тракта позволяют получить почти полное восстановление их функции. Успехи в восстановлении декомпенсированного мочевого тракта дают основание смотреть более оптимистично на эту, еще недавно безнадежную, группу больных.