Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Статева диференціація і розвиток
Чоловіча статева система - Гаметогенез та еякуляція
Гематотестикулярний бар’єр
Стінки звивистих сім’яних канальців вистелені первинними зародковими клітинами (див. нижче), клітинами Сертолі та великими складними глікогеновмісними клітинами, які поширюються від базальної мембрани до порожнини (див. рис. 23-17). Тісні зв’язки між клітинами Сертолі, що прилягають до базальної мембрани, утворюють гематотестикулярний бар’єр, який запобігає проникненню багатьох великих молекул з інтерстиційної тканини до порожнини канальця. Проте стероїди легко переходять через цей бар’єр. Є докази, що деякі білки також паракринним шляхом переходять із клітин Сертолі до клітин Лейдіґа та навпаки. Крім того, зародкові клітини, що дозрівають, повинні перейти через бар’єр, оскільки вони прямують до порожнини. Цей перехід відбувається без порушення цілісності бар’єра завдяки тимчасовому розриву тісних зв’язків над зародковими клітинами та наступному утворенню нових тісних зв’язків під ними. Рідина у порожнині звивистих сім’яних канальців відрізняється від плазми; вона містить мало білка і глюкози, однак багата на андрогени, естрогени, К+, інозитол, глутамінову та аспарагінову кислоти. Підтримка цього складу залежить від гематотестикулярного бар’єра, який захищає зародкові клітини від шкідливих чинників, що походять з крові, а також запобігає потраплянню антигенних продуктів поділу та дозрівання зародкових клітин у кров’яне русло, формуванню автоімунної відповіді. Цей бар’єр також допомагає підтримувати осмотичний градієнт, який сприяє руху рідини до порожнини канальців.
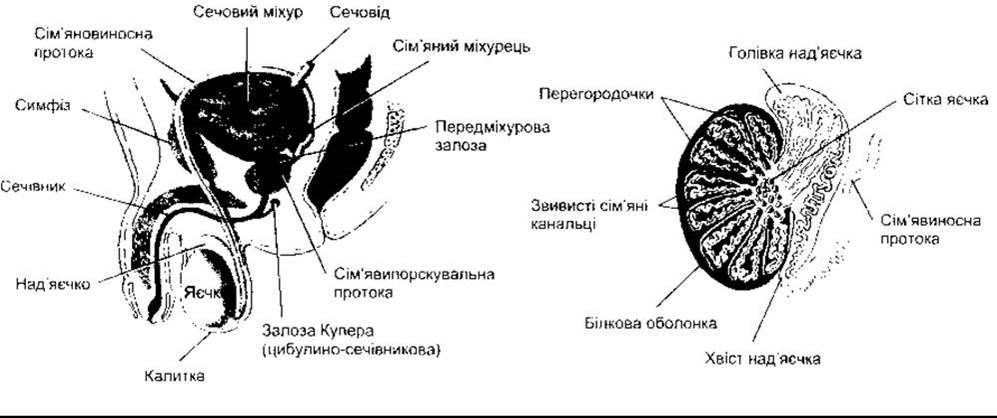
Рис. 23-15. Ліворуч: чоловіча статева система. Праворуч: система проток у яєчках.
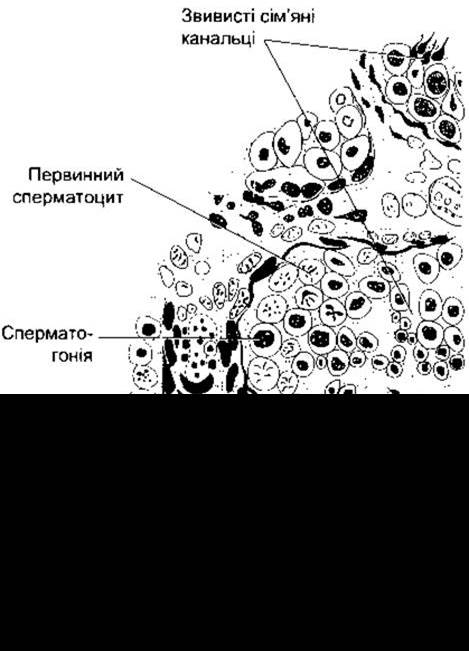
Рис. 23-16. Зріз яєчка людини.
Сперматогенез
Сперматогонії- це первинні зародкові клітини, що розміщені біля базальної мембрани звивистих сім’яних канальців і дозрівають до первинних сперматоцитів (див. рис. 23-17). Цей процес починається у зрілому віці. Первинні сперматоцити підлягають мейотичному поділу, внаслідок якого зменшується кількість їхніх хромосом. Під час цього двостадійного процесу вони діляться до вторинних сперматоцитів і далі - до сперматид, які містять гаплоїдний набір - 23 хромосоми. Сперматиди дозрівають до сперматозоїдів (сперміїв). Під час поділу і дозрівання одного сперматогонія його «потомство» зв’язане між собою через цитоплазматичні мостики аж до пізньої сперматидної фази. Очевидно, це забезпечує синхронність диференціації кожного клону зародкових клітин. Підрахована кількість сперматид, які утворюються з одного сперматогонія - становить 512. У людини утворення зрілого спермія з первинної зародкової клітини шляхом нормального сперматогенезу в середньому триває 74 дні. Кожний сперматозоїд - це складна рухлива клітина, багата на ДНК, з голівкою, яка головно побудована із хромосомного матеріалу (рис. 23-18). Голівка покрита акросомою, наче шапкою. Це лізосомоподібна органела, яка містить ензими, задіяні у пенетрації сперматозоїда в яйцеклітину та інших процесах запліднення. У проксимальній частині рухомий хвіст сперматозоїда має оболонку з численними мітохондріями. Мембрани пізніх сперматид і сперматозоїдів містять спеціальну малу форму ангіотензинконвертувального ензиму, який називають зародковим ангіотензин-ІІ-перетворювальним ензимом (див. Розділ 24). Функція цього ензиму у сперматозоїдах невідома, хоча з’ясовано, що миші чоловічої статі, у яких порушена функція гена ангіотензинперетворювального ензиму, мали знижену плідність.
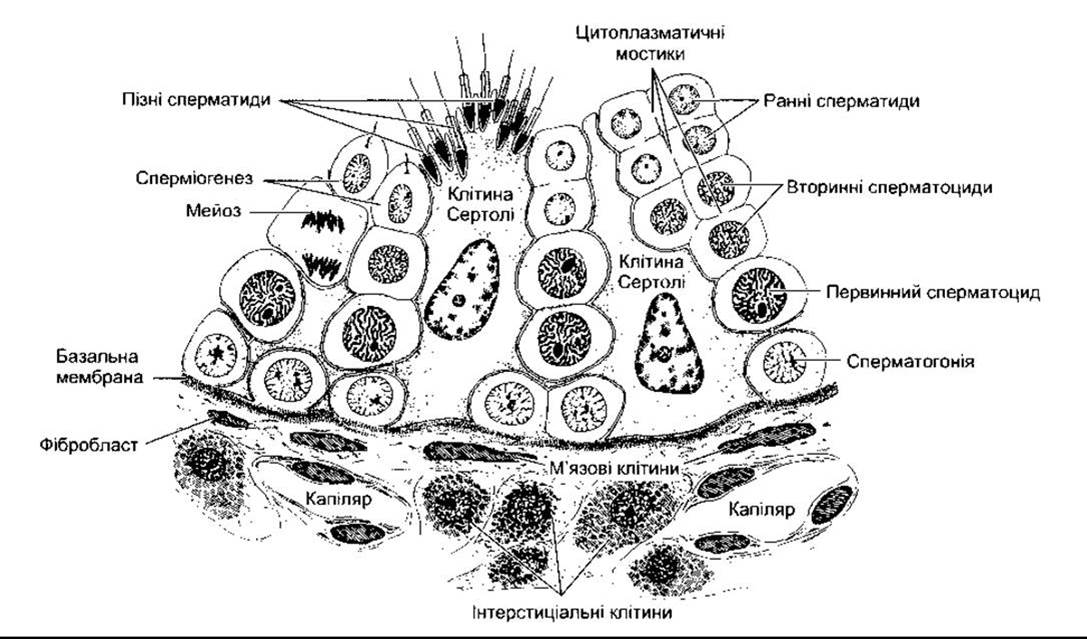
Рис. 23-17. Епітелій звивистого сім’яного канальця. Зазначимо, що зародкові клітини, які дозрівають, є зв’язаними цитоплазматичними мостиками на ранній сперматидній стадії, вони щільно оточені цитоплазмою клітин Сертолі, оскільки рухаються від базальної мембрани до порожнини (відтворено за дозволом з Junqueira LC, Сагпеіго J, Kelley RO: Basic Histology, 9th ed. McGraw-Hill, 1998).
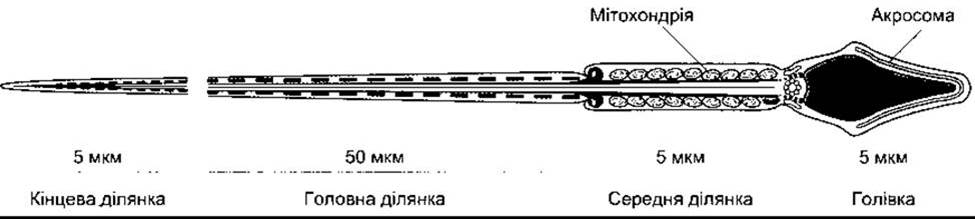
Рис. 23-18. Сперматозоїд людини, зображений у профіль. Акросома - це органела, яка покриває половину голівки сперматозоїда всередині плазмової мембрани спермія (відтворено за дозволом з Junqueira LC, Carneiro J, Kelley RO: Basic Histology, 9th ed. McGraw-Hill, 1998).
Сперматиди дозрівають до сперматозоїдів у глибоких складках цитоплазми клітин Сертолі (див. рис. 23-17). Зрілі сперматозоїди вивільняються з клітин Сертолі у порожнині канальців. Клітини Сертолі виділяють андрогенозв’язувальний білок (АВР - від англ. androgen-binding protein), інгібін і ІРМ; не виділяють андрогенів, однак містять ароматазу (CYP19) - ензим, який відповідає за перетворення андрогенів в естрогени. Крім того, вони можуть продукувати естрогени. Очевидно, функція АВР полягає у підтриманні стабільного постачання андрогенів до канальцевої рідини; інгібін пригнічує виділення ФСГ (див. нижче); ІРМ зумовлює регресію мюллерових протоків у чоловіків під час внутрішньоутробного життя (див. вище).
ФСГ й андрогени підтримують гаметогенну функцію яєчок. Після гіпофізектомії введення ЛГ зумовлює суттєве збільшення локальної концентрації андрогенів у яєчках, а це сприяє гаметогенезу. Стадії розвитку від сперматогоній до сперматид є андрогенозалежними. Дозрівання від сперматид до сперматозоїдів залежить від дії андрогенів на клітини Сертолі, які оточують сперматозоїди, що розвиваються. ФСГ впливає на клітини Сертолі, підтримуючи останні стадії дозрівання сперматид, а також стимулює виділення АВР.
Є нові докази високого вмісту естрогену в рідині сітки яєчок (див. рис. 23-15) та значного рівня естрогенових рецепторів типу альфа у стінках мереж. У цій ділянці рідина реабсорбується, і сперматозоїди концентруються. Якщо ж цього не відбувається, то сперматозоїди потрапляють до над’яєчка зі значним об’ємом рідини, що призводить до неплідності.
Сперматозоїди, які виходять з яєчка, не є повністю рухливими. Вони продовжують дозрівати і набувають рухливості під час проходження через над’яєчко. Якщо відсоток яйцеклітин, запліднених сперматозоїдами з хвоста над’яєчка людини (див. рис. 23-15), прийняти за 100, то відповідне значення для сперматозоїдів із середньої частини над’яєчка становитиме 50, а для сперматозоїдів із голівки над’яєчка - 0. Запліднення можливе, якщо сперматозоїд із голівки яєчка ввести шляхом мікроін’єкції безпосередньо в яйцеклітину. Отже, головна проблема - слабка рухливість сперматозоїда.
Здатність сперматозоїда до запліднення збільшується в разі подальшого надходження до середовища статевих шляхів жінки. Цей ще до кінця не зрозумілий процес капацитації має два компоненти: підвищення рухливості сперматозоїдів і сприяння їхній підготовці до акросомальної реакції. Очевидно, роль капацитації полягає в полегшенні і спрощенні процесу запліднення, оскільки можливе запліднення й in vitro. Наступні етапи запліднення розглянуто нижче у контексті про вагітність.
Вплив температури
Для сперматогенезу потрібна температура, значно нижча від тієї, що є у нижній частині тіла. У нормі в яєчках температура становить близько 32°С. Охолодження підтримуване завдяки циркуляції повітря навколо калитки і, очевидно, теплообміну між спермальними артеріями та венами. У випадку, коли яєчка затримуються в черевній порожнині, або у піддослідних тварин, у яких вони розташовані близько до тіла завдяки міцним тканинним зв’язкам, настає дегенерація стінок канальців та неплідність. Гарячі ванни (43-45°С протягом 30 хв кожного дня) та важкі фізичні навантаження призводять до зменшення кількості сперматозоїдів у людини, у деяких випадках навіть на 90%. Однак зменшення, спричинене в такий спосіб, є недостатнім, щоб зробити цю процедуру однією з форм чоловічої контрацепції. Крім того, є докази сезонних змін у чоловіків - кількість сперматозоїдів збільшується взимку, коли температурні умови сприятливіші для калитки.
Сперма
Сперма - це рідина, яка виділяється під час оргазму. Вона містить сперматозоїди і секрет сім’яних міхурців, передміхурової залози, залоз Купера та, очевидно, залоз сечівника (табл. 23-4). Середній об’єм однієї порції еякуляту становить 2,5-3,5 мл після кількох днів утримання. Об’єм сперми і кількість сперматозоїдів швидко зменшуються із повторними еякуляціями. Хоча потрібен тільки один сперматозоїд для запліднення яйцеклітини, у нормі їх налічується близько 100 мільйонів в одному мілілітрі сперми. П’ятдесят відсотків чоловіків із кількістю 20- 40 млн/мл і практично всі із кількістю до 20 млн/мл є стерильними. У спермі також простежується висока концентрація простагландинів. Вони фактично походять із сім’яних міхурців. Функція цих похідних жирних кислот у спермі остаточно не з’ясована. Їхня будова та множинний вплив на інші частини тіла розглянуто у Розділі 17.
Таблиця 23-4. Складники сперми людини

Сперматозоїди людини рухаються по статевих шляхах жінки зі швидкістю близько 3 мм/хв і досягають маткових труб через 30-60 хв після статевого акту. У деяких видів тварин скорочення жіночих органів сприяє просуванню сперматозоїдів до маткових труб, однак невідомо, чи такі скорочення бувають у людей.
Ерекція
Ерекція відбувається внаслідок розширення артеріол прутня. У цьому разі еректильна тканина прутня наповнюється кров’ю, вени стискуються, блокуючи відтік і надаючи тургор органу. Інтеграційні центри у поперекових сегментах спинного мозку активовані імпульсами від аферентів, іцо відходять від геніталіїв та низхідними шляхами, які опосередковують ерекцію у відповідь на еротичне психічне стимулювання. Еферентні парасимпатичні волокна проходять у тазових вісцеральних нервах. Вірогідно, що вони містять ацетилхолін і ВІП як котрансмітери (див. Розділ 4). Деякі волокна закінчуються пресинаптично на норадренаргічних нейронах, де ацетилхолін діє на мускаринові рецептори, зменшуючи вивільнення норадреналіну вазоконстрикторами. Крім того, ВІП зумовлює вазодилатацію. Проте введення ВІП не забезпечує повністю ерекції. Введення у сечівник ПГЕ, (алпростадилу) також розширює гладку мускулатуру прутня, його застосовують клінічно для сприяння ерекції.
Є також неадренаргічні нехолінергічні волокна у тазових нервах. Вони містять велику кількість NO-синтази - ензиму, що каталізує утворення окису азоту (NO; див. Розділ 31). NO активує гуанілатциклазу, завдяки чому збільшується вироблення цГМФ - сильного вазодилятатора. Введення інгібіторів NO-синтази піддослідним тваринам запобігає ерекції, яку у нормі стимулює тазовий нерв. Отже, зрозуміло, чому NO відіграє важливу роль у виникненні ерекції. Віагра (сілденефіл) пригнічує руйнування цГМФ через фосфодіестерази, тому сьогодні його широко використовують для лікування імпотенції. Множинні фосфодіестерази (PDEs - від англ. phosphodiesterases) організму поділяють на сім ізоензимних родин. Сілденефіл найактивніший стосовно PDE5 - різновиду фосфодіестерази, виявленого у печеристому тілі. Проте зазначимо, що сілденефіл помітно пригнічує PD6. Цей різновид фосфодіестерази виявлений у сітківці. Тому один із побічних ефектів сілденефілу - транзиторна втрата здатності розрізняти синій і зелений кольори (див. Розділ 8).
У нормі ерекція закінчується внаслідок дії симпатичних вазоконстрикторних імпульсів на артеріоли прутня.
Еякуляція
Еякуляція - це двохетапний спинальний рефлекс, який охоплює емісію (рух сперми до сечівника) і власне еякуляцію (виділення сперми з сечівника під час оргазму). Аферентні шляхи - це насамперед волокна від чутливих рецепторів у голівці прутня, які приходять до спинного мозку через внутрішні соромітні нерви. Емісія є симпатичною реакцією, інтегрованою у верхніх поперекових сегментах спинного мозку, вона впливає на скорочення гладкої мускулатури сім’явиносної протоки та сім’яних міхурців у відповідь на подразнення підчеревних нервів. Сперма випорскується із сечівника внаслідок скорочення цибулино-губчастого скелетного м’яза. Спинальні рефлекторні центри цієї частини рефлексу містяться у верхніх крижових та нижніх поперекових сегментах спинного мозку і рухових шляхах на рівні першого-третього крижових корінців та внутрішніх пудендальних нервах. Окис вуглецю бере участь у регулюванні еякуляції, доки НО2-ензим, який каталізує його утворення в нервовій системі (див. Розділ 4), є в достатній кількості у шляхах, пов’язаних з еякуляцією. Еякуляторна здатність зменшується, коли НО2 гена нема.
Простатоспецифічний антиген
Передміхурова залоза виробляє і виділяє у сперму та кров’яне русло 30kDа-серинову протеазу, відому як простатоспецифічний антиген (PSA - від англ. prostate-specific antigen). Ген PSA містить два андрогеночутливі елементи. Він гідролізує семеногелін, інгібітор рухливості сперматозоїдів у спермі, і має декілька субстратів у плазмі, однак його функція для кровообігу не з’ясована. Рівень PSA у плазмі підвищується у випадку раку передміхурової залози; це широко використовують як скринінг-тест для цього захворювання. PSA також підвищений у разі доброякісної гіпертрофії передміхурової залози і простатиту.
Вазектомія
Доведено, що двостороннє перев’язування сім’явиносних проток (вазектомія) є порівняно безпечною контрацептивною процедурою. Проте відомо також і про складність відродження функцій протоки в осіб, які хочуть відновити фертильність. Рівень успішності таких операцій, який оцінювали за настанням вагітності, становить близько 50%. Після вазектомії у половини чоловіків утворювалися антитіла до сперматозоїдів. У мавп наявність таких антитіл пов’язана з високим рівнем неплідності після відновлення роботи протоки. Інших негативних впливів антиспермальних антитіл не виявлено.