Фізіологія людини - Вільям Ф. Ґанонґ 2002
Кровообіг
Рідини, що циркулюють в організмі
Кров - Імунітет
Огляд
У комах та безхребетних простежується вроджений імунітет. Головними у цій системі є рецептори, що приєднуються до певних послідовностей цукрів, жирів та амінокислот звичайних бактерій і активують різноманітні захисні механізми. Рецептори кодовані ще у лінії статевих клітин, і їхня основна структура не змінюється після контакту з антигеном. Унаслідок активування захисних механізмів у різних організмах фіксують виділення інтерферонів, фагоцитоз, утворення антибактеріальних пептидів, активування системи комплементу і декількох протеолітичних каскадних систем. Навіть у рослин у відповідь на інфікування відбувається виділення антибактеріальних пептидів.
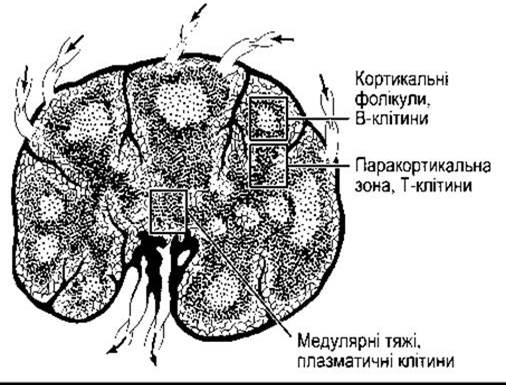
Рис. 27-4. Анатомія нормального лімфовузла (відтворено за дозволом з McPhee SJ et al: [editors]: Pathophysiology of Disease, 3rd ed. McGraw-Hill,2000).
У хребетних вроджений імунітет доповнений набутим імунітетом, системою, у якій Т- та В-лімфоцити активовані специфічними антигенами. Наслідком такого активування є утворення клонів клітин, що атакують сторонні білки, а після припинення інвазії продовжують існувати у вигляді невеликої групи клітин пам’яті, щоб у разі повторного контакту з тим самим антигеном зумовити швидку та масивну імунну атаку. Генетичні зміни, що зумовили появу набутого імунітету, відбулись 450 млн. років тому в пращурів щелепних хребетних і, вірогідно, полягали у проникненні транспосони у геном, що зробило можливим утворення величезної кількості Т-лімфоцитів, які існують в організмі.
У хребетних, у тім числі людей, вроджений імунітет утворює першу лінію захисту від інфекцій і, крім того, запускає каскад реакцій набутого імунітету (рис. 27-5). Механізми природженого та набутого імунітету можуть бути спрямовані також проти пухлин і трансплантатів від інших тварин.
Після активування імунокомпетентні клітини взаємодіють через цитокіни і знищують віруси, бактерії та інші сторонні клітини, виділяючи інші цитокіни та активуючи систему комплементу.
Імунологія, у якій останніми роками простежується великий прогрес, є значною за обсягом та досить складною за змістом наукою. Тому у цій книжці викладено лише загальні положення.
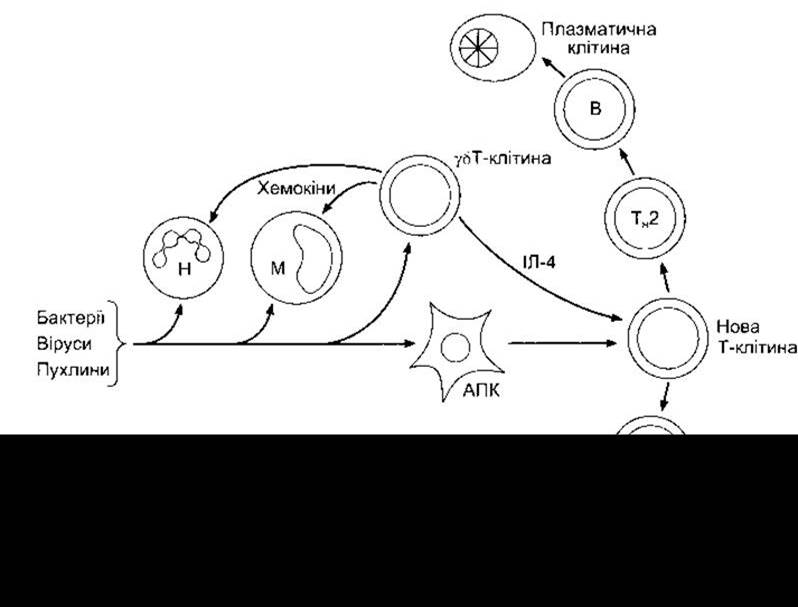
Рис. 27-5. Шлях, яким бактерії, віруси та пухлини активують вроджений імунітет та ініціюють реакції набутого імунітету, АПК - антигенпрезентаційна клітина; М - моноцит; Н - нейтрофіл; Тн1 та Тн2 - Т-клітини хелпери типу 1 та 2, відповідно.
Цитокіни
Цитокіни - це гормоноподібні молекули, що регулюють імунну відповідь паракринним шляхом. їх виділяють не тільки лімфоцити і макрофаги, а й ендотеліальні клітини, нейрони, гліальні та інші види клітин (табл. 27-3). Більшість назв цитокінів пов’язана з їхньою функцією, наприклад, фактор диференціювання В-клітин, фактор 2 стимулювання В-клітин. Однак є домовленість, за якою в разі виявлення послідовності амінокислот певного фактора у людини назву фактора змінювали на інтерлейкін. Наприклад, назву фактора диференціювання В-клітин змінено на інтерлейкін-4. У галузі, що розвивається з такою швидкістю, дуже важко створити повний перелік факторів, однак головні цитокіни наведено у табл. 27-3.
Більшість рецепторів цитокінів та факторів росту гемопоезу (див. вище), як і рецептори пролактину (див. Розділ 23) та гормонів росту (див. Розділ 22), є представниками надродини рецепторів цитокінів, що складаються з трьох підродин (рис. 27-6). Представники підродини 1, які охоплюють рецептори ІЛ-4 та ІЛ-7, є гомодимерами. Представники підродини 2, до яких належать рецептори ІЛ-3, ІЛ-5, та ІЛ-6, є гетеродимерами. Рецептори ІЛ-2 та деяких інших цитокінів унікальні, оскільки вони складаються з гетеродимеру та неспорідненого білка, так званого Тас-антигену. Інші представники підродини мають такий же у-ланцюг, як і ІЛ-2Р. Позаклітинна частина субодиниць гомо- та гетеродимерів містить чотири залишки цистеїну та домен Trp-Ser-X-Trp-Ser, і хоча внутрішньоклітинна частина рецептора й не містить каталітичних доменів тирозинкінази, вона здатна активувати цитоплазматичну тирозин- кіназу в разі приєднання ліґанда до рецептора.
Впливи головних цитокінів наведені у табл. 27-3. Деякі з них мають як системний, так і місцевий паракринний ефекти. Наприклад, зверніть увагу на системний ефект ІЛ- 1 а та ІЛ-1 ß (табл. 27-4). Послідовності цих двох цитокінів мають мало спільного, а впливи подібні, і діють на ті самі рецептори. Вони зумовлюють гарячку, яку можуть спричинити також ІЛ-6, ФНП-а та ФНП-ß. ФНП мають також інші системні впливи, подібні до впливів ІЛ-1. Більшість із цих впливів простежується у людини на початку інфекційних захворювань.
Іншою надродиною цитокінів є родина хемокінів. Хемокіни - це сполуки, що приваблюють нейтрофіли (див. вище) та інші лейкоцити у ділянку запалення чи імунної реакції. Сьогодні відомо понад 40 хемокінів і вже зрозуміло, що вони також беруть участь у клітинному рості та ангюгенезі. Рецептори хемокінів є серпентиновими рецепторами, що діють через гетеродимерні G-білки, спричинюючи також утворення псевдоподій з міграцією клітини у напрямі до джерела хемокінів.
Система комплементу
Знищення клітин у разі вродженого та набутого імунітету частково опосередковане системою білків плазми, яку називають системою комплементу. Білки позначають номерами С1-С9. Білок С1 складається з трьох субодиниць - С1q, С1r, та С1s - тому зрозуміло, що у системі є 11 білків. С1 приєднується до імуноглобулінів, зв’язаних з антигеном, це дає змогу розпочати послідовність реакцій, що активують С3. Таке активування системи комплементу називають активуванням класичним шляхом. Можливе також активування альтернативним, або шляхом пропердину.
Таблиця 27-3. Головні властивості інтерлейкінів людини та інших імунорегуляторних цитокінів1
Головні клітинні джерела |
Головні ефекти2 |
|
Інтерлейкіни ІЛ-1a і ß |
Макрофаги, інші АПК, інші соматичні клітини |
Костимулювання АПК і Т-клітин Проліферація В-клітин та утворення lg Активування фагоцитів Запалення та гарячка (див. табл. 27-5) |
ІЛ-2 |
Активовані Тн1-, Тц-, NK-клітини |
Проліферація активованих Т-клітин Проліферація В-клітин та експресія lgG |
ІЛ-3 |
Тн-лімфоцити |
Ріст ранніх гематопоетичних попередників |
ІЛ-4 |
Тн2-клітини, мастоцити |
Проліферація В-клітин, експресія lgЕ та молекул II класу МНС Проліферація та функціювання Тн2- та Т-клітин Ріст та функціювання еозинофілів і мастоцитів Пригнічення утворення цитокінів запалення |
ІЛ-5 |
Тн2-клітини, мастоцити |
Ріст та функціювання еозинофілів |
ІЛ-6 |
Активовані Тн2-клітини, АПК, інші соматичні клітини |
Синергічні ефекти з ІЛ-1 або ТНФ для стимулювання Т-клітин Проліферація В-клітин та утворення lg Тромбопоез |
ІЛ-7 |
Стромальні клітини тимусу та кісткового мозку |
Лімфопоез Т- та В-клітин Функції Тс-клітин |
ІЛ-8 |
Макрофаги, інші соматичні клітини |
Посилення скупчень та активування нейтрофілів |
ІЛ-9 |
Т-клітини культури клітин |
Деякі гемато- і тимопоетичні ефекти |
ІЛ-10 |
Активовані Тн2, CD8T і В-лімфоцити, макрофаги |
Пригнічення утворень цитокінів Тн1-клітинами, NK-клітинами та АПК Посилення проліферації В-клітин та гуморальної ВІДПОВІДІ Пригнічення клітинного імунітету Ріст мастоцитів |
ІЛ-11 |
Стромальні клітини |
Синергічні впливи на гемато- і тромбопоез |
ІЛ-12 |
В-клітини, макрофаги |
Проліферація та функція активованих Тц- та NK-клітин Утворення у-ІФН Індукція Тн1 -клітин; пригнічення функцій Тн2-клітин Посилення клітинних імунних реакцій |
ІЛ-13 |
Тн2-клітини |
Ефекти, подібні до впливу ІЛ-4 |
Інші цитокіни ТНФ-а |
Активовані макрофаги, інші соматичні клітини |
Ефекти, подібні до впливу ІЛ-1 Судинний тромбоз та некроз пухлин |
ТНФ-ß |
Активовані Тн1-клітини |
Ефекти, подібні до впливу ІЛ-1 Судинний тромбоз та некроз пухлин |
ІНФ-а і ß |
Макрофаги, нейтрофіли, інші соматичні клітини |
Противірусні ефекти Індукція молекул І класу МНС на всіх соматичних клітинах Активування макрофагів та NK-клітин |
ІФН-у |
Активовані Тн1-клітини та NK-клітини |
Індукція молекул І класу МНС на всіх соматичних клітинах Індукція молекул II класу МНС на АПК та соматичних клітинах Активування макрофагів, нейтрофілів та NK-клітин Посилення клітинного імунітету (пригнічення Тн2-клітин) Індукція високих ендотеліальних венул Противірусні ефекти |
ТГФ-ß |
Активовані Т-лімфоцити, тромбоцити, макрофаги, інші соматичні клітини |
Протизапальний (пригнічення утворення цитокінів та експресії молекул II класу МНС) Пригнічення проліферації макрофагів та лімфоцитів Посилення експресії IgA В-клітинами Посилення проліферації фібробластів та загоєння ран |
1 Відтворено за дозволом з Stites DP, Terr AI, Parslow TG [editors]: Medical Immunology, 9th ed. McGraw-Hill, 1997.
2 Усі перелічені ефекти посилюються, окрім позначених інакше.
Головним у цьому варіанті активування є циркулювальний білок, фактор 1, який розпізнає на клітинній мембрані структури, що повторюються, - поліглюкозу або поліфруктозу. Такі послідовності виявляються у бактерій та вірусів і не характерні для клітин ссавців. Взаємодія між фактором 1 та поверхнею клітини-збудника започатковує реакції активування С3 та С5. Пропердин є ще одним білком, що циркулює у крові і стабілізує активувальний комплекс ензимів. І класичний, і альтернативний шляхи ведуть до утворення С3-конвертази, яка, відповідно, перетворює С3 в його активну форму С3в.
Таблиця 27-4. Системні ефекти рекомбінантного ІЛ-1

Білок С3в призводить до опсонізації бактерії, посилюючи фагоцитоз. Він також розпочинає реакції, що активують інші компоненти каскаду системи комплементу. Після активування кінцеві продукти С5-С9 ведуть до утворення хемотаксичних речовин та виділення гістаміну. Як і цитотоксичні Т-клітини, вони також зумовлюють лізис бактерій, деяких вірусів та сторонніх клітин шляхом уведення перфоринів, здатних до утворення пор у мембрані. Це спричинює вільний рух йонів, і клітина гине внаслідок осмотичного лізису.
Вроджений імунітет
До клітин, задіяних у реакціях вродженого імунітету, належать нейтрофіли, макрофаги та природні цитотоксичні клітини, або NK-клітини (від англ. Natural killers), великі лімфоцити, які не є Т-клітинами, однак цитотоксичні. Всі ці клітини реагують на ліпіди та вуглеводи, специфічні для стінки бактерій, та на інші речовини, характерні для пухлин та трансплантатів. Головний ефект забезпечує участь системи комплементу та інших систем, у цьому разі клітини-мішені гинуть переважно внаслідок осмотичного лізису або апоптозу. Цитокіни цих клітин активують також клітини, задіяні у реакціях набутого імунітету.
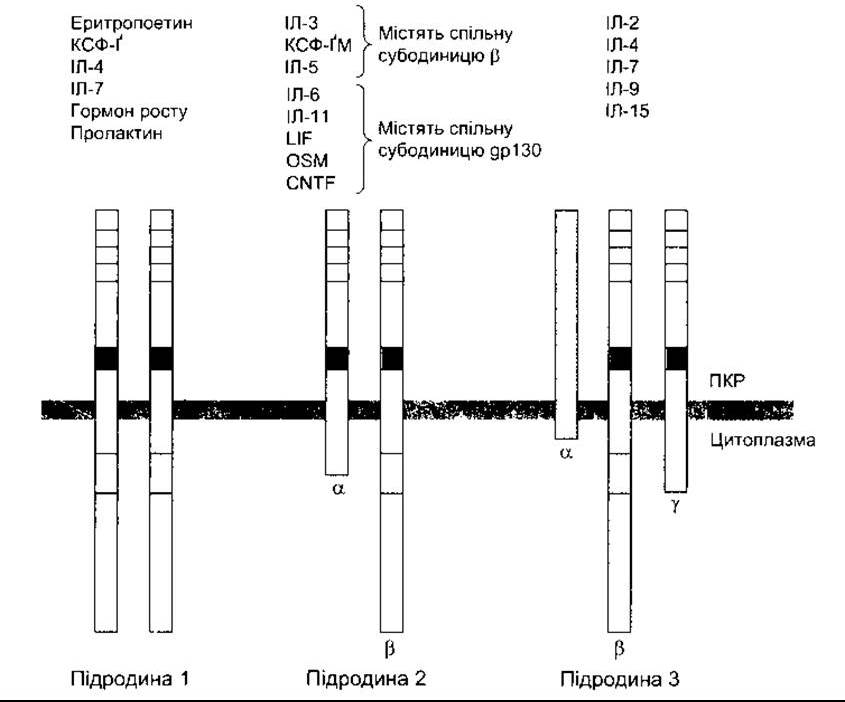
Рис. 27-6. У представників однієї з надродин рецепторів цитокінів виявлено спільні структурні елементи. Зауважимо, що всі субодиниці підродини 3, крім а-субодиниці, мають чотири збережені залишки цистеїну (порожні комірки вгорі) та Trp-Ser-X- Trp-Ser-послідовність (чорний колір). Багато субодиниць містять також критичний регуляторний домен у їхніх цитоплазматичних ділянках (світлий колір) ІЛ-6, UF, OSM та CNTF містять др1 30 замість ß-субодиниці; CNTF(3 англ. ciliary neurotrophic factor) - війковий нейротрофічний фактор; LIF (з англ. leukemia inhibitory factor) - фактор інгібування лейкемії; OSM (з англ. oncostatin) - онкостатин М (модифіковано з D’Andrea AD: Cytokine receptors in congenital hematopoietic disease N Engl H Med 1994:330 839).
Важливою ланкою вродженого імунітету у Drosophila є рецепторний білок toll, який слугує для приєднання антигену гриба та активування генів, що кодують протигрибкові білки. П’ять подібних до toll рецепторів (TLR) сьогодні виявлено у людей. Один з них - TLR4 - приєднує бактеріальні ліпополісахариди і білок, який називають CD14. Ці реакції розпочинають внутрішньоклітинні процеси, що активують транскрипцію генів багатьох білків, задіяних у реакціях природженого імунітету. Це важливо, оскільки бактеріальні ліпополісахариди, що їх утворюють грам-негативні збудники, спричинюють септичний шок.
Набутий імунітет
Як зазначено вище, головне для набутого імунітету - спроможність лімфоцитів виділяти антитіла, що є специфічними для кожного з мільйонів сторонніх агентів, які потрапляють в організм. Антигени, що стимулюють утворення антитіл, є зазвичай білками і поліпептидами, однак антитіла можуть утворюватись і до нуклеїнових кислот та ліпідів, якщо вони належать до складу нуклеопротеїнів та ліпопротеїнів. Антитіла можуть утворюватись і до дрібних молекул, якщо вони зв’язані з білками. Набутий імунітет складається з двох ланок: гуморального та клітинного імунітету. Гуморальний імунітет забезпечують імуноглобулінові антитіла, що циркулюють у крові і належать до у-глобулінової фракції білків плазми. Імуноглобуліни, що їх утворюють В-лімфоцити, активують систему комплементу, атакують та нейтралізують антигени. Гуморальний імунітет є головним захисним механізмом у разі бактерійних інфекцій. У випадку клітинного імунітету задіяні Т-лімфоцити. Ці процеси простежуються під час реакцій гіперчутливості сповільненого типу та відторгнення трансплантата чужої тканини. Цитотоксичні Т-лімфоцити атакують та знищують клітини, що містять антиген, який їх активує. Знищення клітин відбувається шляхом уведення перфоринів (див. вище) та стимулюванням апоптозу. Клітинний імунітет є головним захисним механізмом у випадку інфекцій, спричинених вірусами, грибками та деякими бактеріями, наприклад, бацилою туберкульозу. Він також є важливим протипухлинним механізмом.
Розвиток імунної системи
Під час фетального періоду попередники лімфоцитів виходять з кісткового мозку. Ті, що заселяють тимус (рис. 27-7), перетворюються під впливом мікрооточення тканин органа у лімфоцити, що відповідають за клітинний імунітет (Т-лімфоцити). У птахів попередники, що заселюють бурсу Фабріціуса, лімфоїдну структуру поблизу клоаки, перетворюються на лімфоцити, що відповідають за гуморальний імунітет (В-лімфоцити). У ссавців немає бурси, і трансформація у В-лімфоцити відбувається в еквівалентах бурси, наприклад у печінці плоду, а після народження - у кістковому мозку. Після перебування у печінці чи тимусі значна частина Т- та В-лімфоцитів мігрують у лімфовузли і кістковий мозок. Процеси дозрівання попередників лімфоцитів у тимусі та еквівалентах бурси і міграція у лімфовузли й інші тканини відбуваються у плоду та новонародженого; однак повільне утворення нових лімфоцитів зі стовбурової клітини - і в дорослому організмі. Морфологічно Т- та В-лімфоцити розрізнити неможливо, ідентифікувати їх можна за допомогою маркерів, розміщених на клітинній мембрані. Представники В-клітин диференціюються у плазматичні клітини та В-клітини пам’яті. Розрізняють три головні види Т-лімфоцитів: цитотоксичні Т-клітини, Т-клітини хелпери та Т-клітини пам’яті. Крім того, є два підтипи клітин хелперів: Т-хелпери першого типу (Тн1) виділяють ІЛ-2 та у-інтерферон і пов’язані переважно з клітинним імунітетом; Т- хелпери другого типу (Т2) виділяють ІЛ-4 та ІЛ-5 і взаємодіють переважно з В-клітинами щодо гуморального імунітету. Цитотоксичні Т-клітини руйнують трансплантовані й інші сторонні клітини, причому їхній розвиток регульований Т-хелперами. Більшість цитотоксичних Т-клітин мають на поверхні глікопротеїни CD8, а Т-клітини хелпери - глікопротеїн CD4. Ці білки щільно зв’язані з рецепторами Т-клітин і можуть діяти як корецептори. Залежно від особливостей рецепторів та функції цитотоксичні Т-клітини розділяють на aß- і уδ-типи (див. нижче). Природні цитотоксичні клітини (див. вище) є також цитоксичними лімфоцитами, хоча вони не належать до Т-клітин. Отже, є три головні види цитоксичних лімфоцитів в організмі: aßT-клітини, уδТ-клітини та NK-клітини.
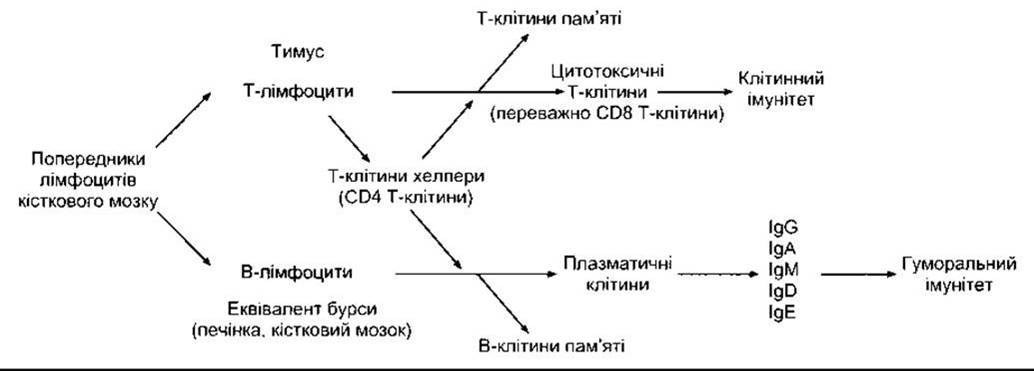
Рис. 27-7. Розвиток системи, що виконує реакції набутого імунітету.
Після контакту з антигеном невелика кількість активованих В- та Т-клітин залишаються у вигляді В- та Т-клітин пам’яті. Ці клітини швидко перетворюються в ефекторні клітини під час повторного контакту з тим самим антигеном. Здатність розвивати прискорену імунну відповідь у разі повторного контакту з антигеном є ще однією важливою рисою набутого імунітету. Вона може зберігатися протягом тривалого часу в лімфоїдній тканині, де розвивалась імунна реакція, і ще довше у плазмі крові. В деяких випадках (наприклад, імунітет проти кору) вона може тривати все життя. Багато суперечок зумовлює питання збереження імунної пам’яті. За однією теорією, цей процес спричинений повторними контактами з антигеном, які призводять до слабкої імунної відповіді без розвитку інфекційного захворювання. Згідно з іншою теорією, клітини пам’яті мають дуже тривалий період життя завдяки періодичному впливу фактора росту нервів, що запобігає їхньому апоптозу. Як зазначено у Розділі 2, фактор росту нервів виявляється у багатьох тканинах додатково до елементів нервової системи.
Розпізнавання антигену
Кількість різних антигенів, що їх розпізнають лімфоцити в організмі, дуже велика. Здатність до розпізнавання є природженою і розвивається без контакту з антигеном. Стовбурові клітини диференціюються у мільйони різних Т- та В-лімфоцитів, кожний з яких може реагувати на певний антиген. У разі першого потрапляння антигену в організм він може зв’язуватись безпосередньо з відповідними рецепторами на В-клітинах. Однак повна гуморальна відповідь потребує взаємодії В-клітин з Т-клітинами хелперами. У випадку Т-клітин антиген захоплює антигенопрезентувальна клітина та частково руйнує. Його пептидний фрагмент представлений відповідним рецепторам на Т-клітинах. У кожному випадку стимулюється клітинний поділ з наступним утворенням клонів клітин, що реагують на цей антиген (клональна селекція).
Презентування антигену
До антигенопрезентувальних клітин (АПК) належать спеціалізовані клітини, які називають дендритними клітинами, лімфовузлів та селезінки і дендритні клітини Ланґерганса у шкірі. Макрофаги та самі В-клітини теж можуть виконувати функцію антигенопрезентувальних клітин. У антигенопрезентувальних клітинах поліпептидні продукти розпаду антигену приєднуються до білкових продуктів генів основного комплексу гістосумісності (МНС - від англ. major histocompatibility complex) і локалізовані на поверхні клітин. Сполуки, що кодовані генами МНС, називають лейкоцитарними антигенами людини (HLA - від англ. human leukocyte antigens).
Гени МНС, що розміщені на короткому відрізку 6-ї хромосоми людини, кодують глікопротеїни; їх розділяють на два класи залежно від поширення та функції. Антигени першого класу містять 45 кДа важкий ланцюг, приєднаний нековалентним зв’язком до ß2-мiкpoглoбyлiнy, кодованого генами, що розміщені поза МНС (рис. 27-8). Вони виявляються у всіх клітинах, що містять ядро. Антигени другого класу є гетеродимерами, що складаються з а-ланцюгів масою 29-34 кДа, приєднаних нековалентним зв’язком до ß-ланцюгів масою 25-28 кДа. Вони виявляються в антигенопрезентувальних клітинах, зокрема В-клітинах, та в активованих Т-клітинах. Білки першого класу МНС (МНС-І білки) переважно приєднуються до пептидних фрагментів, утворених з білків, що синтезуються у клітині. Пептиди, до яких нема толерантності, тобто ті, що походять з вірусів або є наслідком мутацій, розпізнавані Т-клітинами. Розпад цих білків відбувається у протеасомах - комплексі протеолітичних ензимів, кодованих генами групи МНС, після чого пептидні фрагменти зв’язуються з білками МНС в ендоплазматичній сітці. Білки другого класу МНС (МНС-II білки) переважно зв’язуються з пептидними продуктами позаклітинних антигенів, таких як бактерії, що проникають у клітину шляхом ендоцитозу, і руйнуються у пізніх ендосомах.
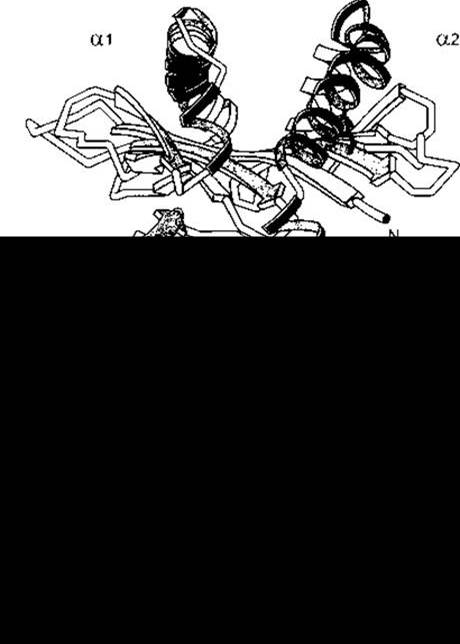
Рис. 27-8. Структура антигену комплексу гістосумісності людини HLA-A2. Кишеня для зв’язування антигену розміщена вгорі й утворена частинами молекули а1 та а2. Ділянка а3 та асоційований з нею β2-мікроглобулін (ß2m) розміщені поблизу мембрани. Продовження С-терміналу з частини а3, яка є трансмембранним доменом, та невелика цитоплазматична частина молекули не зображені (відтворено за дозволом з Bjorkman PH et al: Structure of the human histocompatibility antigen HLA-A2. Nature 1987;329:506).
Рецептори Т-клітин
Комплекси МНС білки-пептиди на поверхні антигено- презентувальних клітин приєднуються до відповідних Т-клітин. Отже, рецептори Т-клітин повинні розпізнавати дуже широкий спектр комплексів. Більшість рецепторів на Т- клітинах, що циркулюють, складаються з двох поліпептидних одиниць, які позначають а та ß. Вони утворюють гетеродимери, що розпізнають МНС білки та фрагменти антигенів, з якими вони зв’язуються (рис. 27-9). Ці клітини називають aß Т-клітини. Близько 10% Т-клітин, що циркулюють у крові, містять рецептори, у складі яких є два інші поліпептиди, які позначають у та δ. Ці клітини називають уδ Т-клітини. Їх виявляють у значній кількості в слизовій шлунково-кишкового тракту. Відомо, що ці клітини є проміжною ланкою між системами вродженого та набутого імунітету завдяки цитокінам, що їх вони виділяють (див. рис. 27-5).
Білки CD8 виявляють на поверхні цитотоксичних Т- клітин, що приєднуються до МНС-І білків, а CD4 простежуються на поверхні Т-клітин хелперів, що зв’язуються з МНС-II білками (рис. 27-10). Білки CD8 та CD4 посилюють приєднання МНС білків до рецепторів Т-клітин, а також прискорюють розвиток лімфоцитів, однак механізми цих впливів невідомі. Активовані CD8 цитотоксичні Т-клітини знищують клітини-мішені безпосередньо, тоді як активовані CD4 Т-клітини хелпери виділяють цитокіни для активування інших лімфоцитів.
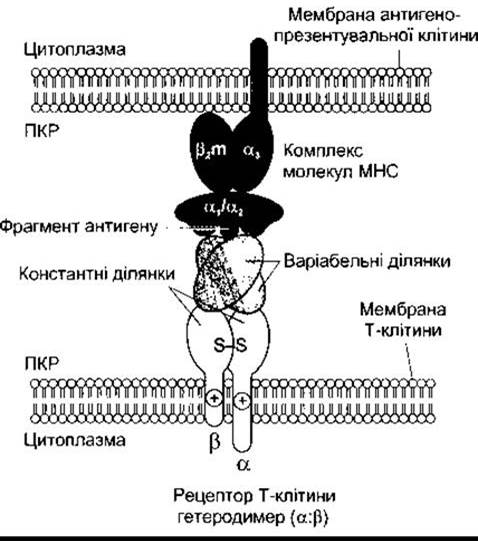
Рис. 27-9. Взаємодія між антигенопрезентувальною клітиною (угорі) і Т-лімфоцитом (унизу). МНС-білки (тут МНС 1) та їхній фрагмент пептидного антигену приєднується до а- та ß-одиниць, які в комплексі формують рецептор Т-клітини.
Рецептори клітин оточені адгезивними молекулами і білками, що приєднуються до комплементарних білків у антигенопрезентувальних клітинах під час тимчасового контакту між двома клітинами з утворенням «імунологічного синапсу», що спричинює активування Т-клітини. Загалом сьогодні вважають, що для активування клітини необхідно два сигнали. Перший з них зумовлений приєднанням фрагментованого антигену до рецептора Т-клітини, другий є наслідком приєднання навколишніх білків «синапсу». Якщо перший сигнал надійшов, а другий - ні, то Т-клітина інактивується і не може реагувати.
В-клітини
Як зазначено вище, В-клітини можуть безпосередньо зв’язуватись з антигеном, однак для розвитку повного активування та утворення антитіл вони повинні взаємодіяти з Т-клітинами хелперами. Переважно задіяний підтип Тн2; Т-клітини хелпери диференціюються у Тн2 під впливом ІЛ-4 (див. нижче). З іншого боку, ІЛ-12 зумовлює диференціювання у напрямі Тн1; ІЛ-2 спричинює проліферацію активованих Т-клітин. Роль різних цитокінів у активуванні В- та Т-клітин відображена на рис. 27-11.
Активовані В-клітини проліферують та перетворюються на В-клітини пам’яті (див. вище) і плазматичні клітини. Плазматичні клітини виділяють велику кількість антитіл у кров. Антитіла циркулюють у складі глобулінової фракції плазми (див. нижче) і, подібно до антитіл будь-якої локалізації, їх називають імуноглобулінами. Очевидно, що імуноглобуліни є секретованою формою антигенозв’язувальних рецепторів на поверхні мембрани В-клітин.
Імуноглобуліни
Антитіла, що циркулюють, захищають організм шляхом зв’язування та нейтралізації деяких білкових токсинів, запобігання прикріпленню деяких вірусів до клітини, опсонізації бактерій (див. вище) та активування комплементу (див. нижче). П’ять головних типів імуноглобулінових антитіл утворює система лімфоцити-плазматичні клітини. Головним компонентом кожного з них є симетрична одиниця, що містить чотири поліпептидні ланцюги (рис. 27- 12). Два довгі ланцюги називають важкими ланцюгами, а два короткі - легкими ланцюгами. Виявлено два типи легких ланцюгів - к та λ, і вісім типів важких. Ланцюги зв’язані між собою дисульфідними зв’язками, що забезпечує мобільність; усередині ланцюгів теж є дисульфідні зв’язки. Крім того, важкі ланцюги є гнучкими у ділянці, яку називають петля. Кожний важкий ланцюг має варіабельний сегмент (V), у якому послідовність амінокислот дуже варіабельна, сегмент різноманітності (D), де послідовність теж дуже різна, з’єднувальний сегмент (J), у якому послідовність помірно варіабельна, та константний сегмент (С), де послідовність стабільна. Кожний легкий ланцюг містить V-, J- та С-сегменти. Сегменти V утворюють ділянку приєднання антигену (Fab-ділянка молекули (див. рис. 27-12)). Ділянка Fс молекули є ефекторною, вона опосередковує реакції, стимульовані антитілами.
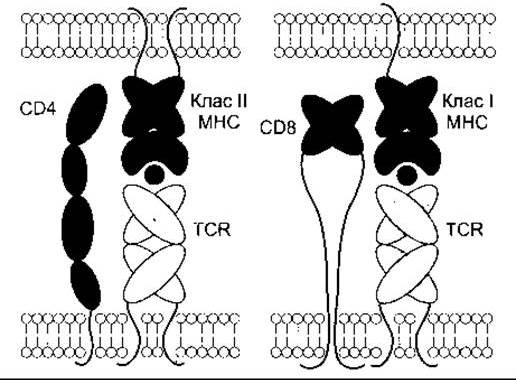
Рис. 27-10. Схема будови CD4 і CD8 та їхнє відношення до МНС-І та МНС-II білків. Зверніть увагу, що CD4 є одним білком, тоді як CD8 - гетеродимером (відтворено за дозволом з Leahy DJ: A structural view of CD4 and CD8. FASEB J 1995;9: 17).
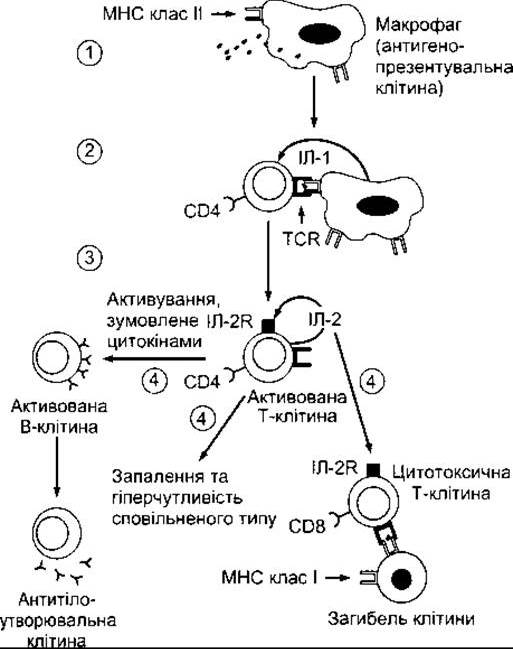
Рис. 27-11. Підсумок реакцій набутого імунітету. 1 -антигенопрезентувальна клітина захоплює та частково перетравлює антиген, потім частина антигену презентується разом з пептидами МНС (у цьому випадку МНС II пептиди на клітинній мембрані); 2 - утворення «імунного синапсу» неактивованою CD4 Т-клітиною, що призводить до активування лімфоцита та виділення ІЛ-2; 3 - ІЛ-2 діє автокринним шляхом, зумовлюючи проліферацію клітини й утворення клону; 4 - активована СО4-клітина може зумовлювати активування В-клітини та утворення плазматичних клітин або активувати цитотоксичні СD8-клітини. Активування СD8-клітин може бути зумовлене також утворенням синапсу з МНС І антигенозв’язувальною клітиною.
Два класи імуноглобулінів містять додаткові поліпептидні компоненти (табл. 27-5). У IgM п’ять головних імуноглобулінових одиниць об’єднані навколо J-ланцюга, утворюючи пентамер. У IgA - секреторних імуноглобулінах - одиниці імуноглобулінів утворюють димери та тримери навколо J-ланцюга та поліпептиду, що походить з епітеліальних клітин, секреторного компонента (СК).
У кишці відбувається захоплення бактеріальних та вірусних антигенів М-клітинами (див. Розділ 25), і вони проходять через прилеглі скупчення лімфоїдної тканини, де стимулюють лімфобласти. Потім ці лімфобласти проникають у систему кровообігу через лімфатичні судини, а після «дозрівання» у кровоносних судинах мігрують до дифузних скупчень лімфоїдних елементів, що розміщені під слизовою оболонкою кишки та під епітелієм у легенях, молочній залозі, сечостатевому тракті та жіночій репродуктивній системі. Там після повторного контакту з антигеном, що спричинив первинну відповідь, вони виділяють значну кількість IgA. Епітеліальні клітини утворюють СК, який слугує рецептором і приєднує IgA. Унаслідок секреторні імуноглобуліни проходять через епітеліальну клітину і виділяються шляхом екзоцитозу. Ця система секреторного імунітету є важливим і ефективним механізмом захисту.
Деякі імунні клітини містять індукувальну NOS (див. Розділ 31); виявилось, що N0 посилює секреторний імунітет у шлунково-кишковому тракті (див. Розділ 26).
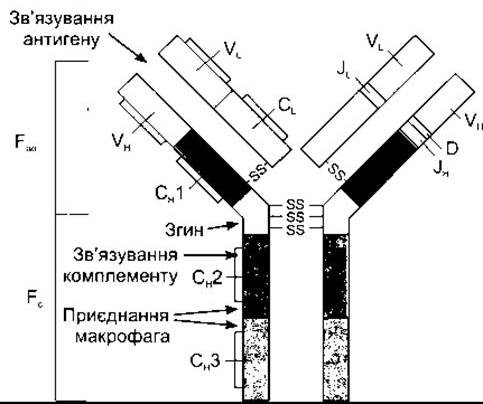
Рис. 27-12. Будова типової молекули імуноглобуліну G; Fab - ділянка молекули, що зв’язується з антигеном; Fc - ефекторна ділянка молекули. Константні ділянки забарвлені, а варіабельні - світлі. Константний сегмент важкого ланцюга ділиться на Сн1, Сн2 та Сн3. Праворуч лінії, які відображають міжсегментарні дисульфідні зв’язки, опущені, що дає змогу показати сегменти JH, D, VH, JL та VL.
Таблиця 27-5. Імуноглобуліни людини У всіх випадках легкими ланцюгами є к або А,
Імуноглобулін |
Функція |
Важкий ланцюг |
Додатковий ланцюг |
Структура |
Концентрація в плазмі, мг/дл |
lgG |
Фіксація комплементу |
y1, y2, y3, y4 |
Мономер |
1000 |
|
lgA |
Місцевий захист у складі зовнішніх секретів (сльози, кишкові секрети тощо) |
a1, a2 |
J, SC |
Мономер; димер з J- або SC-ланцюгами; тример з J-ланцюгом |
200 |
lgM |
Фіксація комплементу |
μ |
J |
Пентамер з J-ланцюгом |
120 |
lgD |
Розпізнавання антигену В-клітинами |
δ |
Мономер |
3 |
|
lgE |
Реагінова активність; виділення гістаміну базофілами та мастоцитами |
ε |
Мономер |
0,05 |
Моноклональні антитіла
Велику кількість імуноглобулінів може синтезувати одна плазматична клітина; якщо її з’єднати з пухлинною клітиною - утвориться «фабрика» антитіл. На практиці тварин імунізують певним антигеном або препаратом клітин. Після їхнього розтину із селезінок виділяють антитілопродукувальні клітини, які потім з’єднують з мієломними клітинами. Мієлома - це пухлина з В-лімфоцитів, клітини якої легко зливаються з плазматичними клітинами, формуючи антитілоутворювальні гібридоми, які добре ростуть та відтворюються. Клітини, що злилися, виділяють стандартними методами, і кожна з них дає початок клону клітин, що походить з єдиної клітини.
Генетичні основи різноманітності імунної системи
Генетичні механізми утворення надзвичайно великої кількості різних конфігурацій імуноглобулінів у депонованих лімфоцитах організму є цікавою біологічною проблемою. Частково різноманітність пояснюють наявністю двох видів легких ланцюгів та восьми видів важких. Як зазначено вище, у кожному ланцюгу є ділянки значної варіабельності (гіперваріабельні ділянки). Варіабельні зони важких ланцюгів складаються з V-, D- та J-сегментів. У родині генів, що кодують ці ділянки, є декілька сотень різних кодувальних місць для V-сегмента, близько 20 для D-сегмента та 4 для J-сегмента. У разі дозрівання В-клітини одне V-, одне D- і одне J-кодувальні місця випадково вибираються та рекомбінують з утворенням гена, що відповідає за певну варіабельну ділянку. У легких ланцюгах простежується подібна варіабельна рекомбінація кодувальних місць, що відповідають за два варіабельні сегменти (V- та J-). Крім того, варіабельність J-сегментів пов’язана з тим, що сегменти гена зв’язуються по-різному і загалом непередбачено (різноманітність, пов’язана з місцем зв’язку), а інколи простежується додавання нуклеотидів (різноманітність, пов’язана із вставкою у зв’язок). Було підраховано, що ці механізми забезпечують утворення 108-1010 різних молекул імуноглобулінів. Додаткова варіабельність досягається завдяки соматичним мутаціям.
Подібна реорганізація генів та механізми зв’язування забезпечують різноманітність рецепторів Т-клітин. У людей а-субодиниця має V-ділянку, кодовану одним з 50 різних генів, та J-ділянку, теж кодовану одним з інших 50 різних генів. У ß-субодиницях простежується V-ділянка, кодована одним з 50 генів, D-ділянка, кодована одним з двох генів, та J-ділянка, кодована одним з трьох генів. Ці варіабельні ділянки дають змогу утворити 1015 різних рецепторів Т-клітин.
Розпізнавання власних структур
Завжди було цікавим питання, чому Т- та В-клітини не утворюють антитіл та не руйнують клітини й органи власного організму. Згідно з сучасними поглядами власні антигени з’являються разом зі сторонніми, однак потім елімінуються у тимусі на ранніх етапах розвитку (клональна делеція). Причини, з яких не відбуваються реакції відторгнення плоду як стороннього тіла організмом матері, розглянуто у Розділі 23.
Автоімунні реакції
Іноді процеси елімінації антитіл проти власних антигенів не спрацьовують, унаслідок чого розвиваються різноманітні автоімунні захворювання. Їх поділяють на опосередковані Т- або В-клітинами, а також на органоспецифічні та системні. До таких захворювань належать цукровий діабет першого типу (антитіла до В-клітин острівців підшлункової залози), міастенія (антитіла до нікотинових холінергічних рецепторів) та розсіяний склероз (антитіла до основного білка мієліну і деяких інших компонентів мієліну).
У деяких випадках антитіла спрямовані проти рецепторів, здатні їх активувати, наприклад, антитіла до TSH- рецепторів підвищують активність щитоподібної залози і зумовлюють базедову хворобу (див. Розділ 18).
Частина автоімунних реакцій пов’язана з утворенням антитіл до мікроорганізмів, які перехресно реагують з нормальними складовими організму (молекулярна мімікрія). Інші ж розвиваються завдяки «ефекту свідка», за якого Т-клітини, що перебувають поблизу вогнища запалення, сенсибілізують. Це призводить до їхнього активування, якого в інших умовах не повинно бути. Однак щодо патогенезу автоімунних захворювань ще багато нез’ясовано.
Трансплантація тканин
Система Т-лімфоцитів відповідає за відторгнення трансплантованої тканини. Якщо тканини, такі як шкіру або нирки, пересаджують від донора до реципієнта таких тканин, то nрансплантат «приживається» і діє деякий час, однак потім відбувається некроз та «відторгнення», оскільки в організмі реципієнта розвиваються імунні реакції проти трансплантованої тканини. Зазвичай це простежується навіть тоді, коли донор та реципієнт є близькими родичами. Реакція відторгнення не відбувається тільки у випадку ідентичних близнюків.
Розроблено багато різних методів пригнічення реакції відторгнення трансплантованих органів у людей. Головна мета лікування - припинення відторгнень за умов запобігання розвитку інфекційних захворювань. Одним з методів є знищення Т-лімфоцитів шляхом ліквідації всіх швидко проліферувальних клітин такими ліками, як азатіоприн, антиметаболітами пурину, однак це робить хворих чутливими до інфекцій та раку. Інший метод - застосування глюкокортикоїдів, які пригнічують проліферацію цитотоксичних Т-клітин шляхом зменшеного виділення ІЛ-2 Т - клітинами, проте це може бути ускладнене остеопорозом, психічними розладами та іншими ознаками синдрому Кушінґа (див. Розділ 20). Ще один метод - застосування циклоспорину або такроліму (FK-506). Активування рецепторів Т-клітин у нормі збільшує концентрацію внутрішньоклітинного кальцію, що діє через кальмодулін, активуючи кальцинеурин (рис. 27-13). Кальцинеурин дефосфорилює фактор транскрипції NF-АТ, який рухається до ядра та підвищує активність генів, що кодують ІЛ-2 та споріднені стимулювальні молекули. Однак ці сполуки пригнічують усі імунні реакції, опосередковані Т-клітинами, а циклоспорин спричинює ураження нирок та рак. Новим та перспективним напрямом лікування реакцій відторгнення є досягнення ареактивності Т-клітин із застосуванням ліків, які блокують другий сигнал костимуляції, потрібний для нормального активування (див. вище). Клінічно ефективні препарати з такою дією можуть бути дуже важливими для хірургів, що займаються трансплантацією.
Інші клінічні кореляції
З нагромадженням знань про імунну систему було описано понад 50 синдромів імунодефіциту, пов’язаних з порушеннями функції імунокомпетентних клітин. Такі зміни виявляються різними за важкістю станами - від помірного збільшення частоти інфекцій до важких, зазвичай смертельних випадків. На рис. 27-14 показано, як блокада на різних етапах шляху дозрівання В- та Т-клітин призводить до розвитку передбачуваних патологічних змін. Крім того, є різні види недостатності комплементу.
Злоякісна трансформація теж може відбутись на різних стадіях дозрівання лімфоцитів. Більша частина (якщо не всі) випадків хронічного лімфоїдного лейкозу пов’язані з неконтрольованою проліферацією В-лімфоцитів, хоча мієлома розвивається в разі пухлинної проліферації клонів зрілих плазматичних клітин. Деякі випадки гострого лімфоїдного лейкозу пов’язані з пухлинною трансформацією Т-клітин. Синдром набутого імунодефіциту (СНІД), який сьогодні є однією з головних проблем людства, унікальний у тому, що ВІЛ (вірус імунодефіциту людини) - ретровірус, що спричинює захворювання - приєднується до CD4 та зумовлює значне зменшення кількості CD4 Т-клітин хелперів. Втрата лімфоцитів хелперів призводить, відповідно, до порушення проліферації CD8 та В клітин з втратою імунної функції та загибелі від інфекцій, зумовлених непатогенною флорою, або злоякісних пухлин.
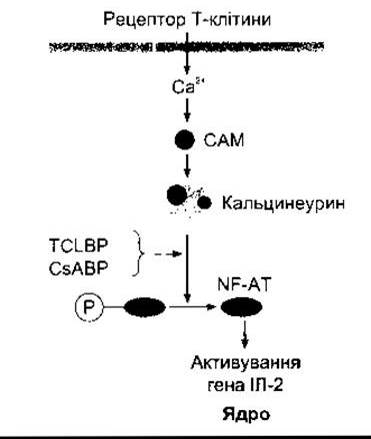
Рис. 27-13. Дія циклоспорину (з англ. cyclosporine CsA) та такроліму (з англ. tacrolimus TCL) на лімфоцит. Активування рецептора Т-клітини зумовлює надходження Са2+, що через кальмодулін (з англ. calmodulin САМ) призводить до активування кальцинеурину. Кальцинеурин дефосфорилює фактор транскрипції NF-АТ, який проникає у ядро та активує ген ІЛ-2. Після приєднання до відповідного імунофіліну (ВР) циклоспорин та такролім пригнічують вплив кальцинеурину на NF-АТ, запобігаючи підвищенню продукування ІЛ-2.