Фізіологія людини - Вільям Ф. Ґанонґ 2002
Утворення і виділення сечі
Регулювання складу та об'єму позаклітинної рідини
Регулювання концентрації Н+
Оскільки механізми кислотно-лужної рівноваги часто вважають «загадковими», то важливо зазначити, що ця рівновага визначена не «буферними основами» чи «зв’язаними катіонами», а лише концентрацією Н+ у ПКР. Механізми, що регулюють склад ГІКР, особливо важливі тому, що клітини організму дуже чутливі до змін концентрації йонів Н+. Концентрація Н+ всередині клітини, яку можна визначити за допомогою мікроелектродів, pH-чутливих флуоресцентних барвників та фосфорного магнітного резонансу, відрізняється від pH позаклітинної рідини і, ймовірно, впливає на численні процеси всередині клітини. Однак вона чутлива до змін концентрації Н+ у ПКР.
Значення pH - це зручний спосіб відображення концентрації Н+ в рідинних середовищах організму, оскільки концентрація Н+ низька порівняно із концентрацією інших катіонів. За нормальних умов концентрація Na+ в плазмі артеріальної крові, що перебуває у стані рівноваги з еритроцитами, становить близько 140 мекв/л, тоді як концентрація Н+-лише 0,00004 мекв/л (табл. 39-1). Отже, pH - це від’ємний десятковий логарифм, тому від 0,00004 - дорівнює 7,4. Зрозуміло, що зниження pH на одну одиницю, тобто з 7,0 до 6,0, відповідає збільшенню концентрації Н+ у десять разів. Важливо пам’ятати, що pH крові - це pH справжньої плазми, тобто плазми, що перебуває у стані рівноваги з еритроцитами, оскільки еритроцити містять гемоглобін, який за кількісними показниками є одним з найважливіших буферних систем крові (див. Розділ 35).
Таблиця 39-1. Концентрація йонів Н+ та pH у різних рідких середовищах організму
Концентрація Н+ |
pH |
|||
мекв/л |
моль/л |
|||
Шлунковий сік |
150 |
0,15 |
0,8 |
|
Максимальна кислотність сечі |
0,03 |
3 х 10-5 |
4,5 |
|
Термінальний ацидоз |
0,0001 |
1 х 10-7 |
7,0 |
|
Плазма |
Норма |
0,00004 |
4 х 10-8 |
7,4 |
крові |
Термінальний алкалоз |
0,00002 |
2 х 10-8 |
7,7 |
Сік підшлункової залози |
0,00001 |
1 х 10-8 |
8,0 |
|
Рівновага Н+
Значення pH плазми артеріальної крові в нормі становить 7,40, а венозної - дещо менше. Вважають, що про ацидоз треба говорити, коли pH артеріальної крові - понад 7,40, а про алкалоз - коли це значення перевищує 7,40 хоча коливання pH у межах 0,05 не призводять до жодних небажаних наслідків. Граничні концентрації Н+, сумісні з життям, відрізняються у п’ять разів - від 0,00002 (pH 7,7) до 0,0001 мекв/л (pH 7,0). У печінці в процесі глюконеогенезу відбувається метаболізм амінокислот, побічними продуктами якого є йони NH4+ та НСО3, тобто їхні амінні та карбоксилові групи (рис. 39-3). Йони NH4 + ВИВОДЯТЬСЯ у вигляді сечовини, а йони Н+ в середині клітин зв’язуються з утворенням НСО3. Отже, у кровоплин потрапляє лише незначна кількість NH4+ та НСО3. Проте внаслідок метаболізму сірковмісних амінокислот утворюється H2SО4, а в процесі метаболізму фосфоровмісних амінокислот, таких як фосфосерин, - Н3РО4. Ці сильні кислоти, надходячи у кровоплин, спричинюють значне кислотне навантаження на буферні системи ПКР. Унаслідок метаболізму амінокислот у нормі за добу утворюється близько 50 мекв Н+. Газ СО2, що є кінцевим продуктом тканинного метаболізму, значно пов’язаний з утворенням Н2СО3 (див. Розділ 35), а загальне надходження Н+ з цього джерела перевищує 12 500 мекв/добу. Однак більша частина СО2 піддається екскреції в легенях, і лише незначну частину Н+ екскретують нирки. Найпоширенішими джерелами додаткового кислотного навантаження є інтенсивне фізичне навантаження (посилене надходження молочної кислоти), діабетичний кетоацидоз (ацетооцтова кислота та ß-гідроксибутират) та приймання ацидифікувальних солей, таких як NH4Cl та СаСl2, які фактично збільшують надходження в організм НСl. Неспроможність уражених патологічним процесом нирок секретувати нормальну кількість Н+ також може бути причиною ацидозу. Фрукти є головним харчовим джерелом лугів. Вони містять натрієві та калієві солі слабких органічних кислот, аніони яких метаболізуються до СО2, забезпечуючи надходження в організм NaHCО3 та КНСО3. Сіль NaHCО3 та інші алкалінізувальні солі часто надходять у великих кількостях, та найчастішою причиною алкалозу є втрата H+, яка виникає внаслідок тривалого інтенсивного блювання, коли втрачається шлунковий сік, що містить значну кількість НСl. Це, звичайно, еквівалентне введенню в організм відповідної кількості лугу.
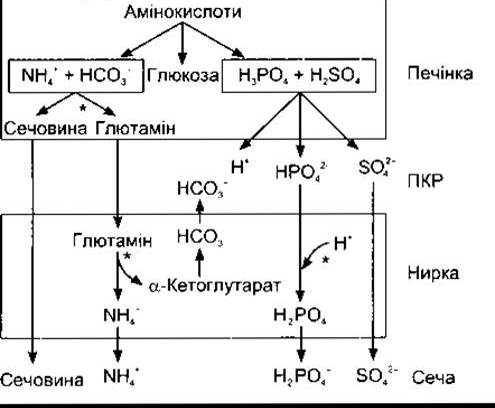
Рис. 39-3. Роль печінки та нирок у виведенні надлишку кислот. Ділянки, на яких відбувається регулювання, позначені зірочками (модифіковано та відтворено з Кnерреr МА et al. Ammonium, urea, and systemic pH regulation. Am J Physiol 1987; 235:F199).
Буферні системи
Буферні системи детально розглянуто в Розділі 1 та частково в Розділі 35 у контексті механізмів транспортування СО2 в організмі. Вони відіграють ключову роль у підтриманні гомеостазу Н+.
Рівняння Гендерсона-Гассельбальха
Загальне рівняння, що описує будь-яку буферну систему, має такий вигляд:
![]()
де А відповідає будь-якому аніону, а НА - це недисоційована кислота. Якщо у розчин, що місить цю буферну систему, потрапляє сильніша кислота, ніж НА, то рівновага зміщується ліворуч. Нони Н+ зв’язуються з утворенням додаткової кількості недисоційованої НА, отже, концентрація Н+ збільшується значно менше, ніж без цієї буферної системи. Натомість, якщо до системи додати луг, то йони Н+ та ОН реагують з утворенням Н2О; однак у цьому разі відбувається посилена дисоціація НА, що компенсує втрату йонів Н+. Згідно з законом дії мас, у рівноважному стані добуток концентрацій продуктів хімічної реакції, поділений на добуток концентрацій речовин, що реагують, є сталим:
![]()
Якщо цей математичний вираз записати для pH (від’ємного десяткового логарифму концентрації H+), то одержимо рівняння, виведене Гендерсоном та Гассельбальхом, яке описує зміни pH унаслідок додавання до будь-якої буферної системи H+ чи ОН (рівняння Гендерсона-Гассельбальха):
![]()
З цього рівняння чітко видно, що буферна ємність системи найбільша, коли кількість вільних аніонів дорівнює кількості недисоційованої НА, тобто коли [А ]/[НА] = 1, тоді log [А ]/[НА] = 0 і pH = рК. Тому природно очікувати, що найпотужнішими буферними системами організму є ті, що мають рК, яке наближається до pH, за якого вони діють. Значення pH крові у нормі становить 7,4; pH внутрішньоклітинного середовища - 7,2; pH сечі - від 4,5 до 8,0.
Важливо зазначити, що стала рівноваги К стосується лише ідеальних розчинів, тобто тих, у яких можна нехтувати силами електричної взаємодії між йонами. Стосовно рідких середовищ організму доцільніше користуватись так званою сталою йонізації К'.
Буферні системи крові
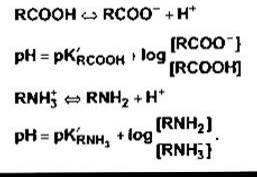
Білки крові, зокрема, білки плазми, є ефективними буферними системами оскільки здатність до дисоціації мають як карбоксилові, так і амінні вільні групи:
Інша важлива буферна система забезпечена дисоціацією імідазольних груп залишків гістидину у молекулі гемоглобіну:
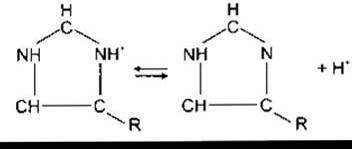
У діапазоні значень pH 7,0-7,7 вільні карбоксилові та амінні групи гемоглобіну роблять лише незначний внесок у його буферну ємність. Та оскільки молекула гемоглобіну містить 38 залишків гістидину і гемоглобін міститься в крові у значній кількості, то цей білок має буферну ємність, у шість разів потужнішу, ніж у білків плазми крові. Крім того, дія гемоглобіну дещо унікальна тому, що імідазольні групи деоксигемоглобіну дисоціюють значно менше, ніж оксигемоглобіну. Отже, Нb є слабкою кислотою і тому ліпшим буфером, ніж НbO2. Титраційні криві для Нb і НbO2 показані на рис. 39-4.
Третім важливим буферним механізмом є карбонат-бікарбонатна система:
![]()
Рівняння Гендерсона-Гассельбаха для цієї системи буде виглядати так:
![]()
Значення рК для цієї системи за умови ідеального розчину є малим (близько 3), і кількість Н2СO3 теж мала, тому її важко достатньо точно визначити. Однак в організмі Н2СO3 перебуває в стані рівноваги з СO2:
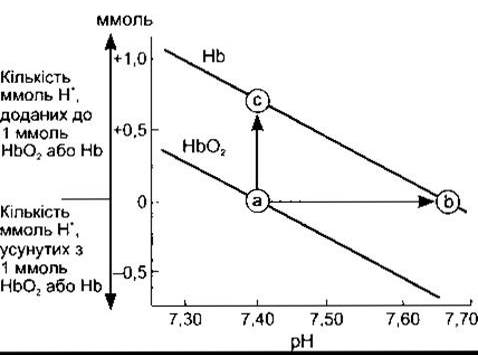
Рис. 39-4. Титраційні криві Нb та НbO2. Стрілка від а до с відображає кількість ммоль Н+ яке повинно бути додане без зсуву pH. Стрілка від а до b позначає зміну pH у випадку деоксигенації.
![]()
Якщо рК замінити на рК' (див. вище), a [CO2] - на [Н2С03], то рК' становитиме 6,1.
Наведена нижче форма цього рівняння має деяке клінічно-діагностичне значення:
![]()
бо кількість розчиненого СO2 пропорційна до парціального тиску СO2 у міліметрах ртутного стовпчика, а коефіцієнт розчинності СO2 становить 0,0301 ммоль/л. Значення [НСO3-] неможливо виміряти прямо, однак pH і РСO2 можна достатньо точно визначити за допомогою скляних електродів. Значення [НСO3-] одержують розрахунковим способом.
Значення рК' цієї системи все ж таки набагато менше, ніж pH крові, однак ця система є однією з найефективніших буферних систем організму, бо кількість розчиненого СO2 визначена процесами дихання. Крім того, концентрація НСO3 в плазмі крові регульована нирками. Якщо до крові додати деяку кількість Н+, то концентрація НСO3 зменшується, оскільки утворюється більше Н2СO3. Якби надлишкова кількість Н2СO3 не розпадалась на Н2O і СO2, який згодом виходить через легені, то концентрація Н2СO3 невпинно зростала б. Якщо до плазми крові додати таку кількість йонів Н+, яка зв’язала б половину йонів НСO3 у плазмі крові, то її pH миттєво зменшився б з 7,4 до 6,0. Та, окрім видалення надлишкової кількості Н2СO3, збільшення вмісту Н+ стимулює дихання, що призводить до зменшення РСO2 і видалення додаткової кількості Н2СO3. Отже, pH зменшується лише до 7,2-7,3 (рис. 39-5).
Без специфічного ензиму карбоангідрази хімічна реакція СO2 + Н2O ⇄ Н2СO3 відбувається повільно в обох напрямах. Плазма крові не містить карбоангідрази, проте вона у великій кількості є в еритроцитах. Значний її вміст характерний також для кислотосекретувальних клітин шлунка (див. Розділ 26) та клітин ниркових канальців (див. Розділ 38). Карбоангідраза - це білок із молекулярною масою 30 000, що містить один атом цинку в кожній молекулі. Його інгібують ціаніди, азиди та сульфіди. Сульфаніламіди також інгібують цей ензим, і тому їхні похідні застосовують у клінічній практиці як сечогінні засоби, завдяки їхній здатності чинити інгібіторний вплив на карбоангідразу нирок (див. Розділ 38).
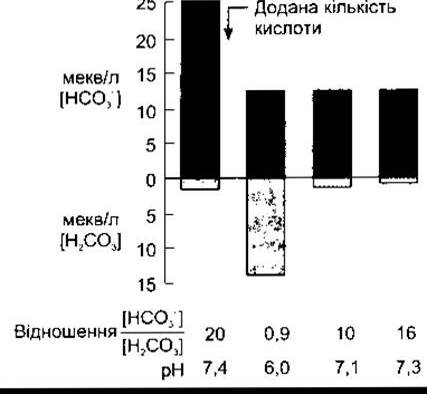
Рис. 39-5. Механізм дії бікарбонатної буферної системи крові. Стовпчики показують емпірично покроковий порядок, щоб відобразити вплив первинної реакції, зменшення вмісту Н2СO3 щодо попередніх значень і подальше його зменшення внаслідок посилення вентиляції легень; [Н2СO3] - це фактично концентрація розчиненого СO2. Значення в мекв/л є довільними.
Система Н2РO4 ⇄ Н+ + НРO42 має значення рК, що дорівнює 6,80. Концентрація фосфатів у плазмі крові занадто мала для того, щоб ця система відігравала кількісно значну роль, однак вона має важливе значення для підтримання внутрішньоклітинного гомеостазу та pH сечі (див. Розділ 38).
Буферні системи in vivo
Буферні системи живого організму, звичайно, не зводяться лише до крові. Головні буферні системи крові, інтерстиційної та внутрішньоклітинної рідини наведені в табл. 39-2. У спинномозковій рідині та сечі провідну роль відіграють бікарбонатна та фосфатна буферні системи. У разі метаболічного ацидозу лише 15-20% кислотного навантаження зв’язує бікарбонатна система; решта H+ здебільшого зв’язується всередині клітин. У випадку метаболічного алкалозу близько 30-35% надлишку ОН- зв’язується всередині клітин, тоді як у разі респіраторного ацидозу та алкалозу практично все буферне навантаження беруть на себе саме внутрішньоклітинні механізми.
Таблиця 39-2. Головні буферні системи організму
Кров |
H2CO3 ⇄ H+ + HCO3- НБілок ⇄ Н+ + Білок- ННb ⇄ H+ + Hb- |
Інтерстиційна рідина |
H2CO3 ⇄ H+ + HCO3- |
Внутрішньоклітинна рідина |
НБілок ⇄ H+ + Білок- Н2PO4 ⇄ H+ + HPO42- |
Головними регуляторами pH внутрішньоклітинного середовища у тварин є транспортери НСO3. Найліпше вивчені сьогодні Сl -НСO3 -обмінник смуги 3 (див. Розділ 35), три різновиди Na+-HCO3 - котранспортерів і один К - НСO3 - котранспортер.
Висновок
Якщо до крові додати сильну кислоту, то головні буферні реакції зсуваються ліворуч. Концентрація в крові трьох «буферних аніонів» - Нb (гемоглобіну), Білок та НСO3 - значно зменшується. Аніони кислоти, що надійшла до організму, піддаються фільтрації у ниркових канальцях. їх супроводжують («покривають») катіони, зокрема Na+, оскільки в цьому разі підтримується електрохімічна нейтральність. За допомогою процесів, які описано у Розділі 38, у канальцях відбувається процес заміщення Na+ на Н+ з одночасною реабсорбцією еквімолярної кількості Na+ та НСO3, завдяки чому зберігаються катіони, виводиться надлишкова кількість кислот, а запас буферних аніонів поновлюється. Якщо до плазми крові додати деяку кількість СO2, то відбуваються аналогічні хімічні реакції, за винятком того, що внаслідок утворення Н2СO3 концентрація НСO3 у плазмі крові збільшується, а не зменшується.
Респіраторний ацидоз та алкалоз
Підвищення РСO2 артеріальної крові внаслідок гіповен- тиляції називають респіраторним ацидозом. Газ СO2 перебуває у стані рівноваги з Н2СO3, який, відповідно, є у стані рівноваги з НСO3, отже, рівень НСO3 збільшується, і настає новий рівноважний стан уже за меншого pH. Графічним відображенням цього є крива залежності концентрації НСO3 від pH (рис. 39-6). Натомість, зниження РCO2 призводить до респіраторного алкалозу.
Початкові зміни, відображені нарис. 39-6, відбуваються незалежно від будь-яких компенсаторних механізмів, тобто виникають у разі декомпенсованого респіраторного ацидозу чи алкалозу. У будь-якому випадку, ці зміни створюють нирки, які намагаються компенсувати ацидоз чи алкалоз, змінюючи pH у бік норми.
Ниркова компенсація
Реабсорбція НСO3- у ниркових канальцях залежить не лише від фільтраційного навантаження НСO3, яке арифметично виражене добутком ШКФ та рівня НСO3 у плазмі крові, а й від швидкості секреції нирковими канальцями Н+, оскільки йони НСO3 реабсорбуються в обмін на Н+. Швидкість секреції Н+, а, отже, і реабсорбції НСO3, залежить від РCO2 артеріальної крові. Ймовірна причина цього та, що чим більший вміст у клітинах СO2, з якого утворюється Н2СO3, тим більше Н+ може секретуватись (див. Розділ 35). У випадку респіраторного ацидозу канальцева секреція Н+ в нирках посилюється, внаслідок чого надлишок Н+ виходить з організму. У цьому разі навіть якщо рівень НСO3 в плазмі крові підвищений, то реабсорбція НСO3 посилюється, внаслідок чого концентрація НСO3 в плазмі крові збільшується. Отже, ниркова компенсація респіраторного ацидозу зводиться до переходу ацидозу з гострої у хронічну форму, що графічно показано рис. 39-6. Посилюється екскреція Сl, отже, зі збільшенням вмісту НСO3 концентрація Сl в плазмі крові зменшується. Натомість, у разі респіраторного алкалозу зниження РCO2 призводить до сповільнення секреції Н+ нирками, реабсорбції НСO3 та посилення екскреції НСO3-, що призводить до ще більшого зменшення концентрації НСO3 в плазмі крові, внаслідок чого pH зменшується до нормальних показників (див. рис. 39-6).
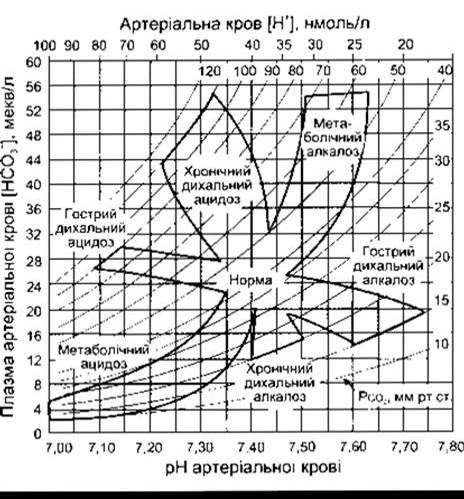
Рис. 39-6. Номограма кислотно-лужного стану, яка показує зміни РСO2 (криві на графіку), концентрації НСO3- у плазмі крові та pH артеріальної крові у разі респіраторного та метаболічного ацидозу Зверніть увагу на зсуви концентрації НСO3- та зміни pH у разі компенсації гострого респіраторного ацидозу та алкалозу, що призводить, відповідно, до хронічних ацидозу та алкалозу (відтворено за дозволом з Cogan MG, Rector FC Jr: Acid-base disorders. Pages 457-517 In: The Kidney, 4th ed. Brenner BM, Rector FC Jr [editors]. Saunders, 1991).
Метаболічний ацидоз
Коли у кров потрапляють кислоти, сильніші від ННb та інших буферних кислот, то виникає метаболічний ацидоз; а якщо концентрація вільних йонів Н+ зменшується внаслідок надлишкового надходження лугів або втрати кислот, - то метаболічний алкалоз. Якщо ж, наприклад, уводять H2SO4, то Н+ зв’язуються з буферами, а вміст у плазмі крові Нb, Білок і НСO3, відповідно, зменшується. Унаслідок утворена Н2СO3 розпадається на Н2O та СO2; вуглекислий газ досить швидко виходить через легені. Це трапляється у разі декомпенсованого метаболічного ацидозу (рис. 39- 7). Збільшення концентрації йонів Н+ фактично стимулює процеси дихання, внаслідок чого PCO2, не зростає чи навіть не змінюється, а навпаки, знижується. Отже, респіраторна компенсація ацидозу призводить до ще інтенсивнішого збільшення pH. Екскрецію надлишку йонів Н+ забезпечують ниркові компенсаторні механізми, які повертають буферні системи організму до їхнього нормального стану.
Ниркова компенсація
Аніони, які заміщають НСO3 в плазмі крові в разі метаболічного ацидозу, піддаються фільтрації, причому кожного з них супроводжує катіон (переважно Na+), що забезпечує незмінно нейтральний загальний електричний заряд плазми крові. Клітини ниркових канальців секретують Н+ у канальцеву рідину в обмін на йони Na+, у цьому разі на кожен йон Н+, що його виділили нирки, припадає один йон Na+ та один йон НСO3 (див. Розділ 38). Якби в сечі не було буферних сполук, які зв’язують H+, то її pH швидко б досягав гранично можливого значення 4,5, і виділення йонів Н+ із сечею було б нехтувано малим. Однак Н+, що піддається секреції, реагує із НСO3 з утворенням СO2 та Н2O (реабсорбція бікарбонату); із НРO42 з утворенням Н2РO4 ; із NH3 з утворенням NH4+. Отже, відбувається секреція значної кількості Н+ із надходженням у рідинні середовища організму відповідного об’єму НСO3, який поповнює резерви буферних систем, та реабсорбція багатьох фізіологічно важливих катіонів. Лише у випадку надходження ззовні дуже великої кількості кислоти катіони втрачаються разом з аніонами, що спричинює посилене сечовиділення та виснаження катіонних запасів організму. У разі хронічного ацидозу посилюється синтез глютамінової кислоти в печінці, у процесі якого використовується певна частина йонів NH4+, ЯКІ зазвичай зв’язуються під час синтезу сечовини (див. рис. 39-3), а глютамат, відповідно, є додатковим джерелом NH4+ у нирках (див. Розділ 38). Секреція NH3 посилюється упродовж декількох днів (адаптація секреції NH3, див. Розділ 38), що поліпшує ниркову компенсацію ацидозу. Крім того, внаслідок метаболізму глютаміну в нирках утворюється а-кетоглутарат, що, відповідно, декарбоксилює з утворенням НСO3, який, надходячи у кровоплин, зв’язує надлишкові йони Н+ (див. рис. 39-3).
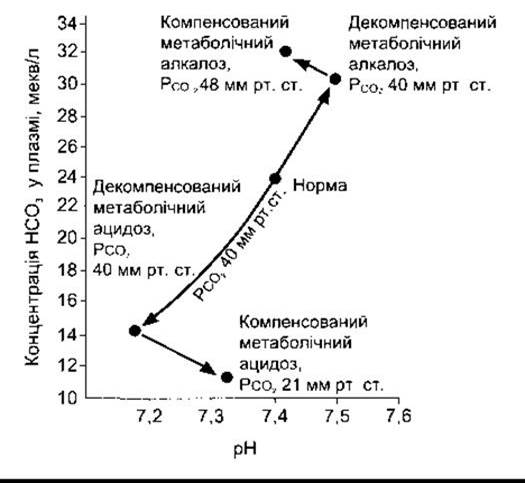
Рис. 39-7. Зміни pH справжньої плазми, концентрації НСO3- та РCO2 У разі метаболічного ацидозу та алкалозу (діаграма Давенпорта) (Davenport HW: The ABC of Acid-Base Chemistry, 6tg ed. Univ of Chicago Press, 1974).
Унаслідок додавання сильної кислоти, наприклад H2SO4, у крові відбувається така хімічна реакція:
![]()
На кожен моль Н+, що надходить, втрачається 1 моль NaHCO3. У ниркових канальцях ця хімічна реакція відбувається у зворотному напрямі:
![]()
Н+ та SO42 у цьому разі екскретуються. Звичайно, H2SO4 не екскретується в незміненому вигляді; йони Н+ з’являються в сечі у вигляді її кислотності та NH4+.
У випадку метаболічного ацидозу дихальна компенсація зумовлює пригнічення ниркових механізмів регулювання кислотно-лужної рівноваги, оскільки значне зниження PCO2, що простежується тоді, гальмує секрецію кислот. Проте, з іншого боку, дихальна компенсація зменшує фільтрацію НСO3, і, отже, загальний інгібіторний ефект не є значно вираженим.
Метаболічний алкалоз
У випадку метаболічного алкалозу рівень НСO3 та СO2 в плазмі крові підвищується (див. рис. 39-7). Дихальна компенсація відбувається шляхом послаблення вентиляції легень у відповідь на зменшення концентрації Н+ в плазмі крові і, відповідно, підвищення РCO2. Унаслідок цього pH набуває нормальних значень, тоді як концентрація НСO3 в плазмі крові значно збільшується. Цей компенсаторний механізм регулюють хеморецептори аорти та каротидної зони, які активують центр дихання, якщо відбувається помітне зниження РO2 артеріальної крові. У випадку метаболічного алкалозу посилюється секреція Н+ нирками та реабсорбція НСO3. Якщо концентрація НСO3 у плазмі крові перевищує 26-28 мекв/л, то НСO3 з’являється в сечі. Підвищення РСO2 пригнічує ниркову компенсацію, полегшуючи секрецію кислот, однак кінцевий ефект цього порівняно незначний.
Клінічна оцінка кислотно-лужної рівноваги
У комплексі показників кислотно-лужної рівноваги важливе клінічне значення мають pH артеріальної крові та вміст НСo3 у її плазмі. Надійне значення pH можна отримати за допомогою pH-метра та скляних рН-електродів. Вміст НСO3 у плазмі крові неможливо визначити прямо, однак натомість можна визначити РСO2 за допомогою СO2 електродів, а концентрацію НСO3 отримати розрахунковим способом, як це описано вище. У плазмі венозної крові порівняно з артеріальною РСO2 на 7-8 мм рт. ст. вищий, а pH на 0,03-0,04 одиниці більше. Це зумовлене тим, що венозна кров містить СO2, який вона переносить до легень. Отже, розрахункова концентрація НСO3 у венозній крові більша майже на 2 ммоль/л. З огляду на це здебільшого можна, замість артеріальної, брати на дослідження венозну кров.
У диференційній діагностиці метаболічного ацидозу цінним є такий показник, як аніонний проміжок (від англ, anion gap). Хоча цей термін - один з прикладів лінгвістичної неточності у науковій термінології, його широко застосовують. Чисельно цей показник дорівнює різниці між концентрацією катіонів (окрім Na+) та концентрацією аніонів (окрім Сl та НСO3) у плазмі крові. Його значення визначають здебільшого білки в аніонній формі, НРO42, SO42 та органічні кислоти. У нормі він становить близько 12 мекв/л. Аніонний проміжок збільшується зі зменшенням концентрації К+, Са2+ та Mg2+, збільшенням концентрації або електричного заряду білків плазми крові, або коли в крові накопичуються органічні аніони, наприклад лактат. Він зменшується зі збільшенням вмісту катіонів або зменшенням вмісту альбуміну в плазмі крові. Аніонний проміжок збільшується у випадку метаболічного ацидозу внаслідок надлишкового вмісту кетонових тіл, лактату та в разі інших форм ацидозу, що зумовлені надлишком органічних аніонів. Він не змінюється в разі гіперхлоремічного ацидозу, що виникає внаслідок приймання NH4Cl або інгібіторів карбоангідрази.
Крива Сіґґаарда-Андерсена
Коли в клініці виникає потреба визначити кислотно- основні характеристики артеріальної крові, то це можна швидко і легко зробити за допомогою кривої або номограми Сіґґаарда-Андерсена. Ця номограма має вигляд логарифмічної кривої; по осі абсцис відкладено pH, по осі ординат - РСO2. Отже, ділянка кривої ліворуч від вертикальної лінії, проведеної через значення pH 7,40, стосується ацидозу, а праворуч - алкалозу. Ділянка кривої нижче горизонтальної лінії, проведеної через значення РСO2 40 мм рт. ст., відповідає гіпервентиляції, вище - гіповентиляції.
Якщо розчин, у якому є NaHCO3 і нема буферних систем, урівноважувати з газовими сумішами, що мають різний вміст СO2, то значення pH та СO2 змінювалися б так, що утворили криву, яка показана у лівій частині графіка на рис. 39-8 або вздовж лінії, що паралельна до неї. За наявності буферних речовин ухил кривої був би більшим; чим більша буферна ємність розчину, тим крутішою буде крива. Для нормальної крові, 1 дл якої містить 15 г гемоглобіну, лінія титрування СO2 проходить через відмітку 15 г/дл на гемоглобіновій шкалі (з внутрішнього боку верхньої викривленої шкали) і точку, де перетинаються значення РСO2 40 мм рт. ст. та pH 7,40, як це показано на рис. 39-8. Коли вміст гемоглобіну у крові низький, то простежується значна втрата буферної ємності, і ухил лінії титрування СO2 зменшується. Та оскільки, крім гемоглобіну, кров містить інші буферні системи, то лінія, проведена через нульову відмітку гемоглобінової шкали через перетин нормальних значень pH та РCO2, є крутішою, ніж крива для розчину, що не містить жодних буферних сполук.
На практиці в анаеробних умовах забирають артеріальну або артеріалізовану капілярну кров та вимірюють її pH. Визначають також pH того ж зразка крові після зрівноважування з двома газовими сумішами, які мають різний відомий вміст СO2. Значення pH за різних показників PCO2 наносять на графік і з’єднують, унаслідок чого утворюється лінія титрування СO2 цього зразка крові. Значення pH цього зразка крові до зрівноважування з газами також наносять на графік, і РСO2, що відповідає йому, зчитують з вертикальної шкали. Стандартний вміст бікарбонату в зразку крові відповідає точці, де лінія титрування СO2 перетинає бікарбонатну шкалу, яка проходить через значення PCО2 паралельно до горизонтальної осі. Стандартний вміст бікарбонату - це не є фактична концентрація бікарбонату в зразку, а, радше, така його концентрація, яка була б у разі усунення будь-якого впливу дихання на кислотно-лужну рівновагу. Цей показник відображає лужні резерви крові, хоч його і визначають за pH, а не за повним вмістом СО2 у зразку крові після зрівноваження. Подібно до лужного резерву, він є показником вираження наявного метаболічного ацидозу чи алкалозу.

Рис. 39-8. Номограма Сігїаарда-Андерсена (з дозволу О Siggaard-Andersen and Radiometer, Copenhagen, Denmark).
Додаткові позначки на верхній викривленій шкалі номограми (див. рис. 39-8) слугують для визначення вмісту буферних основ; точка, де лінія калібрування С02 артеріальної крові перетинає цю шкалу, відображає вміст буферних основ у крові (мекв/л). Термін «буферні основи» еквівалентний кількості буферних аніонів (здебільшого - Білок, НСО3 та Нb; див. Розділ 35), які можуть зв’язувати йони Н+ у крові. Нормальне значення цього показника у людини з вмістом гемоглобіну 15 г/дл становить 48 мекв/л.
Точка, у якій крива калібрування СO2 перетинає нижню викривлену шкалу номограми, відповідає надлишку основ.
Це значення, яке є додатним у разі алкалозу та від’ємним у випадку ацидозу, відповідає кількості кислоти або основи, яка може відновити нормальний кислотно-лужний стан 1 л крові при РСO2, що дорівнює 40 мм рт. ст. Важливо зазначити, що дефіцит основ неможливо повністю відновити, просто обчисливши різницю між нормальним рівнем стандартного бікарбонату (24 мекв/л) і його фактичним рівнем та ввівши довенно відповідну кількість NaHCO3 У цьому разі деяка кількість НСO3 перетворюється на СO2 та Н2O, а СO2 виходить через легені. Кількість NaHCO3, яку насправді треба ввести, у 1,2 раза перевищує дефіцит стандартного бікарбонату, однак точніші дані можна одержати, використовуючи нижню викривлену шкалу, яку розроблено емпіричним способом як результат аналізу великої кількості зразків артеріальної крові.
Деякі приклади розладів кислотно-лужної рівноваги наведені в табл. 39-3.
У разі коригування розладів кислотно-лужної рівноваги треба пам’ятати не лише про кров, а й про інші рідинні середовища організму. Концентрації буферних речовин в інших середовищах помітно відрізняються від значень, характерних для крові. Емпіричним способом з’ясовано, що введення кількості кислоти (в разі алкалозу) чи лугу (у випадку ацидозу), яка дорівнює добутку 50% маси тіла (кг) на надлишок основ (на 1 л), цілком достатньо для повного коригування кислотно-лужного стану організму. Якщо ж є глибокі розлади кислотно-лужної рівноваги, то небезпечно домагатись швидкого й одноразового їх коригування. Тоді доцільніше ввести половину належної кількості кислоти чи лугу та знову через деякий час визначити стан кислотно-лужної рівноваги і буферних систем. Після цього треба розрахувати кількість кислоти чи лугу, необхідну для остаточного коригування. Важливо також зазначити, що в разі ацидозу, спричиненого надлишком лактату, NaHCO3 має властивість зменшувати хвилинний об’єм та
знижувати артеріальний тиск, отже, його треба застосовувати обережно.
Таблиця 39-3. Концентрація НСO3-, pH та РСO2 плазми крові для різних типових розладів кислотно-лужної рівноваги1
Стан |
Показники |
Причини |
||
pH |
HCO3-, мекв/л |
РCO2, мм рт. ст. |
||
НОРМА |
7,40 |
24,1 |
40 |
Приймання NH4Cl |
Метаболічний ацидоз |
7,28 |
18,1 |
40 |
Діабетичний ацидоз |
6,96 |
5,0 |
23 |
Приймання NaHCO3 |
|
Метаболічний алкалоз |
7,50 |
30,1 |
40 |
Тривале блювання |
7,56 |
49,8 |
58 |
Дихальний ацидоз |
|
Дихальний ацидоз |
7,34 |
25,0 |
48 |
Вдихання 7% СO2 |
7,34 |
33,5 |
64 |
Емфізема легень |
|
Дихальний алкалоз |
7,53 |
22,0 |
27 |
Гіпервентиляція |
7,48 |
18,7 |
26 |
Перебування упродовж трьох тижнів на висоті 4000 м над рівнем моря |
|
1 У разі діабетичного кетоацидозу і тривалого блювання виникає дихальна компенсація первинного метаболічного ацидозу та алкалозу, і РСO2 відхиляється від нормального значення (40 мм рт. ст.). У випадку емфіземи легень і перебування на великій висоті виникає ниркова компенсація первинного дихального ацидозу та алкалозу, і тому відхилення концентрації НСO3- у плазмі крові є більшим, ніж без ниркової компенсації.
Співвідношення між метаболізмом калію та кислотно-лужною рівновагою
Концентрації К+ та Н+ у спинномозковій рідині збігаються, частково тому, що К+ впливає на екскрецію H+ нирками (див. Розділ 38). Внаслідок цього за метаболічного алкалозу практично завжди наявна гіпокаліємія. Дефіцит K+ призводить до внутрішньоклітинного ацидозу, сприяючи виділенню йонів Н+ із сечею. Згодом Н+ виходить з організму та посилюється реабсорбція НСO3-, що призводить до виникнення алкалозу позаклітинної рідини. Натомість, надлишок К+ призводить до посилення його секреції клітинами ниркових канальців.