Фізіологія людини - Вільям Ф. Ґанонґ 2002
Вступ
Загальні засади та клітинні основи фізіології людини
Транспортування через клітинну мембрану
Транспортування через клітинні мембрани відбувається передусім за допомогою екзоцитозу, ендоцитозу, руху через йонні канали та первинного і вторинного активного транспортування.
Екзоцитоз
Білки, що їх секретують клітини, рухаються з ендоплазматичної сітки до апарату Ґольджі, а з транс-боку Ґольджі відбувається їхнє виштовхування в секреторні гранули чи пухирці (див. рис. 1-24). Ці гранули та пухирці рухаються до клітинної мембрани, з якою потім зливаються їхні мембрани (рис. 1-25), а ділянка злиття руйнується. Унаслідок цього вміст гранул чи пухирців опиняється за межами клітини, клітинна ж мембрана залишається неушкодженою. Процес виштовхування поза межі клітини називають екзоцитозом. Він потребує Са2 та енергії, а також акцепторних білків (див. нижче, а також Розділ 4).
Зазначимо, що є два шляхи секреції з клітини (див. рис. 1-24). У разі неконститутивного шляху білки з апарату Ґольджі потрапляють у секреторні гранули, де перед екзоцитозом відбувається процесинг прогормонів у зрілі гормони. Інший шлях - конститутивний - спричиняє швидке транспортування білків до клітинної мембрани в пухирцях з незначним процесингом чи накопичуванням або без цього. Неконститутивний шлях інколи називають регульованим шляхом, однак цей термін неправильний, оскільки виділення білків конститутивним шляхом також регульоване.
Ендоцитоз
Процес ендоцитозу протилежний до екзоцитозу. Він буває різних типів. Фагоцитоз («поїдання клітини») - це процес, під час якого бактерії, мертву тканину чи інші частки матерії, видимі під мікроскопом, поглинають клітини, наприклад, поліморфоядерні лейкоцити крові. Матеріал контактує з клітинною мембраною, яка інвагінує. Далі інвагінація відщеплюється, внаслідок чого поглинутий матеріал опиняється в оточеній мембраною вакуолі, а клітинна мембрана не ушкоджена. Піноцитоз («випивання клітини») подібний до фагоцитозу, з тою лише різницею, що поглинуті частки перебувають у розчині і тому не видимі під мікроскопом.
Кожен з типів ендоцитозу може бути конститутивним або клатрин-опосередкованим. Конститутивний ендоцитоз є неспеціалізованим процесом, тоді як клатрин-опосередкований ендоцитоз відбувається майже повністю через покриті клатрином заглиблення на клітинній мембрані. Молекули клатрину мають форму трилисника з трьома ніжками, що подібно до променів відходять від центральної втулки (рис. 1-26). У разі прогресування ендоцитозу молекули клатрину утворюють геометричну множину, яка оточує ендоплазматичний пухирець. У шийці пухирця міститься білок динамін (гуанозинтрифосфатаза), який безпосередньо або опосередковано проколює пухирець (тому цей білок називають пінказа (від англ. pinch - ущипнути)). Як тільки пухирець повністю сформовано, клатрин відпадає, і триніжкові білки внаслідок рециклінгу залучаються до утворення інших пухирців, які надалі розчиняються і передають свій вміст ранній ендосомі (див. рис. 1-24). З ранньої ендосоми новий пухирець відбруньковується і повертається назад до клітинної мембрани (див. рис. 4-5). Альтернативно, рання ендосома може ставати пізньою ендосомою. Пізні ендосоми зливаються з лізосомами (див. рис. 1 -24), а їхній вміст розчиняють лізосомні ензими.
Клатрин-опосередкований ендоцитоз може відбуватися швидше, ніж конститутивний, і специфічніше в тому сенсі, що молекули, які стимулювали його, сконцентровані на своїх рецепторах у покритих заглибленнях і, відповідно, покритих пухирцях. Такий ендоцитоз відповідає за інтерналізацію багатьох рецепторів, з якими зв’язуються ліганди, наприклад, фактор росту нервів - ліпопротеїни низької щільності - важливі елементи клітинного метаболізму холестерину (див. Розділ 17). Він також відіграє важливу роль у функціонуванні синапсів (див. Розділ 4).
Клітинна мембрана містить маленькі ямки кавеолі, покриті білком кавеоліном, а не клатрином. У них є сайти для ендоцитозу, що сприяють поглинанню різних вітамінів і пептидів.
Зрозуміло, що внаслідок екзоцитозу збільшується загальний вміст мембрани, яка оточує клітини. Однак під час ендоцитозу вміст мембрани зменшується. Отже, пара процесів екзоцитоз-ендоцитоз підтримує поверхню клітини в межах її нормального розміру.
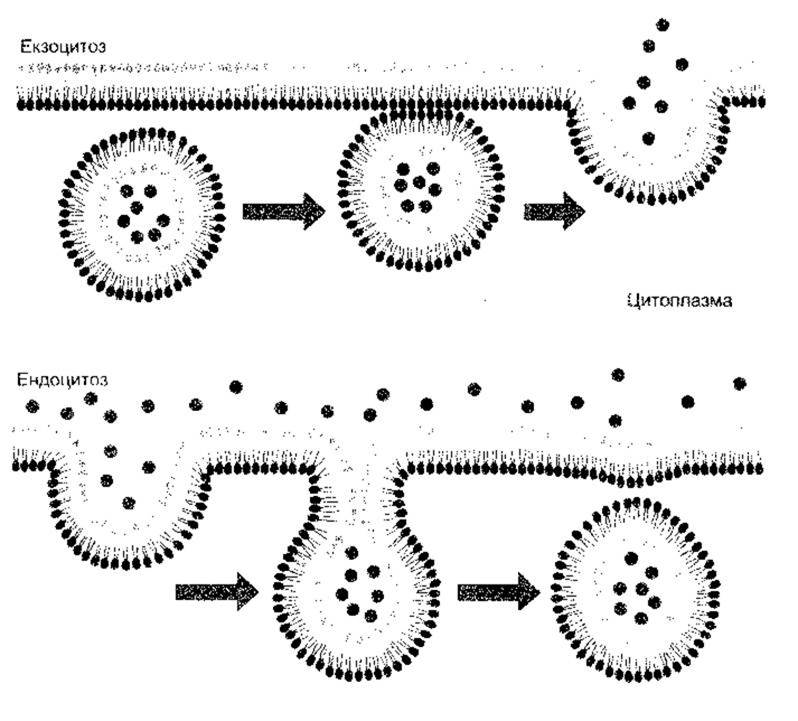
Рис. 1-25. Екзоцитоз та ендоцитоз. Зверніть увагу на те, що в разі екзоцитозу зливаються цитоплазматичні частини двох мембран, тоді як у разі ендоцитозу - дві нецитоплазматичні частини (відтворено за дозволом з Alberts В et al. Molecular Biology of the Ctll, 2nd ed. Garland, 1989).
Механізми, задіяні в транспортуванні пухирців
Значного прогресу досягнуто в аналізі біохімічної основи утворення пухирців, їхнього транспортування та акцептування в клітинах. Транспортування в межах клітини доречно аналізувати поряд з екзо- та ендоцитозом, оскільки тут задіяні дуже подібні механізми.
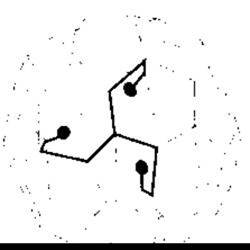
Рис. 1-26. Молекула клатрину на поверхні ендоцитозного пухирця Зверніть увагу на характерну форму трилисника клатрину і факт утворення підтримувальної сітки для пухирця, спільної з іншими молекулами
Уже відомо, що всі пухирці, які беруть участь у транспортуванні, мають білкові оболонки. Розрізняють чотири оболонки: АР-1 клатрин, АР-2 клатрин, СОРІ та СОРІІ. Пухирці, що транспортують білки з транс-боків апарату Ґольджі до лізосом, мають АР-1 клатрин оболонки, а ендоцитозні, що транспортують білки в ендосоми, - АР-2 клатрин. Пухирці, які забезпечують транспортування між ендоплазматичною сіткою та апаратом Ґольджі, мають СОРІ та СОРІІ оболонки. Певні амінокислотні послідовності чи приєднані групи на транспортованих білках спрямовують їх у відповідні місця розташування. Наприклад, амінокислотна послідовність Asn-Pro-будь-яка амінокислота-Tyr спрямовує транспортування з поверхні клітини до ендосом, а прикріплені маноза-6-фосфат групи - з апарату Ґольджі до ендосом. Пухирці дифундують у клітини на невелику відстань і рухаються по мікротрубочках на довгі відстані. Як тільки пухирець досягає мішені, він акцептується, коли V-пастка білків пухирця утворює замок з Т-пасткою білків на мішені. Кожна мішень має унікальний набір Т-пасток білків, що гарантує акцептування лише пухирця з відповідним набором V-пасток білків. Білки-мішені та білки-акцептори детальніше описані в Розділі 4 в контексті синаптичної трансмісії.
З різноманітними типами пухирців пов’язані різноманітні малі ГТФ (гуанозин 5'-трифосфат)-зв’язувальні білки Rab родини (див. нижче).
Поширення йонів та інших речовин через клітинну мембрану
Від специфічних властивостей клітинних мембран залежать відмінності у складі внутрішньоклітинної та інтерстиційної рідини. Специфічні вмісти для однієї тканини ссавця наведено в табл. 1-2. Середні вмісти для людей зображено на рис. 1 -27, а вміст Na та К в різних частинах тіла є в табл. 1-6.
Проникність мембрани та мембранне транспортування білків
Клітинна мембрана практично непроникна для внутрішньоклітинних білків та інших органічних аніонів, що становлять більшість усіх внутрішньоклітинних аніонів. Як звичайно, ці аніони позначають символом А. У разі аналізування проникності мембрани для менших молекул важливо чітко розмежувати власне ліпідний бішар та різноманітні численні транспортні білки, які містяться у ньому. Транспортні білки є трансмембранними, що вибірково сприяють руху кількох, а часто й однієї речовини через мембрану. Ліпідний шар проникний головно для води. Його проникність для інших речовин залежить від їхнього розміру (табл. 1 -7), розчинності та заряду. Такі неполярні, тобто гідрофобні молекули, як О2, та N2, розчиняються в бішарі та легко його проходять. Малі незаряджені полярні (гідрофільні) молекули, наприклад СО2, теж швидко дифундують через ліпідні бішари, водночас дифузія великих незаряджених полярних молекул, зокрема глюкози та заряджених частинок, тобто йонів, надзвичайно повільна. Однак йони, глюкоза, сечовина, а також багато інших малих молекул invivo використовують транспортні білки для проходження через клітинну мембрану, дифузію ж води підсилюють водні канали.
Значно розширює наші знання про транспортні білки техніка петч клемп (прилипання до шматочка плазматичної мембрани). За цією технологією кінець мікропіпетки розміщують на мембрані клітини так, щоб був тісний контакт. Шматочок мембрани під кінчиком піпетки містить лише кілька транспортних білків, які піддають детальному вивченню (рис. 1-28). Є декілька варіантів цієї техніки: клітину можна залишити неушкодженою (прикріплений до клітини захоплений шматочок); шматочок можна відірвати від клітини й отримати відірваний шматочок; можна втягнути шматочок мікропіпеткою, яка прикріплена до решти клітинної мембрани, забезпечивши прямий доступ до вмісту клітини (повне записування клітини).
Деякі транспортні білки є простими водянистими йонними каналами. Окремі з них постійно відкриті, тоді як інші мають ворота, які відкриваються і закриваються. Деколи стан воріт залежить від змін мембранного потенціалу (потенціалозалежні ворота), інші можуть відкриватися і закриватися, коли зв’язуються з лігандом (канал, що відкривається/закривається лігандом). Часто ліганд є зовнішнім (наприклад, нейротрансмітер чи гормон). Однак він може бути і внутрішнім. Зокрема, внутрішньоклітинний Са2+, цАМФ чи один з G-білків, продукованих у клітинах (див. нижче), можуть зв’язуватися безпосередньо з каналами й активувати їх. Деякі канали відкриваються внаслідок механічного розтягування. Типовим потенціалозалежним є Nа+- канал (див. нижче), а типовим каналом, що пов’язаний з реакцією лігандів, - рецептор ацетилхоліну (див. Розділ 4).
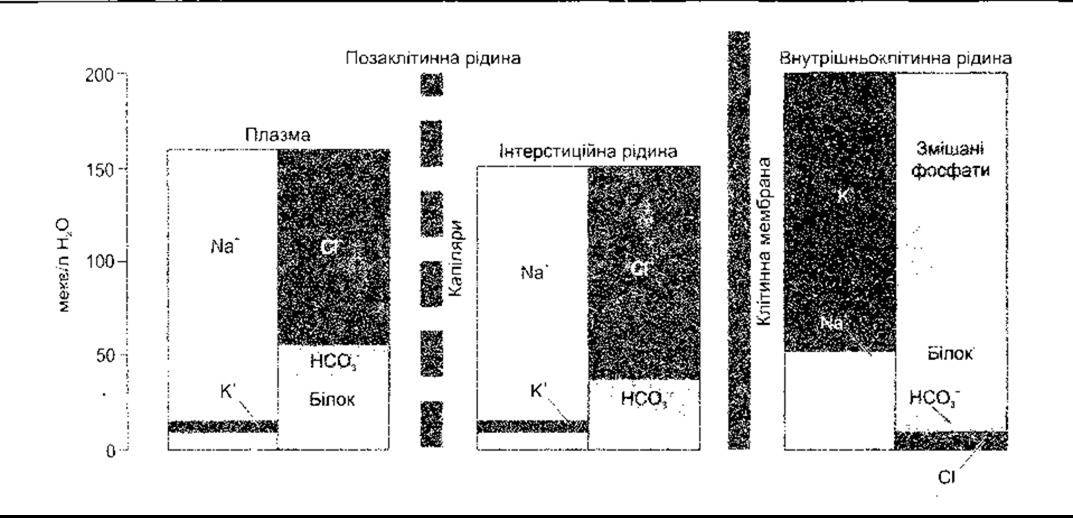
Рис. 1-27. Електролітичний склад рідин організму людини. Зверніть увагу на те, що величини виражені в мекв/л води, а не рідини організму (відтворено за дозволом з Jonson LR [editor] Essential Medical Physiology. Raven Press, 1992).
Таблиця 1-6. Розподіл натрію та калію в організмі людини
Компонент |
Вміст, % |
|
Na+ |
К+ |
|
Повністю внутрішньоклітинний |
9,0 |
89,6 |
Повністю позаклітинний |
91,0 |
10,4 |
Плазма |
11,2 |
0,4 |
Інтерстиційна рідина |
29,0 |
1,0 |
Щільна сполучна тканина та хрящ |
11,7 |
0,4 |
Кістка |
36,51 |
7,6 |
Міжклітинне розташування |
2,6 |
1,0 |
1 З них 11,0 можуть обмінюватися, а 25,5 - ні.
Інші транспортні білки - це носії, що зв’язують йони та інші молекули, а потім змінюють конфігурацію, переміщаючи зв’язану молекулу від одного боку клітинної мембрани до іншого. Молекули рухаються з ділянок високої концентрації в ділянки низької (в напрямі зниження їхнього хімічного градієнта), катіони - до негативно заряджених ділянок, а аніони - до позитивно заряджених (у напрямі зниження їхнього електричного градієнта). Процес переміщення білками-носіями речовин у напрямі їхнього хімічного чи електричного градієнтів не передбачає використання енергії. Його називають полегшеною дифузією. Типовим прикладом такого процесу є транспортування глюкози глюкозотранспортером, який переміщає її в напрямі зниження концентраційного градієнта з ПКР до цитоплазми клітини (див. Розділ 19). Інші носії транспортують речовини в напрямі, протилежному до їхніх електричного та хімічного градієнтів. Ця форма транспортування потребує енергії і називається активним транспортуванням. У тваринних клітинах енергія в переважній більшості забезпечена гідролізом АТФ (див. вище, а також Розділ 17).
Таблиця 1-7. Розмір гідратованих йонів та інших біологічно важливих речовин1
Речовина |
Атомна чи молекулярна маса |
Радіус, нм |
Cl- |
35 |
0,12 |
К+ |
39 |
0,12 |
Н2O |
18 |
0,12 |
Са2+ |
40 |
0,15 |
Na+ |
23 |
0,18 |
Сечовина |
60 |
0,23 |
Li+ |
7 |
0,24 |
Глюкоза |
180 |
0,38 |
Цукроза |
342 |
0,48 |
Інулін |
5 000 |
0,75 |
Альбумін |
69 000 |
7,50 |
1 Дані взято з Moore EW: Physiology of Intestinal Water and Electrolyte Absorption, American Gastroenterological Association, 1976.
Отже, не дивно, що молекулами-носіями є АТФ-ази - ензими, які каталізують гідроліз АТФ. Одна з цих АТФ-аз-натрій-калій-активована аденозинтрифосфатаза
(Na+-K+ -АТФ-аза), відома ще як Na+-K+-пoмпa. Є також Н+ - К+-АТФ-ази в слизовій оболонці шлунка (див. Розділ 26) та ниркових канальцях (див. Розділ 38). Зокрема, V-АТФ-ази - це протон-АТФ-ази, що підкиснюють багато внутрішньоклітинних органел, у тому числі частини апарату Ґольджі та лізосоми; F-АТФ-ази наявні в мітохондріях та синтезують АТФ з АДФ. Деякі мембрани містять АТФ- ази, що транспортують Са2+.
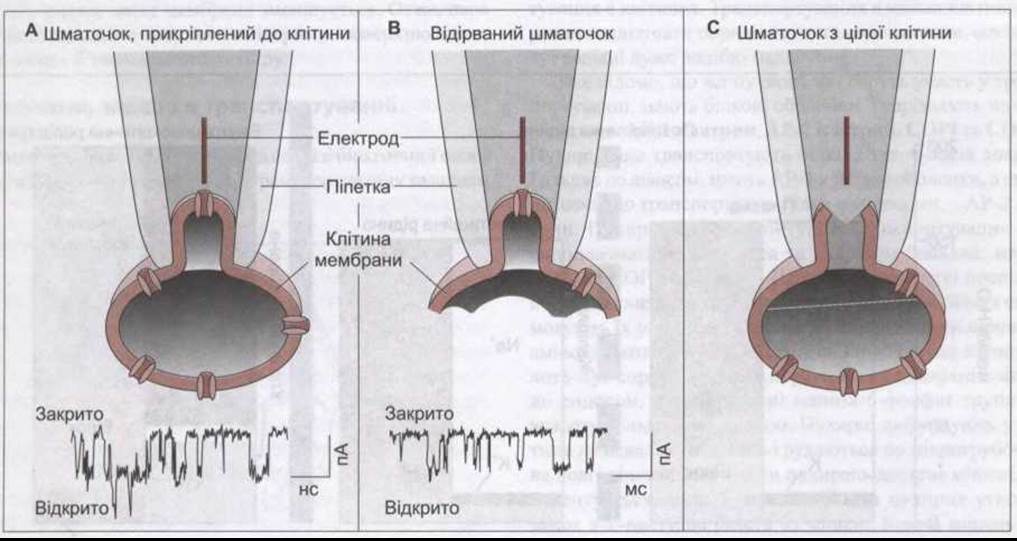
Рис. 1-28. Типи захоплених шматочків, які використовують для вивчення активності йонних каналів через клітинну мембрану. На А та В також зображено зміни в мембрані за певний час (модифіковано з Ackerman MJ, Clapman DE: Ion channals: Basic science and clinical desease. N Engl J Med 1997;336:1575).
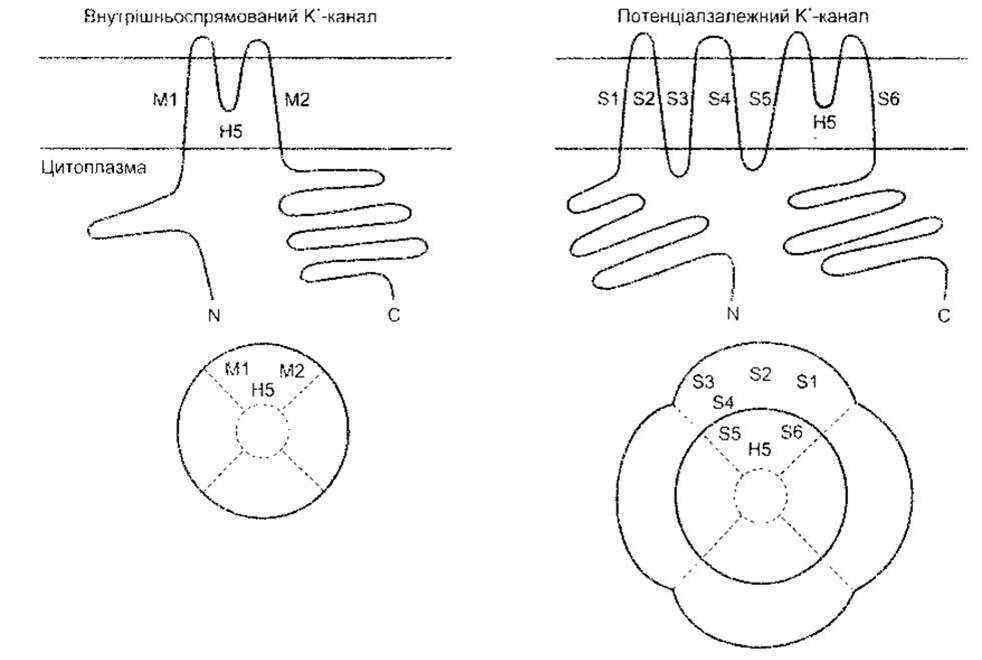
Рис. 1-29. Дві родини К+ каналів Ліворуч: спрямований внутрішньо ректифікаційний К+ канал. Угорі: зв’язок з клітинними мембранами Унизу: утворення водянистої пори чотирма субодиницями. Праворуч: потенціалозалежні «ворота» (відтворено за дозволом з Kubo Y et al: Primary structure and functional expression of a mause inward rectifier potassium channel Nature 1993;362 127)
Деякі транспортні білки називають уніпортами, тому що вони транспортують лише одну речовину. Інші називають сим портами, оскільки цей спосіб транспортування передбачає зв’язування з транспортним білком більше ніж однієї речовини, які разом транспортуються через мембрану. Прикладом є симпорт у слизовій оболонці кишки, що відповідає за спільне транспортування у разі полегшеної дифузії Na та глюкози з кишкового просвіту в клітини слизової оболонки (див. Розділ 25). Інші транспортери називають антипортами, оскільки вони замінюють одні речовини іншими. Типовим антипортом є згадана вище Na+ -K+ -АТФ-аза: па кожні три Na+, які вона переміщує з клітини, припадають два К+, які вона переносить у клітину.
Йонні канали
Відомо йонні канали для К+, Na+, Ca2+ та Сl. Кожен з них має численні форми з різноманітними властивостями. Першими, можливо, розвинулися внутрішньоспрямовані ректифікаційні K+-канали, названі так тому, що вони сприяють надходженню К+, майже не впливаючи на їхній відтік. Ці канали не містять потенціалозалежних воріт, і кожен складається з чотирьох субодиниць, що мають два трансмембранні домени (М1 та М2; рис. 1-29). Ці субодиниці оточують водянисту пору. Інша родина К+-рецепторів, ймовірно, розвинулася пізніше і має чотири додаткові трансмембранні домени в зовнішній оболонці. Вони містять потенціалозалежні ворота й амінозакінчення їхніх субодиниць мають форму м’яча і ланцюга. Після активації відбувається розхитування м’яча, який, потрапляючи в пору, спричинює швидку інактивацію каналу, незважаючи на деполяризацію, що ще триває. Після деполяризації конформаційні зміни каналу набувають нормального стану під час спокою (рис. 1-30).
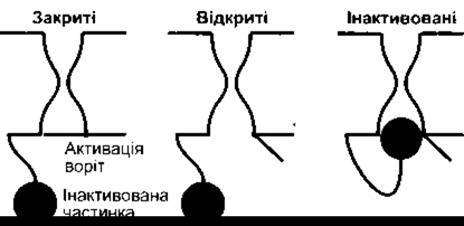
Рис. 1-30. Швидка інактивація потенціалозалежних воріт К+- каналів. Деполяризація відкриває активовані ворота, а пізніше амінозакінчення субодиниць коливається у напрямі до каналу, зупиняючи провідність і незважаючи на деполяризацію, що триває Після реполяризаціі мембрани зміни конформації білка відновлюються так, як у стані спокою (відтворено за дозволом з Antz С, Fakler В: Fast inactivation of voltage-gated K+ channels from cartoon to ctructure News Physiol Sсi 1998; 13:177)
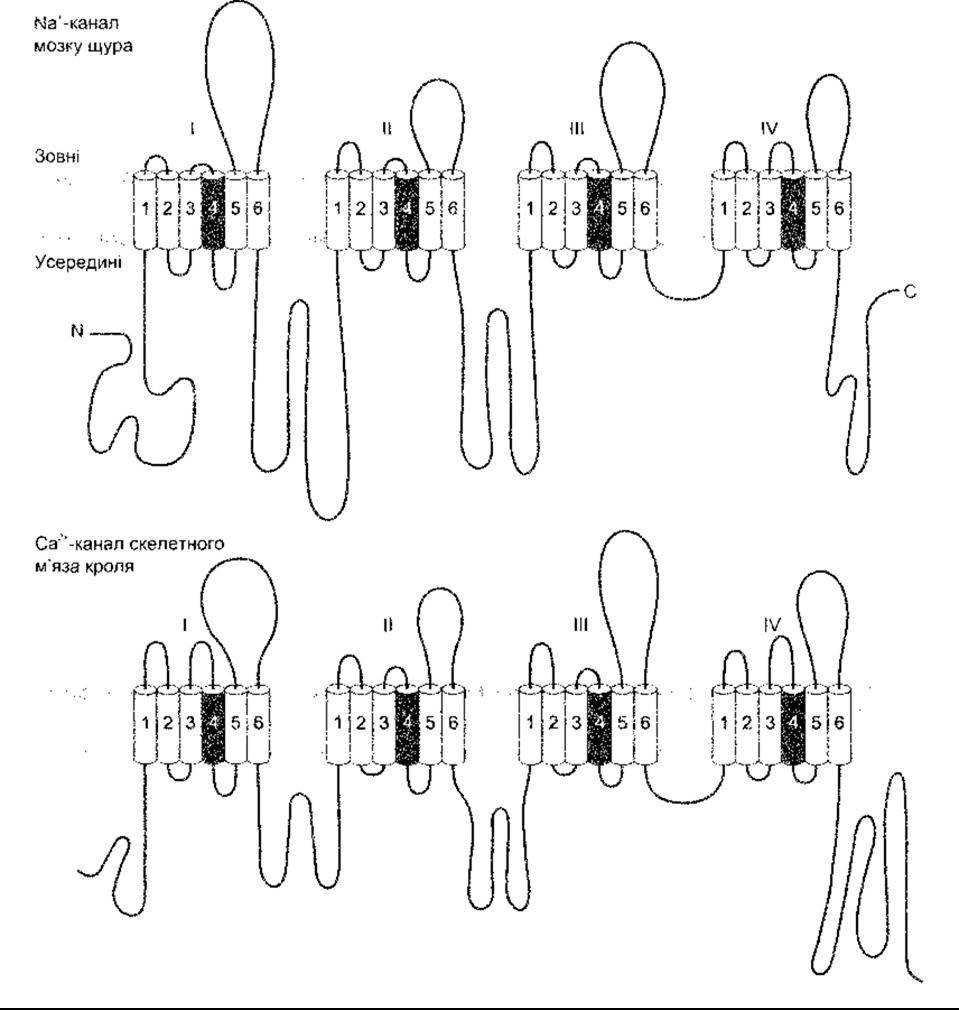
Рис. 1-31. Схематичне зображення будови головних субодиниць двох йонних каналів. Деякі Na+- та Са2+-канали мають додаткові субодиниці Арабськими цифрами позначено а-спіральні домени, що перетинають клітинну мембрану. Домен Н5 не зображений (за Catteral WK. Модифіковано і відтворено з Hall ZW: An Introduction to Molecular Neurology. Sinauer, 1992).
У ссавців описано понад 40 різноманітних К+-каналів. Усі вони тетрамери і кожен тип субодиниці кодований іншим геном.
Канали Ca2+ та потенціалозалежні Na+-вopoтa також складаються з чотирьох груп, кожна з яких має шість трансмембранних доменів, що оточують водянисту пору діаметром понад 0,5 нм. Однак від К+ -каналів вони відрізняються тим, що кожен є продуктом єдиного гена зі сшивальними пептидними ланцюгами, що з’єднують групи (рис. 1-31). Описано понад 30 різноманітних потенціалозалежних воріт чи циклічних нуклеотидних воріт Na+- та Са2 -каналів. Деякі з них мають нетранспортувальні одиниці, пов’язані з ними in vivo. Токсини тетрадоксин (ТТХ - від англ. tetradoxin) та сакситоксин (STX - від англ. saxitoxin) зв’язуються з Na+ - каналами та блокують їх. Кількість та поширення Na+ - каналів можна визначати, приєднуючи до них ТТХ чи STX, що мають відповідну мітку, та аналізуючи поширення мітки.
Родину епітеліальних Na+- каналів, що мають іншу структуру, виявлено в апікальних мембранах клітин епітелію нирок, товстої кишки, легень та мозку. Кожен натрієвий канал епітеліальних клітин (NaKE) складається з трьох субодиниць, кодованих трьома різними генами. Кожна субодиниця, ймовірно, двічі охоплює мембрану, а кінцева аміногрупа та кінцева карбоксильна група розташовані всередині клітини; а-субодиниця транспортує Na+, тоді як ß- та у-субодиниці цього не роблять. Точної стехіометрії NaKE не визначено, отже in vivo в рецепторах може бути більше ніж одна з трьох субодиниць. Такі канали інгібовані амілодіуретиком ридином, що зв’язується з а-субодиницею. Часто їх називають амілоридин-інгібованими Na+ - каналами. У нирці вони відіграють важливу роль, регулюючи об’єм IIKP за допомогою альдостерону (див. Розділ 38). Піддослідні миші, у яких не функціонують NaKE, народжуються живими, однак швидко вмирають, оскільки їхній організм не здатний випомпувати Na+, а отже, - воду з легень.
Є також багато Сl - каналів, значно задіяних у регулюванні об’єму клітин, трансепітеліальному йонному транспортуванні та, очевидно, в регулюванні функції м’язів і нирок. Наприклад, ГАМК-рецептор та гліцин-рецептор є Сl - каналами (див. Розділ 4). У значних кількостях Сl - канали містяться в скелетному м’язі. Нормальна функція цих м’язових каналів невідома, однак мутації в гені, що їх кодує, спричинюють вроджену міотонію, хворобу, що супроводжується гіперзбудливістю м’язів.
Nа+-К+-АТФ-аза
Як зазначено вище, Na+-K+-АТФ-аза каталізує гідроліз АТФ до АДФ, використовуючи енергію для виштовхування трьох Na+ з клітини та поглинання двох К+ у клітину на кожен моль гідролгюваного АТФ. Відповідно, потенціалозалежна помпа має коефіцієнт зв’язування 3:2, оскільки переміщує три позитивні заряди з клітини на кожні два в клітину. Такі помпи є в усіх частинах тіла. їхню діяльність інгібують уабаїн і подібні глікозиди наперстянки, які використовують для лікування серцевої недостатності. Це гетеродимер, який складається з а-субодиниці, що має молекулярну масу приблизно 100 000, та ß-субодиниці, що має молекулярну масу приблизно 55 000. Обидві проходять через клітинну мембрану (рис. 1 -32). Роз’єднання субодиниць зумовлює припинення активності. Однак ß-субодиниця є глікопротеїном, годі як Na+ - та К+-транспортування відбувається через а-субодиницю. Субодиниця ß має єдиний трансмембранний домен та три позаклітинні ділянки глікозилювання, у кожному з яких є прикріплені вуглеводневі залишки. Ці залишки становлять одну третину її молекулярної маси. Субодиниця а охоплює мембрану десять разів NH2 тa COOH кінцями, які розташовані всередині клітини. Вона має внутрішньоклітинний Na+-тa АТФ-зв’язувальні ділянки, ділянку фосфорилювання, а також позаклітинну ділянку зв’язування для К+ та уабаїну. Коли Na+ зв’язується з а-субодиницею, АТФ також зв’язується і перетворюється в АДФ, а фосфат перетворюється на Asp 376 ділянку фосфорилювання. Це спричиняє зміну в конфігурації білка, виштовхуючи Na+ у ПКР. Далі позаклітинно зв’язується К+, фосфорилюючи а-субодиницю, що набуває своєї попередньої конфігурації, вивільнюючи К у цитоплазму. Зазначимо, що а- та ß-субодиниці гетерогенні і мають а1, а2, та a3, а також ß1, ß2, і ß3 субодиниці; а1-ізоформа міститься в мембранах більшості клітин, тоді як а2 є в м’язах, серці, жировій тканині та в мозку, а а2 - у серці та мозку. Субодиниця ß, поширена, однак її нема в певних астроцитах, вестибулярних клітинах внутрішнього вуха та гліколітичних м’язах, здатних до швидких скорочень; ці м’язи містять тільки ß2-cyбoдиницю. Різноманітні структури а- та ß-субодиниць Na+ -К+ -АТФ-ази в різноманітних тканинах, очевидно відображають спеціалізацію специфічних функцій тканини.
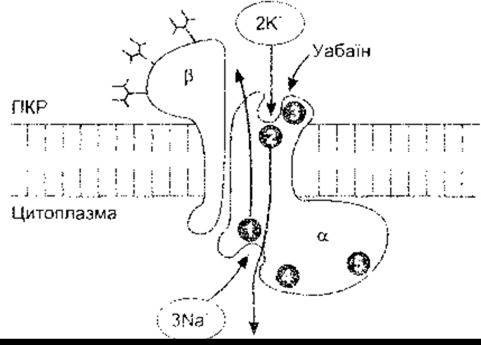
Рис. 1-32. Nа+-К+-АТФ-аза Внутрішньоклітинна частина ß-субодиниці має Nа+-зв’язувальний сайт (1), сайт фосфорилювання (4) та АТФ-зв’язувальний сайт (5). Позаклітинна частина має К+- (2) та уабаінзв’язувальні сайти (3) (з Horisberger J-D et al. Structure-function relationship of Na-K-ATPase Annu Rev Physiol 1991;53:565. Відтворено за дозволом з Annual Review of Physiology, vol. 53. Annual Reviews, 1991).
Регулювання Nа+-К+-АТФ-ази
Звичайно, кількість Na+, насиченого в клітину, не є стабільною. Наприклад, якщо вона збільшується, то посилюється активність помпи і, відповідно, збільшується кількість Na+, що виштовхується з клітини. На активність помпи впливають вторинні месенджери, продуковані в клітинах, зокрема, цАМФ, діацилгліцерол (ДАГ) та похідні арахідонової кислоти (див. нижче). Розмір та напрям таких впливів змінюються відповідно до експериментальних умов. Гормони щитоподібної залози підвищують активність помпи геномною дією, прискорюючи утворення молекул Na+ -K+ -АТФ-ази. Альдостерон також збільшує кількість помп, хоча цей вплив є вторинним (див. Розділ 20 і 38). Дофамін у нирці гальмує помпу, фосфорилюючи її і спричинюючи натрійурез. Інсулін підвищує активність помпи за допомогою різноманітних механізмів. Нарешті, Na+ -К+ - АТФ-аза зв’язана в мембрані цитоскелетоном, і, що цікаво, G-актин (див. вище) також підвищує активність помпи.
Вторинне активне транспортування
У багатьох випадках активне транспортування Na+ пов’язане з транспортуванням інших речовин (вторинне активне транспортування). Наприклад, люмінальні мембрани клітин слизової оболонки тонкої кишки містять симпорт, що транспортує глюкозу в клітину тільки тоді, коли Na+ одночасно приєднується до білка і транспортується в напрямі зменшення його електрохімічного градієнта.
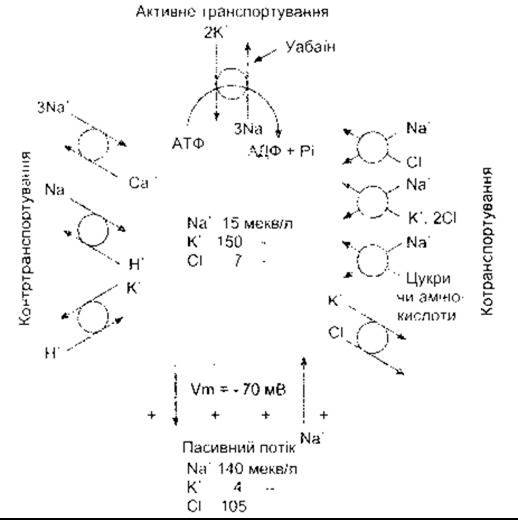
Рис. 1-33. Складена схема головних вторинних ефектів активного транспортування Na+ та К+; Na+-К+-АТФ-аза конвертує хімічну енергію гідролізу АТФ на підтримку спрямованого внутрішньо ґрадієнта для Na+ та зовнішньо спрямованого для К Енергія ґрадієнтів використовується для контртранспортування, котранспортування та підтримки мембранного потенціалу (відтворено за дозволом з Skou JC' The Na-K pump. News Physiol Sci 1992;7 95)
Електрохімічний градієнт Na+ підтримується активним транспортуванням Na+ з клітин слизової оболонки в ПКР (див. Розділ 25). Інші приклади зображено на рис. 1-33. У серці Na+ -К+ -АТФ-аза непрямо впливає на транспортування Са2. Антипорт у мембранах клітин серцевого м’яза в нормальному стані виконує обмін внутрішньоклітинного Са2, на позаклітинний Na'. Коефіцієнт цього обміну пропорційний до концентраційного ґрадієнта Na+ через клітинну мембрану. Якщо діяльність Na+ -К+ -АТФ-ази інгібована (наприклад уабаїном), то внутрішньоклітинна концентрація Na збільшується, градієнт Na+ через клітинну мембрану зменшується, а виштовхування Са2 послаблюється. Унаслідок цього збільшення внутрішньоклітинного Са2+ поліпшує скорочення серцевого м’яза (позитивний інотропний ефект; див. Розділ 3).
Активне транспортування Na+ та К+ є одним з головних енергозатрати их процесів у тілі організму людини. В середньому він потребує близько 24% енергії, виробленої клітинами, а в нейронах - 70%. Отже, він відповідає за значну частину основного метаболізму.