ОСНОВЫ МИКРОБИОЛОГИИ - В. М. Самыгин - 2015
ГЛАВА 10. ОСНОВНЫЕ ПРИНЦИПЫ ВЫРАЩИВАНИЯ БАКТЕРИЙ
Выращивание (культивирование) микроорганизмов необходимо для получения биомассы или различных метаболитов (продуктов обмена веществ) микробной клетки. Выращивание микробов в лабораторных условиях производят на искусственных питательных средах, в культурах тканей и в организме экспериментальных животных. Культуральные признаки микроорганизмов определяют по характеру роста на питательных средах. Эти признаки имеют важное диагностическое значение и являются постоянными для каждого вида микроорганизмов.
На плотных питательных средах при посеве большого количества микробных клеток наблюдается сплошной рост в виде «газонной» культуры микроорганизмов. При посеве ограниченного числа клеток образуются различные по форме и величине колонии, которые представляют собой видимые скопления особей одного вида микроорганизмов, формирующиеся в результате размножения одной клетки. Колонии бывают плоскими, выпуклыми, куполообразными, вдавленными, поверхность их - гладкой (S-формы), шероховатой (R-формы), исчерченной, бугристой, края - ровными, зазубренными, волокнистыми, бахромчатыми. Форма колоний разнообразна: круглая, розеткообразная, звездчатая, древовидная. По величине колонии бывают крупные (4-5 мм в диаметре), средние (2-4 мм), мелкие (1-2 мм) и карликовые (менее 1 мм). Колонии отличаются по консистенции, плотности, цвету. Они бывают прозрачными и непрозрачными, окрашенными и бесцветными, влажными, сухими и слизистыми (рис. 10 и 11).
Рис. 10. Основные типы колоний микроорганизмов
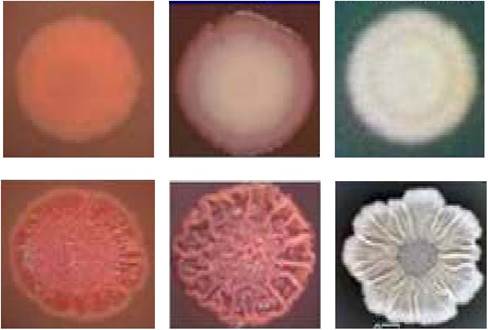
Рис. 11. Морфологическое и структурное разнообразие колоний: 1 - формы выпуклости колоний над поверхностью питательной среды: 2 - очертания колоний: 3 - характер края колоний: 4 - внутренняя структура колоний

В жидких питательных средах микробы растут с образованием диффузной мути, пленки, осадка, видимых невооруженным глазом. Иногда наблюдается пристеночный рост бактерий.
В лабораторных условиях бактерии выращивают в пробирках, чашках Петри, флаконах, бактериологических матрицах. В производственных условиях культивирование микроорганизмов осуществляют в различных ферментерах (ферментаторах, биореакторах) по специально разработанной технологии.
При оценке эффективности роста обычно измеряют биомассу или число микробных клеток. Прямой способ измерения клеточной массы - это определение веса сухого вещества клеток, содержащихся в определенном объеме культуры, путем отделения их от среды, высушивания и последующего взвешивания. Однако с помощью обычных весов трудно точно определить массу менее 1 мг, а такое количество сухого вещества может содержать до 5 млрд бактерий.
Более удобным методом определения массы одноклеточных микроорганизмов является оптический метод - измерение количества света, рассеянного суспензией клеток. Он основан на том, что рассеяние света мелкими частицами в определенных пределах пропорционально их концентрации, и доля пропущенного света служит мерой оптической плотности суспензии. Измерения проводят с помощью спектрофотометра или фотоэлектроколориметра. Эти приборы показывают единицы оптической плотности, которая представляет собой логарифм отношения интенсивности света, падающего на суспензию, к интенсивности пропущенного света. Нижний предел чувствительности данного метода - около 10 млн клеток в 1 мл.
Для определения числа клеток можно использовать микроскопический метод на специальных предметных стеклах - счетных камерах, прямой подсчет клеток с помощью электронного прибора (счетчик Коултера) и др. Однако чаще подсчет общего количества клеток в суспензии проводят с помощью бактериального стандарта мутности, а также высевом микроорганизмов на плотную питательную среду в чашки Петри.
Стандарт мутности представляет собой взвешенные в дистиллированной воде частицы стекла диаметром от 0,5 до 3,5 мкм. Взвесь этого стекла при взбалтывании осадка соответствует определенной концентрации клеток. Стандарт состоит из запаянных пробирок-эталонов, эквивалентных по степени мутности 5 и 10 международным единицам мутности (5 • 108 и 109 кл/мл соответственно). К комплекту бактериальных эталонов прилагается шрифтовая таблица, содержащая набор различных шрифтов. Исследуемую культуральную взвесь помещают в стандартную пробирку, толщина стенок и цвет стекла которых соответствует пробиркам- эталонам. Разбавляя культуру измеренными количествами физиологического раствора, доводят мутность в исследуемой пробирке до эталонной и производят расчет исходной концентрации микробных клеток. Расчет производят либо по степени разведения культуры, либо на основе общего количества клеток в бактериальной суспензии.
Число одноклеточных микроорганизмов можно подсчитать также после высева на плотную питательную среду в чашки Петри, поскольку жизнеспособные клетки, пространственно отдаленные друг от друга на поверхности плотной среды, в процессе роста образуют отдельные колонии, видимые невооруженным глазом. Следовательно, приготовив соответствующие разведения бактериальной популяции и использовав их для засева среды, можно определить число жизнеспособных клеток в исходной суспензии путем подсчета числа вырастающих после инкубации колоний и умножения этой цифры на коэффициент разведения. Этот метод называют определением концентрации жизнеспособных клеток,так как он позволяет учесть только те микроорганизмы, которые могут расти на питательной среде. Определение числа жизнеспособных клеток, несомненно, является наиболее чувствительным методом количественного учета бактерий, так как он дает возможность зарегистрировать даже единичную жизнеспособную клетку в суспензии. Для установления доли жизнеспособных клеток в популяции можно использовать методы отдельного определения общего числа клеток (с помощью стандарта мутности) и числа жизнеспособных клеток.