БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
Розділ 15. БІОТЕХНОЛОГІЯ І ВАКЦИНИ МАЙБУТНЬОГО
Відомо, що імуногенність або здатність індукувати в організмі біосинтез антитіл визначається присутністю на поверхні білкової молекули так званих епітопів або антигенних детермінант. Вони утворені тільки 6-10-ма амінокислотними залишками (зазвичай гідрофільними амінокислотами), що мають найбільшу спорідненість з активним центром антитіла і оточені 5-10-ма амінокислотними залишками (зазвичай це гідрофобні амінокислоти). Епітопи у складі імуногенної білкової молекули, що знаходиться на поверхні вірусної частинки чи бактеріальної клітини, або у вигляді синтезованого тим чи іншим шляхом олігопептиду, пізнаються певними клонами специфічних лімфоцитів, які забезпечують надалі біосинтез антитіл проти даного набору антигенних детермінант (епітопу).
З цього погляду вакцина, що використовується в повсякденній практиці, — це малоконтрольована надкомплексна суміш з великою кількістю баластних, у тому числі високотоксичних забруднюючих компонентів з мікробних клітин, живильного середовища, з клітин, у яких вирощуються віруси. В ідеалі для створення імунітету необхідні один-два епітопи, що не містять забруднюючих баластних речовин, токсичних неконтрольованих домішок. А в організм при вакцинації вводяться сотні найскладніших комплексів, унаслідок чого виникають важкі поствакцинальні ускладнення, настає алергезація осіб, яким зроблено щеплення (Петров Р.В., Хаітов Р.М., 1986).
З огляду на вищевикладене цілком реальною є ідея оптимізації вакцини в напрямку усунення тих негативних наслідків, які супроводжують їхнє використання. Насамперед це високоефективні вакцини, за допомогою яких, незважаючи на властиві їм негативні моменти, вдалося перевести в розряд переможених низку інфекцій, що викликали колись спустошливі епідемії й епізоотії, які заподіювали населенню численні лихоліття.
Необхідність нетрадиційних підходів виникла особливо гостро при конструюванні нових вакцин, покликаних забезпечити ефективний захист від інфекцій, проти яких на сьогодні такого захисту немає. До категорії так званих непереможених інфекцій належать вірусні захворювання людини і тварин (гепатит А, гепатит В, грип, ящур, африканська чума свиней й інші заразні хвороби). У людини і тварин відсутній надійний захист від інфекційних захворювань кишечника, а також від стафілококів, стрептококів, пневмококів і паразитарних інфекцій, у тому числі малярії та інших.
Досягнення молекулярної біології і генетичної інженерії повинні бути використані для одержання насамперед противірусних вакцин.
В опублікованих протягом останнього часу роботах вітчизняні і закордонні дослідники у своїх спробах одержати антивірусні вакцини виходили насамперед з необхідності виділення з геному гена, що кодує у вірусній частинці поверхневий білок, який має антигенні властивості. Потім за участю ізольованого гена конструювали рекомбінантну молекулу ДНК, що після трансформації експресувалась у бактеріальній чи дріжджовій клітині. Передбачалося, що отриманий біотехнологічним шляхом і відповідним чином очищений капсидний білок з його антигенними властивостями може бути використаний як ефективний вакцинальний препарат субодиничного типу. Ген, що несе інформацію про білок поверхні вірусу грипу (поверхневий гемаглютинін), гепатиту в людини, поліомієліту й інших захворювань, удалося змусити експресуватись у прокаріотичній бактеріальній клітині чи в такому одноклітинному еукаріотичному організмі, як дріжджі. Залишалося очистити отриманий імуногенний білок і застосувати його як вакцинальний препарат.
Труднощі, що виникають на цьому етапі, як вважає Тихо- ненко Т.І. (1984), навряд чи можна подолати. Річ у тім, що паразитування багатьох вірусів у клітинах вищих еукаріотичних організмів передбачає використання ферментних систем останніх для здійснення функції відтворення вірусів, у тому числі формування капсидних вірусних білків. Однак ферментні системи, що забезпечують утворення функціонально активних молекул
РНК (процесинг) за допомогою посттранскрипційної модифікації первинної РНК, що полягає в елімінації полінуклеотидних фрагментів, які відповідають інтронам, і наступному лігіруванню фрагментів РНК, що несуть інформацію і відповідають екзонам (сплайсинг), а також посттрансляційні модифікації синтезованих білкових молекул у бактеріальних і дріжджових клітинах істотно відрізняються від тих умов, у яких відбувається відтворення вірусу при його паразитуванні в клітинах вищих еукаріот (людини і тварин насамперед). Так, у бактеріальній і дріжджовій клітинах, де експресуються гени, що кодують капсидні вірусні білки, відсутні необхідні умови для процесингу, не відбувається посттрансляційне протеолітичне розщеплення і глікозування білка вірусної оболонки, що перешкоджає формуванню такої третинної і четвертинної структури, яка утвориться при інфікуванні вірусом клітин вищих еукаріот.
Відхилення в конформації білкових молекул призводять до того, що амінокислотні залишки, з набору яких формується епітопна ділянка, екрануються іншими атомними групами. У тих випадках, коли антигенна детермінанта створюється відповідними конформаційними перебудовами за рахунок просторового зближення вилучених ділянок поліпептидного ланцюга при формуванні третинної структури або мономерних поліпептидів при утворенні надмолекулярної четвертинної структури, відповідні амінокислотні залишки взагалі не можуть бути зібрані у відповідну епітопну групу.
Незалежно від причин, що обумовили конформаційні відхилення, синтезований у бактеріальній чи дріжджовій клітині білок позбавлений головної властивості — він неімуногенний. Синтезований за допомогою технології рекомбінантних ДНК у дріжджовій клітині HBS-антиген вірусу гепатиту В мав 50 % імуногенності порівнянно з аутентичними частками 22 нм. Створенню біотехнологічного виробництва HBS-антигену і вакцини чи діагностичного препарату перешкоджають відсутність посттрансляційного глікозування при експресії гена, що кодує антигенний білок вірусу гепатиту В в дріжджах, а також необхідність руйнування дріжджових клітин для одержання антигену, тому що той у середовище не виділяється.
Тихоненко Т.І. (1983) для вирішення найбільш гострих проблем і подалання труднощів виробництва повнорозмірних імуногенних вірусних білків пропонує використовувати культуру клітин людини чи тварин з наступною її трансформацією генами капсидних вірусних білків, забезпечених регуляторними елементами еукаріот.
Вітчизняні і закордонні автори встановили, що отримані шляхом хімічного синтезу чи еліміновані з відповідної білкової молекули олігопептидні структури, адекватні по набору послідовності залишків амінокислот, а також конформації епітопних ділянок нативного капсидного вірусного білка забезпечують імуногенний ефект, подібний до активності інтактного вірусу. Цей принцип покладений в основу одержання протиящурної вакцини, синтетичні олігопептидні епітопи якої відтворюють антигенні детермінанти, що знаходяться як у мономерних поліпептидах, так і в четвертинних надмолекулярних структурах і належать до епітопів конформаційного типу. У зв’язку з цим є розходження в первинній структурі синтетичних олігопептидних епітопів і епітопів, які сформовані амінокислотними залишками в нативному капсидному білку, що, однак, не першкоджають досягненню синтезованими епітопами імуногенного ефекту.
Білкові молекули, що у розчині приймають вторинну і третинну структури, заздалегідь визначену дослідником, використовуються в практичній імунології. Оскільки тривалість життя синтезованих генно-інженерним шляхом олігопептидних епітопів у бактеріальній клітині дуже коротка, пропонується для подолання цієї перешкоди включати антигенні детермінанти олігопептидних епітопів, що належать одному чи декільком серотипам або навіть декільком видам вірусу, до складу спеціального сконструйованого химерного білка-носія з заздалегідь установленою вторинною і третинною структурами. Це дозволяє антигенним детермінантним ділянкам прийняти положення, що забезпечує найбільшу імуногенну активність.
Цей принцип був використаний Тихоненко Т.І. (1983) при створенні вакцини проти вірусу гепатиту В людини. Ген, який входив до складу сконструйованої ним рекомбінантної ДНК, кодував біосинтез химерного білка, у складі якого знаходилися
олігопептидні ділянки, що є епітопами HBS-антигену вірусу гепатиту В людини. При парентеральному введенні тваринам цього білка було встановлене утворення нейтралізуючих вірус (протективних) антитіл. Гетерополіантигенні поліпептидні структури, названі вакцинами другого покоління, цікаві ще й тим, що їхнє виробництво може бути полегшене біотехнологічним шляхом.
При створенні вакцин третього покоління ставиться завдання використовувати для утворення антитіл консервативні епітопні ділянки, загальні не тільки для вірусів різних серотипів, але й видів, а можливо, навіть родів. Вони також розташовані на поверхні й беруть участь в утворенні капсидної оболонки, однак від антигенних детермінант, що мають високу імуногенную активність, відрізняються значною мінливістю первинної структури, у зв’язку з чим цим вірусам удається порівняно легко переборювати імунний захист клітини-господаря. Вони характеризуються дуже слабкою імуногенністю, хоча і не позбавлені потенційної здатності індукувати синтез антитіл. Синтез хімічним чи генно-інженерним шляхом консервативних антигенних детермінант, пошук прийомів, спрямованих на підвищення їхньої імуногенної активності, складають основний зміст нового підходу в конструюванні вакцин третього покоління, які, є штучними, тому що в природних умовах потенціал консервативних епітопів не реалізується. До цього варто додати здатність вакцин третього покоління індукувати синтез протективних антитіл і захищати від вірусів, ступінь генетичного споріднення між якими віднаходить відбиток в адекватності слабкоімуногенних консервативних епітопів, розташованих у консервативних ділянках капсидних поверхневих вірусних білків. Практичним підтвердженням цієї ідеї є синтез нейтралізуючих серотипи вірусу грипу А і В антитіл, що утворилися в результаті імунізації синтезованими хімічним шляхом антигенними детермінантами, локалізованими в зоні консервативних ділянок вірусного гемаглютиніну.
Провідний радянський імунолог Петров Р.В. (1984), характеризуючи план створення й основні параметри вакцини майбутнього, вказує на те, що антигенний її компонент буде представлений синтетичними олігопептидними епітопами, включеними в полілізинову структуру, складену з багатьох сотень залишків амінокислоти лізину, тобто носієм полігетероантигенних детермінант є полііонна, а точніше, полікатіонна структура. Однієї імунізації достатньо, щоб захистити організм людини чи тварин від тих інфекцій, антигенні детермінанти яких були представлені в полікатіонному носії. Петров Р.В. пропонує нові підходи - цілеспрямований вплив на імунну систему організму за допомогою введення в штучну вакцину стимулюючого компонента на основі знання механізмів реалізації генетичного контролю імунної відповіді.
На сьогодні існує обгрунтована й експериментально підтверджена дослідженнями Петрова Р.В., Хаітова Р.М. і Кабанова В.А. наукова концепція і програма конструювання штучних антигенів нового типу, кінцевою метою якої є створення штучних макромолекулярних вакцинуючих препаратів, що не мають відповідних природних аналогів.
Щоб вакцина майбутнього, проект якої в 1973 р. представив Села М., була ефективною у всіх випадках її застосування, необхідно одержати відповідь на питання, чому деякі організми, оброблені приготованими за пастерівськими принципами ослабленими чи мертвими вакцинами або виділеними з них антигенами і в багатьох інших випадках діяли безвідмовно, залишалися неімунними. Крім того, приготовані за класичним принципом вакцини при багатьох інфекціях виявляються неефективними; не виникає імунітету до повторного зараження даним збудником навіть після хвороби, викликаної деякими інфекціями. У зв’язку з цим низка інфекцій належить до категорії непереможених. Тим часом збудники цих інфекцій є носіями антигенних детермінант. Однак заздалегідь відомо, що їхнє виділення, установлення структури з урахуванням можливих конформаційних впливів, наступний ресинтез і використання як субодиничних вакцин не матимуть ефекту. Причини нереагування чи низького реагування на введену в макроорганізм субстанцію мають геномну локалізацію, тобто є генетично детермінованими.
Села М. (1969, 1983), Петров Р.В. (1976), Петров Р.В., Хаітов Р.М., Атауллоханов Г.І. (1983) й інші з відкриттям генів імунної відповіді встановили механізм генетичного контролю сили імунного реагування. Виявлено гени імунної відповіді (Ir-гени) і гени імунної супресії (Is-гени). При антигенному впливі на організм реакція Ir-генів реалізується у вигляді високої чи низької відповіді до даних антигенів залежно від того, який Ir-ген (високої чи низької відповіді) знаходиться в геномі. Деякі гени на антигенну детермінанту певної будови реагують розвитком вираженої імунної відповіді, інші генотипи на цей епітоп реагують слабко чи не відгукуються зовсім на антигенні детермінанти, що розрізняються за будовою. В одних випадках розвивається швидка і висока імунна реакція, в інших — розвинути таку реакцію організм не може. У тих випадках, коли в геномі міститься Ir-ген низької відповіді і (чи) Is-ген сильної супресії, традиційно приготованою вакциною ефективної імунної відповіді одержати не вдається.
За сформульованим і успішно реалізованим Петровим Р.В. і його школою принципом створення штучних вакцин допускається одержання макромолекул, що включають епітопний компонент і полііонну штучну структуру, яка індукує імуногенез і забезпечує обхід Т-клітинного і Ir-генного контролю імунної відповіді. Незалежність такого штучного макромолекулярного комплексу від антигенної конкуренції створює принципову можливість її використання як вакцинний препарат проти тих інфекцій, що дотепер належали до категорії непереможених людиною, а також, можливо, проти раку й алергійних станів. Отже, за новим принципом створення штучних вакцин можлива участь певного епітопу в макромолекулярному вакцинуючому комплексі як обов’язкового компонента.
Вирішенню цього питання молекулярної імунології передували дослідження з моделювання антигенів. Антигенні властивості встановлені у тринітрофенолу, приєднаного до такої високомолекулярної сполуки, як полі-2-метил-5-вінілпіридин (молекулярна маса — 80-100 тис. дальтон), динітрофенолу, кон’югованого з макромолекулярною полікатіонною структурою, створеною на основі полі-лізину, у кон’югату тетрапептиду Тир-Глу-Ала-Ліз (сополімер тирозину, глутамінової кислоти, аланіну і лізину) з поліаніоном, утвореним у результаті полімеризації чи сополімеризації акрилової кислоти (поліакрилова кислота).
У ході цих досліджень було сформульоване поняття про антигенну детермінанту (епітоп). Установлено, що антигенна специфічність макромолекулярної структури визначається антигенною детермінантою, а за допомогою антитіл виявляються незначні зміни в структурі антигенних детермінант; були ідентифіковані гени імунної відповіді в морських свинок (1963) і виявлені Ir-гени у мишей; експериментально підтверджені слабкі антигенні властивості поліпептидів навіть у тих випадках, коли вони модифікувалися гаптенами, а також виявлена така важлива властивість полііонних носіїв гаптенів, як здатність їх виступати ефективними імуностимуляторами. Головним при проведенні цих досліджень було те, що антигенні макромолекулярні комплекси на полііонній основі взагалі не стимулювали біосинтез антитіл, а процес антитілоутворення тривав активно навіть у тих генотипів, що при традиційній вакцинації не залежали від тимуса і від Ir-генного контролю імунної відповіді. Остання обставина була покладена в основу при конструюванні штучних вакцин нового типу.
Крім штучних антигенних структур, інтенсивно вивчаються олігопептидні білкові ділянки, що формують антигенні детермінанти вірусів, бактерій, найпростіших. Досить грунтовно досліджуються олігоцукристі антигенні детермінанти сальмонел.
Було встановлено, що виділені з білкової структури вірусу чи отримані синтетичним шляхом олігопептиди з різною кількістю амінокислотних залишків здатні індукувати біосинтез антитіл проти цілого білка; взаємодія антитіл з білковою молекулою, що утримує антигенні детермінанти, приводить до нейтралізації вихідного вірусу. Виділені чи синтезовані олігопептидні структури з’єднували найчастіше з такими носіями, як бичачий сироватковий альбумін, полі-аланін, правцевий анатоксин, гемоціанін равлика, лізоцим, гликопептид та ін. Майже у всіх випадках сконструйовані на основі олігопепти- дної антигенної детермінанти і поліпептидної структури, використаної як носій, антигенні комплекси для стимулювання імуногенезу мали потребу в одночасному введенні ад’ювантів (найчастіше повного ад’юванта Фрейда, алюмінієвих квасців чи гідроокису алюмінію, які застосовувалися окремо чи в сполуках). Винятком були дослідження, де як носій використовувався мурамилдипептид, що стимулює імуногенез.
Синтез олігопептидів, що імітують константні ділянки антигенної детермінанти поверхневого білка гемаглютиніну (НА) вірусу грипу, має неабиякий практичний інтерес, тому що цей принцип може бути покладений в основу конструювання вакцини, при введенні якої синтезуються протективні (віруснейтралізуючі) антитіла проти декількох різновидів вірусу грипу.
Білок 1 вірусу ящура (VP1) є найбільш ефективним антигеном, у відповідь на введення якого індукується біосинтез віруснейтралізуючих антитіл (рис. 15.1). Крім того, відомо, що фрагмент VP1 включає 141—160-й амінокислотні залишки і схильний до найбільших змін у різних серотипів вірусу ящура. Передбачається, що вакцина, створена кон’югуванням олігопептидів, характерних для кожного серотипу вірусу, на загальному білковому носії повинна забезпечити біосинтез протективних антитіл, що нейтралізують А-, О- і С-серотипи вірусу ящура (Shinnick T.M. et al., 1983).
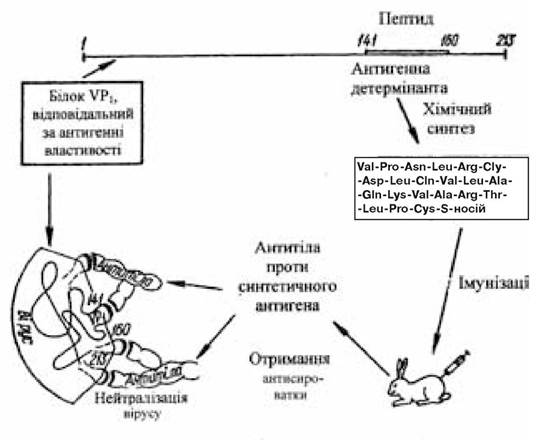
Рис. 15.1. Схема конструювання протиящурної вакцини
(за Овчінніковим Ю.А., 1986)
У колишньому Радянському Союзі був одержаний і пройшов виробничі випробування вакцинуючий комплекс, створений із синтезованого пентадекапептиду і його фрагментів, що включають послідовність 145-159-го залишків амінокислот VP1-білка вірусу ящура і з’єднаних з такими носіями, як гемоціанин равлика, БСА і глікопептид (Вольпіна О.М. й ін., 1984).
У дослідників, що працють у цьому напрямку, очевидно, найбільшими труднощами є подолання Т-клітинного і Ir-генного контролю сили імунного реагування. Зазначені труднощі можна здолати за допомогою штучних вакцин нового типу .
Аналогічні прийоми були використані при створенні синтетичних олігопептидних антигенних детермінант для конструювання вакцини проти бактерій і їхніх токсинів: синтез олігопептидного фрагмента, що включає епітопну ділянку, приєднання синтезованого олігопептиду до білкового носія (бичачий сироватковий альбумін, полі-D,L-аланін, полі-L-лізин, правцевий анатоксин та ін.) за допомогою біфункціонального глутарового альдегіду чи іншим способом, введення отриманих комплексів одночасно з повним ад’ювантом Фрейда або мурамилдіпептидом в організм тварин.
Синтетичні олігопептидні фрагменти, що відтворюють антигенні детермінанти дифтерійного і холерного токсинів, а також М-білка Streptococcus pyogenes, приєднані до поліпептидного носія, індукували біосинтез пептидспецифічних антитіл, здатних взаємодіяти з інтактними токсинами і в деяких випадках їх нейтралізувати. Кон’югати олігопептидних епітопів бактеріальних білків і їхніх токсинів з поліпептидними носіями також не забезпечують обхід Т-клітинного і Ir-генного контролю імуногенезу, у зв’язку з чим створені на цій базі вакцини не можуть індукувати ефективну імунну відповідь у генетично низькореагуючих індивідуумів.
До складу структурного поверхневого білка спорозонтів P. Knowlesi входить 24-амінокислотна пептидна послідовність з властивостями антигенної детермінанти. Моноклональні антитіла проти поверхневого антигенного білка P. Knowlesi вступали у взаємодію із синтезованим пептидом з 24-х залишків амінокислот, що виконують функцію антигенної детермінанти.
Отримані методом хімічного синтезу з повторюваних олігоцукристих ланок фрагменти мали властивості і специфічність антигенних детермінант О-антигену сальмонел. При з’єднанні синтетичних олігоцукристих фрагментів з бичачим сироватковим альбуміном чи дифтерійним токсином були отримані антигенні комплекси, що при кількаразових імунізаціях за участю ад’ювантів (повний ад’ювант Фрейда) набули деяких імуногенних і протективних властивостей, що охороняло генетично високореагуючих на бичачий сироватковий альбумін особин від LD50, збільшеної приблизно в 10 разів. На тварин, генетично низькореагуючих на бичачий сироватковий альбумін, сконструйований у такий спосіб антигенний комплекс зовсім не викликав імунізуючого ефекту. Ця обставина ще раз підтверджує перспективність ідеї, розвинутої Петровим Р.В. і Хаітовим Р.М. та їхньою школою (1986) про необхідність фенотипічної корекції генного контролю імунної відповіді з метою вивчення підходів для переведення тварин, що слабко реагують на введений антиген, в особини з ефективною імунною відповіддю.
У результаті проведених з 1972 р. у цьому напрямку досліджень установлено, що синтетичні полііони (полі-2-метил-5-вінілпіридин — ПМВП; поліакрилова кислота — ПАК; декстрансульфат; полі-4-вінілпіридин — ПВП; N-вінілпіролідон - NВПД; четвертинні солі полі-4-вінілпіридину і поліконідину й ін.) є одним з головних компонентів у створенні штучних вакцин нового типу. Молекулярна маса полііонів коливається в межах 10-100 тис. дальтон. Ні самі полімерні з’єднання, ні мономерні ланки, з яких складаються полімерні молекули, не виявляють антигенних властивостей. Один з інтегральних ефектів, вироблених полііонами — їх імунопотенціююча дія, складовими якої є окремі ланки імуногенезу. Так, уведення полііонів значною мірою збільшує швидкість міграцій Т- і В-лімфоцитів відповідно з тимуса і кісткового мозку в кров і селезінку, де забезпечуються необхідні умови для взаємодії Т- і В-лімфоцитів, тобто Т-хелперів з В-клітинами, прискорення розмноження і диференціація останніх в антитілоутворюючі клітини (АУК).
При цьому поліаніони (ПАК, декстрансульфат) впливають тільки на В-клітини, а полікатіони активують також і Т-лімфо- цити, підвищуючи в присутності макрофагів синтез ДНК: поліаніони слабко стимулюють біосинтез ДНК і тому належать до малоефективних мітогенів. Важливим для рішення розглянутої проблеми (обхід Т-клітинного і Ir-генного контролю імуногенезу) є встановлення можливості прямого стимулювання розподілу і диференціації В-лімфоцитів в АУК за допомогою полііо нів; реакція на введення безтимусним тваринам полііонів адекватна тому ефекту, що одержують при введенні в їхній організм Т-хелперів.
У забезпеченні збалансованої функції імунної системи беруть участь Т-супресори, що під впливом полііонів також інактивуються. Однак стимулюючий вплив полііонів на швидкість розмноження В-лімфоцитів, їх диференціювання в антитілоутворюючі клітини й участь останніх в утворенні антитіл, збереглися. Виявлено позитивний вплив полііонів на активність природних кілерних клітин і кілерів, що походять з кровотворної стовбурної клітини. За допомогою полііонів досягається активування реакцій, що супроводжують імунну відповідь, яка була пригнічена внаслідок антигенної активації Т-супресорів. Дія полііонів на імунокомпетентні клітини залежить від дози поліелектроліту і його молекулярної маси.
Поліелектролітна природа розглянутих полімерних ад’ювантів і поліфункціональність властивостей білків, укладенихх у клітинні мембрани, мають ідеальну можливість для їхньої ба- гатоточкової кооперативної взаємодії й утворення інтерполімерних комплексів. Супутня процесу комплексоутворення агрегація білків клітинної мембрани призводить до порушення її проникливості: збільшується швидкість надходження іонів калію і кальцію за градієнтом концентрації — калій виходить із клітини, а кальцій входить в клітину. Декотрі експериментальні дані підтверджують аргументованість цієї точки зору. Так, нейтральні полімери, а також олігополімери довжиною — 0,5-5 нм позбавлені комплексоутворючої активності, не надто впливають на проникливість клітинної мембрани для калію і кальцію, а за допомогою електронної мікроскопії виявлені кластери, що поєднують полііонні молекули 20-50 білкових глобул. До того ж активність Na+-, K+-, Са2+-АТФаз, впливаючи полііонною молекулою на клітинну мембрану, також зростає.
Сконструйовані на синтетичній полііонній основі за участю гаптенів (тринітрофенолу - ТНФ) і білкових речовин (бичачого сироваткового альбуміну) штучні антигени без використання ад’ювантів формують імунологічну пам’ять після одноразової імунізації. Кон’югати на полііонній основі є дуже сильними антигенами, індукуючими біосинтез специфічних до ТНФ і білкового компонента антитіл. Був отриманий штучний антиген, що є трикомпонентним комплексним з’єднанням О-поліцукру, отриманого з О-антигену сальмонел методом кислотного гідролізу, джгутикового антигену білкової природи — флагеліну, також виділеного із сальмонел, з поліаніоном ПАК. Названий комплекс має високі імуногенні властивості, що чітко реалізується у вигляді первинної і вторинної імунної відповіді. Двокомпонентні антигенні комплекси О-поліцукор-ПАК і флагелін-ПАК без застосування ад’ювантів індукують високого рівня імунну відповідь зі специфічністю відповідно О-антигену і флагеліну. Штучний трикомпонентний антигенний комплекс доцільніше використовувати для створення штучної протисаль- монельозної вакцини.
Індукування процесу розмноження і диференціації В-лімфоциту в антитілоутворюючу клітину відбувається в результаті його контакту з Т-лімфоцитом, що одержали від макрофага стимулюючі сигнали, які сформувалися при взаємодії антигену і білка, що є продуктом Ir-гена. В-лімфоцит впізнає антигени самостійно. В експериментах з використанням штучних комплексів, де складовими елементами виступали полііони, а також гаптени, білки і поліцукри, на мишах, у яких практично відсутні Т-лімфоцити (В-миші), після імунізації накопичується така ж кількість антитілоутворюючих клітин, як у нормальних мишей. Такі антигенні комплекси виявляють сильний тимуснезалежний імуногенний ефект. Крім того, було встановлено, що слабкі тимусзалежні білкові антигени (бичачий сироватковий альбумін) при з’єднанні з полііонними макромолекулами забезпечують тимусзалежність імунної відповіді і нагромадження специфічних для цього білка антитілоутворюючих клітин у великій кsлькості. У цьому випадку антигенна детермінанта, що входить до складу комплексної молекули штучного антигену, знаходить клітини зі специфічними рецепторами на їхній поверхні. Ділянки полііонної структури, що перебувають у складі комплексної молекули і вільні від зв’язку з антигеном, вступають у взаємодію з поверхнею імунокомпетентної антигенспецифічної клітини. Агрегація мембранних білків, що відбулася в результаті такої взаємодії, підвищує іонну проникливість останньої. Усього цього достатньо для індукування процесу розподілу і диференціації В-лімфоцитів даної специфічності в антитілоутворюючі клітини без участі Т-хелперів.
Оскільки Ir- і Is-гени реалізують свою участь у контролі імунної відповіді переважно через Т-лімфоцити, використання антигенів чи антигенних детермінант у комплексі з полііонними носіями дозволяє забезпечити незалежність імунних реакцій від впливу Т-лімфоцитів та Ir-генного контролю, у зв’язку з чим особини, що генетично не реагують або реагують на визначений антиген слабко, дають повноцінну як первинну, так і вторинну імунну відповідь. На основі цього принципу можливе створення ефективних вакцин проти інфекцій, що раніше належали до категорії непереможених, а також, можливо, проти раку й алегрій.
Ідея конструювання штучних вакцин нового типу реалізована колективом під керівництвом Петрова Р.В. (1986), що створили препарат, який захищає тварин від сальмонельозної інфекції. У ході розробки штучної протисальмонельозної вакцини було встановлено, що кон’югати поліцукристого компонента, виділеного з О-антигену, і білкового компонента флагеліну (Н-антиген) з такими носіями, як поліакрилова кислота, полі-4-вінілпіридин чи сополімер акрилової кислоти і N-вініл- піролідона, у вигляді двокомпонентних (О-поліцукор-поліелектроліт або флагелін-поліелектроліт) чи трикомпонентних (О-поліцукор-флагелін-поліелектроліт) штучних антигенів забезпечують захист мишей при зараженні їх надлетальними дозами (100 LD50) збудника S. typhimurium такого інфекційного захворювання, як мишачий тиф. Одночасно була підтверджена раніше висловлена думка про те, що поліелектролітний носій без відповідної антигенної детермінантної ділянки навіть у великих дозах не може захистити при інфікуванні тварин.
Крім того, у низькореагуючих на О-поліцукристий антиген і флагелін (Н-антиген) генотипів при введенні кон’югатів названих антигенів з полііонними макромолекулами стимулювання проліферації В-лімфоцитів і утворення антитіл було виражено сильніше, ніж в індивідуумів з більш високим вихідним рівнем імунної відповіді. Як стверджують Петров Р.В. і Хаітов Р.М. (1981), за допомогою полііонних носіїв можливо здійснювати фенотипічну корекцію генного контролю імунної відповіді.
Відмінною рисою штучних комплексних антигенних препаратів є їх високий протективний ефект: введені одноразово, вони забезпечують необхідний рівень набутої стійкості до сальмонельозної інфекції. Проте, штучні вакцинуючі препарати при повторному введенні О- і Н-антигенів сальмонел здатні розвивати високу імунну відповідь. Це свідчить про те, що створені штучні імуногени забезпечують прояв добре вираженої імунологічної пам’яті. Найбільш високий захисний ефект одержували при імунізації мишей трикомпонентним штучним антигеном О-поліцукор-флагелінолііон.
З огляду на вищевикладені дані є підстава зарахувати названі штучні антигенні комплекси до принципово нового типу вакцинуючих препаратів з контрольованими структорую і іму- ногенністю (Петров Р.В., Хаітов Р.М., 1987).
Розроблена ідея виявилася плідною і при вирішенні питання про можливість конструювання протигрипозної вакцини. Епітопи з імуногенними властивостями входять до складу основних антигенів вірусу - гемаглютиніну і нейрамінідази. Під впливом антигенних детермінант, локалізованих у гемаглютиніні і нейрамінідазі, при проникненні вірусу в організм відбувається біосинтез специфічних віруснейтралізуючих антитіл. На відміну від поверхневих антигенів (гемаглютиніну, нейрамінідази), первинна структура яких у процесі антигенного дрейфу зазнає значних змін, що створюють часом нездоланні труднощі при виготовленні ефективної протигрипозної вакцини, внутрішні антигени, зосереджені в матриксному білку (М-білку) вірусної частки, характеризуються сталістю своєї первинної структури, яка у всіх різновидів вірусу однакова, і в ході антигенного дрейфу практично не зазнають змін.
Однак М-білок є слабким антигеном, і антитіла, що утворюються під його впливом, не здатні захистити організм від вірусної інфекції. Консервативність первинної структури, що передбачає сталість його епітопних ділянок, у поєднанні з ідентичністю структури в багатьох різновидів серотипів вірусу грипу була покладена в основу конструювання штучних антигенів, що забезпечують біосинтез протективних антитіл, ефективних проти деяких різновидів вірусу грипу.
Для виготовлення вакцин необхідні антигенні препарати. Еліміновані з вірусних штамів гемаглютинін і нейрамінідаза, введені в організм тварини порізно чи разом, сприяють збільшенню кількості антитілоутворюючих клітин, які синтезують IgM, у 2-2,5 раза, чого недостатньо для забезпечення вірусней- тралізуючої функції і захисту тварин (мишей) від грипу (виживало не більше 14 % мишей). При цьому слід зазначити, що в популяції антитілоутворюючих клітин не було виявлено тих, котрі синтезують IgG.
Зовсім іншими виявилися результати імунізації мишей кон’югатами гемаглютинін-полііон, нейрамінідаза-полііон і гемаглютинін-нейрамінідаза-полііон. Одноразове введення штучних антигенів на поліелектролітній основі у визначеному дозуванні забезпечувало абсолютну стійкість до вірусу.
Трикомпонентні штучні антигени (гемаглютинін-нейрамінідаза-поліелектроліт) виявилися ефективнішими за антигени, до складу яких входили гемаглютинін і полііон. Штучні антигени, сконструйовані на полііонній основі, підвищують також інтенсивність гіперчутливості уповільненого типу, тобто Т-клітинної імунної відповіді. Сконструйований штучний антиген, що включає виділений з віріонів М-білок і поліелектролітний носій, при імунізації тварин забезпечує виражений вірус-нейтралізуючий ефект, що дає підставу вважати реальною можливість створення штучної поліспецифічної вакцини, яка складається з константного М-білка і поліелектролітної частини компонента.
Принцип використання константної антигенної детермінанти був покладений в основу конструювання цілком штучної протигрипозної вакцини. Для цього була синтезована константна антигенна детермінанта, ідентична за будовою до N-кінцево- гоу фрагменту, що включає 11 амінокислотних залишків, легкого ланцюга (НА2-субодиниці) гемаглютиніну вірусу грипу А. Потім до С-кінця олігопептидного фрагмента був приєднаний гліцин, внаслідок чого отриманий додекапептид (пептид активації злиття F/A) такої амінокислотної послідовності: Глі-Лей-Фен-Глі-Ала-Іле-Ала-Глі-Фен-Іле-Глу-Глі. Кон’югати синтезованого додекапептиду з полііонними носіями мали добре виражену імуногенну активність. Вони індукували біосинтез протективних антитіл ізотипу IgG, що реагують як з гомологічною антигенною детермінантою, так і з гемаглютинінами різних серотипів вірусу грипу А. Значний вірусонейтралі- зуючий ефект із широким протективним спектром при одноразовому введені дає підставу зарахувати сконструйований препарат до цілком штучної протигрипозної вакцини. При цьому біосинтез антипептидних, антигемаглютинінових і протигрипозних антитіл не був виявлений у жодному з досліджень, у яких пептид F/A вводили в організм з різними носіями, що не є речовинами полііонної природи.
Ідентифікація деяких ракових антигенів (α-фетопротеїн, що виявляється при захворюванні первинною карциномою печінки, а також карциноембріональний антиген, поява якого позв’язана з аденокарциномною патологією органів травлення) і одержання їх у чистому вигляді (Петров Р.В. і ін., 1972-1987) дозволяють порушувати питання про створення протиракової вакцини.
Синтезований за кордоном ундекапептид, що відповідає за амінокислотною послідовністю N-кінцю карциноембріонального антигену, при з’єднанні його з поліамінокислотним носієм і бичачим сироватковим альбуміном в організмі тварин індукував синтез антитіл, які взаємодіяли з нативним карциноембріо- нальним антигеном (R. Arnon et al., 1976). У лабораторії Р.В. Петрова (1983) було отримано комплексне з’єднання, складовими якого є α-фетопротеїн і полііонний носій, які належать до класу полібетаїнів. Порівняння результатів, отриманих при застосуванні одного α-фетопротеїну і кон’югату α-фетопротеїн-полібетаїн, показало, що в другому випадку інтенсивність утворення антитіл майже в 100 разів вища, ніж у першому. Цей напрямок також є перспективним.
Використання поліелектролітних носіїв при створенні штучних антигенів і штучних вакцинуючих препаратів дало можливість забезпечити тимуснезалежність імунної відповіді і пов’язаної з ним здатності скасовувати ефект конкуренції антигенів, обхід Ir-генного контролю сили імунного реагування, одержати ефективну імунну відповідь в особин з генетично детермінованим низьким рівнем імунної відповіді на той чи інший антиген. Це створює широкі можливості для конструювання вакцин проти інфекцій, що дотепер належали до категорії непе- реможених, дозволяє розраховувати на успіх при розробці поліспецифічних препаратів із включенням у кон’югатепітоп - поліелектроліт консервативного пептиду і створенні ефективних вакцин для захисту людини і тварин від протозойної інвазії, штучних протиракових і алерговакцин. Особливе значення епітоп-поліелектролітні кон’югати мають в умовах Т-клітинного дефіциту. Незважаючи на унікальність властивостей поліелектролітів, що застосовуються, триває робота над зниженням їхньої токсичності, підвищенням процесу біодеструкції і виведенням з організму, а також підвищеннюям здатності полііоних молекул виконувати функцію Т-хелперів, спонукаючи В-лімфоцити до проліферації. Це досягається за допомогою приєднання до комплексу іонофорів мурамілдипептиду й інших компонентів. Специфічність взаємодії штучного імунізуючого комплексу з В-лімфоцитом може бути підвищена за рахунок більш адекватного синтезу антигенних детермінант.
Генно-інженерний підхід у поєднанні із застосуванням поліелектролітів спроможні вже сьогодні значно поліпшити якість існуючих вакцин.
У світі проводяться широкі дослідження зі створення високоефективних вакцин для профілактики хвороб тварин за допомогою методів генетичної інженерії. Інактивовані вакцини, що застосовуються у ветеринарній практиці, мають порівняно низьку імуногенність, тому вдаються до допомоги ад’ювантів. Використання вакцин з атенуірованих штамів викликає ускладнення. Загальним недоліком тих чи інших вакцинуючих препаратів є наявність великої кількості баластового матеріалу.
Методи генетичної інженерії найбільш прийнятні для виготовлення вакцин проти вірусних захворювань. Сучасний підхід базується на використанні в складі вакцини тільки тих антигенних детермінант, що індукують антитілоутворення. Виготовлення вакцини включає такі етапи: виділення збудника і його розмноження; установлення структури вірусу; елімінація специфічно активної структури, яка індукує антитілогенез; синтез цього фрагмента в лабораторних умовах; визначення генетичного коду синтезованого поліпептиду; конструювання рекомбі- нантної ДНК і укладання рекомбінантної ДНК у бактерію.
Вмонтовуванням вірусних генів, що кодують відповідні антигенні детермінанти в геном бактерії чи еукаріотичної клітини, які знаходяться в культурі, передбачається одержувати вакцини належного складу. Необхідно довести нову технологію до того рівня, що дозволило б вакцинам нового покоління успішно конкурувати з вакцинуючими препаратами, які створюються традиційними методами.