БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина І. Загальна біотехнологія
РОЗДІЛ 5. ОСНОВИ ГЕНЕТИЧНОЇ ІНЖЕНЕРІЇ
5.1.БІОТЕХНОЛОГІЯ КОНСТРУЮВАННЯ РЕКОМБІНАНТНИХ ДНК
5.1.4.Клонування молекул рекомбінантної ДНК
Уведена тим чи іншим шляхом у бактеріальну клітину рекомбінантна молекула ДНК багаторазово там реплікується. Кожна гібридна молекула ДНК у результаті реплікації створює потомство ідентичних їй дочірніх молекул. Багаторазово розмножене потомство однієї бактеріальної клітини, що характеризується ідентичністю всіх складових його молекул, називають клоном. Фрагмент ДНК, попередньо отриманий у результаті розщеплення рестрикційною ендонуклеазою геномної ДНК (наприклад, еукаріотичного організму), у межах кожної клональної популяції присутній у чистому вигляді, єдиною домішкою якого є ДНК-вектор, що міститься в гібридній молекулі. Тому в більш вузькому значенні клоном називають убудований фрагмент чужорідної ДНК, попередньо виділений з його первісного геномного оточення і в результаті вибіркового розмноження присутній у великій кількості копій в однорідній популяції гібридних молекул. Як було сказано вище, у плазмідні чи вірусні вектори можуть долучатися різні фрагменти ДНК, що несуть у своєму складі різні гени, у зв’язку з чим утворюються сотні тисяч гібридних молекул, що розрізняються, і які при розмноженні утворюють клональні популяції. Родоначальницею кожної популяції є одна гібридна молекула ДНК.
При використанні як вектора бактеріофага гібридні ДНК, що утворилися і які складаються з фрагмента геномної ДНК еукаріотичного походження і ДНК вірусу, вводять у клітини Е.соlі. Рекомбінантні фаги багаторазово розмножуються у клітинах Е.соlі; у результаті їх лізування одержують великий набір окремих клональних популяцій — бібліотеку клонів.
Наступний етап — ідентифікація клонів. Завдання полягає в тому, щоб у бібліотеці клонів знайти одну чи кілька популяцій, що несуть рекомбінантну молекулу ДНК і містять потрібний ген. Добір клонів можна проводити за ознаками, характерними для самого клонованого гена чи для вектора, у який убудований потрібний ген. Ідентифікація є порівняно простою маніпуляцією, якщо раніше був клонований родинний потрібному ген. Клоно- ваний раніше фрагмент ДНК позначають радіоактивним ізотопом і встановлюють необхідний клон гібридизацією. При цьому враховується та обставина, що радіоактивна ДНК у зв’язку з комплементарністю нуклеотидних послідовностей буде зв’язуватися переважно з клонованим фрагментом ДНК, який розшукується. Що стосується ідентифікації клонованих фрагментів еукаріотичної ДНК, то і тут основою відбору є гібридизація.
Розроблено прийоми, за допомогою яких можна виділити іРНК (на її матриці здійснюється синтез відповідного білка) і її ДНК-копію. У тих клітинах, які спеціалізовані для синтезу певного білка у великих кількостях, іРНК також виявляється в концентраціях, що дозволяють порівняно легко виділити її, а також ДНК-копію відповідної іРНК у кількостях, необхідних для тестування гена, що розшукується. Цей метод виявляється результативним і в тих випадках, коли іРНК знаходиться в клітині, де її кількість складає десяті частки відсотка стосовно інших матричних РНК. Цей метод може бути використаний і тоді, коли через малу кількість існуючих прийомів іРНК не може бути ізольованою. Запропонований вихід з цього становища полягає у виділенні невеликої кількості чистого білка, біосинтез якого здійснюється на матриці іРНК, яка цікавить дослідника. Потім визначається амінокислотна послідовність цього білка і на підставі знання генетичного коду здійснюється визначення нуклеотидної послідовності відповідної іРНК і ДНК, що кодує аналізований білок.
На наступному етапі з окремих нуклеотидів хімічним шляхом синтезують невеликі олігонуклеотидні фрагменти ДНК з необхідною послідовністю азотистих основ. Ці фрагменти ДНК надалі використовуються як тести для ідентифікації і виділення клонів, що розшукуються.
З метою ідентифікації і відбору клонів використовується імунологічний метод. У цьому випадку виділяється чистий білок, кодований геном, що знаходиться у складі рекомбінантної ДНК у фаговому векторі. При введенні в бактеріальну клітину гібридного фагового вектора одночасно з його розмноженням здійснюється біосинтез невеликих кількостей цього білка. Подальше завдання полягає в тому, щоб проти потрібного білка одержати антитіла і використовувати приготований на їхній основі препарат для ідентифікації і відбору клону, що містить ген, який розшукується.
Ідентифікацію і відбір потрібного клону здійснюють за специфічною ознакою, носієм якої є плазмідна частина рекомбінантної молекули ДНК. Так, створена останнім часом плазміда рВR322 є носієм генів, що забезпечують стійкість утримуючих ці плазміди бактерій до тетрацикліну й ампіциліну (рис. 5.3). Крім того, кожна з таких рестрикційних ендонуклеаз, як ЕсоRІ, НіndIII, Sа1L, ВаmНІ, розщеплює названу плазміду в одному чітко визначеному місці. Плазміда рВR322, оброблена рестриктазами ШndШ, '8аИ, ВаmНІ після введення у місця рестрикції фрагментів гетерогенної ДНК, утрачає раніше властиву їй здатність забезпечувати стійкість до тетрацикліну бактерій, що містять цю плазміду. Таке явище називається інактиваційною вставкою, або інсерційною інактивацією; стійкість цих клітин до ампіциліну зберігається. Використовуючи ознаки стійкості до ампіциліну й чутливості до тетрацикліну, роблять ідентифікацію і відбір клонів. Чутливість до тетрацикліну й ампіциліну зберігають ті бактеріальні клітини, у які плазміда рВR322, що несе гени стійкості до названих антибіотиків, не змогла вбудуватися. Клітини, у які проникла плазміда рВR322, але не мала вставки фрагмента чужорідної ДНК, стійкі і до тетрацикліну, і до ампіциліну. Стійкість до обох антибіотиків зберігають також клітини, що містять плазміду з вставкою фрагмента ДНК у ділянці рестрикції, утвореній після обробки плазміди рестрикційною ендонуклеазою ЕсоRІ.
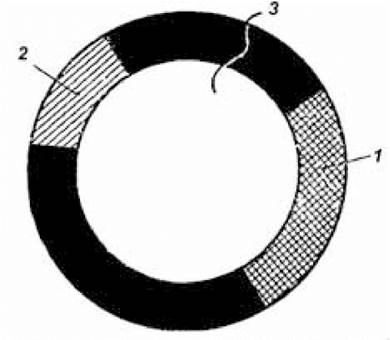
Рис. 5.3. Схематична карта плазміди рВК322
(за Страйєром Л., 1985):
1 — ген стійкості до тетрацикліну; 2 — ген стійкості до ампіциліну; 3 — місце дії рестриктази ЕсоRІ.
Проведені обчислення показують, що тільки один з 180 тис. клонів може містити унікальний еукаріотичний ген. Присутність цього гена в одній бляшці фага λ можна установити радіоавтографічним методом за допомогою радіоактивної молекули РНК чи ДНК. Продуктивність радіоавтографічного методу досить велика: протягом дня можна перевірити близько 1 млн клонів. Потрібно ще раз наголосити, що ідентифікація і добір шуканих клонів методом радіоавтографії можливі за наявності раніше клонованих генів, які є родинними до генів, що розшукуються, чи транскрибованих з цього гена РНК (Страйєр Л, 1985). Для тих випадків, коли описаний підхід виявляється неприйнятним, використовуються інші прийоми, засновані на створенні специфічного тесту, що дозволяє ідентифікувати і відібрати клон, котрий є носієм необхідного гена.
Отримані в результаті розщеплення рестриктуючими ендонуклеазами сумарної ДНК еукаріотичних і прокаріотичних організмів фрагменти, що містять гени, які кодують той чи інший білок, можуть бути використані для вбудовування їх у вектори і створення рекомбінантних, чи гібридних ДНК. Бактеріальні гени, які беруть участь в утворенні рекомбінантних молекул, вбудовані у вектори в складі фрагментів ДНК, можна змусити експресуватися. Так, у фрагменті ДНК, отриманому при дії рестриктази на геномний матеріал Е.соlі, виявився триптофановий оперон. Його клонування у складі рекомбінантної молекули ДНК, яка складається з фрагмента ДНК із триптофановим опероном і плазмідного вектора СоlЕІ, приводить до експресії.
У триптофановому опероні встановлена наявність п’яти генів, що кодують біосинтез п’яти ферментів, які беруть участь в утворенні з хоризмата через такі проміжні з’єднання, як антранілат, N-5'-фосфорибозилантранілат, 1-(О-карбоксифеніламіно)-1-дезоксирибулозо-5-фосфат, індол-3-гліцерофосфат критичної незамінної амінокислоти триптофану:
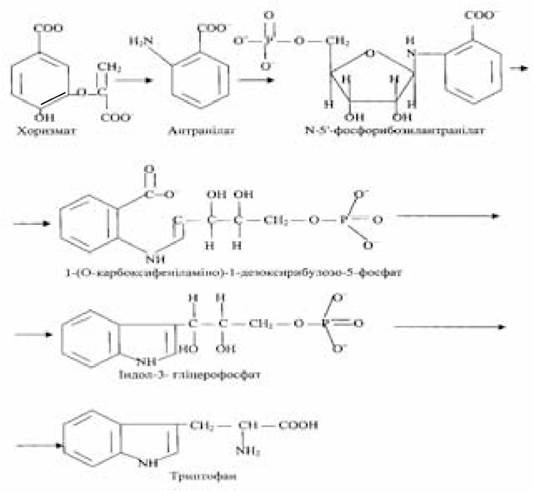
Концентрація ферментів, кодованих генами триптофанового оперона, що входить до складу плазмідного вектора СоlЕІ, приблизно в 20 разів перевищує їхній уміст, синтезований у звичайних клітинах Е.соlі. Це пов’язано з тим, що кількість гібридних молекул плазміди СоіЕІ у клітині Е.соіі може досягати кількох десятків копій. Зазвичай в бактеріальній клітині близько 25 копій плазміди СоlЕІ, а при дії на бактерію антибіотиком хлорамфеніколом кількість плазмід СоlЕІ збільшується, досягаючи 1000 копій. Механізм дії хлорамфеніколу зводиться до блокування процесів біосинтезу білка і реплікації хромосоми бактеріальної клітини; реплікація ДНК плазміди СоlЕІ у присутності антибіотика не порушується.
Загальною властивістю коліциногенних плазмід, у тому числі і СоlЕІ, є відсутність чіткого контролю їхньої реплікації. Є приклади, які свідчать про можливість експресії в бактеріальній клітині генів, взятих із дріжджів. Так, мутант Е.соlі, що потребує для свого росту збагаченого гістидином живильного середовища, ставав незалежним від екзогенних надходжень цієї амінокислоти при трансформації ауксотрофної клітини рекомбінантною ДНК, що складається з фрагмента дріжджової ДНК і фага λ. Підтвердженням того факту, що ген, який кодує фермент імідазолілгліцеролфосфатдегідрогеназу, вставлений у фаг λ у складі фрагмента дріжджовий ДНК, експресувався, є перетворення мутанта Е.соlі у незалежну від зовнішніх надходжень гістидину клітину. Що стосується генів ссавців, є дані, за якими бактерії не здатні експресувати еукаріотичні гени, що містять інтрони. Як вже зазначалося, на відміну від прокаріот еукаріотичні гени не є безперервними структурами.
У зв’язку з цим молекула, що утворилася в результаті транскрипції РНК (первинний транскрипт), перш ніж опинитися в цитоплазмі, проходить стадію дозрівання (процесинг), під час якого синтезована молекула РНК ферментативним шляхом розщеплюється на окремі фрагменти. Деякі з отриманих фрагментів з’єднуються між собою (сплайсуються), а велика частина нуклеотидних послідовностей під час процесингу елімінується з первинного транскрипта. В результаті з первинного транскрипту виходить іРНК. Однак у бактеріальній клітині,
очевидно, відсутні можливості для забезпечення процесингу первинного транскрипта. Тому, якщо навіть припустити, що еукаріотичний ген експресується у бактеріальній клітині, то отриманий у результаті трансляції недозрілої іРНК білок не буде ідентичний тому, що міг утворитися в результаті експресії цього ж гена в еукаріотичній клітині.
Вихід з положення, що створилося, може бути досягнуто таким чином, якщо при конструюванні рекомбінантних молекул у плазмідний чи вірусний вектор вбудовувати фрагмент еукаріотичній ДНК, комплементарний зрілій іРНК. Практичне рішення цього питання стало можливим після того, як була встановлена зворотна транскрипція іРНК за допомогою ферменту ревертази (зворотної транскриптази). Зворотна транскриптаза кодується геном РНК-вмісних вірусів, що ініціюють пухлинний ріст.
Для вирішення питань молекулярної біології і генетичної інженерії зворотну транскриптазу в основному одержують з вірусу мієлобластозу птахів. Важливою властивістю зворотної транскриптази є її здатність синтезувати на матриці іРНК комплементарний ланцюг ДНК і створювати на цьому ланцюзі ДНК шпилькоподібну структуру, що іншим ферментом — ДНК-полімеразою — використовується як відпал при синтезі іншого ланцюга ДНК. Варто звернути увагу і на той факт, що зворотна транскриптаза кодується не тільки геномом РНК, який містить віруси, що ініціюють пухлинний ріст, але виявляється і в нормальних клітинах миші і людини, де вона виконує, швидше за все, певну нормальну функцію.
Штучно синтезована на матриці, яка пройшла стадію процесингу, іРНК — копія дволанцюгової комплементарної ДНК (кДНК) містить безперервну генетичну інформацію, тобто є безінтронним штучним геном. Кодована ділянка гена яєчного альбуміну (овальбуміну) складається з восьми окремих ділянок, розділених інтронами, які розташовані у різних місцях геному. Овальбумінова іРНК, нуклеотидна послідовність якої розшифрована, містить всю інформацію про овальбумін, який складається з 387 амінокислотних залишків. Зворотною транскрипцією овальбумінової іРНК отримана кДНК, у результаті експресії якої у складі рекомбінантної ДНК у клітинах Е.соlі утворюється близько 1,5 % овальбуміну; значна частина його виділяється з клітини.
Прикладом одержання необхідного для клонування безінтронного гена може слугувати процес створення кДНК на матриці іРНК препроінсуліну — попередника функціонально активного гормона інсуліну. Було відомо, що в клітинах інсуліноми (пухлини підшлункової залози) синтезується велика кількість інсуліну, і що клітини цієї пухлини містять порівняно високу концентрацію іРНК препроінсуліну, у який під час процесингу вилучені інтрони. Експресія рекомбінантної ДНК, створеної вбудовуванням в плазмідний вектор кДНК, що кодує безінтронну іРНК препроінсуліну в клітинах Е. соlі, дозволила дати відповідь на два питання, що цікавили дослідників. По-перше, була доведена можливість експресії генів ссавців у бактеріальних клітинах. По-друге, біотехнологічний спосіб одержання інсуліну для задоволення потреб практичної медицини виявився більш рентабельним порівняно з раніше розробленим методом хімічного синтезу.
Якщо відома амінокислотна послідовність білка (виробництво його передбачається налагодити на біотехнологічній основі), одночасно з генетичним проводиться хіміко-ферментативний синтез гена за методикою, в основу якої покладені розробки лауреата Нобелівської премії Корани Г. (1969). Для цього олігонуклеотидні послідовності синтезуються хімічним шляхом, а потім за допомогою ферменту лігази з’єднуються між собою, у результаті чого виходить нуклеотидна послідовність ДНК, що кодує біосинтез білка проінсуліну.
Процес синтезу генів, що кодують білки невеликих розмірів, хіміко-ферментативним шляхом можна значно прискорити, використовуючи для цієї мети «генні машини» (рис. 5.4), у яких синтез специфічних послідовностей ДНК автоматизований.
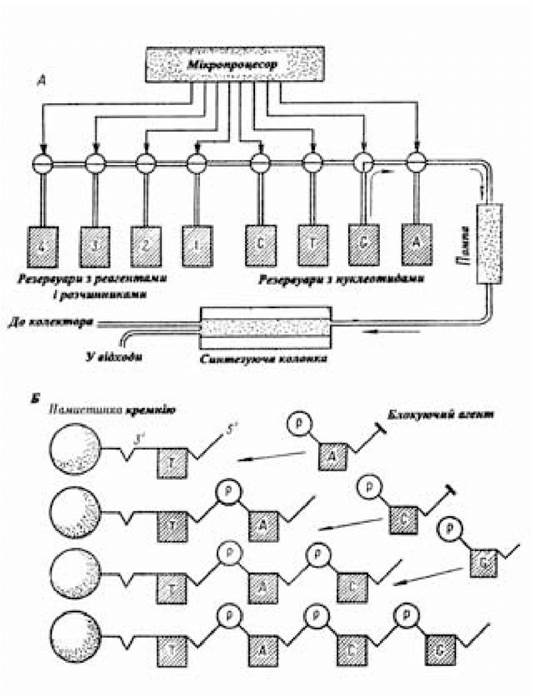
Рис. 5.4. Схема «генної машини»
(за Хопвудом Д., 1984)
Послідовність основ, що відповідає послідовності амінокислот білка, біотехнологічний синтез якого необхідно здійснити, вводиться на клавішний пульт керування. Через клапани, що відкриваються за допомогою мікропроцесора, у синтезуючу колонку за допомогою помпи подаються необхідні для процесу синтезу компоненти. Дрібні кремнієві намистинки, якими наповнена колонка, використовують як тверду основу, на якій здійснюється створення полінуклеотидної послідовності (Б). Перед заповненням синтезуючої колонки намистинками до них попередньо приєднують нуклеотиди (Т), 6'-кінець яких залишається вільним. Введена в колонку за участю мікропроцесора наступна порція нуклеотиду (А), у якого 6'-кінець захищений від небажаних взаємодій блокуючим агентом, своїм 3'-положенням реагує з 6'-кінцем нуклеотиду, прикріпленого до намистинки. Перш ніж вступити в реакцію з наступним нуклеотидом (С), 6'-кінець щойно приєднаного нуклеотида А звільняється від блокуючого агента, що створює необхідні умови для приєднання нового нуклеотида G. За допомогою «генної машини» синтезуються ланцюги довжиною до 40 нуклеотидів зі швидкістю один нуклеотид за 30 хв. Готові послідовності одноланцюгової ДНК відщіплюють від намистинки і вимивають у колектор (Хопвуд А., 1984). Для експресії синтезованого хіміко-ферментативним шляхом гена його разом з ділянками, що забезпечують активність цього гена, переносять у плазмідний вектор. Потім створену рекомбінантну молекулу ДНК трансформують у бактеріальні клітини й одержують штам, що продукує проінсулін, з якого виробляють інсулін. Таким способом був отриманий комерційний препарат інсуліну в США і в Інституті біоорганічної хімії АН СРСР під керівництвом академіка Овчинникова Ю.А.
Клонування синтетичної ДНК зазвичай здійснювали шляхом вбудовування у векторну ДНК дволанцюгових фрагментів, у яких обидва ланцюги були синтезовані хімічним або хіміко- ферментативним шляхом, або один з ланцюгів був отриманий ферментативним способом.
В Інституті цитології і генетики СВ АН СРСР була доведена принципова можливість клонування одноланцюгової синтетичної ДНК без додаткової збірки другого комплементарного ланцюга. Для клонування автори використовували одноланцюговий полінуклеотид, що складається з 93 нуклеотидних ланок і включає в себе лідерну послідовність гена людського фібробластного інтерферону. Спочатку хімічним способом синтезували три полінуклеотидних фрагменти, які складаються відповідно з 15, 38 і 43 нуклеотидних ланок. Потім ці фрагменти були з’єднані між собою. Сутність методу полягає в тому, що полінуклеотидний ланцюг збирається шляхом лігазної зшивки синтетичних фрагментів на коротких комплементарних цим фрагментам олігонуклеотидних «підкладках», чи «штифтах», що не є суцільним комплементарним ланцюгом.
Вбудовування 93-ланкового полінуклеотиду в плазміду рВR327, яку попередньо гідролізували рестриктазами ЕсоRІ і НіndIII, проводили в присутності олігонуклеотидів, що складаються з 20 і 16 нуклеотидних ланок і комплементарних відповідно 5'- і 3'-кінцям цього 93-ланкового полінуклеотиду. Олігонуклеотид, що складається з 16 ланок, використовувався як «штифт» при лігазній зшивці 93-ланцюгового полінуклеотиду з плазмідним вектором.
Цей метод при повному хімічному синтезі однієї з ланцюгів клонованої ДНК усував необхідність у синтезі другого комплементарного ланцюга. Отже, заощаджуються праця, час і реактиви, необхідні для забезпечення синтезу та лігазної зшивки другого ланцюга.