БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
Розділ 7. БІОТЕХНОЛОГІЯ ВИРОБНИЦТВА І ЗАСТОСУВАННЯ ІММОБІЛІЗОВАНИХ ПРЕПАРАТІВ
7.4. НОСІЇ ДЛЯ ІММОБІЛІЗАЦІЇ ФЕРМЕНТІВ
7.4.1. Органічні полімерні носії
Існуючі органічні полімерні носії можна розділити на два класи: природні і синтетичні. У свою чергу, клас природних полімерів можна розділити на групи відповідно до їх біохімічної класифікації: поліцукристі, білкові і ліпідні носії. Синтетичні полімери також розділяються на групи відповідно до хімічної будови основного ланцюга макромолекул: поліметиленові, поліамідні і поліефірні носії.
Із цієї групи носіїв широкого застосування для іммобілізації ферментів набули природні поліцукристі носії і синтетичні носії поліметиленового типу.
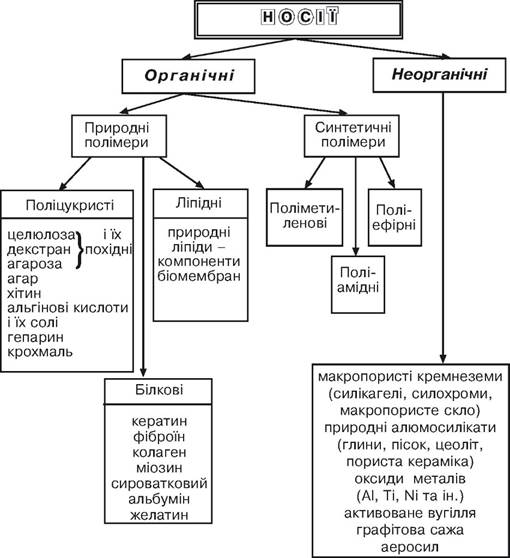
Рис. 7.1. Класифікація носіїв, які використовуються для іммобілізації БАР
(О.В. Скородумова, Н.Г. Рибальський, 1990)
Природні носії. Велике значення природних полімерів як носіїв для іммобілізації пояснюється їх доступністю і наявністю на їх поверхні реакційноздатних функціональних груп (у вихідному або модифікованому препараті), які легко вступають у різні хімічні реакції, а також високою гідрофільністю. До недоліків природних носіїв належать нестійкість до дії мікроорганізмів і висока вартість деяких з них.
Поліцукристі носії — це целюлоза, декстран, агароза і їх похідні, агар, хітин, альгінові кислоти і їх солі, гепарин, крохмаль.
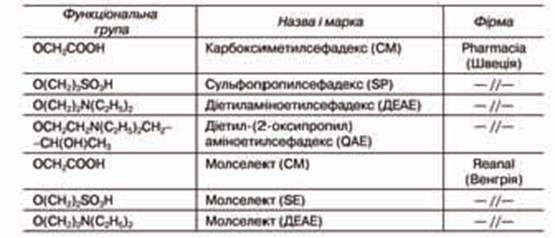
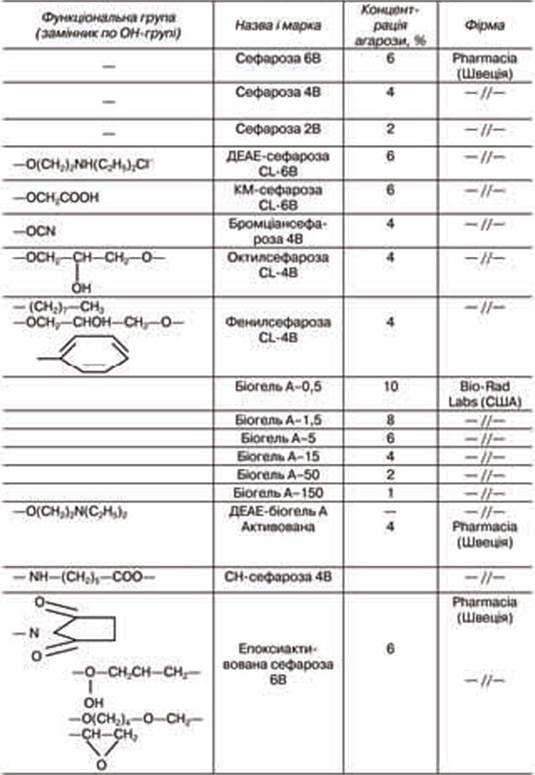
Серед них широко використовуються похідні целюлози, декстрана, агарози, модифіковані різними хімічними зшивками. Різні типи таких препаратів виробляються зарубіжними фірмами для іммобілізації або афінної хроматографії.
Целюлоза — це полі-1,4-β-D-глюкопіранозил-D-глюкопіраноза:
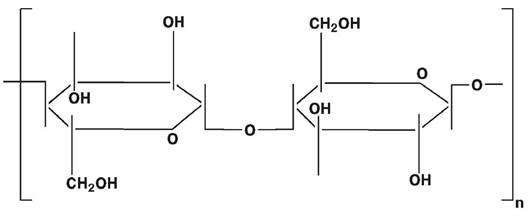
Целюлоза відзначається високою гідрофільністю, а наявність на її поверхні великої кількості гідроксильних груп дає можливість її легко модифікувати шляхом введення різних замінників. Препарати целюлози для надання їм хімічної стійкості «зшивають» епіхлоргідрином. Для збільшення механічної міцності целюлозу гранулюють шляхом часткового гідролізу, в результаті чого руйнуються її аморфні ділянки. На їх місце для збереження пористості вводять хімічні зшивки. Гранульована целюлоза завдяки простоті одержання, порівняно низькій вартості належить до зручних носіїв для іммобілізації ферментів і афінної хроматографії. Вітчизняні і зарубіжні фірми випускають різні промислові марки целюлози (табл. 7.2) для іммобілізації ферментів і афінної хроматографії. Недоліком целюлози як носія є нестійкість до впливу сильних кислот, лугів та окислювачів.
Декстран — полі 1,6-а-D-глюкопіранозил-D-глюкопіраноза — розгалужений поліцукор з бактеріальних джерел, який містить залишки глюкози, що зв’язані в основному 1,6-глюкозидними зв’язками (а також 1,2-, 1,3- і 1,4-зв’язками):
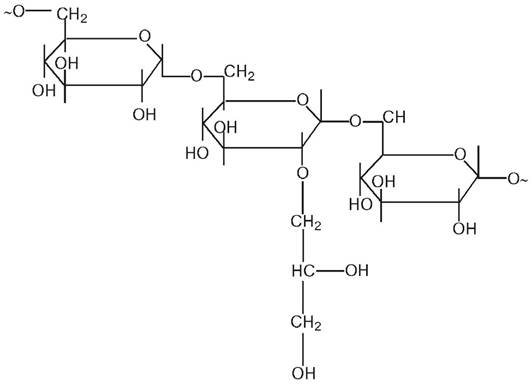
Гелі на основі декстрану, зшиті епіхлоргідрином, випускаються фірмою Pharmacia (Швеція) за комерційною назвою «сефадекс» і Reanal (Угорщина) «молселект». При висушуванні сефадекси стискаються, а у водних розчинах сильно набухають. Середній розмір пор у сітці гелю регулюється зміною частки зшивки. Гелі на основі декстрану мають високу хімічну стійкість і гідрофільність. Зарубіжними фірмами випускаються також похідні декстрану, які містять різні функціональні групи (табл. 7.3).
Таблиця 7.2.
Целюлоза і деякі її похідні (І.В. Березін і ін., 1987)
о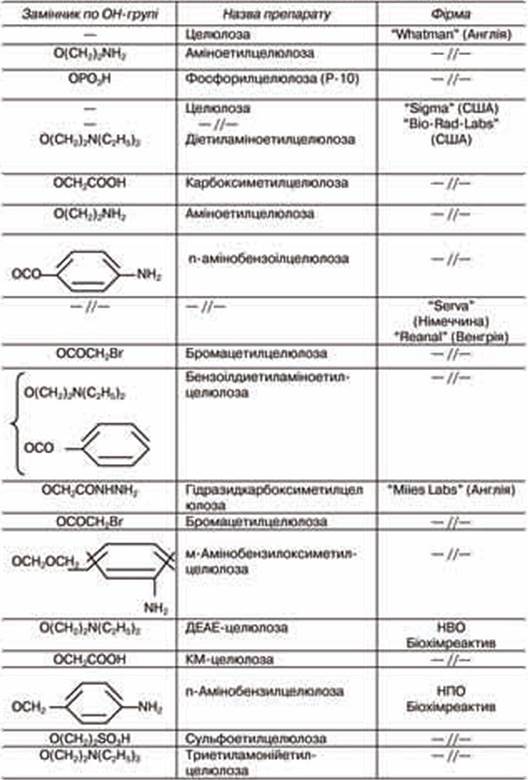
Таблиця 7.3.
Комерційні препарати похідних декстрину
(І.В. Берген та ін. 1987)
До групи декстранів можна віднести також крохмаль - суміш поліцукрів, основним компонентом якого амілозаа. Шляхом хімічної модифікації крохмалю зшиваючими агентами, такими як формальдегід, гліоксаль, глутаровий альдегід, одержаний новий носій губчастий крохмаль з підвищеною стійкістю до ферментів, які гідролізують поліцукри.
На основі декстранів одержують водорозчинні препарати з різними функціональними групами, які використовуються в медицині як носії лікарських речовин. Вибір носіїв на основі декстрану для медичних цілей обумовлено тим, що вони легко піддаються деградації.
Агароза- полі-β-галактопірозил-3,6-ангідро-α-L.-галактопіраноза:
Агароза широко використовується для іммобілізації, але вартість її зависока, через що розробляються методи її модифікації з метою одержання форм, які легко регенеруються. При охолодженні гарячого 2-6%-го водного розчину агарози до температури нижче 45 оС утворюються міцні крупнопористі гелі, які є свого роду складною сумішшю із заряджених і нейтральних поліцукрів. У процесі утворення гелю індивідуальні поліцукридні ланцюги утворюють подвійні спіралі, які потім агрегують з утворенням «вузлів». При температурі близько 100 оС гель агарози розплавлюється, тому на відміну від сефадексів його не можна автоклавувати. Висушування агарози призводить до незворотньої деструкції гелю, тому його необхідно зберігати у вигляді водної суспензії.
Гелі на основі агарози виробляються різними зарубіжними фірмами і випускаються під комерційними назвами «сефароза», «біогель А», «ультрагель А», «сефароза CL» (табл. 7.4).
Агар виділяють з клітинних мембран деяких червоних морських водоростей. Точний склад його невідомий. Однак установлено, що він містить два поліцукри: агарозу і агаропектин. Гелі агару утворюються аналогічно до агарозних при охолодженні водного розчину до температури 38 оС. Після висушування гель агару перетворюється на прозору плівку, що дає можливість використовувати для вивчення іммобілізованого в гелі ферменту оптичні методи дослідження.
До переваг агару варто віднести низьку вартість і нетоксичність. Відмінною особливістю цього носія є здатність формувати механічно міцні гелі навіть при малих концентраціях у розчині.
Суттєвого покращення властивостей агару можна досягнути зшиванням епіхлоргідрином, діепоксидними сполуками тощо. Зшитий агар стійкий до нагрівання навіть у лужному середовищі, має високу механічну міцність, а наявність на поверхні великої кількості гідроксильних груп дає змогу для проведення модифікації. Це дало підставу вважати його майже ідеальним носієм.
Альгінові кислоти і їх солі — це поліцукри бурих морських водоростей, які складаються з поєднаних β-1,4-зв’язками залишків D-маннуронової кислоти:
Таблиця 7.4.
Агароза і деякі її похідні (І. В. Березін та ін., 1987)
Характерною властивістю цих носіїв є різка залежність їх розчинності від температури і рН розчину. Так, альгінові кислоти добре розчинні в гарячій воді і мало — у холодній. Альгінати кальцію мають здатність утворювати гелі, які використовуються для іммобілізації ферментів, клітин, органел шляхом включення.
Гепарин — це кислий поліцукор, який містить ланки сульфатованої D-глюкуронової кислоти (або L-ідуронової) і сульфатованого глюкозаміну (або N-ацетил-глюкозаміну):
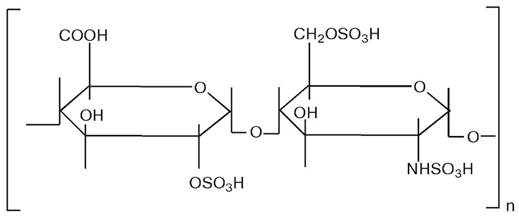
Він успішно використовується для одержання водорозчинних препаратів іммобілізованих ферментів, які використовуються у медицині для введення in vivo.
Загальними недоліками поліцукристих носіїв є їх нестійкість до дії мікроорганізмів і неспецифічна сорбція білків.
Хітин — природний амінополіцукор. Його можна розглядати як целюлозу, в якій СН2ОН-група замінена ацетамідним залишком:
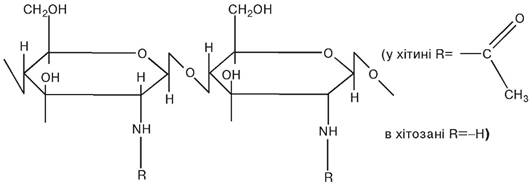
Він є основним компонентом зовнішнього скелету ракоподібних, комах, а також клітинних оболонок деяких грибів. Ця сполука є відходом промислової переробки креветок і крабів, тому доступна у великих кількостях при відносно невеликій вартості.
Хітин має пористу структуру, не розчиняється у воді, розбавлених кислотах і лугах, а також у органічних розчинниках. Для переведення у реакційноздатну форму він може модифікуватись глутаровим альдегідом, а також солями важких металів (наприклад Ti).
Обробка хітину концентрованими розчинами лугів (деацилювання) приводить до утворення хітозану. Хітозан, який має вільні аміногрупи, може використовуватися для ковалентної іммобілізації ферментів за допомогою таких біфункціональних реагентів, як діальдегіди, діізоціанати. На відміну від хітину хітозан розчиняється у мінеральних і органічних кислотах, тому для іммобілізації часто використовується у вигляді розчинів (рН 3-7).
При використанні хітозану як носія одержані препарати іммобілізованих ферментів мають високу каталітичну активність і стійкість до дії мікроорганізмів, а також спостерігається суттєве підвищення їх термостабільності.
Значний інтерес останнім часом викликають мікробні хіто- занази, які ще недостатньо вивчені. Для виділення хітозаназ із продуцента Bacillus sp. 739 і їх афінного очищення ефективним сорбентом виявився колоїдний розчин хітозану (Г.Е. Актуганов і ін., 2003). Для адсорбції доцільна концентрація хітозану 0,12-0,15 %, що сприяє значній економії носія і зберігає можливість його подальшої регенерації.
У природі хітозан розповсюджений не так широко, як хітин, і виявлений поки що лише у деяких видів нижчих грибів (К.Г. Скрябіна та ін., 2000). Тому у промислових масштабах його одержують в основному з хітину панцирів крабів або креветок шляхом лужного дезацетилювання.
Білкові носії. До них належать кератин, фіброїн, фібрин, колаген, міозин, сироватковий альбумін, казеїн та інші.
Використання білків як носіїв для іммобілізації ферментів має велике практичне значення, наприклад, у медицині. Такі носії дозволяють наблизитись до умов функціонування ферментів in vivo, вирішити проблему біодеградації і використати більшість із них у вигляді мембран і плівок. Іммобілізацію на білкових носіях можна проводити як у присутності зшиваючих агентів, так і без них.
Загальним недоліком для білкових носіїв, які використовуються в медицині, є їх імуногенність при введенні в організм (винятком є колаген і фібрин).
Найчастіше як носії використовуються кератин, фіброїн, колаген, міозин і сироватковий альбумін.
Колаген — фібрилярний білок групи склеропротеїдів. Він є основним компонентом хрящів і сухожилля, має високу стійкість до розриву. На своїй поверхні колаген має велику кількість реакційноздатних груп, його можна легко модифікувати, надаючи матриці широкий набір бажаних властивостей. Так, блокуванням аміно- або карбоксильних груп можна змінити поверхневий заряд носія і, відповідно, гідрофільно-гідрофобний баланс; за допомогою зшиваючих агентів можна одержати стиснену мікроструктуру.
Колаген має високу гідрофільність. Він здатний сорбувати від 1 до 5 г води на 1 г білка, залишаючись при цьому в нерозчинному вигляді і зберігаючи волокнисту структуру.
Продуктом переробки колагену є желатин — розчинна суміш поліпептидів. Одержують його тривалою обробкою колагену окропом, у ході чого гідролізуються деякі ковалентні зв’язки колагену. В результаті волокнистий нерозчинний колаген перетворюється на розчинну суміш поліпептидів, яка називається желатиною і має гелеву структуру.
Цінність цього носія полягає в його нетоксичності, легкій біодеградації, що дозволяє використовувати желатин у фармацевтичній і харчовій промисловості.
Кератин — фібрилярний білок групи склеропротеїдів, з якого майже повністю складається шерсть, волосся, рогові покриви, пір’я і т.д. Його, як правило, одержують при переробці пір’я (побічний продукт птахопереробних підприємств). Кератин доступний у великих кількостях і дешевий.
Синтетичні полімерні носії. Величезна різноманітність доступних синтетичних полімерів забезпечила їх широке використання як носіїв для іммобілізації ферментів. Вводячи в полімерні молекули різні функціональні групи, можна у широких межах змінювати фізичні і хімічні властивості носія.
Синтетичні полімери універсальні і можуть використовуватись як для ковалентної і сорбційної іммобілізації ферментів, так і для включення в структуру носія (в гелі, мікрокапсули, трубки).
Найбільш широко використовуються полімери на основі стиролу, похідних акрілової кислоти, полівінілового спирту, поліамідів, поліуретанів і ін. Структура і фізико-хімічні властивості синтетичних полімерних носіїв абсолютно різні і варіюють у широких межах. Серед них є носії у вигляді сферичних частинок, гранул, порошків, мембран, трубок, пористі носії з макро- сітчастою, ізопористою і гетеропористою структурами, які використовуються як для сорбційної іммобілізації, так і для одержання гелей, мікрокапсул, або з високореакційними функціональними групами — для ковалентної іммобілізації.
Полімери на основі стиролу. Вони є основою для багатьох промислових марок іонообмінних матеріалів — Дауекс і Амберліт. Для сорбційної іммобілізації використовуються як мікропористі, так і макропористі носії, а також носії, які мають макросітчасту ізопористу і гетеропористу структури. Макросітчасті полістіроли подібні до скла, вони мають стабільну структуру пор, не набухають у воді і мають високу механічну міцність. Немодифіковані полістірольні носії гідрофобні.
Введення реакційноздатних груп до складу синтетичних полімерів на основі стиролу дає можливість отримати нові види носіїв, придатних для хімічної іммобілізації.
Полімери на основі похідних акрілової кислоти. Одним із численних похідних акрілової кислоти, які широко використовуються для одержання полімерних гідрофільних носіїв, є акріламід. Його використовують для одержання гелю — поліакріламідний гель (ПААГ). Він випускається низкою фірм. Так, фірма Bio-Rad Labs (США) виробляє ПААГ і його похідні під назвою «біогелі» типу Р, Koch-Light (Велика Британія) — «ен- закріли», Reanal (Угорщина) — «акрілекси».
Фірми LKB (Швеція) та IBF (Франція) випускають також носії змішаного типу на основі ПААГ і агарози під назвою ультрагелі типу AcA. Це жорстка матриця, яка створюється агарозою з контролюючою пористістю, що забезпечується ПААГ. Носії випускаються у вигляді водної суспензії сферичних гранул і використовуються для синтезу афінних сорбентів і нековалентної іммобілізації ферментів.
Для ковалентної іммобілізації ферментів поліакріламідний носій активують одним із способів: або в готовий полімер долучають функціональні групи методом хімічної модифікації, або полімеризують відповідне функціональне похідне мономера.
Із інших похідних акрілової кислоти, які використовуються для одержання полімерних носіїв, є хлорангідрид метакрілової кислоти.
Більшість полімерів на основі акрілової кислоти не стійкі до впливу багатьох хімічних реагентів, а також набухають у воді і органічних розчинниках. Тому у випадках, коли необхідна жорстка структура носія, використовують змішаного типу носії — ультрагель типу АсА на основі синтетичного і природного полімерів. До синтетичних полімерів із жорсткою структурою належать сополімери похідних акрілової кислоти, які випускаються під назвою «сферон» фірмами Lachema (Чехія) і Realco Chem. Co (США). Це макропористі полімерні гелі. Вони
механічно міцні, хімічно і біологічно стійкі. Наявність гідроксильних груп на поверхні надає матриці схожість з сефарозою. Це дозволяє використовувати розроблені для сефарози методи активації носія.
Поліамідні носії. Це група різних гетероланцюгових полімерів з амідною групою, яка повторюється -C(O)-NH-. Один із способів їх одержання грунтується на гомополіконден- сації амінокарбонових кислот — найлон-6, капрон. Окрім найлона-6, для іммобілізації використовуються поліізонітрил- найлон, поліаміноарилнайлон та ін. Амідні групи надають полімерам гідрофільності.
Для використання як носіїв поліаміди активують, частково гідролізуючи їх, з подальшою обробкою, наприклад, глутаровим альдегідом.
Головною перевагою носіїв цього типу є те, що вони можуть бути створені в різній фізичній формі: у вигляді гранул, порошків, волокон, мембран, трубок тощо.
До групи поліамідних носіїв належать також полімери на основі N-вінілпіролідону.
Широке використання цих носіїв, перш за все для медичних потреб, обумовлено їх біологічною інертністю і стійкістю до впливу середовища. При використанні полівінілпіролідону і сополімерів на його основі одержані препарати іммобілізованих ферментів, які здатні повільно деградувати в організмі, причому швидкість розпаду залежить від природи другого мономера і концентрації зшиваючого агента у суміші.
Носії на основі полівінілового спирту. Ці носії, запропоновані Г. Манеке і Г. Фогтом (1980), мають високу реакційну здатність. Відповідна обробка дозволяє вводити в них різні функціональні групи: дісульфідні, альдегідні та ін. Для одержання гідрофільних гелів носії можуть бути зшиті глутаровим альдегідом у кислому середовищі, а в лужному — епіхлоргідрином або n-ксилилендіхлоридом:
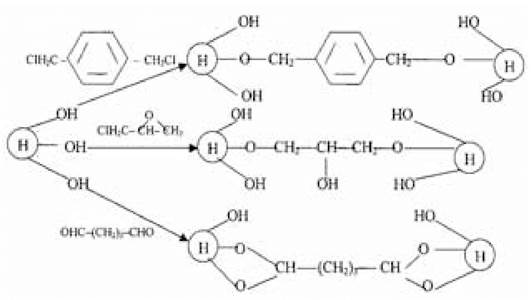
До переваг носіїв на основі полівінілового спирту слід віднести, окрім високого вмісту реакційноздатних груп, велику місткість.
Поліуретани. Гідрофільні поліуретанові полімери містять угруповання![]() Вони є зручними матеріалами для включення ферментів у гель.
Вони є зручними матеріалами для включення ферментів у гель.
Процес іммобілізації у даному випадку полягає у простому змішуванні компонентів. Поліуретани мають більшу стійкістью стосовно води, ніж поліаміди.
Органічні низькомолекулярні носії. Природні носії — ліпіди. Використання природних ліпідів як носіїв для іммобілізації вимагає спеціальної техніки і дуже трудомістке. Ця іммобілізація наближена до умов функціонування ферментативних систем у живій клітині, тому що використовуються, як правило, ліпіди — компоненти біомембран: гліцероліпіди, сфінголіпіди, холестерин, кардіоліпін.
У зв’язку з тим, що ці носії дорого коштують, а для проведення іммобілізації необхідне дороге і складне обладнання, вони використовуються переважно для одержання лікарських препаратів.
Як правило, ліпідні носії використовуються у вигляді моношарів на різних поверхнях або біошарів сферичної форми — ліпосом.
Моношари ліпідів на поверхні води. Ліпіди здатні утворювати мономолекулярні плівки на межі розділення фаз (вода : повітря або вода : неполярний розчинник). Ліпідні молекули в моношарі розміщені таким чином, що їх полярні головні групи занурені у водну фазу, а вуглеводневі частини направлені у повітря або занурені в органічний розчинник. Така плівка здатна сорбувати білкові молекули.
Одержання моношарів на поверхні води вимагає спеціальної техніки і є досить трудомісткою процедурою, що обмежує їх використання.
Моношари ліпіду на твердій поверхні. Ці системи як носії були запропоновані О.М. Полтораком і Є.С. Чухрай (1966). Суть методу полягає у нанесенні ліпідного моношару на тверду підкладку (силікагель, сажа, аеросил) з подальшою адсорбцією білка із водного розчину. Як ліпідну матрицю використовують зазвичай лецитин, фосфатидилетаноламін і холестерин. Розроблений також метод одержання штучних змішаних лецитин-холестеринових шарів.
Можливість змінювати структуру і орієнтацію молекул у ліпідних шарах досягається підбором полярності носія і природи розчинника ліпіду, який використовується.
Ліпосоми. Вперше ліпосоми були описані А. Бенгемом в 1964 р. Для їх виготовлення часто використовуються фосфатидилхоліни (лецитіни), фосфатидилетаноламін, фосфатидилсерин, кардіоліпін, сфінгомієлін, причому вони утворюються як із чистих ліпідів, так і сумішей.
Існує три різних види ліпосом: мультиламелярні, монола- мелярні і макровезикулярні. Мультиламелярні ліпосоми — це замкнуті структури, які складаються із декількох концентричних ліпідних біслоїв, відокремлених один від одного водним середовищем. Сумарний діаметр мультіламелярних ліпосом коливається від 1-2 до 50 мкм.
Ультразвукова обробка мультиламелярних ліпосом приводить до трансформації їх у прості або моноламелярні з меншими розмірами частинок. Діаметр моноламелярних ліпосом становить від 20,0 до 50 нм.
Третій тип ліпосом — макровезикулярні, які утворюються, наприклад, шляхом злиття малих ліпосом, що індукуються іонами Са2+, а також присутністю фосфоліпідів з негативно зарядженими головними групами. Такі ліпосоми складаються з одного бішару і можуть мати діаметр від 60,0 нм до 100 мкм.
Розмір і форма ліпосом залежить від способу їх виготовлення, а також від таких факторів, як кислотність середовища, присутність неорганічних солей і природи ліпіду, який використовується.
Широке використання ліпосом як носіїв для іммобілізації ферментів і лікарських препаратів обумовлено простотою одержання і легкістю регенерації іммобілізованого препарату, а також можливістю застосування in vivo.
Синтетичні аналоги ліпідів (поверхнево-активні речовини). Поверхнево-активні речовини (ПАР) складаються з молекул дифільної природи, які містять у своєму складі як полярну головну групу, так і неполярну вуглеводневу частину. Природні ліпіди, в принципі, теж відносяться до ПАР. Синтетичні ПАР — це сполуки, чимало з яких є продуктами крупно- тоннажного виробництва.
Залежно від того, які групи присутні у головній частині молекули, усі ПАР можна розділити на чотири основних типу: аніонні, катіонні, неіонні і цвітеріонні. Наприклад, біо-2-етил- гексиловий ефір натрієвої солі сульфоянтарної кислоти — аніонна ПАР; цетилтриметиламонійбромід — катіонна ПАР; полі (9-10) оксиетилена октилфеніловий ефір (трітон Х-100) — неіонна ПАР; алкілдіметилкарбоксибетаін — цвітеріонна ПАР. Фірмою Servera випускається понад 30 найменувань тільки неіонних ПАР різної будови.
Як носії для іммобілізації ферментів використовуються такі форми ПАР: обернені (спрямовані) міцели ПАР в органічних розчинниках; синтетичні миючі засоби (СМЗ) з біодобавками — ферментами; носії з полімеризованих ПАР.