БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
Розділ 7. БІОТЕХНОЛОГІЯ ВИРОБНИЦТВА І ЗАСТОСУВАННЯ ІММОБІЛІЗОВАНИХ ПРЕПАРАТІВ
7.5. МЕТОДИ ІММОБІЛІЗАЦІЇ ФЕРМЕНТІВ
Існуючі способи іммобілізації ферментів діляться на 2 групи: фізичні і хімічні методи.
7.5.1.Фізичні методи іммобілізації
7.5.1.1.Іммобілізація ферментів шляхом адсорбції на нерозчинних носіях
Адсорбційна іммобілізація є найдавнішим з усіх існуючих методів. Так, ще в 1916 р. Дж. Нельсон і Е. Гріффін провели успішну іммобілізацію інвертази шляхом адсорбції на активованому вугіллі і гелі гідроксиду алюмінію.
Іммобілізація ферментів адсорбцією на нерозчинних носіях передбачає контакт водного розчину ферменту з носіями органічної і неорганічної природи. Утримання адсорбованої молекули ферменту на поверхні носія забезпечується за рахунок неспецифічних ван-дер-ваальсових взаємодій, електростатичних взаємодій, водневих зв’язків і гідрофобних взаємодій між носієм і поверхневими групами білка-ферменту. Тип зв’язку залежить від природи носія і функціональних груп на поверхні молекули ферменту.
Методика адсорбційної іммобілізації. На практиці для одержання іммобілізованих адсорбцією ферментів використовуються такі методичні підходи.
Статичний метод (рис. 7.3, а) найбільш простий і полягає в тому, що носій додають у водний розчин ферменту і одержану суміш залишають на певний час без перемішування. Іммобілізація досягається за рахунок довільної дифузії ферменту до поверхні носія з подальшою адсорбцією. Недоліком методу є те, що для одержання препарату з високим вмістом адсорбованого ферменту потрібен тривалий час.
Спосіб з перемішуванням, або динамічний метод. При ньому носій суспендується в розчині ферменту і одержана суміш безперервно перемішується за допомогою магнітного чи механічного змішувача, або на лабораторній гойдалці (рис. 7.3, б). Цей спосіб більш ефективний за попередній.
Відокремлення іммобілізованого ферменту проводиться шляхом фільтрування або центрифугування. Після відмивання неадсорбованого ферменту препарат готовий до використання.
Метод електроосадження. У цьому випадку в розчин ферменту занурюють два електроди з нанесеним на поверхню одного з них шару носія. При вмиканні електричного струму молекули ферменту завдяки наявним на їх поверхні зарядженим групам починають переміщуватися в розчині й осаджуються на поверхні носія (рис. 7.3, в).
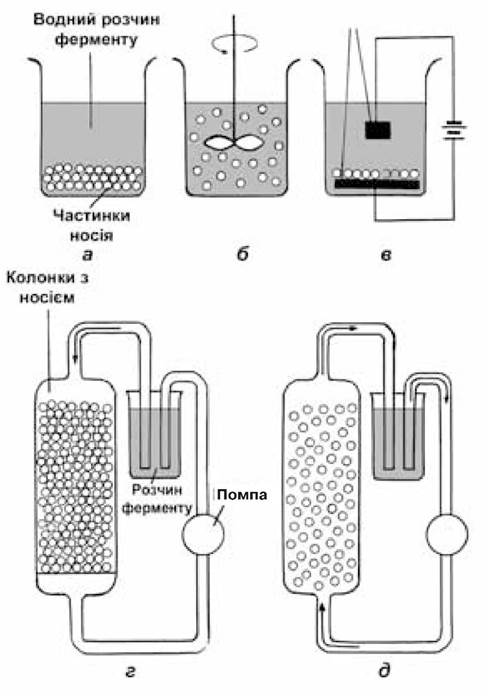
Рис. 7.3. Способи адсорбційної іммобілізації ферментів
(за Березіним І.В. та ін., 1987)
Метод нанесення в колонці. Найбільш зручний для технологічного використання іммобілізованого ферменту. Через колонку, заповнену носієм, за допомогою помпи прокачують розчин ферменту, причому швидкість потоку має бути такою, щоб частинки були у завислому стані, утворюючи «кип’ячий шар». Промивку теж проводять у колонці (рис. 7.3, г, д).
Процес адсорбції і міцність зв’язування ферменту з носієм значною мірою залежить від умов проведення іммобілізації. Основними факторами, які впливають на адсорбцію ферменту, є питома поверхня і пористість носія, значення рН та іонної сили розчину ферменту, його концентрація і температура проведення процесу адсорбції.
Питома поверхня і пористість носія. Сорбційна ємність носія пропорційна його питомій поверхні у випадку, коли носій непористий або коли діаметр пор буде приблизно удвічі більший за розмір молекули білка. Коли ж пори будуть малими, то не зможуть вмістити молекулу ферменту і сорбційна ємність носія буде незначною. При цьому вважається, що молекулярні розміри субстрату набагато менші, ніж ферменту, і молекула субстрату здатна проникнути у пору, де знаходиться сорбований фермент. У разі, коли субстратом є речовина з дуже великою молекулярною масою, вибір діаметра пор носія уже диктується розмірами молекули субстрату. До того ж, високо- молекулярний субстрат сам може слугувати носієм для іммобілізації ферменту. Наприклад, для адсорбційної іммобілізації ферментів целюлазного комплексу з успіхом був використаний як носій його субстрат — целюлоза.
Значення рН. Реакція середовища дуже впливає на ефективність сорбції ферменту на поверхні носія, особливо якщо сорбція відбувається головним чином за рахунок електростатичних взаємодій. Це пов’язано з тим, що при зміні рН змінюється стан іонізації іоногенних груп носія і білка, які відповідальні за адсорбцію. При використанні носіїв, які не є іонообмінниками, максимальна адсорбція досягається в ізоелектричній точці білка.
Іонна сила. Значення цієї величини впливає на міцність зв’язування ферменту з носієм. При високій концентрації солей присутні в розчині іони витісняють з поверхні носія зв’язані за
рахунок електростатичних взаємодій молекули білка-ферменту. Тобто підвищення іонної сили розчину, як правило, викликає десорбцію ферменту.
Концентрація ферменту. При збільшенні концентрації ферменту в розчині кількість сорбованого на носії ферменту збільшується і відповідно зростає питома каталітична активність іммобілізованого препарату. Але ця закономірність існує до певної межі. При подальшому підвищенні концентрації ферменту не збільшується сорбція ферменту на носії, тобто відбувається «насичення» носія.
Температура. Підвищення температури по-різному впливає на процес адсорбції. З одного боку, сильне нагрівання призводить до денатурації білка і втрати каталітичної активності. З іншого — зростання температури зазвичай забезпечує прискорення процесу. Отже, є оптимальна температура для проведення адсорбційної іммобілізації, величини якої залежать від природи ферменту і носія.
Таким чином, ефективність адсорбційної іммобілізації ферментів визначається тонким балансом цілої низки факторів. Порушення цього балансу внаслідок змін будь-якого із зовнішніх факторів може призвести до різкого ослаблення взаємодії ферменту з носієм і, як наслідок, до його десорбції.
Ефективність сорбції може бути підвищена використанням попередньо модифікованих носіїв і ферментів.
Іммобілізація на попередньо модифікованих носіях. Попередня модифікація носія у багатьох випадках дозволяє суттєво підвищити міцність зв’язування ферменту на матриці.
Модифікуючими агентами для носіїв виступають гідрофобні речовини, розчини іонів металокомплексоутворювачів, а також речовини з великою кількістю груп, здатних до електростатичної взаємодії з білковою глобулою.
1. Обробка носіїв іонами металів (Ti, Sn, Zn, V, Fe) підвищує міцність зв’язування ферменту з носієм за рахунок утворення комплексу білка з іонами металів. Іон металу відіграє роль містка, який з’єднує молекулу ферменту з носієм (рис. 7.4, а). Цей метод ефективний при іммобілізації різних ферментів на таких носіях, як, наприклад, целюлоза, найлон, скло, фільтрувальний папір тощо.
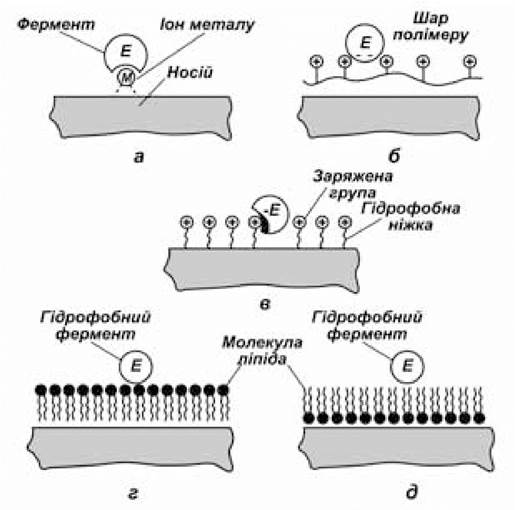
Рис. 7.4. Адсорбційна іммобілізація ферментів на попередньо модифікованих носіях
(за Березіним І.В. та ін., 1987)
2. Модифікація гідрофобними сполуками теж сприяє підвищенню ефективності сорбції, що забезпечується гідрофобними взаємодіями між модифікатором і неполярними ділянками на поверхні білкової глобули (рис. 7.4, в). Із носіїв найчастіше використовуються різні агарози, які ковалентно модифіковані гідрофобними групами (алкільними, фенільними та ін.); поліцукристі носії, модифіковані таніном та інші. На кінці такої гідрофобної «ніжки» може бути присутня й заряджена група, завдяки чому забезпечується взаємодія з ферментом одночасно за рахунок електростатичних і гідрофобних сил.
3. Обробка носія речовинами, молекули яких містять велику кількість функціональних груп, здатних взаємодіяти з групами на поверхні білкової глобули за рахунок електростатичних сил і водневих зв’язків (рис. 7.4, б). Наприклад, полімеризація на поверхні носія силохрому акрілової кислоти, вінілацетата та ін. з подальшою хімічною модифікацією полі- мера приводить до утворення носія з високою поверхневою концентрацією функціональних груп (гідроксильних, аміноалкильних, аміноарильних і гідразідних), здатних до електростатичної взаємодії з білковою глобулою.
Як модифікатор часто використовується також альбумін, який наноситься на носій шляхом адсорбції, а потім піддається денатурації нагріванням. Шар денатурованого альбуміну утворює на поверхні носія «м’яку» підкладку з великою кількістю функціональних груп, які здатні міцно зв’язувати молекули ферменту, водночас забезпечуючи для них сприятливе мікро- оточення. В результаті у багатьох випадках при обробці альбуміном вдається досягти підвищення ефективності сорбції і покращення каталітичних характеристик іммобілізованого ферменту.
Модифікація носія, окрім підвищення ефективності сорбції, часто забезпечує також покращення каталітичних властивостей іммобілізованого ферменту за рахунок створення для його молекул сприятливого мікрооточення. Крім того, інколи без попередньої модифікації носія взагалі не вдається зберегти каталітичну активність ферменту при адсорбційній іммобілізації. Наприклад, якщо фермент з низькою стабільністю у кислому середовищі рН, то при його адсорбції на силікагелі може відбутися втрата каталітичної активності через те, що поверхня цього носія має кислий характер (рН ~ 4). Для уникнення інактивації ферменту необхідно носій витримати деякий час у буферному розчині зі значенням рН, яке відповідало б оптимальному рН для ферменту.
Аналогічна проблема часто виникає при адсорбційній іммобілізації ферментів, яким для нормального функціонування необхідна наявність в активному центрі іона металу.
При іммобілізації металозалежних ферментів може відбутись вихід іона металу з активного центру ферменту і його зв’язування на поверхні носія, що супроводжується частковою або повною втратою його каталітичної активності. Це небажане явище можна усунути шляхом обробки носія розчином, який містить іони відповідного металу, а отже, насичити центри сорбції іонів металів на носії.
Модифікація ферментів аналогічно передбачає введення іоногенних груп (полікислоти, карбоксиметилцелюлоза, залишки янтарної кислоти та ін.) або обробку гідрофобними речовинами. У деяких випадках для підвищення зв’язку адсорбованого ферменту з носієм та запобігання його змивання з носія (десорбції) використовується обробка його біфункціональним зшиваючим реагентом. У цьому випадку поверхня носія виявляється покритою плівкою зі зшитих між собою молекул ферменту. Як зшиваючий агент найчастіше використовується глутаровий альдегід.
Переваги і недоліки методу. Іммобілізація ферментів шляхом адсорбції широко розповсюджена. Метод простий, доступний, дешевий, а носії, які використовуються для проведення адсорбції, порівняно недорогі. Іммобілізовані шляхом адсорбції ферменти в більшості випадків мають високу каталітичну активність і переваги в технологічному плані.
Одним із суттєвих недоліків методу є десорбція ферменту, тобто сповзання його з носія, що призводить до втрати дорогого біокаталізатора та забруднення кінцевого продукту, який одержують. Частіше це трапляється в момент додавання субстрату до іммобілізованого ферменту. До інших недоліків можна віднести низький вихід зв’язаного ферменту з розрахунку на одиницю маси носія, а також часткову або повну його інактивацію.
Крім того, недоліком адсорбційного методу іммобілізації є неможливість дати загальні рекомендації, які дозволили б заздалегідь зробити правильний вибір носія і оптимальних умов проведення процесу іммобілізації конкретного ферменту. Це завдання доводиться щоразу вирішувати заново, використовуючи метод проб і помилок.