БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
Розділ 7. БІОТЕХНОЛОГІЯ ВИРОБНИЦТВА І ЗАСТОСУВАННЯ ІММОБІЛІЗОВАНИХ ПРЕПАРАТІВ
7.5. МЕТОДИ ІММОБІЛІЗАЦІЇ ФЕРМЕНТІВ
7.5.2. Хімічні методи іммобілізації
7.5.2.1.Основні принципи конструювання препаратів ковалентно іммобілізованих ферментів
При проведенні іммобілізації хімічним методом використовується величезна різноманітність хімічних реакцій, вихідних компонентів та умов перебігу реакцій.
Практично всі функціональні групи білків (α і ε-аміногрупи, α, β і γ-карбоксильні групи, сульфогідрильні групи цистеїну, ароматичні кільця тирозину і триптофану, імідазольна група гістидіну, гідроксильна група амінокислот) можуть бути використані для зшивання ферменту з носієм. Зокрема, широко використовують реакції, які ведуть до утворення пептидних зв’язків між аміногрупами ферменту і карбоксильними групами носія або, навпаки, між карбоксильними групами каталізатора і аміногрупами носія.
В основі методик, що використовуються для хімічної іммобілізації, лежать реакції утворення:
а) амідного зв’язку [-C(0)-NH];
б) карбамідних зв’язків (похідних сечовини: -(NH,0)-C(O,S)-NH-);
в) вторинних амінів [-NH-];
г) азосполучення (утворення азосполук зі зв’язком -N=N-);
д) тіолдисульфідного обміну та інші.
Але незалежно від кількості і хімічної природи компонентів, які використовуються в процесі іммобілізації, кількості і труднощів окремих стадій цього процесу, створюється одна із трьох моделей, до складу яких входить не більше трьох елементів: фермент (Ф), носій (Н) і зшиваючий бі- або поліфункціональний реагент (С, З), який називається «зшивка», «вставка», «спейсер», «ніжка» і займає проміжне положення між молекулами, що зшиваються.
Таким чином, ковалентна іммобілізація ферментів передбачає створення конструкцій, сполучених хімічними зв’язками трьох елементів: НЗФ (максимум) або двох НФ і ЗФ (мінімум). У свою чергу принципи конструювання відповідних моделей можна назвати термінами: «пришивкою» (для НФ), «зшивкою» (для НЗФ) і «вшивкою» для (ЗФ).
Утворення хімічних зв’язків між елементами можливе тільки за наявності специфічних реакційноздатних груп у всіх реагентів, що вступають у взаємодію: ферменту, носія і зшиваючого агента.
За наявності на поверхні носія функціональних груп, здатних вступати у хімічні реакції з функціональними групами ферменту з утворенням ковалентних зв’язків, методика хімічної іммобілізації аналогічна адсорбційній. В розчин ферменту вводиться носій і на ньому проходить адсорбція ферменту, але вона незворотна, бо фермент пришивається до носія однією або декількома ковалентними зв’язками — Н-Ф (рис. 7.6, а).
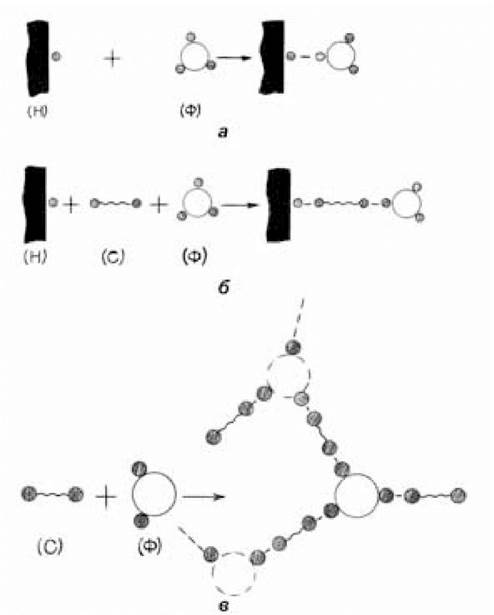
Рис. 7.6. Блок-схеми ковалентної іммобілізації ферментів
(за Березіним І.В. та ін., 1987)
У разі, коли тісний контакт з носієм може виявитись небажаним, наприклад, через несприятливі зміни мікросередовища ферменту, стеричних і дифузних обмежень, необхідно віддалити фермент від носія на деяку відстань. Ковалентна іммобілізація у цьому випадку відбувається шляхом зшивки ферменту з носієм за допомогою зшиваючого реагента різної довжини — Н-З-Ф (рис. 7.6, б).
За різноманітністю методичних прийомів цей спосіб незрівнянно багатший і гнучкіший за попередній за рахунок зшиваючого агента. По-перше, підбираючи довжину зшиваючого агента (або підбираючи оптимальну суміш зшиваючих агентів різної довжини), можна змінювати каталітичні характеристики іммобілізованого ферменту.
По-друге, можна спеціально конструювати зшивку так, щоб вона містила зв’язок, лабільний за певних умов або такий, що специфічно розщеплюється певними реагентами (зокрема, ферментативно). Це дає ключ до контрольованого відокремлення іммобілізованого ферменту від носія, наприклад, при вирішенні проблем направленого транспорту ферментів у живому організмі.
Ковалентна іммобілізація можлива і в системах, які початково не містять носія, а тільки фермент і зшиваючий реагент (З-Ф). Носій (як тверде тіло) формується безпосередньо у процесі іммобілізації, або ж сам фермент слугує одночасно і носієм. Таким чином, відбувається ковалентне вшивання молекули ферменту в різні типи сіток (рис. 7.6, в). Ідея конструювання ферментних сіток (ретикуляція ферментів) випливає із полі- функціональної природи самої молекули ферменту, який має на поверхні, окрім активного центру, велику кількість реакційноз- датних груп. При введенні в розчин ферменту біфункціонального зшиваючого реагента окремі молекули ферменту зшиваються одна з одною і утворюють сітку, в якій вузлами слугують самі молекули ферменту. Залежно від природи і кількості зшиваючого агента можна одержати як водорозчинні, так і водонерозчинні препарати.
Інший спосіб ретикуляції заснований на використанні ферментів, попередньо ковалентно модифікованих зшиваючим реагентом, який має подвійний зв’язок (наприклад, акрилоілхлоридом). У цьому випадку при співполімеризації білкового макромономера з низькомолекулярними мономерами (наприклад, з акриламідом), утворюються сітчасті полімерні гелі, зшиті білком або додатковим зшиваючим мономером (наприклад, N, N-метилен-біс-акриламідом). У наведеній системі вихідний стан — рідкий розчин, а кінцевий (після полімеризації) — тверде тіло (гель), причому, звичайно, воно набуває форми тієї посудини (реактора), в якій проводиться полімеризація.
Зшивкою білка в об’ємі розчинника (сополімеризація) одержують тривимірний гель (рис. 7.7, а) у вигляді крупного однорідного блока, який можна механічно подрібнювати і використовувати у вигляді частинок у суспензіях.
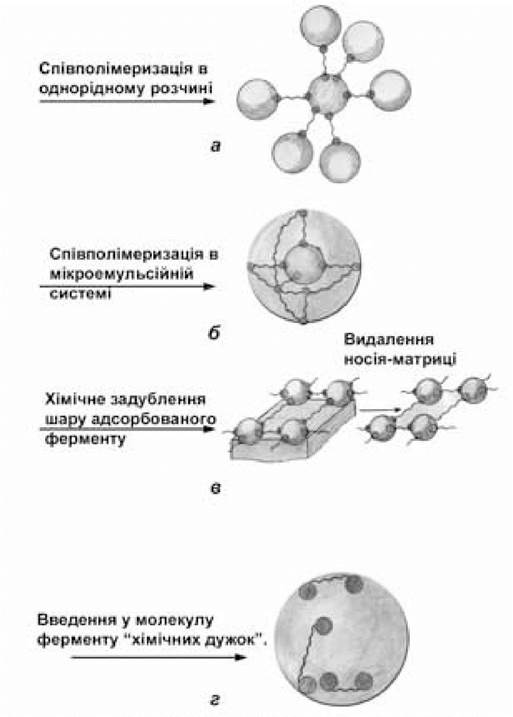
Рис. 7.7. Типи ретикуляції ферментів
(за Березіним І.В. та ін., 1987):
а — міжмолекулярна трьохмірна сітка; б — сітчаста оболонка навколо молекули ферменту (молекулярно-іммобілізований фермент); в — міжмолекулярна двомірна сітка; г — внутрішньомолекулярна сітка із по- ліпептидних ланцюгів білка та «хімічних дужок».
Тривимірний гель можна готувати і безпосередньо у вигляді дрібних частинок сферичної форми шляхом емульсійної полімеризації. Емульсії одержують диспергуванням водного розчину, який містить мономери в органічному розчиннику, що не змішується з водою. Варіантом таких систем є мікроемульсії або гідратовані обернені (спрямовані) міцели поверхнево-активних речовин (ПАР) в органічних розчинниках. В міцелярних системах розміри «крапельок», які містять модифікований фермент і мономери, можна варіювати і навіть одержувати їх близькими до власних розмірів молекул ферменту. При їх використанні можна обшивати окремі молекули ферменту полімерною оболонкою заданої товщини, тобто одягти фермент у «сорочку, яка зшита за міркою» (рис. 7.7, б). Це нова якість іммобілізації — молекулярний рівень.
Процес ретикуляції може відбуватись не тільки в розчині ферменту, але й при використанні його іммобілізованних препаратів. Так, додаткова обробка адсорбційно іммобілізованого ферменту на інертному носії зшиваючим агентом приведе до — підвищення міцності (задублення) препарата. Носій тут не бере участі в хімічній реакції, а слугує лише матрицею для організації шару (моношару) адсорбованого ферменту і обумовлює двовимірну направленість ретикуляції. До того ж, носій може бути взагалі видалений (наприклад, нітроцелюлозу розчиняють у метанолі) і таким чином одержують зшиту ферментну плівку (рис. 7.7, в).
Препарати молекулярно іммобілізованих ферментів можуть бути одержані, якщо обидві групи біфункціонального зшиваючого реагента взаємодіють з однією і тією спмою молекулою білка — ферменту. Тут можна говорити про накладання «хімічних дужок», які внутрішньомолекулярно закріплюють структуру ферменту (рис. 7.7, г).