БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
РОЗДІЛ 9. ВИКОРИСТАННЯ ІММОБІЛІЗОВАНИХ ФЕРМЕНТІВ У АНАЛІТИЧНІЙ РОБОТІ
9.6.ІМУНОФЕРМЕНТНИЙ АНАЛІЗ (ІФА) І ЙОГО ВИКОРИСТАННЯ
Серед вимог до сучасних методів біохімічного аналізу найважливішим є специфічність, тобто здатність детектувати (виявляти) дану речовину у складних багатокомпонентних середовищах, таких як сироватка крові, сік рослин або ферментаційне середовище. Найбільшу специфічність мають імунохімічні методи, що грунтуються на реакції антитіл з антигеном, які утворюють одне з одним стійкі комплекси.
Сутність будь-якого імунохімічного аналізу зводиться до того, щоб після завершення реакції антиген-антитіло визначити концентрацію надлишкового компонента (антигена або антитіла), який не вступив у реакцію. Оскільки ці концентрації невисокі (10-12 - 10-8 моль/л), для їх виявлення зазвичай використовують легко детектовану мітку (радіоактивний йод, трітій). Нові можливості були відкриті при використанні ферментів для підвищення чутливості імунохімічних методів аналізу. Виявилося, що без втрати чутливості методу радіоактивна мітка може бути замінена приєднанням ферменту, який після реакції виявляється за його каталітичною активністю.
Поєднання ферментативних та імунохімічних методів аналізу зумовило створення імуноферментних методів аналізу, в яких антитіло виступає як специфічний детектор речовини, що визначається, а фермент - як маркер імунохімічної реакції, за допомогою якого візуалізується утворення комплексу. В ІФА використовуються різноманітні методи ферментативного аналізу, що визначає її високу специфічність і чутливість.
Принципи імунохімічного аналізу
ІФА - процес утворення кон’югату відомого антитіла і ферменту та наступного приєднання отриманої комплексної сполуки до антигена.
Для проведення ІФА потрібна іммобілізація антитіла або антигена на твердому носії (підкладці) шляхом гідрофобної, електростатичної взаємодії або в результаті ковалентного зв’язування антитіла чи антигена з носієм.
Антитіло, утворюючи комплекс з антигеном, може забезпечити унікальне за специфічністю виявлення речовини в будь- яких складних багатокомпонентних системах. Спочатку основою імуноферментного аналізу була властивість антитіл (Ab) «склеювати» антигени (Ag). Цей процес подається наступною системою рівняння:
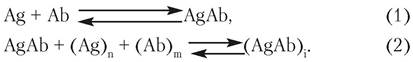
Оскільки молекули антитіл є двовалентними, вони здатні зв’язуватися з двома молекулами антигену в комплекс, який, у свою чергу, може зв’язувати інше антитіло і т.д. Утворення таких агрегатів можна виявити за збільшенням помутніння розчину, або за випадінням в осад. Цей підхід використовується, наприклад, для визначення груп крові при «склеюванні» еритроцитів антитілами тієї чи іншої специфічності. Така реакція одержала назву гемаглютинації і досі широко використовується. Взаємодія білкових антигенів з антитілами викликає їх осаджування, тобто преципітацію. Цей метод також широко застосовується при визначенні білків плазми крові в концентрації 10"6 г/мл. Але ці методи не можуть забезпечити кількісне визначення речовин. Вони належать до якісних або напівкількісних.
Принципово новий крок був зроблений при використанні в імунохімічних реакціях компонентів, помічених маркером, який детектується одним із відомих фізико-хімічних методів з високою чутливістю.
Визначення концентрації антигену ґрунтується на принципі конкурентного зв’язування антитілами міченого і неміченого антигена. Суть цих методів подається таким рівнянням:
![]()
де: Ag* і Ag - визначуваний антиген з міткою і без мітки;
Ab - антитіла;
AgAb і Ag*Ab - відповідні комплекси.
Для визначення концентрації комплексу Ag*Ab його потрібно віддокремити від вільного міченого антигена Ag*, або змінити властивості маркера в комплексі з антигеном. Обидва принципи знайшли практичне застосування в методах імунохімічного аналізу.
Маркери в імунохімічному аналізі
Як мітки використовуються різні речовини: радіоактивні ізотопи 125I або 3Н, ферменти або їх субстрати, флуоресцюючі барвники. Від чутливості маркера залежить чутливість методу аналізу. Вибір маркера і способу його «прив’язування» до антигену є одним із важливих етапів у проведенні аналізу.
Радіоактивні мітки. Вперше вони були запропоновані американськими дослідниками (Берсон С.А., Ялоу Р.С., 1959) і спочатку мали широке застосування. Однак сьогодні перевага надається маркерам-ферментам. Це зумовлено труднощами, пов’язаними з використанням ізотопних маркерів. Це складність і висока вартість обладнання, необхідність централізованої системи розподілу імунохімічних наборів, мічених радіоактивними ізотопами та небезпека ізотопів для навколишнього середовища. Тому були запропоновані маркери-ферменти.
Ферментні мітки. З відомих нині понад 2000 різних ферментів, тільки деякі використовуються в імуноферментному аналізі. Це пояснюється високими вимогами, які висуваються до властивостей ферментів-маркерів. Фермент має бути високоактивним, а продукти його реакції виявлятися з високою чутливістю; стабільним, щоб активність його зберігалася протягом року; вміст ферменту-маркера у досліджуваному зразку має бути мінімальним. Через це для різних об’єктів використовуються різні ферменти. У багатьох випадках, коли необхідний якісний результат, оцінка імунохімічної реакції може бути проведена візуально.
Субстратні мітки. Крім ферментів, як маркери можуть використовуватися субстрати. Зокрема, часто використовуються як мітки АТФ і НАД, що можуть бути «пришиті» до молекули антигену через аденіновий залишок таким чином, що зберігається їх здатність взаємодіяти з ферментом. Аналогічно були використані субстрати пероксидази (люмінол, ізолюмінол).
Одержання кон’югатів з ферментами
Для введення ферментної мітки розроблено багато різних хімічних, біохімічних та імунологічних способів. Першим реагентом, який використовувався для синтезу імуноферментних кон’югатів, був глутаровий альдегід, що реагує з аміногрупами лізину білкових молекул. За його допомогою були одержані кон’югати антитіл і антигенів з пероксидазою, лужною фосфатазою, глюкооксидазою, глюкоамілазою. Склад одержаних кон’югатів можна варіювати, змінюючи концентрацію альдегіду і білкових компонентів.
З водонерозчинних карбодиімідів найбільш успішно для синтезу кон’югатів використовуються 1-етил-3-(3-діметиламінопропіл) карбодиімід і 1-циклогексил-3-(2-морфоліноетил) карбодиімідметил-n-толуолсульфонат, які утворюють пептидний зв’язок між вільними карбоксильними і NH2-групами білкових компонентів.
Широкого розповсюдження набув метод синтезу імунопероксидазних кон’югатів, в основі якого лежить окислення перйодатом натрію вуглеводної частини молекули пероксидази з утворенням альдегідних груп.
Розроблені методи одержання імуноферментних кон’югатів з β-галактозідазою, що містить до 20 SH-груп. Вони базуються на тому, що зв’язування через них антигенів не відображається на каталітичних функціях ферменту.
Враховуючи те, що ферменти з великою молекулярною масою можуть інгібувати реакцію антиген-антитіло за рахунок стеричного екранування антигенних детермінант, у деяких випадках доцільно використовувати як мітки не цілу молекулу ферменту, а пептид, який має специфічну активність. Такий синтез здійснювався при одержанні кон’югата Fab-фрагмента з гемоктапептидом, що має пероксидазну активність.
Ковалентні методи одержання імуноферментних кон’югатів широко розповсюджені, однак у деяких випадках дія зшиваючого реагента негативно впливає на ферментативну та імунологічну активність компонентів гібридної макромолекули.
У зв’язку з цим певний інтерес викликають імунологічні методи введення ферментної мітки - це метод «гібридних антитіл». Гібридомна технологія відкриває принципово новий шлях одержання гібридних антитіл. Він полягає в тому, що зливаються моноклональні клітини, специфічні проти даного антигену і ферменту-маркера, в результаті чого утворюються гібридоми другого покоління, які синтезують антитіла з двома специфічностями.
Розділення вільних і зв’язаних маркерів
Одним із важливих моментів у проведенні імунофермент- ного аналізу є розділення вільних і зв’язаних з антитілами мічених компонентів. Найбільш розповсюдженим є метод, заснований на іммобілізації антитіл на твердій підкладці (стінки полістирольних пробірок або кульок, целюлозні диски, гранули макропористих носіїв для хроматографії). Особливо перспективними є полістиролові пробірки або планшети, що містять 96 лунок. Суть методів розділення полягає в тому, що одні з компонентів, наприклад, антитіла, можуть бути сорбційно іммобілізовані на поверхні вимірювальної кювети. Після проведення інкубації зі зразком антиген сорбується на поверхні, а всі інші компоненти залишаються в розчині і можуть легко відділятися, наприклад, за допомогою пористих частин під дією магнітного поля. Основні проблеми, які виникають при реалізації твердофазових методів розділення, є стандартизація поверхні і зменшення неспецифічного зв’язування мічених компонентів з носієм.
Інший шлях розділення мічених і немічених компонентів грунтується на принципі модуляції активності ферментів антитілами. При взаємодії антитіл з гаптеном, «пришитим» поблизу активного центру ферменту, відбувається повне інгібування його активності. При додаванні до такої системи вільного гаптена відбувається дисоціація комплексу, в результаті чого активність ферменту відновлюється (рис. 9.4, рівняння 4, 5):
![]()
де: Е-Г - комплекс ферменту (Е) з гаптеном (Г);
Ab - антитіло;
S - субстрат;
Р - продукт ферментативної реакції.
Ці методи одержали назву гомогенного аналізу.
Методи імуноферментного аналізу (ІФА)
Методи ІФА поділяються на дві великі групи: твердофазові і гомогенні.
При твердофазових методах, які одержали назву ELISA (enzyme linced immunosorbent assy), використовується принцип іммобілізації одного із компонентів (антигену Ag або антитіла Ab) на твердому носії (підкладці) шляхом гідрофобної, електростатичної взаємодії. Як носій найчастіше використовують полімерний матеріал. Речовина, що визначається (антитіло чи антиген), відповідно конкурує з аналогічними речовинами, в які введений фермент-маркер, за зв’язування на сорбенті:
![]()
Після видалення речовин, які не прореагували, визначається концентрація ферменту, що зв’язався з носієм.
У системах твердофазового імуноферментного аналізу (ELISA) антигенів (рис. 9.5) можна виділити декілька основних методів (варіантів).
1. Прямий конкурентний метод - антитіла, іммобілізовані на твердій фазі (носії), а мічений і немічений антигени, додані одночасно, конкурують один з одним за зв’язування (рис. 9.5, а).
2. Метод послідовного насичення - спочатку з антитілами інкубують зразок, а потім після видалення компонентів, які не зв’язалися, додають мічений антиген. Використовується у випадку, коли досліджуваний зразок може впливати на маркер, або якщо константи зв’язування обох компонентів з антитілами різні (рис. 9.5, б).
3. Метод інгібування з використанням подвійних антитіл. Базується на конкуренції вільних антитіл з антигеном, який попередньо іммобілізований на носії, і антигеном, що визначається і знаходиться у розчині (рис. 9.5, в).
![]()
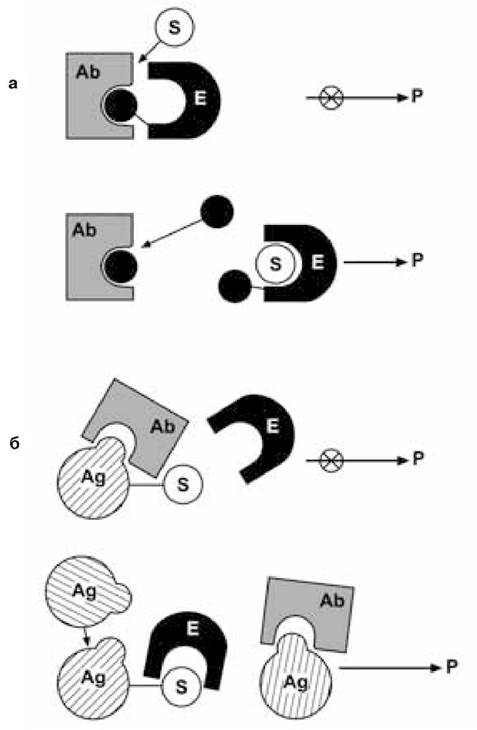
Рис. 9.4. Принципові схеми гомогенних методів імуноферментного аналізу (за Березіним І.В. та ін., 1987):
а-Г — вільний гаптен; Е-Г — мічений ферментом гаптен; Аb — антитіла;
S і Р — субстрат і продукт ферментної реакції; б — Аg-S — мічений субстратом антиген; Аg — вільний антиген; Е — фермент;
Р — продукт ферментної реакції; символ х — інгібування ферментної реакції.

Рис. 9.5. Схеми конкурентних методів твердофазового аналізу
(за Березіним І.В. та ін., 1987):
a — прямий конкурентний метод; б — метод послідовного насичення; в — метод інгібування з використанням подвійних антитіл;
Ab і | — Ag — антитіла і антигени, які адсорбовані на носії; Ag-Е і Ag — мічений ферментом і вільний антиген; Ab-Е — другі антитіла, які мічені ферментом; S і Р — субстрат і продукт ферментної реакції; стадії І і II — інкубація з наступним відмиванням компонентів, що не зв'язалися; стадія III — додавання субстрату і детекція ферментної активності.
Гомогенні методи аналізу EMIT (enzyme multiplay immunotechnic) були розроблені для визначення низькомолекулярних сполук - гаптенів, ліків, гормонів, фізіологічно активних речовин. Суть методів полягає в тому, що гаптен пришивається ковалентно поблизу активного центру ферменту таким чином, що після його взаємодії з антитілом молекула ферменту втрачає свою каталітичну активність.
Додавання до цієї системи вільного гаптену приводить до пропорційного збільшення активності ферменту внаслідок витіснення антитіл із комплексу. Принципові схеми гомогенних методів імуноферментного аналізу наведені на рис. 9.4.
Як ферменти в таких системах використовуються лізоцим, малатдегідрогеназа, глюкозо-6-фосфатдегідрогеназа; як субстрати - кофактори. Певно, при утворенні комплексу фермент-гаптен з антитілом, останній так змінює конформацію білкової глобули, що кофактор не може продуктивно зв’язуватися з активним центром ферменту, в результаті чого його активність зникає.
Антигени, мічені субстратами і кофакторами, також знайшли застосування в гомогенних методах ІФА. Суть цих методів (рівняння 6, 7, 8) полягає в тому, що при взаємодії міченого антигену з антитілами субстрат стає недоступним для дії ферменту, внаслідок чого продукт ферментативної реакції не накопичується в системі (рис. 9.4, б):
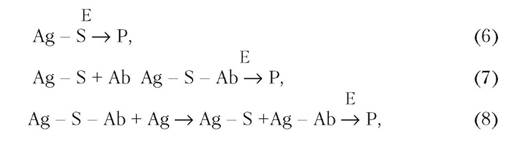
де: Ag - S - комплекс антигену з субстратом.
Отже, утворення комплексу Ag-Ab може відбутися в розчині без спеціального розділення вільних і зв’язаних компонентів безпосередньо в пробірках.
Гомогенний аналіз на основі біолюмінесценції (ЛІКА).
При ньому маркером є молекула АТФ, яка пришита до інсуліну. Додавання антитіл проти інсуліну призводить до екранування молекули АТФ і її недоступності для світлячкової люциферази. Аналогічний підхід був використаний для застосування як
маркера НАД. У цьому випадку детектуючою системою слугувала алкогольдегідрогеназа печінки коня, за допомогою якої в системі внутрішньої регенерації можна визначити до 10-7 М інсуліну.
Особливістю гомогенних методів є простота й експресність - час аналізу займає декілька хвилин (до 15 хв), тому що в них відсутні дифузійні ускладнення імунохімічної реакції, характерні для твердофазових методів аналізу.
Метод широко застосовується при визначенні гормонів, барбітуратів, антиепілептичних засобів та ін.
Використання ІФА
Серед різних напрямів розробки ІФА неабиякий інтерес викликає створення методів, які дозволяють в одному зразку визначити декілька речовин. Наприклад, при діагностиці вірусного гепатиту важливим є одночасне визначення декількох антигенів, що дає можливість визначити стадію інфекційного процесу. Використання суміші антитіл, мічених різними ферментами, - один із шляхів, який дає можливість вирішити проблему.
Методи ІФА знайшли широке розповсюдження у медицині (гуманній і ветеринарній), контролі технологічних процесів і якості біотехнологічної, фармацевтичної, харчової продукції та наукових дослідженнях.
У медичній діагностиці методи ІФА використовуються для виявлення мікробних та вірусних збудників і антитіл проти них, а також збудників паразитарних інфекцій (гельмінти, малярійний плазмодій та ін.), що мають складний і мінливий антигенний склад.
Методи ІФА широко застосовуються і в діагностиці неін- фекційних захворювань, таких як діабет, рак, серцево-судинні й ендокринні захворювання.
Методи гомогенного ІФА використовуються для контролю лікарської терапії, особливо препаратів, які впливають на серцево-судинну систему, антибіотиків, психотропних речовин. Ці методи дають можливість швидко виявляти отруєння, наявність наркотиків і допінгових препаратів у організмі.
У ветеринарній практиці метод ІФА найчастіше застосовують для виявлення антитіл вірусу ящуру, хвороби Ауескі, африканської чуми свиней, чуми великої рогатої худоби, ротавірусної та коронавірусної інфекцій, для оцінки ефективності вакцинації, а також при епізоотичному обстеженні тварин. Методи ІФА вважаються особливо ефективними при виявленні невідомих, важко культивованих і таких збудників, що дуже складно виявляються в лабораторних умовах, а також для розпізнавання маловідомих хвороб.
Можливість візуального виявлення комплексу антитіло- фермент, чому сприяє утворення кольорового продукту ферментної реакції під час розщеплення певного субстрату, робить цей метод доступним для застосування у виробничих лабораторіях. Можливість експрес-діагностики окремих захворювань дає змогу проводити досліди на великому поголів’ї.
Налагоджено випуск антивидових мічених ферментами антитіл до глобулінів кролів, мишей, свиней, великої рогатої худоби, а також створені тест-системи для виявлення вірусних антигенів і вірус-специфічних антитіл, що створило сприятливі умови для впровадження методів ІФА у ветеринарну практику.
У зв’язку з інтенсивним розвитком промислової біотехнології методи ІФА дедалі ширше застосовуються для контролю технологічних процесів і якості біотехнологічної продукції. Так, у мікробіологічних виробництвах методи ІФА використовуються для швидкого виявлення високоефективних мікроорга- нізмів-продуцентів різних фізіологічно активних речовин (ферментів, антибіотиків та ін.), контролю наявності сторонніх мікроорганізмів і бактеріофагів у ферментерах, для визначення забруднення повітря промислових приміщень на наявність шкідливих речовин, які викликають професійні захворювання обслуговуючого персоналу.
Важливими є методи ІФА при виробництві лікарських препаратів, в тому числі із сировини тваринного походження і донорської крові. Домішки супутніх речовин або вірусних антигенів можуть бути дуже шкідливими для організму. Важливим є виявлення у донорській крові вірусу гепатиту В, білкових домішок у препаратах інсуліну тощо.
У наукових дослідженнях імуноферментний аналіз застосовується як у традиційних сферах біохімічних досліджень, так і в нових, пов’язаних з розробкою методів генетичної і клітинної інженерії. Наприклад, одержання гібридом цілком базується на використанні ІФА при клонуванні клітин. При генно-інженерних роботах ці методи дозволяють швидко відбирати клони- продуценти.
Методи ІФА ефективні при вирішенні фундаментальних проблем онкології, вірусології, біохімії, фізіології тощо.