Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Генная терапия
Генная терапия ex vivo
Генная терапия ex vivo, как правило, включает следующие этапы (рис. 21.1).
1. Получение клеток от больного.
2. Исправление генетического дефекта с помощью переноса нужного гена в изолированные клетки.
3. Отбор и наращивание генетически «исправленных» клеток.
4. Инфузия или трансплантация этих клеток пациенту.
Использование собственных клеток пациента (аутологичных клеток) гарантирует, что после инфузии или трансплантации у него не разовьется иммунный ответ.
Необходимо, чтобы процедура переноса генов, используемая для генной терапии ex vivo, была эффективной, а «терапевтический» ген стабильно поддерживался и непрерывно экспрессировался. Этим условиям отвечают векторы, полученные на основе мышиных ретровирусов. Но ретровирусы имеют существенный недостаток — они могут приводить к злокачественной транформации клеток. Такую вероятность необходимо уменьшить, а лучше полностью исключить.

Рис. 21.1. Схематическое представление генной терапии ex vivo. Процедура включает: 1) получение от пациента клеток с генным дефектом; 2) культивирование изолированных клеток; 3) трансфекцию «терапевтической» генной конструкции в изолированные клетки; 4) отбор, выращивание и тестирование трансфицированных клеток; 5) трансплантацию или трансфузию трансфицированных клеток пациенту.
Геном ретровируса дикого типа представлен двумя идентичными одноцепочечными молекулами РНК, каждая из которых состоит из шести участков: длинного концевого повтора (5' -LTR, от англ. long terminal repeat); некодирующей последовательности пси+ (ψ+), необходимой для упаковки РНК в вирусную частицу; трех генов, кодирующих структурный белок внутреннего капсида (gag), белок, обладающий функциями обратной транскриптазы и интегразы (pol), и белок оболочки (env)ж 3'- LTR-последовательности (рис. 21.2). Жизненный цикл ретровируса включает следующие стадии.
1. Инфицирование клетки-мишени.
2. Синтез ДНК-копии генома с помощью собственной обратной транскриптазы.
3. Транспорт вирусной ДНК в ядро.
4. Встраивание вирусной ДНК в один из хромосомных сайтов клетки-хозяина.
5. Транскрипцию мРНК с вирусной ДНК под контролем сильного промотора, локализованного в 5'-LTR.
6. Трансляцию белков Gag, Pol и Env в цитоплазме.
7. Образование вирусного капсида и упаковку в него двух РНК-цепей и молекул обратной транскриптазы.
8. Высвобождение вирионов из клетки.
Для получения ретровирусного вектора полноразмерную ДНК ретровируса встраивают в плазмиду, с помощью эндонуклеазного расщепления удаляют большую часть гена gag и гены pol и env, оставляя 5'-концевой участок гена gag и 5'- и 3'-LTR, а затем рядом с ψ+-областью встраивают «терапевтический» ген, транскрипция которого будет контролироваться 5'-LTR-прoмотором; при необходимости можно встроить и маркерный селективный ген с собственным промотором (рис. 21.3). Такая конструкция позволяет экспрессировать оба клонированных гена. На основе этой схемы созданы различные ретровирусные векторы. Максимальный размер ДНК-вставки, которую может переносить ретровирусный вектор, — примерно 8 т. п. н. ДНК ретровирусного вектора можно использовать для трансформации клеток саму по себе, но эффективность доставки ее в ядро и интеграции в геном клетки-хозяина крайне низка. Поэтому была разработана методика упаковки полноразмерной РНК ретровирусного вектора в интактные вирусные частицы, с высокой частотой проникающие в клетку, что гарантирует встраивание соответствующей ей ДНК в геном клетки-хозяина. Для этого с помощью генной инженерии была создана «пакующая» клеточная линия, в одном из участков генома которой содержится ∆ψ+-сегмент 5 - LТR-gаg-3'-LTR (т. е. сегмент, лишенный функциональной ψ+-последовательности), а в другом — ∆ψ+-сегмент 5'- LTR-pol-env-3'-LTR. Оба этих сегмента транскрибируются, но из-за отсутствия ψ+-последовательности и образования вирусных молекул РНК меньшего, чем в норме, размера формируются пустые вирусные частицы. При трансфекции ДНК ретровирусного вектора в такие клетки она встраивается в хромосомную ДНК и транскрибируется с образованием полноразмерной РНК ретровируса, содержащей ψ+-последовательность. В таких условиях в вирусные капсиды упаковывается только РНК вектора. Образующиеся интактные вирусные частицы можно использовать для высокоэффективной доставки ретровирусного вектора в клетки-мишени (рис. 21.4).
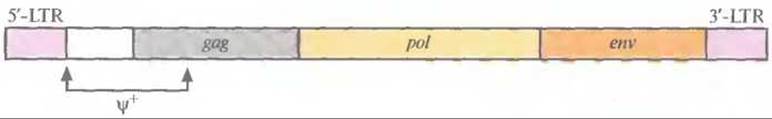
Рис. 21.2. Генетическая карта типичного ретровируса. ψ+ — последовательность, ответственная за упаковку, gag, pol и env — области, кодирующие соответственно белок капсида, белок, обладающий активностью обратной транскриптазы и интегразы, и белок оболочки. 5'-LTR содержит сигналы инициации транскрипции, причем весь геном транскрибируется как одна молекула РНК. 3'-LTR содержит сигнал полиаденилирования.
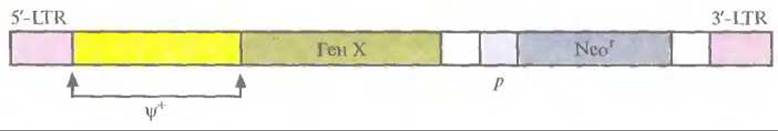
Рис. 21.3. Генетическая карта ретровирусного вектора, несущего два гена. Транскрипция «терапевтического» гена (Ген X) контролируется 5'-LTR-пpoмотoром, транскрипция селективного маркерного гена (Neor) — внутренним промотором (р). 3'-LTR содержит сигнал полиаденилирования. ψ+ — последовательность, ответственная за упаковку.
В «пакующей» клеточной линии не образуются компетентные по репликации ретровирусы дикого типа, способные встраиваться в гены и приводить к некотролируемой пролиферации некоторых клеток (т. е. к превращению их в раковые клетки). Это весьма существенно, особенно если частицы ретровирусного вектора предполагается использовать для геной терапии соматических клеток человека. В качестве меры предосторожности все же проводят регулярное тестирование готовых ретровирусных векторов, с тем чтобы выявить ретровирусы дикого типа. Кроме того, в «пакующей» клеточной линии нуклеотидные последовательности ретровируса и вектора локализованы в трех разных областях хромосомы, что делает весьма маловероятной возможность последовательных рекомбинационных событий, которые могли бы привести к образованию компетентного по репликации ретровируса.
Ретровирусы активно инфицируют реплицирующиеся клетки. Для переноса генов в интенсивно растущие клетки-мишени последние обрабатывают очищенными частицами упакованного ретровирусного вектора либо проводят их совместное культивирование с производящей его клеточной линией, а затем осуществляют дифференциальную селекцию для разделения клеток-мишеней и «пакующих» клеток. Трансдуцированные клетки-мишени (те, в которые при помощи вируса была перенесена невирусная ДНК) тестируют, чтобы удостовериться, что: 1) в них синтезируется продукт терапевтического гена; 2) не образуются компетентные по репликации ретровирусы; 3) ДНК ретровирусного вектора не встроилась в сайт, изменяющий способность клеток к росту либо препятствующий их нормальному функционированию. После тестирования трансдуцированные клетки наращивают в больших количествах и с разными интервалами вводят пациенту.
Наиболее вероятными кандидатами для проведения генной терапии ex vivo (рис. 21.5) являются пациенты с наследственными заболеваниями, для лечения которых применяют трансплантацию костного мозга. Терапевтический эффект трансплантации костного мозга в отношении целого ряда болезней связан с наличием в нем тотипотентных эмбриональных стволовых клеток, которые встречаются с частотой 10-4—10-5, могут пролиферировать и дифференцироваться в различные типы клеток, такие как В- и Т-лимфоциты (В-клетки и Т-клетки), макрофаги, эритроциты, тромбоциты и остеокласты. Например, в том случае, когда генная мутация нарушает функции макрофагов, трансплантация костного мозга обеспечивает реципиенту постоянный запас компетентных макрофагов, происходящих из популяции тотипотентных стволовых клеток.
Генноинженерная модификация тотипотентных стволовых клеток с их последующей инфузией или трансплантацией пациенту для замещения утраченного типа клеток или генного продукта может стать основным способом генной терапии ex vivo. В качестве примера можно рассмотреть дефект АДА, приводящий к повышению в крови уровня аденозина и дезоксиаденозина, токсическое действие которых приводит к гибели В- и Т-лимфоцитов и развитию тяжелого иммунодефицита. Поскольку и В-, и Т-лимфоциты происходят из тотипотентных стволовых клеток, перенос в последние функционального гена АДА с последующим введением их пациенту способствует понижению в крови уровней аденозина и дезоксиаденозина и предотвращает разрушение В- и Т-лимфоцитов. Стволовые клетки можно получить от самого пациента (оптимальный вариант) или от совместимых доноров, которых обычно нелегко найти.
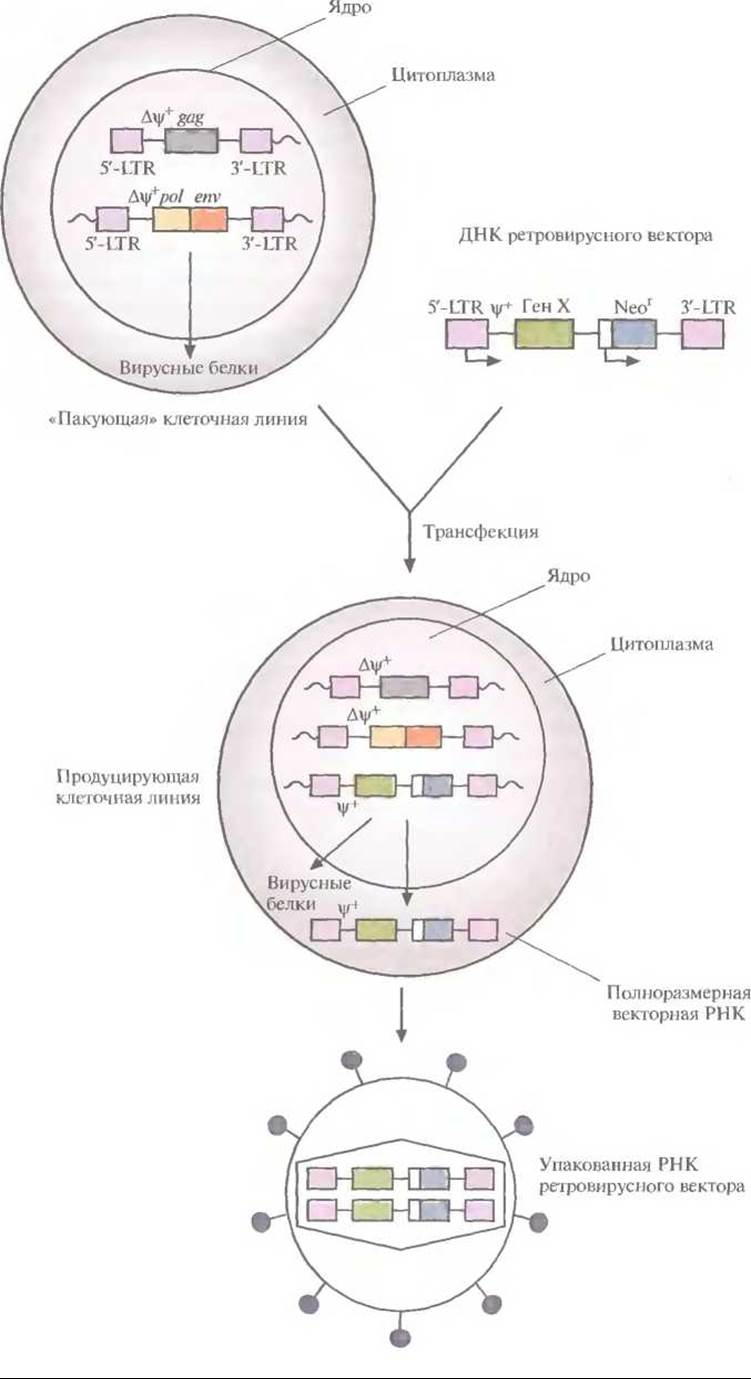
Рис. 21.4. Получение упакованного ретровирусного вектора. В двух разных участках хромосом «пакующей» клеточной линии содержатся ретровирусные гены: в одном — gag, в другом — pol и env. Их транскрипция контролируется 5'-LTR-npoмотоpoм; оба участка лишены последовательности, необходимой для упаковки (∆ψ+). «Пакующая» линия клеток синтезирует вирусные белки, но из-за отсутствия в любой из ретровирусных мРНК последовательности, ответственной за упаковку, образуются пустые вирусные капсиды. После трансфекции «пакующей» линии клеток ретровирусным вектором, содержащим необходимую для упаковки последовательность (ψ+), его полноразмерные РНК транскрибируются и упаковываются в капсиды. Высвобождаемые вирусные частицы не способны реплицироваться и в данном случае содержат «терапевтический» ген (Ген X) и селективный маркерный ген (Neor).

Рис. 21.5. Наследственные заболевания, для лечения которых применяют трансплантацию костного мозга.
К сожалению, тотипотентные стволовые клетки очень трудно выделять из костного мозга и культивировать. Исследования по ех vivo-генной терапии SCID, вызванного дефицитом АДА, проводили на аутологичных Т-клетках, модифицированных с помощью ретровирусных векторов. Т-лимфоциты имеют ограниченное время жизни, поэтому необходимо проводить их повторные инфузии. В первом испытании двум девочкам вливали с интервалом в несколько месяцев собственные генетически «исправленные» Т-клетки, продуцирующие АДА. Наблюдаемый положительный эффект, возможно, объяснялся снижением уровня аденозина и дезоксиаденозина в крови и предотвращением гибели В- и Т-клеток.
Т-клетки — не оптимальная система доставки, применяемая при генной терапии заболеваний гемопоэтических (происходящих из костного мозга) клеток. Предпочтительнее (хотя это не всегда возможно) использовать пуповинную кровь, содержащую стволовые клетки. Так, при однократном введении новорожденным с дефицитом АДА СD34+-клеток, полученных из их пуповинной крови и трансдуцированных кДНК АДА, эта кДНК поддерживалась и экспрессировалась в клетках крови неэритроидного ряда как минимум 18 мес.
В качестве примера успешной генной терапии ex vivo с использованием аутологичных клеток можно привести случай с пациенткой, гомозиготной по рецессивному гену семейной гиперхолестеролемии. Ее гепатоциты были лишены рецепторов липопротеинов низкой плотности (ЛПНП) и не разрушали холестерол; он постоянно циркулировал в крови, приводя к закупорке артерий и тяжелой болезни сердца. Лекарственные средства в подобных случаях неэффективны, а шунтирование коронарных артерий дает непродолжительный эффект.
В описываемом случае пациентке удалили около 15% печени, гепатоциты поместили в культуральную среду и ввели в них ДНК рекомбинантного ретровируса, содержащую кДНК ЛПНП-рецептора. Затем осуществили инфузию трансдуцированных гепатоиитов в печень пациентки, где они прижились, экспрессировали кДНК ЛПНП-рецептора и вырабатывали функциональный рецептор как минимум 18 мес. Если брать за основу показатели содержания липидов, то состояние пациентки значительно улучшилось. Более того, в ее организме не образовывались антитела к ЛПНП-рецептору. Генная терапия ex vivo основана на трансплантации генетически модифицированных клеток, производящих терапевтический белок. Использование собственных клеток пациента предотвращает их отторжение, но ограничивает сферу применения генной терапии ex vivo. Так, число клеток ткани-мишени может быть недостаточно для их извлечения и культивирования in vitro, некоторые соматические клетки неэффективно поглощают ДНК, а экспрессия клонированного гена иногда оказывается временной. Поэтому в настоящее время разрабатывают системы, которые защищают неаутологичные (ксеногенные, аллогенные) клетки от иммунного ответа и позволяют высвобождать «терапевтический» белок.

Неаутологичная генная терапия ex vivo включает выделение тканеспецифичных клеток, хорошо растущих в культуре (например, фибробластов или кератиноцитов кожи, астроцитов мозга, гепатоцитов или миобластов), и их генетическую модификацию с помощью «терапевтического» гена. Рекомбинантные клетки заключают в искусственную полупроницаемую полимерную мембрану, через которую выходит рекомбинантный белок и поступают в клетки питательные вещества. Мембрана неиммуногенна и не вызывает сенсибилизации пациента и отторжения имплантированных клеток. В качестве инкапсулирующего материала используют разные полимеры:
альгинат—поли-L-лизин—альгинат, полиэфирсульфон, поли(акрилонитрил-ковинилхлорид).
Доклинические испытания, проведенные in vitro и на модельных животных, показали, что инкапсулированные рекомбинантные клетки могут пролиферировать и длительное время производить большие количества рекомбинантного белка. Чтобы попытаться предотвратить гибель мотонейронов, приводящую к нейродегенеративному заболеванию боковому амиотрофическому склерозу, была проведена I фаза клинических испытаний с использованием инкапсулированных клеток, вырабатывающих цилиарный нейротрофический фактор (CNTF, от англ. ciliary neurotrophic factor). Процедуа была признана безопасной, но у пациентов с боковым амиотрофическим склерозом улучшения состояния не наблюдалось. При имплантации инкапсулированных CNTF-производящих клеток в мозг животных с химически индуцированным повреждением, моделирующим другое фатальное нейродегенеративное заболевание, хорею Гентингтона, клетки мозга не разрушались. Метод инкапсуляции клеток, модифицированных с помощью генной инженерии, находится на ранней стадии развития, но может стать эффективным способом доставки терапевтических генных продуктов при лечении многих заболеваний.