Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Получение рекомбинантных белков с помощью эукариотических систем
Для получения гетерологичных рекомбинантных белков с клонированной эукариотической комплементарной ДНК (кДНК) обычно используются прокариотические системы экспрессии. Однако в некоторых случаях эукариотические белки, синтезированные в бактериях, оказываются нестабильными или биологически неактивными. Кроме того, как бы тщательно ни проводилась очистка, конечный продукт может быть загрязнен токсичными веществами или веществами, вызывающими повышение температуры у человека и животных (пирогенами). Чтобы решить эти проблемы, для получения рекомбинантных белков, предназначенных для использования в медицине, были разработаны эукариотические системы экспрессии. Такие белки должны быть идентичны природным по своим биохимическим, физическим и функциональным свойствам. Неспособность прокариот синтезировать аутентичные варианты белков обусловлена в основном отсутствием у них адекватных механизмов внесения специфических посттрансляционных модификаций.
Белки в клетках эукариот претерпевают следующие посттрансляционные изменения.
✵ Образование дисульфидных связей. Эту реакцию катализирует фермент дисульфидизомераза. Неправильно уложенный белок оказывается нестабильным и неактивным.
✵ Протеолитическое расщепление предшественника, удаление определенного участка полипептидной цепи с образованием функционально активного белка.
✵ Гликозилирование: основная модификация, благодаря которой белки приобретают стабильность, а в некоторых случаях — особые свойства. Наиболее распространенная реакция гликолизирования — это присоединение специфического сахарного остатка либо к серину или треонину (О-гликозилирование), либо к аспарагину (N-гликолизирование).
✵ Модификации аминокислот в составе белка: фосфорилирование, ацетилирование, ацилирование, гамма-карбоксилирование, сульфатирование, миристилирование и пальмитоилирование.
Из всех этих модификаций прокариотические хозяйские клетки наименее всего способны осуществлять правильное гликозилирование и модификацию специфических аминокислот в гетерологичном белке. Однако ни одна эукариотическая система не может осуществить одновременно все посттрансляционные изменения в каждом потенциальном гетерологичном белке. Таким образом, для получения белка с полным набором специфических модификаций необходимо провести тестирование различных эукариотических систем экспрессии и найти такую, которая воспроизводила бы биологически аутентичный продукт.
Эукариотические экспрессирующие векторы имеют такую же структуру, что и их прокариотические аналоги (рис. 7.1), и должны содержать:
✵ эукариотический селективный маркер
✵ эукариотический промотор
✵ соответствующие эукариотические сайты терминации транскрипции и трансляции
✵ сигнал полиаденилирования мРНК.
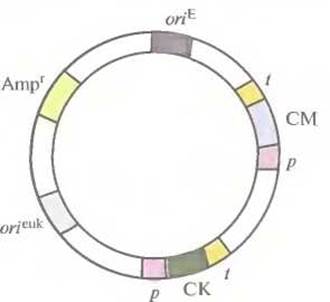
Рис. 7.1. Обобщенная структура эукариотического экспрессирующего вектора. Его основные элементы: эукариотический транскриптон с промотором (р), сайтом клонирования (СК) и сигналами терминации и полиаденилирования (t); эукариотический селективный маркер (СМ); сайт инициации репликации, функционирующий в клетках эукариот (оrieuk); сайт инициации репликации, функционирующий в Е. coli (oriE); селективный маркер Е. coli (Ampr).
Если вектор представляет собой плазмиду, реплицирующуюся независимо от хромосомы, то он должен содержать сайт инициации репликации, функционирующий в хозяйской клетке. Если же вектор предназначен для встраивания в хозяйскую хромосомную ДНК, то для обеспечения рекомбинации он должен нести последовательность, комплементарную определенному участку хромосомной ДНК хозяина (хромосомный сайт интеграции). Поскольку технически многие операции с рекомбинантными ДНК сложнее проводить в клетках эукариот, чем прокариот, большинство эукариотических векторов сконструированы как челночные. Другими словами, эти векторы несут два типа сайтов инициации трансляции и два типа селективных маркерных генов, одни из которых функционируют в Escherichia coli, а другие — в эукариотических хозяйских клетках. Такие векторные системы экспрессии разработаны для дрожжей, насекомых и клеток млекопитающих.
Введение ДНК в бактериальные и дрожжевые клетки называется трансформацией. В микробиологии этот термин используется для описания наследственных изменений в результате внедрения (приобретения) экзогенной (чужеродной) ДНК. А применительно к животным клеткам трансформация обозначает изменение характера их роста в культуре, обусловленное превращением нормальных клеток в раковые. Чтобы избежать путаницы в терминологии, для обозначения наследственных изменений в животных клетках после введения в них экзогенной ДНК был выбран термин трансфекция.
Для трансформации дрожжей обычно используют три способа. В первом случае экзогенную ДНК добавляют к клеткам дрожжей, клеточные стенки которых удалены химически или энзиматически (протопласты) (1). В других случаях клетки перед добавлением чужеродной ДНК обрабатывают ацетатом лития (2) или подвергают электропорации (3). Трансфекцию культур животных клеток осуществляют инкубацией клеток с ДНК, осажденной фосфатом кальция или ДЕАЕ-декстрином (1), либо электропорацией в присутствии очищенной трансфицирующей ДНК (2). Как уже упоминалось в гл. 4, электропорация заключается в воздействии на клетки коротких мощных импульсов электрического тока, вследствие чего в наружной мембране или клеточной стенке образуются временные поры, через которые в клетку может проникнуть ДНК. В некоторых эукариотических системах для доставки ДНК в реципиентные клетки используют вирусы.