Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Использование рекомбинантных микроорганизмов для получения коммерческих продуктов
Антибиотики
Со времени открытия пенициллина в конце 1920-х годов из различных микроорганизмов были выделены более 6000 антибиотиков, обладающих разной специфичностью и разным механизмом действия. Их широкое применение для лечения инфекционных заболеваний помогло сохранить миллионы жизней. Подавляющее большинство основных антибиотиков было выделено из грамположительной почвенной бактерии Streptomyces, хотя их продуцируют также грибы и другие грамположительные и грамотрицательные бактерии. Ежегодно во всем мире производится 100 000 т антибиотиков на сумму примерно 5 млрд, долларов, в том числе более 100 млн. долларов приходится на долю антибиотиков, добавляемых в корм скоту в качестве добавок или ускорителей роста.
По оценкам, каждый год ученые обнаруживают от 100 до 200 новых антибиотиков, прежде всего в рамках обширных исследовательских программ по поиску среди тысяч различных микроорганизмов таких, которые синтезировали бы уникальные антибиотики. Получение и клинические испытания новых препаратов обходятся очень дорого, и в продажу поступают только те из них, которые имеют большую терапевтическую ценность и представляют экономический интерес. На их долю приходится 1 —2% всех обнаруживаемых антибиотиков. Большой эффект здесь может дать технология рекомбинантных ДНК. Во-первых, с ее помощью можно создавать новые антибиотики с уникальной структурой, оказывающие более мощное воздействие на определенные микроорганизмы и обладающие минимальными побочными эффектами. Во-вторых, генноинженерные подходы могут использоваться для увеличения выхода антибиотиков и соответственно для снижения стоимости их производства.
При создании рекомбинантных штаммов Streptomyces — основного микроорганизма, используемого для получения антибиотиков, — важно помнить, что трансформация и отбор трансформированных клеток не должны быть слишком сложными. Однако в отличие от Е. coli Streptomyces существуют не в виде изолированных клеток, а в виде протяженных мицелл, поэтому перед трансформацией необходимо разрушить клеточную стенку и высвободить отдельные протопласты (рис. 12.9). Без этого будет невозможно отличить трансформированные клетки от нетрансформированных, поскольку видимые колонии на твердой среде будут образовываться из группы клеток, а не из индивидуальной клетки; соответственно колонии, растущие в присутствии селективного антибиотика, будут представлять собой смесь трансформированных и нетрансформированных клеток. Проникновение плазмидной ДНК в протопласты Streptomyces облегчается в присутствии полиэтиленгликоля. После трансформации протопласты сначала высевают на твердую среду, чтобы образовалась клеточная стенка, а затем для отбора трансформированных клеток переносят на селективную среду, обычно содержащую либо неомицин, либо тиострептон.
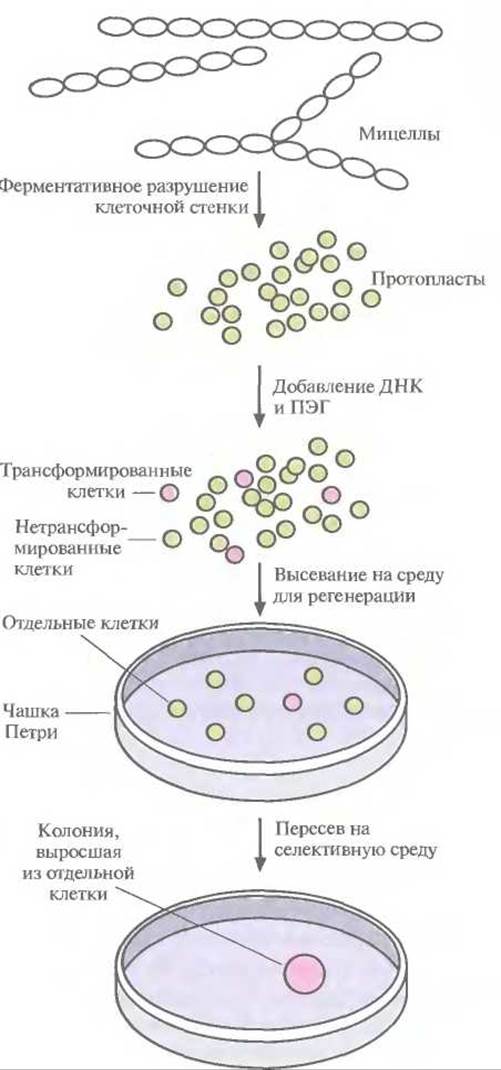
Рис. 12.9. Схема трансформации и отбора рекомбинантных штаммов Streptomyces. Трансформированные клетки обозначены розовыми кружками, нетрансформированные — зелеными. ПЭГ — полиэтиленгликоль.
Клонирование генов биосинтеза антибиотиков
Процесс биосинтеза одного антибиотика может состоять из 10—30 ферментативных реакций, так что клонирование всех генов его биосинтеза — задача не из легких. Один из подходов к выделению полного набора таких генов основан на трансформации одного или нескольких мутантных штаммов, не способных синтезировать данный антибиотик, банком клонов, созданным из хромосомной ДНК штамма дикого типа. После введения банка клонов в мутантные клетки проводят отбор трансформантов, способных синтезировать антибиотик. Затем выделяют плазмидную ДНК клона, содержащего функциональный экспрессирующийся ген антибиотика [т. е. ген, восстанавливающий (комплементирующий) утраченную мутантным штаммом функцию], и используют ее в качестве зонда для скрининга другого банка клонов хромосомной ДНК штамма дикого типа, из которого отбирают клоны, содержащие нуклеотидные последовательности, которые перекрываются с последовательностью зонда. Таким образом идентифицируют, а затем клонируют элементы ДНК, примыкающие к комплементирующей последовательности, и воссоздают полный кластер генов биосинтеза антибиотика. Описанная процедура относится к случаю, когда эти гены сгруппированы в одном сайте хромосомной ДНК. Если же гены биосинтеза разбросаны в виде небольших кластеров по разным сайтам, то нужно иметь по крайней мере по одному мутанту на кластер, чтобы получить клоны ДНК, с помощью которых можно идентифицировать остальные гены кластеров.
Этот подход с успехом использовался для идентификации некоторых генов биосинтеза ундецилпродигиозина из Streptomyces coelicolor A3 (рис. 12.10). В этом случае комплементационный анализ основывается на сравнении цвета колоний: колонии микроорганизмов дикого типа имеют красный цвет, а колонии мутантных микроорганизмов — кремовый. Таким образом, в результате комплементации образуется красная колония. Помимо комплементации, для идентификации генов биосинтеза антибиотиков могут использоваться и более прямые подходы. Так, с помощью генетических или биохимических экспериментов можно идентифицировать, а затем выделить один или несколько ключевых ферментов биосинтеза, определить их N-концевые аминокислотные последовательности и, исходя из этих данных, синтезировать олигонуклеотидные зонды. Этот подход использовался для выделения из Penicillium chrysogenum гена синтетазы изопенициллина N. Этот фермент катализирует окислительную конденсацию δ-(L-а-аминоадипил)-L-цистеинил-D-валина в изопенициллин N, ключевое промежуточное звено в биосинтезе пенициллинов, цефалоспоринов и цефамицинов (рис. 12.11).
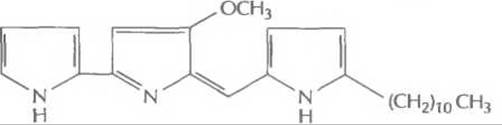
Рис. 12.10. Структурная формула унденилпродигиозина.
Синтез новых антибиотиков Новые антибиотики с уникальными свойствами и специфичностью можно получить, проводя генноинженерные манипуляции с генами, участвующими в биосинтезе уже известных антибиотиков. Один из первых экспериментов, в ходе которого был получен новый антибиотик, состоял в объединении в одном микроорганизме двух немного различающихся путей биосинтеза антибиотика.
Одна из плазмид Streptomyces, рIJ2303, несущая фрагмент хромосомной ДНК S. coelicolor длиной 32,5 т.п.н., содержит все гены ферментов, ответственных за биосинтез из ацетата антибиотика актинородина, представителя семейства изохроманхиноновых антибиотиков (рис. 12.12). Целую плазмиду и различные субклоны, несущие части 32,5 т.п.н.-фрагмента (например, рIJ2315), вводили либо в штамм АМ-7161 Streptomyces sp., синтезирующий родственный антибиотик медермицин, либо в штамм В1140 или Tü22 S. violaceoruber, синтезирующие родственные антибиотики гранатицин и дигидрогранатицин. Все указанные антибиотики являются кислотно-щелочными индикаторами, которые придают растущей культуре характерный цвет, зависящий от pH среды (табл. 12.3). В свою очередь pH (и цвет) среды зависят от того, какое соединение синтезируется. Мутанты родительского штамма S. coelicolor, не способные синтезировать актинородин, бесцветные. Появление окраски после трансформации штамма АМ-7161 Streptomyces sp. либо штаммов В1140 или Tü22 S. violaceomber плазмидой, несущей все или несколько генов, кодирующих ферменты биосинтеза актинородина, свидетельствует о синтезе нового антибиотика (рис. 12.12, табл. 12.3). Трансформанты штамма АМ-7161 Streptomyces sp. и штамма В1140 S. violaceomber, содержащие плазмиду рIJ2303, синтезируют антибиотики, кодируемые и плазмидой, и хромосомной ДНК. Однако при трансформации штамма Tü22 S. violaceoruber плазмидой plJ2303 наряду с актинородином синтезируется новый антибиотик — дигидрогранатиродин, а при трансформации штамма АМ-7161 Streptomuces sp. плазмидой pIJ2315 синтезируется еще один новый антибиотик — медерродин А.
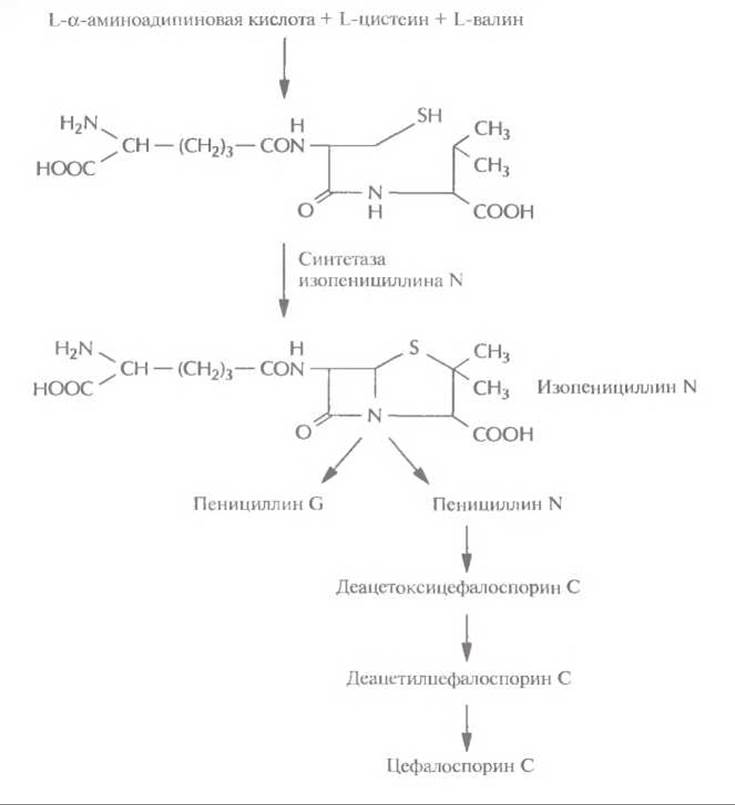
Рис. 12.11. Биосинтез пенициллинов и цефалоспоринов в Р. chrysogenum. Синтетаза изопенициллина N катализирует синтез из δ-(L-а-аминоадипил)-L-цистеинил-D-валина изопенициллина N — предшественника пенициллина G, пенициллина N и цефалоспорина С.
В структурном отношении эти новые антибиотики мало отличаются от актинородина, медермицина, гранатицина и гидрогранатицина и, вероятно, образуются в том случае, когда промежуточный продукт одного пути биосинтеза служит субстратом для фермента другого пути. Когда будут детально изучены биохимические свойства различных путей биосинтеза антибиотиков, появится возможность создавать новые уникальные высокоспецифичные антибиотики, манипулируя генами, которые кодируют соответствующие ферменты. Разработка новых методов получения поликетидных антибиотиков Термин «поликетидные» относится к классу антибиотиков, которые образуются в результате последовательной ферментативной конденсации карбоновых кислот типа ацетата, пропионата и бутирата. Некоторые поликетидные антибиотики синтезируются растениями и грибами, но большая их часть образуется актиномицетами в виде вторичных метаболитов. Прежде чем проводить манипуляции с генами, кодирующими ферменты биосинтеза поликетидных антибиотиков, необходимо выяснить механизм действия этих ферментов.
Таблица 12.3. Антибиотики, синтезируемые различными штаммами Streptomyces, в том числе штаммами, трансформированными плазмидами рIJ2303 и рIJ23151)
|
Штамм/плазмида |
Цвет культуры |
Антибиотик(и) |
|
|
кислая среда |
щелочная среда |
||
|
S. coelicolor |
Красный |
Синий |
Актинородин |
|
Streptomyces sp. |
Желтый |
Коричневый |
Медермицин |
|
Streptomyces sp./pIJ2303 |
Красный |
Синий |
Медермицин, актинородин |
|
Streptomyces sp./pIJ2315 |
-"- |
Фиолетовый |
Медерродин А, медермицин |
|
S. violaceoruber В1140 |
-"- |
Сине-фиолетовый |
Гранатицин, дигидрогранатицин |
|
S. violaceoruber B1140/plJ2303 |
-"- |
-"- |
Гранатицин, дигидрогранатицин, актинородин |
|
S. violaceoruberTu22 |
-"- |
-"- |
Гранатицин, дигидрогранатицин |
|
S. violaceoruber Tü22/pIJ2303 |
-"- |
-"- |
Дигидрогранатиродин, актинородин |
1) По данным работы Hopwood et al., Nature 314: 642—644, 1985.
Поликетидные антибиотики синтезируются по тому же пути, что и длинноцепочечные жирные кислоты. В результате каждого цикла конденсации к растущей углеродной цепи добавляется ß-кетогруппа. Процесс состоит из ряда повторяющихся стадий, включающих восстановление кетогруппы, дегидратацию и восстановление ß-еноильных групп в растущей поликетидной цепи. Существуют два класса поликетидсинтаз — ферментных комплексов, ответственных за синтез поликетидных антибиотиков (рис. 12.13). Первый класс составляют синтазы, катализирующие реакции биосинтеза ароматических поликетидов; каждая синтаза представляет собой один полипептид с одним активным центром, который последовательно катализирует биосинтетические реакции (рис. 12.13, А). Второй класс включает синтазы, образованные несколькими полипептидами (А—Е на рис. 12.13, Б); каждый из них имеет свой активный центр и обладает специфической ферментативной активностью, катализирующей определенную реакцию биосинтеза.
Если каждый домен субъединицы многофункциональной поликетидсинтазы, обладающий ферментативной активностью, катализирует определенную реакцию, то утрата любой из активностей затронет только одну реакцию биосинтеза, а изменение домена с известной функцией приведет к предсказуемым изменениям структуры синтезируемого антибиотика. Так, детально изучив генетические и биохимические составляющие биосинтеза эритромицина в клетках Saccharopolyspora erythraea, удалось внести специфические изменения в гены, ассоциированные с биосинтезом этого антибиотика, и синтезировать производные эритромицина с другими свойствами. Вначале была определена первичная структура фрагмента ДНК S. erythraea длиной 56 т. п. н., содержащего кластер генов ety, затем двумя разными способами модифицирована эритромицинполикетидсинтаза. Для этого 1) удаляли участок ДНК, кодирующий ß-кеторедуктазу, либо 2) вносили изменение в участок ДНК, кодирующий еноилредуктазу. Делеция ß-кеторедуктазного гена приводила к накоплению промежуточного продукта, у которого к C-5-атому кольца была присоединена карбонильная группа, а не гидроксильная (рис. 12.14), а мутация в гене еноилредуктазы — к образованию двойной связи между атомами С-6 и С-7 (рис. 12.14). Из этих экспериментов следует, что если идентифицировать и охарактеризовать кластер генов, кодирующих ферменты биосинтеза определенного поликетидного антибиотика, то, внося в них специфические изменения, можно будет направленно изменять структуру антибиотика. Кроме того, вырезая и соединяя те или иные участки ДНК, можно перемещать домены поликетидсинтазы и получать новые поликетидные антибиотики.
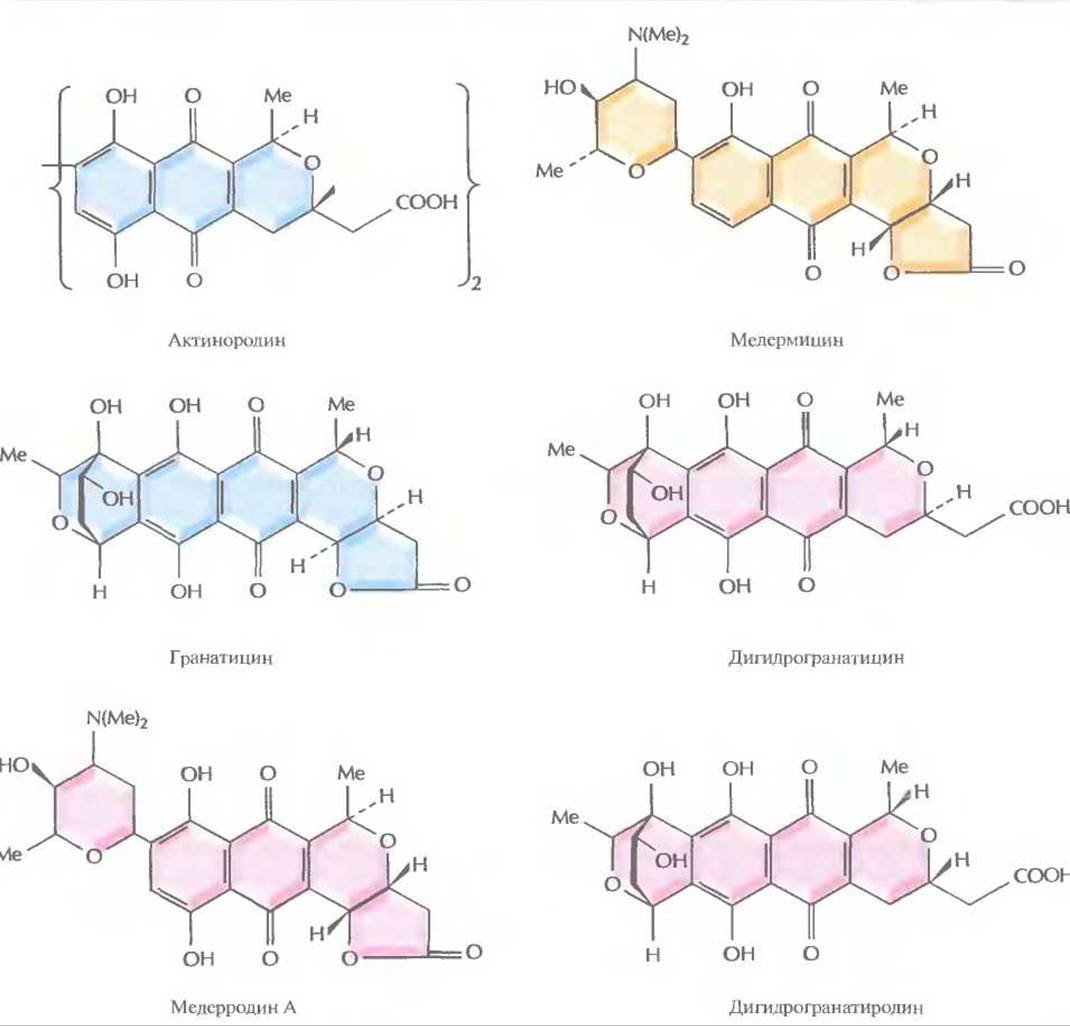
Рис. 12.12. Структурные формулы различных изохроманхиноновых антибиотиков, синтезируемых штаммами Streptomyces. S. соеliсоlor дикого типа и плазмида pІJ2303 кодируют актинородин; Streptomyces sp. синтезирует медермицин, a S. violaceoruber — гранатицин и дигидрогранатицин. Синтезируемые гибридные антибиотики — это медерродин А и дигидрогранатиродин.
Все кластеры генов ароматических поликетидов содержат три гена, кодирующих так называемую минимальную поликетидсинтазу. Этот ферментный комплекс включает кетосинтазу (с ацилтрансферазным доменом), фактор, определяющий длину цепи, и ацилпереносящий белок. Минимальная поликетидсинтаза отвечает за синтез ароматического поликетидного остова, а его модификации осуществляются другими ферментами, действующими согласованно с ней. Гены, кодирующие все эти ферменты, обычно организованы в один кластер (рис. 12.15). Каждый кластер генов кодирует синтез определенного антибиотика. С помощью обмена генами между кластерами были синтезированы два новых ароматических поликетидных антибиотика (рис. 12.16), что еще раз иллюстрирует возможности генной инженерии.
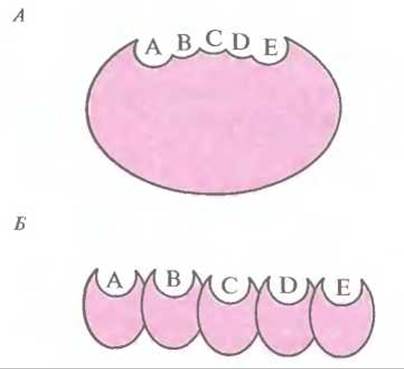
Рис. 12.13. Схематическое изображение структуры поликетидсинтазы ароматических поликетидов, у которой активный центр находится в одном полипептиде (А), и поликетидсинтазы, представляющей собой комплекс нескольких полипептидов с разными активными центрами (Б). Ферменты обоих типов содержат несколько доменов (А—Е), каждый из которых обладает собственной ферментативной активностью.

Рис. 12.14. Производные эритромицина, полученные генноинженерными методами. А. В результате мутации в гене споил редуктазы образуется продукт с двойной связью между атомами С-6 и С-7 (цветной кружок). Б. Деления гена ß-кеторедукгазы сопровождается образованием производного с C-5-карбонильной, а не гидроксильной группой (цветной кружок). (По данным работы Kutz, Donadio, Аnnu. Rev. Microbiol. 47: 875—912, 1993.)
Усовершенствование производства антибиотиков
С помощью генной инженерии можно не только создавать новые антибиотики, но и увеличивать эффективность синтеза уже известных. Лимитирующим фактором в промышленном производстве антибиотиков с помощью Streptomyces spp. часто является количество доступного клеткам кислорода. Вследствие плохой растворимости кислорода в воде и высокой плотности культуры Streptomyces его часто оказывается недостаточно, рост клеток замедляется и выход антибиотика снижается. Чтобы решить эту проблему, можно, во-первых, изменить конструкцию биореакторов, в которых выращивается культура Streptomyces, а во-вторых, используя методы генной инженерии, создать штаммы Streptomyces, более эффективно использующие имеющийся кислород. Эти два подхода не исключают друг друга.
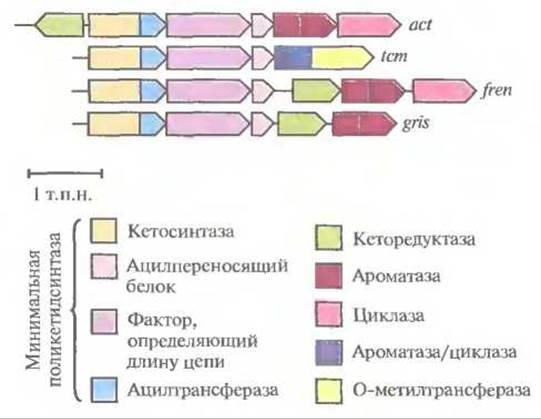
Рис. 12.15. Кластер генов биосинтеза ароматических поликетидных антибиотиков актинородина (act), тетраценомицина (tcm), френолицина (freu) и гризеузина (gris). Каждый кластер содержит гены, кодирующие минимальную поликетидсинтазу, которая отвечает за синтез поликетидного остова. Ферменты, кодируемые другими генами, катализируют реакции его модификации. Сужающийся «конец» гена указывает направление его транскрипции.
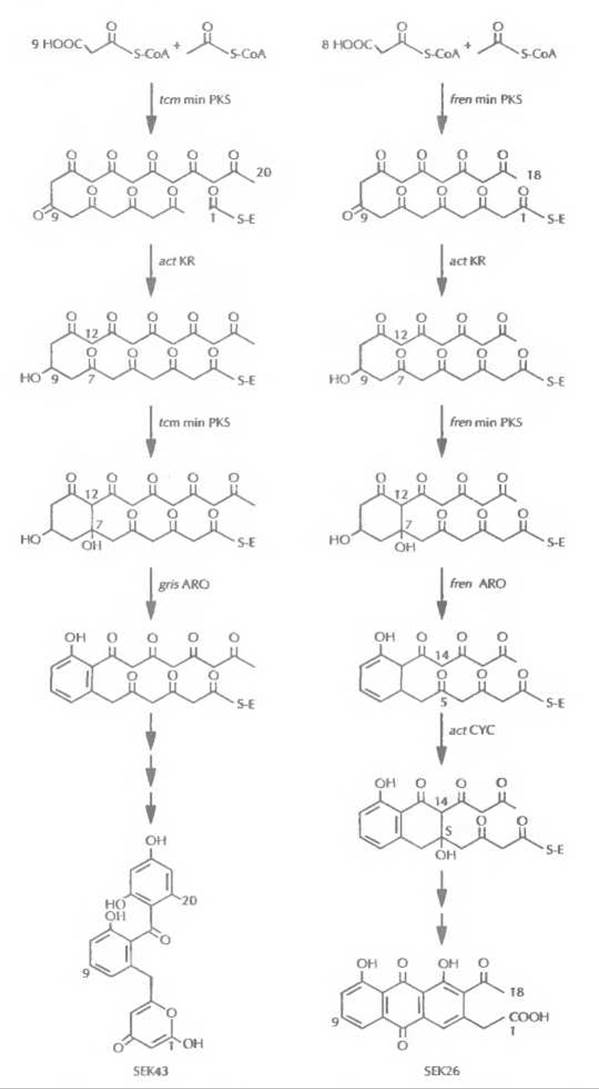
Рис. 12.16. Искусственно созданные пути биосинтеза поликетидных антибиотиков SEK43 и SEK26. Обозначения: act — актинородин, tcm — тетраценомицин, fren — френолицин, gris — гризеузин, min PKS — минимальная поликетидсинтаза, KR — ß-кеторедуктаза, ARO — ароматаза, CYC — циклаза.
Одна из стратегий, используемых некоторыми аэробными микроорганизмами для выживания в условиях недостатка кислорода, состоит в синтезе гемоглобинподобного продукта, способного аккумулировать кислород и доставлять его в клетки. Например, аэробная бактерия Vitreoscilla sp. синтезирует гомодимерный гемсодержащий белок, функционально подобный эукариотическому гемоглобину. Ген «гемоглобина» Vitreoscilla был выделен, встроен в плазмидный вектор Streptomyces и введен в клетки этого микроорганизма. После его экспрессии на долю гемоглобина Vitreoscilla приходилось примерно 0,1% всех клеточных белков S. соеliсоlor даже в том случае, когда экспрессия осуществлялась под контролем собственного промотора гена гемоглобина Vitreoscilla, а не промотора Streptomyces. Трансформированные клетки S. coelicolor, растущие при низком содержании растворенного кислорода (примерно 5% от насыщающей концентрации), синтезировали в 10 раз больше актинородина на 1 г сухой клеточной массы и имели большую скорость роста, чем нетрансформированные. Этот подход можно использовать и для обеспечения кислородом других микроорганизмов, растущих в условиях недостатка кислорода.

Исходным материалом при химическом синтезе некоторых цефалоспоринов — антибиотиков, обладающих незначительным побочным эффектом и активных в отношении множества бактерий, — является 7-аминоцефалоспорановая кислота (7АСА), которая в свою очередь синтезируется из антибиотика цефалоспорина С (рис. 12.11). К сожалению, природных микроорганизмов, способных синтезировать 7АСА, до сих пор не выявлено. Новый путь биосинтеза 7АСА был сконструирован включением специфических генов в плазмиду гриба Acremonium chrysogenum, который обычно синтеризует только цефалоспорин С. Один из этих генов был представлен кДНК гриба Fusarium solani, кодирующей оксидазу D-аминокислот, а другой происходил из геномной ДНК Pseudomonas diminuta и кодировал цефалоспоринацилазу. В плазмиде гены находились под контролем промотора
A. chrysogenum. На первом этапе нового биосинтетического пути цефалоспорин С превращается в 7-β-(5-карбокси-5-оксопентанамид) цефалоспорановую кислоту (кетo-AD-7ACA) при помощи оксидазы D-аминокислот (рис. 12.17). Часть этого продукта, вступая в реакцию с пероксидом водорода, одним из побочных продуктов, превращается в 7-ß-(4- карбоксибутанамид) цефалоспорановую кислоту (GL-7ACA). И цефалоспорин С, и кето-AD-7ACA, и GL-7ACA могут подвергаться гидролизу цефалоспоринацилазой с образованием 7АСА, однако только 5% цефалоспорина С напрямую гидролизуется до 7АСА. Следовательно, для образования 7АСА с высоким выходом необходимы оба фермента.
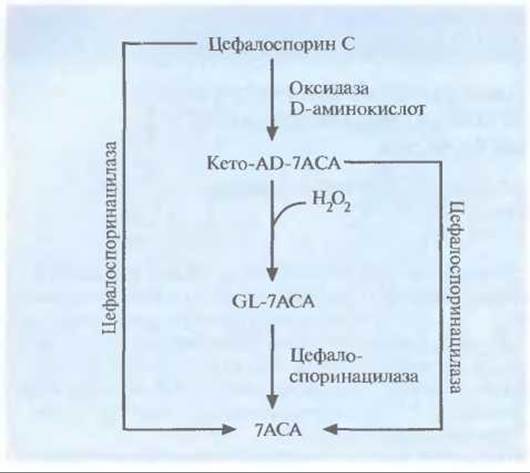
Рис. 12.17. Генетически сконструированный путь биосинтеза 7-аминоцефалоспорановой кислоты (7АСА) из цефалоспорина С. Ген оксидазы D-аминокислот выделен из гриба F. solani, а ген цефалоспоринацилазы — из бактерии Р. diminuta.