Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Биодеградация токсичных соединений и утилизация биомассы
Утилизация крахмала и сахаров
Крахмал, основной резервный полисахарид растений, представляет собой смесь гомополимеров D-глюкозы — как линейных (амилоза), так и разветвленных (амилопектин). Молекула амилозы состоит из 1∙102—4∙105 остатков D-глюкозы, соединенных а-1,4-связями (рис. 13.9, A), a амилопектина — из коротких (17—23 остатков D-глюкозы, соединенных а-1,4-связями) линейных цепей, соединенных 1,6- и 1,3-связями и формирующих сильно разветвленную структуру, содержащую 1∙104—4∙107 остатков глюкозы (рис. 13.9, Б). Степень разветвления и соотношение между амилозой и амилопектином варьируют в зависимости от вида и возраста растения, из которого был получен крахмал.
Таблица 13.3. Рост родительских и рекомбинантного штаммов Pseudomonas на разных ароматических соединениях1)
|
Штамм |
Рост на2) |
||||
|
бифениле |
дифенилметане |
толуоле |
бензоле |
трихлорэтилене |
|
|
З. putida KF715 |
+ ++ |
+++ |
- |
- |
- |
|
Р. putida Fl |
- |
- |
+++ |
+++ |
+ |
|
Р. putida KF715-D53) |
++ |
+ |
+++ |
+++ |
+++ |
1) Из работы Suyama et al., J. Bacteriol. 178: 4039—4046, 1996, с изменениями.
2) Обозначения: +++ хороший рост; ++ умеренный рост; + плохой рост; — очень плохой рост или нет роста.
3) О Штамм KF715-D5 Р. putida получен путем замены гена bphAl в штамме KF715 на ген todCl из штамма F1
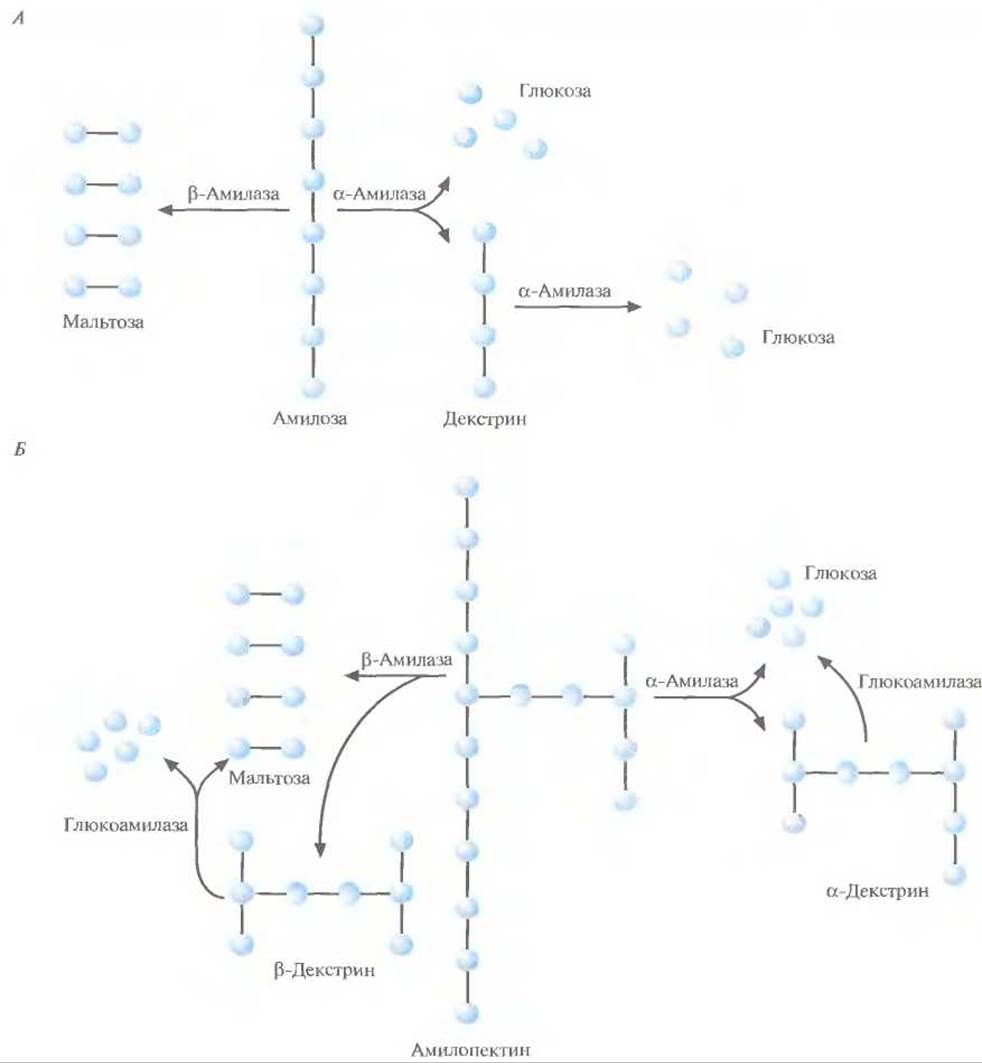
Рис. 13.9. А. Ферментативный гидролиз амилозы. Б. Ферментативный гидролиз амилопектина. Голубые кружки — остатки D-глюкозы.
Промышленное производство фруктозы и этанола
Крахмал широко используется в пищевой промышленности и пивоварении; при этом его сначала гидролизуют до низкомолекулярных компонентов, а затем превращают в другие соединения, преимущественно во фруктозу и этанол. Основные ферменты, необходимые для гидролиза крахмала и дальнейших превращений, — а-амилаза, глюкоамилаза и глюкозоизомераза. Их стоимость составляет примерно 30% обшей стоимости всех ферментов, применяемых в настоящее время в промышленности.

Рис. 13.10. Промышленное производство фруктозы и этанола из крахмала.
Промышленное производство фруктозы и этанола из крахмала — это многоэтапный процесс, включающий следующие ферментативные и неферментативные стадии (рис. 13.10).
1. Желирование молотого зерна (обычно кукурузного, содержание крахмала в котором составляет примерно 40%). Для этого зерно обрабатывают паром под давлением, в результате чего разрушаются крахмальные зерна и крахмал становится доступным для последующего фрементативного гидролиза. Получаемый продукт имеет желеобразную консистенцию.
2. Ожижение. Желированный крахмал охлаждают до 50—60 °С и добавляют а-амилазу. При этом происходит гидролиз доступных а-1,4-связей и образуются низкомолекулярные полисахариды. Высокая температура повышает эффективность проникновения фермента в желированный крахмал и увеличивает скорость гидролиза.
3. Осахаривание (полный гидролиз) низкомолекулярных полисахаридов (как линейных, так и разветвленных) до молекул глюкозы. Происходит под действием глюкоамилазы.
Конечным продуктом такой обработки является глюкоза, из которой затем можно получить этанол (с помощью дрожжевой ферментации) или фруктозу (с помощью глюкозоизомеразы). Благодаря высокой эффективности последнего процесса вместо сахарозы при приготовлении пищи и в пивоварении в Северной Америке используют более дешевую фруктозу. Крахмал при промышленном производстве фруктозы обычно получают из кукурузы, поэтому его конечный продукт называют кукурузным сиропом с высоким содержанием фруктозы или просто сиропом с высоким содержанием фруктозы, хотя он состоит из примерно равных долей фруктозы и глюкозы.
Фермент а-амилаза гидролизует а-1,4-связи в молекулах амилозы и аминопектина случайным образом, при этом образуется смесь глюкозы, мальтозы (два остатка глюкозы, соединенные а-1,4-связью), мальтотриозы (три остатка глюкозы, соединенные а-1,4-связью) и ряд а- декстринов, которые представляют собой фрагменты амилопектиновых цепей с поперечными сшивками (рис. 13.9). а-Амилазу можно выделять из многих микроорганизмов, но для промышленных целей ее обычно получают из Bacillus amyloliquefaciens.
Иногда для расщепления крахмала вместо а- амилазы или одновременно с ней используют ß- амилазу, которая гидролизует каждую вторую a-1,4-связь, начиная с концов цепей амилозы и амилопектина, в результате чего образуются остатки мальтозы и различные ß-декстрины. Фермент глюкоамилаза гидролизует а-1,3-, а-1,4- и а-1,6-связи. Однако а-1,4-связи она гидролизует менее эффективно, чем а-амилаза, и поэтому обычно используется совместно с ней. Основная функция глюкоамилазы — расщепление поперечных сшивок в молекуле декстрина с превращением его в глюкозу. Этот и другие ферменты используются для уменьшения доли углеводов (декстринов) в нормальных сортах пива и получения так называемых светлых и сухих сортов. Обработку глюкоамилазой обычно проводят перед ферментацией, однако эти два процесса можно объединить. Глюкоамилазу синтезируют многие микроорганизмы, но обычно ее получают из грибов Aspergillus niger.

Повышение эффективности производства фруктозы и этанола
Стоимость производства этанола или фруктозы из молотого зерна в основном определяется стоимостью ферментов, которые обычно используются однократно. Поэтому разработка новых подходов недорогого широкомасштабного производства этих ферментов может существенно снизить стоимость конечных продуктов. Этого можно достичь несколькими способами.
✵ Использовать для сверхпродукции ферментов быстрорастущие рекомбинантные микроорганизмы, утилизирующие недорогой субстрат. Это будет дешевле, чем получать ферменты из природных микроорганизмов.
✵ Использовать разновидности а-амилазы (встречающиеся в природе или созданные методами генной инженерии), которые обладают более высокой активностью и позволяют проводить ожижение при 80—90 °С. Это ускорит гидролиз желированного крахмала и сэкономит энергию, расходуемую на его охлаждение до температуры, при которой обычно проводят гидролиз.
✵ Модифицировать гены а-амилазы и глюкоамилазы таким образом, чтобы кодируемые ими ферменты имели одинаковые оптимумы температуры и pH. Это позволит совместить этапы ожижения и осахаривания.
✵ Найти или создать фермент, который будет эффективно расщеплять необработанный крахмал, что позволит исключить этап желирования и сэкономит большое количество энергии.
✵ Создать такой микроорганизм для ферментации, который будет синтезировать и секретировать глюкоамилазу, что устранит необходимость ее добавления в процессе ферментации.
В настоящее время проводятся исследования, которые покажут, возможна ли разработка таких подходов.
Гены, кодирующие а-амилазу, были выделены из многих микроорганизмов, в том числе из В. amyloliquefaciem и термофильной бактерии В. stearothermophilus. Для этого экстрагировали их хромосомную ДНК, частично гидролизовали ее рестрицирующей эндонуклеазой Sаu3АI и встроили в обработанную рестриктазой ВаmIII плазмиду pUB110, которая содержит уникальный ВаmHI-сайт и несет ген устойчивости к канамицину. Полученным банком клонов трансформировали не обладающие а-амилазной активностью клетки В. subtilis, отобрали трансформированные клетки по признаку устойчивости к канамицину и тестировали их на способность к синтезу и секреции а-амилазы при помощи иод-крахмального теста. Для этого чашки с колониями, образованными трансформантами при 65 °С на содержащей крахмал твердой среде, поместили в пары иода. Колонии, продуцирующие а-амилазу, были окружены четко различимым гало, что свидетельствовало о гидролизе крахмала вблизи них. Положительный иод-крахмальный тест указывает на транскрипцию гена а-амилазы под контролем своего промотора (вектор не содержит промотора) и на наличие сигнала, необходимого для секреции (молекулы субстрата велики и не могут проникнуть в клетку). Возможность получения генов а-амилазы из разных источников позволила исследователям внести в них изменения, необходимые для того, чтобы эти гены можно было использовать в конкретных промышленных процессах.
Возможность исключения этапа осахаривания при производстве этанола из крахмала была доказана следующим образом. Выделенную из грибов Aspergillus awamori полноразмерную кДНК глюкоамилазы встроили в одну из плазмид Saccharomyces cerevisiae так, чтобы она находилась под контролем промотора и регуляторных последовательностей терминации транскрипции гена енолазы дрожжей (ENO1). «Лабораторный» штамм S. cerevisiae, трансформированный этой плазмидой, приобрел глюкоамилазную активность и мог превращать растворимый крахмал в этанол.
К сожалению, некоторые свойства этого штамма (чувствительность к высокой концентрации этанола, неэффективность экспрессии кДНК глюкоамилазы, поддержание плазмид только при определенном давлении отбора) делают его непригодным для промышленного использования. Однако эти недостатки удалось устранить. Во-первых, продукцию глюкоамилазы повысили примерно в 5 раз, удалив из плазмиды область отрицательной регуляции ENOl-промотора длиной 175 п. н. Во-вторых, из плазмиды удалили «дрожжевой» сайт инициации репликации и встроили в нее сегмент ДНК, гомологичный участку дрожжевой хромосомы, превратив ее тем самым в интегрирующий вектор, который встраивается в дрожжевую хромосому и стабильно поддерживается в клетке. В-третьих, в качестве клетки-хозяина для модифицированной таким образом плазмиды использовали другой штамм S. cerevisiae (пивные дрожжи), устойчивый к высокой концентрации этанола.
В результате получили два новых штамма дрожжей, которые гидролизуют и ферментируют растворимый крахмал более эффективно, чем близкие к S. cerevisiae природные амилолитические (гидролизующие крахмал) дрожжи S. cliastaticus (табл. 13.4). «Пивной» штамм S. cerevisiae с встроенным в хромосому геном глюкоамилазы действовал более эффективно, чем «лабораторный» с тем же геном в составе многокопийной плазмиды, что, по-видимому, свидетельствует о ее нестабильности и утрате введенного гена глюкоамилазы. Как «лабораторный», так и «пивной» штаммы S. cerevisiae по введения в них гена глюкоамилазы не могли утилизировать растворимый крахмал. Плазмидная и интегрированная кДНК глюкоамилазы A. awamori находилась под контролем регуляторных последовательностей гена EN01, откуда была удалена область отрицательной регуляции длиной 175 п. н. Для поддержания плазмиды создавалось определенное селективное давление. Для повышения продукции глюкоамилазы в хромосомную ДНК грибов A. niger встроили несколько копий ее гена. Оказалось, что активность глюкоамилазы не коррелирует с числом копий гена, но сильно зависит от того, в какой участок хромосомы они были встроены. Таким образом, простого увеличения числа копий гена недостаточно для повышения продукции активного фермента.
Таблица 13.4. Расщепление растворимого крахмала (25%, в/о) разными штаммами дрожжей1)
|
Штамм |
Утилизация углеводов, % |
Производство этанола, г/л |
Выход этанола, г/г субстрата |
|
«Лабораторный» |
5 |
<0,1 |
0 |
|
«Лабораторный» + плазмида |
68 |
75,6 |
0,41 |
|
«Пивной» |
<1 |
3,1 |
0 |
|
«Пивной» + встроенный ген |
93 |
118,2 |
0,48 |
|
S. diastaticus |
43 |
44,2 |
0,38 |
1) Из работы Cole et al., Bio/Technology 6: 417—421, 1988, с изменениями.
Фермент глюкозоизомеразу следовало бы назвать ксилозо/глюкозоизомеразой, поскольку основная катализируемая им реакция — это превращение пятиуглеродного моносахарида D-ксилозы в D-ксилулозу, а реакция изомеризации D-глюкозы в D-фруктозу является побочной. Ксилозо/глюкозоизомераза имеет более низкую каталитическую константу kcat и более высокую константу связывания КM для глюкозы, чем для ксилозы; это означает, что ксилоза прочнее связывается с ферментом и быстрее превращается в ксилулозу, чем глюкоза превращается во фруктозу.
С помощью внутриклеточных ферментов, к которым относится ксилозо/глюкозоизомераза, не удается получать продукты такой же степени чистоты и в таком же количестве, как в случае внеклеточных (секретируемых) ферментов. Большинство ферментов, используемых в промышленных процессах, не подвергаются тщательной очистке, а в препарате внеклеточного фермента обычно содержится гораздо меньше белковых примесей, чем в экстракте внутриклеточного. Кроме того, для получения экстракта внутриклеточного фермента необходимо отделить клетки от культуральной среды, механически их разрушить и удалить образовавшиеся фрагменты. Все это повышает стоимость конечного продукта — ксилозо/глюкозоизомеразы. Чтобы решить эту проблему, можно иммобилизовать фермент на твердом носителе и использовать его многократно.
Изомеризация глюкозы с образованием фруктозы — обратимая реакция, конечное содержание образующейся в ее ходе фруктозы находится в прямой зависимости от температуры, которая в большинстве производственных процессов составляет примерно 60 °С. Повысив температурный оптимум и термостабильность ксилозо/глюкозоизомеразы, можно увеличить выход фруктозы.
Термофильная бактерия Thermus thermophilus продуцирует ксилозо/глюкозоизомеразу, которая сохраняет свою активность и остается стабильной при 95°С, а потому представляется весьма перспективной для промышленного использования. К сожалению, природный штамм Т. thermophilus вырабатывает ее в небольшом количестве. Чтобы устранить этот недостаток, выделили ген ксилозо/глюкозоизомеразы Т. thermophilus и осуществили его экспрессию в Е. coli и В. brevis с использованием разных промоторов и разных сайтов связывания с рибосомой (табл. 13.5). В последней из представленных в табл. 13.5 систем фермент вырабатывался в количестве, более чем в 1000 раз превышающем исходное, что позволяет использовать ее для промышленного получения фруктозы. Есть еще одна возможность — повысить субстратную специфичность фермента. В одной из серий экспериментов с помощью сайт-специфического мутагенеза заменяли нуклеотиды, кодирующие одну или две аминокислоты ксилозо/глюкозоизомеразы термофильной бактерии Clostridium thermosulfurogenes. Выбор сайтов для модификации основывался на данных об участии соответствующих аминокислот в связывании субстрата. Замена триптофана в положении 139 на фенилаланин или валина в положении 186 на треонин привела к повышению каталитической эффективности (kcat/KM) фермента в отношении глюкозы в 1,7 и 2,6 раза соответственно (табл. 13.6) и к ее уменьшению для ксилозы в 2 и 7 раз. При одновременной замене двух аминокислот каталитическая эффективность в отношении глюкозы повысилась в 5,7 раза, а в отношении ксилозы снизилась в 4,5 раза. Таким образом, двойная замена привела к тому, что фермент, который исходно был в 17 раз активнее в отношении ксилозы, стал в 1,5 раза активнее в отношении глюкозы. Изменение специфичности и повышение термостабильности ксилозо/глюкозоизомеразы, которого удалось достичь, позволит использовать ее для промышленного превращения глюкозы во фруктозу.
Таблица 13.5. Активность ксилозо/глюкозоизомеразы Т. thermophilus и разных бактериях1)
|
Бактерия2) |
Число копий плазмиды |
Промотор |
Сайт связывания с рибосомой |
Ферментативная активность, ЕД/л |
|
Г. thermophilus |
Нет |
Т. thermophilus |
Т. thermophilus |
20 |
|
Е. coli |
200 |
Е. coli tac |
Т. thermophilus |
190 |
|
Е. coli |
20 |
Е. coli tac |
Т. thermophilus |
1 790 |
|
Е. coli |
20 |
Е. coli tac |
Е. coli |
3 260 |
|
Е. coli |
20 |
ФагТ7 f10 |
Е. coli |
7 050 |
|
В. brevis |
20 |
В. brevis cwp |
Т. thermophilus |
1 400 |
|
В. brevis |
20 |
В. brevis cwp |
В. brevis |
25 000 |
1) Из работы Dekker et ak. Appl. Microbiol. Bioteehnol. 36: 727—732» 1992, с изменениями.
2) Данные, приведенные в первой строке, относятся к природному штамму, продуцирующему данный фермент. Все остальные штаммы получены путем трансформации и содержат ген ксилозо/глюкозоизомеразы Т. thermophilus в составе мультикопийной плазмиды.
Таблица 13.6. Каталитическая эффективность природной и мутантных форм ксилозо/глюкозоизомеразы С. thermosulfurogenes1)
|
Замены аминокислот |
Каталитическая |
|
|
эффективность kcat/KM, мин-1∙мМ-1 |
||
|
глюкоза |
фруктоза |
|
|
Нет (природная) |
5,8 |
97,2 |
|
Тrр-139 → Pile |
15 |
13,6 |
|
Val-186 → Thr |
9,7 |
55,4 |
|
Trp-139 → Phe/Val-186 → Thr |
32,9 |
21,6 |
1) Из работы Meng et al.. Proc. Nail. Acad. Sei. USA 88: 4015—4019. 1991, с изменениями.
Zymomonas mobilis
Сбраживание субстрата при промышленном производстве этанола осуществляют в основном с помощью S. cerevisiae, но вместо нее можно было бы использовать бактерию Zymomonas mobilis. Это грамотрицательная палочка, которая сбраживает глюкозу, фруктозу и сахарозу с относительно большим выходом этанола (табл. 13.7). По-видимому, это связано со снижением ее пролиферации (прироста биомассы) в ходе ферментации и уменьшением количества расходуемого на это субстрата, который теперь идет на образование этанола. Расщепляя 1 моль глюкозы, дрожжи вырабатывают 2 моля АТР, а использующая другой метаболический путь Zymomonas — 1 моль. Исторически сложилось так, что Zymomonas использовали для ферментации при производстве алкогольных напитков в тропических странах (например, в Мексике для производства напитка, называемого пулька, который содержит 3—5% спирта и вырабатывается из сока агавы).
Основное различие между Zymomonas и S. cerevisiae как продуцентами этанола заключается в скорости его образования. У Zymomonas она гораздо выше (табл. 13.7). Однако существуют некоторые биологические и технические ограничения, не позволяющие использовать Zymomonas для промышленного производства этанола:
1) небольшое число углеродных субстратов, которые она может использовать для синтеза этанола; 2) проблемы, возникающие при поддержании в ней клонирующих векторов с широким кругом хозяев, а значит, и чужеродных генов; 3) природная устойчивость к наиболее распространенным антибиотикам, что не позволяет при проведении экспериментов по клонированию использовать стандартные маркерные системы устойчивости к антибиотикам.
Таблица 13.7. Сравнение Z. mobilis и S. cerevisiae как продуцентов этанола1)
|
Показатель2* |
Значение для: |
|
|
Z. mobilis |
S. cerevisiae |
|
|
Превращение сахара в этанол, % |
96 |
96 |
|
Максимальная концентрация этанола. % |
12 |
12 |
|
Скорость продукции этанола, г ∙ г-1∙ ч-1 |
5,67 |
0,67 |
|
Объемная скорость продукции этанола, г ∙ л-1∙ ч-1 |
200 |
29 |
|
Допустимая концентрация сахара,% |
>40 |
>40 |
|
Диапазон pH |
3,5-7,5 |
2-6,5 |
|
Оптимальная температура, °С |
25-30 |
30-38 |
1) Из работы Buchholz et al, Trends Biotechnol. 5: 199—204, 1987.
2) Скорость продукции этанола измеряли в стандартных условиях ферментации, объемную скорость — в непрерывной культуре.
Несмотря на все это ученым удалось встроить и экспрессировать в Zymomonas некоторые чужеродные гены. Большинство проведенных экспериментов были направлены на расширение спектра утилизируемых ею субстратов. Так, в Zymomonas были введены гены ферментов, гидролизующих лактозу, крахмал, целлюлозу, ксилозу и целлобиозу. Трансформированные клетки экспрессировали все эти гены, но в большинстве случаев не могли использовать перечисленные выше субстраты в качестве единственного источника углерода. Придать Zymomonas новые катаболические свойства оказалось весьма непросто, хотя по крайней мере в одном случае удалось использовать этот микроорганизм для получения этанола из отходов, содержащих ксилозу. В самом начале работы по созданию штаммов Z mobilis, способных расти и продуцировать этанол с использованием ксилозы в качестве субстрата, в эту бактерию ввели гены глюкозо/ксилозоизомеразы и ксилулокиназы — ферментов, необходимых для утилизации ксилозы. Но полученные трансформанты не могли использовать образующиеся при расщеплении ксилозы пентозы (ксилулозо-5-фосфат, рибулозо-5-фосфат и рибозо-5-фосфат). Поэтому на следующем этапе в Z. mobilis ввели плазмиду, несущую два синтетических оперона, один из которых кодировал два фермента, расщепляющих ксилозу, а другой — два фермента, метаболизирующих пентозу (транскетолазу и трансальдолазу) (рис. 13.11). Транскрипция генов первого оперона находилась под контролем сильного конститутивного промотора гена глицеральдегид-3-фосфатдегидрогеназы Z. mobilis, а второго — под контролем промотора гена енолазы Z. mobilis. Эти два синтетических оперона встроили в челночный вектор Е. coli—Z. mobilis, которым и трансформировали Z. mobilis. Как и ожидалось, трансформированные клетки утилизировали ксилозу и преобразовывали пентозы до фруктозо-6-фосфата и глицеральдегид-3-фосфата, которые затем превращались в этанол по пути Энтнера—Дудороффа. Более того, трансформанты эффективно росли на глюкозе, ксилозе и их смеси и превращали ксилозу в этанол с большим выходом последнего. Эта работа продемонстрировала возможность генноинженерной модификации Z. mobilis для создания микроорганизма — продуцента этанола, который использовал бы в качестве источника углерода ксилозу, побочный продукт деревообрабатывающей и целлюлозно-бумажной промышленности.
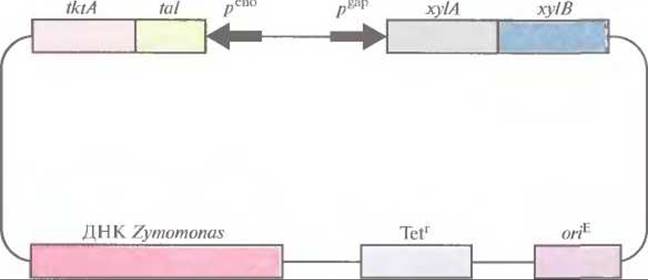
Рис. 13.11. Челночный вектор Zymomonas-E. coli, несущий два оперона, один из которых содержит гены ферментов, необходимых для утилизации ксилозы (xylA и хуlB), а другой — гены ферментов, участвующих в метаболизме пентозы (tktA и tal). Стрелками указано направление транскрипции с каждого промотора. рeno — промотор гена енолазы, рgap — промотор гена глицеральдегид-3-фосфатдегидрогеназы, хуlА — ген ксилозоизомеразы, хуlВ — ген ксилулокиназы, tktА — ген транскетолазы, tal — гентрансальдолазы, Tetr - ген устойчивости к тетрациклину, оriЕ - точка инициации репликации Е. coli. ДНК Zymomonas содержит собственную точку инициации репликации.
Получение силоса
Такие сельскохозяйственные культуры, как кормовые злаки, кукуруза и люцерна, широко используются в качестве корма для скота, поэтому очень важно обеспечить правильные условия их хранения в течение многих месяцев. Традиционно для этого применяют природные молочнокислые бактерии, для которых растительный материал служит субстратом при синтезе молочной и уксусной кислот. Эти кислоты подавляют рост других микроорганизмов, способствуя сохранению кормовой растительной массы (силоса). Если молочнокислые бактерии присутствуют на свежем растительном материале в небольшом количестве, нужно добавить бактериальный посевной материал (обычно Lactobacillus plantarum). К сожалению, эта мера оказывается малоэффективной в том случае, когда растительная культура содержит недостаточное для поддержания роста бактерий и производства молочной кислоты количество водорастворимых углеводов.
Для создания бактерии, способной осуществлять эффективную ферментацию растительного материала, встроили ген а-плазмиды «не силосного» штамма L. amylovorus в хромосомный ген конъюгированной гидролазы желчных кислот (cbh) одного из штаммов L. plantarum (рис. 13.12). Этот ген кодирует фермент, который активируется при попадании бактерии в кишечник животного и, следовательно, не нужен при образовании силоса. Данная работа представляет собой первый шаг на пути создания штаммов L. plantarum, способствующих более эффективному образованию силоса из сельскохозяйственных культур, содержащих много крахмала, таких как люцерна.