Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Микробные инсектициды
Токсин, синтезируемый Bacillus thuringiensis
Механизм действия и использование
Под «микробным инсектицидом» иногда понимается микроорганизм, либо синтезирующий какое-либо токсичное вещество, избирательно действующее на определенных насекомых, либо инфицирующий насекомое-мишень и приводящий к его гибели. Наиболее изученные, наиболее эффективные и наиболее часто используемые микробные инсектициды — бактерии В. thuringiensis. Они представлены множеством штаммов и подвидов (subsp.), и каждый из них синтезирует токсин, специфичный в отношении определенных насекомых (табл. 15.1). Например, В. thuringiensis subsp. kurstaki токсичен для личинок чешуекрылых (в том числе моли и бабочек), для личинок толстоголовки, мермитид и гусениц листовертки-почкоеда елового. В. thuringiensis subsp. israelensis уничтожает двукрылых: комаров и мошек. В. thuringiensis subsp. tenebrionis (также известный как san diego) эффективен в отношении жесткокрылых, в том числе колорадского жука и хлопкового долгоносика. Описаны и другие штаммы В. thuringiensis, каждый из которых токсичен для определенных насекомых. Инсектицид (белковый токсин) В. thuringiensis subsp. kurstaki и других штаммов находится в клетке в виде так называемого параспорального кристалла — структуры, которая образуется во время споруляции бактерий. Никакой особенной биологической функции эта структура не несет. На ее долю приходится от 20 до 30% сухой массы спорулирующей культуры и состоит она главным образом из белка (~95%) и некоторого количества углеводородов (~5%). Кристалл — это на самом деле некий белковый агрегат, диссоциирующий на субъединицы в слабой щелочи. Субъединицы можно далее диссоциировать in vitro обработкой ß-меркаптоэтанолом, который восстанавливает дисульфидные связи (рис. 15.1).
Таблица 15.1. Некоторые свойства инсектицидных токсинов, синтезируемых разными штаммами В. thuringiensis1)
|
Штамм В. thuringiensis или подвид |
Класс |
Мол. масса протоксина, кДа |
Насекомое-мишень |
Серотип |
|
berliner |
CryI |
130-140 |
Чешуекрылые |
1 |
|
kurstaki КТО, HD-I |
CryI |
130-140 |
Чешуекрылые |
3 |
|
entomocidus 6.01 |
CryI |
130-140 |
Чешуекрылые |
6 |
|
aizawai 7.29 |
CryІ |
130-140 |
Чешуекрылые |
7 |
|
aizpwai IC I |
CryI |
135 |
Чешуекрылые, двукрылые |
7 |
|
kurstaki HD-I |
CryІI |
71 |
Чешуекрылые, двукрылые |
3 |
|
tenebrionis (sun diego) |
CrvIII |
66-73 |
Жесткокрылые |
8 |
|
morrisoni PG14 |
CryIV |
125-145 |
Двукрылые |
8 |
|
israelensis |
CryIV |
68 |
Двукрылые |
14 |
1) Из работы Lerechus et аl., р. 37—69, in Entwistle et al., (ed.), Bacillus thuringiensis, an Environmental Biopesticide: Theory and Practice, 1993.
Все инсектицидные токсины, выделенные из множества штаммов В. thuringiensis, в соответствии с их токсичностью можно сгруппировать в четыре основных класса: CryI, CryII, СrуIII и CryIV. Белки CryI токсичны для чешуекрылых, CryІІ — для чешуекрылых и двукрылых, СrуIII — для жесткокрылых, CryIV — для двукрылых. Классы можно разделить далее на подклассы (А, В, С, ...) и подгруппы (а, b, с, ...) согласно нуклеотидным последовательностям генов соответствующих токсинов. Например, класс генов cryІ включает шесть подклассов (от cryIA до F), а подкласс cryIA — три подгруппы [от crylA(a) до (с)]. Кроме того, в соответствии с иммунологическими особенностями выделяют примерно 30 разных серотипов В. thuringiensis (табл. 15.1). Каждый серотип отличается от другого специфическим набором антигенных детерминант на поверхности клеток определенного штамма В. thuringiensis. В параспоральном кристалле инсектицид обычно находится в неактивной форме: при солюбилизации кристалла белок высвобождается в форме протоксина, предшественника активного токсина. Протоксин класса токсинов Cryl имеет мол. массу примерно 130 кДа (рис. 15.1). После заглатывания насекомым параспорального кристалла протоксин активируется в кишечнике в условиях щелочного pH (7,5—8,0) и под действием специфических пищеварительных протеиназ превращается в активный токсин с мол. массой примерно 68 кДа (рис. 15.1). В таком виде он встраивается в мембрану эпителиальных клеток кишечника насекомого и образует ионный канал, через который, как полагают, происходит утечка значительной части клеточного АТР (рис. 15.2). Примерно через 15 мин после формирования такого ионного канала клеточный метаболизм блокируется, насекомое перестает питаться, происходит обезвоживание организма и в конечном счете наступает смерть. Поскольку превращение протоксина в активный токсин происходит только в условиях щелочного pH и в присутствии определенных протеиназ, вероятность вредного воздействия токсинов на человека и сельскохозяйственных животных мала.

Рис. 15.1. Схематическое изображение параспорального кристалла В. thuringiensis, состоящего из белкового протоксина Cryl. Каждая белковая субъединица имеет мол. массу 250 кДа и содержит два полипептида мол. массой 130 кДа каждый. Молекулярные массы определяли с помощью электрофореза в полиакриламидном геле; приведены округленные значения. Превращение протоксина (130 кДа) в активный токсин (68 кДа) происходит только в слабощелочных условиях (pH 7,5—8) в присутствии специфической протеиназы (протеиназ). Именно эти условия реализуются в кишечнике насекомого.
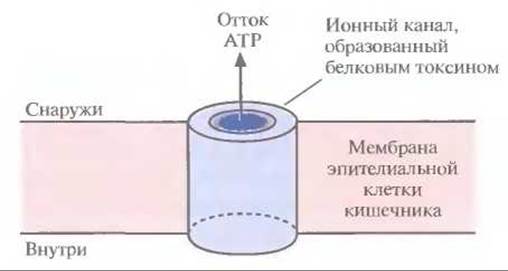
Рис. 15.2. Встраивание токсина В. thuringiensis в мембрану эпителиальной клетки кишечника насекомого и образование ионного канала.
Способ действия токсинов В. thuringiensis налагает некоторые ограничения на область их применения. Чтобы убить насекомое, В. thuringiensis обязательно должен попасть в его кишечник, в противном случае никакого эффекта не будет. В. thuringiensis чаще всего распыляют, причем бактерии обычно смешивают с атрактантами насекомых, чтобы повысить вероятность того, что насекомое-вредитель проглотит токсин. Однако для насекомых, обитаюших в тканях растений или на корнях, токсин В. thuringiensis при такой обработке вряд ли будет представлять какую-либо опасность. С учетом всего этого были предприняты попытки разработать другие стратегии защиты растений от таких вредителей. Один из подходов состоит в создании трансгенных растений, несущих и экспрессирующих ген токсина В. thuringiensis и, следовательно, защищенных от насекомых-вредителей в течение всего периода вегетации.
Второе ограничение, налагаемое на применение токсина В. thuringiensis, связано с тем, что этот токсин действует на насекомое, находящееся только на определенной стадии развития. Именно в этот момент и должна проводиться обработка.
Штамм В. thuringiensis subsp. kurstaki был выделен в 1901 г., но интерес к нему как к ценному коммерческому продукту возник лишь в 1951 г., а за последние десять лет эта бактерия стала основным инструментом контроля численности гусениц листовертки-почкоеда елового в Канаде. В 1979 г. лишь над 1% лесов Канады, обрабатываемых инсектицидами с целью уничтожения этого насекомого (что соответствует примерно 2 млн. га), распыляли В. thuringiensis subsp. kurstaki; остальные площади обрабатывали химическими инсектицидами. К 1986 г. масштабы использования В. thuringiensis subsp. kurstaki возросли до 74%. В других странах В. thuringiensis subsp. kurstaki используют для борьбы с коконопрядом, непарным шелкопрядом, мертимидами, совкой капустной и бражником. Основное препятствие на пути еще более широкого применения В. thuringiensis subsp. kurstaki состоит в его дороговизне: стоимость такого препарата в 1,5—3 раза выше, чем химических инсектицидов.
Для биоконтроля численности насекомых-вредителей распыляют 1,5 ∙ 109—2,5 ∙ 109 спор В. thuringiensis subsp. kurstaki на каждый квадратный метр обрабатываемого участка. Обработку проводят в тот период, когда число личинок в популяции насекомого-мишени максимально, поскольку параспоральные кристаллы чувствительны к солнечному свету и быстро разрушаются. В лабораторных условиях на свету за 24 ч разлагается более 60% остатков триптофана в белках параспорального кристалла, а в окружающей среде в зависимости от освещенности кристаллы могут сохраняться от одних суток до одного месяца. Такая нестабильность инсектицидного протоксина подразумевает, что появление устойчивых к нему насекомых маловероятно.
Однако в том случае, когда В. thuringiensis subsp. kurstaki использовали в качестве инсектицида в условиях малой освешенности (например, в зернохранилищах), через несколько генераций появлялись устойчивые к токсину насекомые. Одна из причин такой передаваемой по наследству устойчивости заключается в изменении мембранного белка клеток кишечника, в норме выполняющего функцию рецептора токсина В. thuringiensis subsp. kurstaki. Возможно, она возникает вследствие того, что в этих условиях протоксин не разрушается и служит фактором отбора. Из всего этого следует, что появления насекомых, устойчивых к В. Thuringiensis subsp. kurstaki, проще всего избежать, если ограничить применение данного микроорганизма полевыми условиями. Впрочем, имея в виду масштабы использования В. thuringiensis, нельзя исключить, что может произойти его накопление в среде в количестве, достаточном для того, чтобы вступил в действие механизм отбора. А поскольку В. thuringiensis используется все более широко в разных регионах, вероятность появления популяций устойчивых насекомых будет увеличиваться.
Идентификация генов токсинов
Для создания штаммов В. thuringiensis, более эффективно синтезирующих инсектициды и имеющих широкий круг хозяев, нужно было идентифицировать и охарактеризовать ген(ы) протоксина, и в первую очередь выяснить, где они локализованы: в плазмиде или в хромосомной ДНК. Чтобы проверить гипотезу плазмидной локализации, штамм В. thuringiensis, продуцирующий токсин, можно конъюгировать со штаммом, не обладающим инсектицидной активностью. Передача хромосомной ДНК во время конъюгации происходит крайне редко, и если «дефектный» штамм приобретает способность синтезировать инсектицид, значит, токсиновые гены локализованы в плазмиде.
Для идентификации гена, кодирующего протоксин, используют обычную методику.
В. thuringiensis выращивают в культуре и лизируют клетки. Выделяют суммарную клеточную ДНК и центрифугируют ее в градиенте плотности CsCl, чтобы разделить плазмидную и хромосомную ДНК. Если гены протоксинов входят в состав генома, создают банк клонов хромосомной ДНК. Если же они содержатся в плазмиде, то плазмидную ДНК фракционируют по размерам центрифугированием в градиенте плотности сахарозы. Это обогащает ту плазмидную фракцию, которая послужит в дальнейшем исходным материалом для идентификации генов протоксинов (рис. 15.3). Ген протоксина В. thuringiensis subsp. kurstaki находится на одной из семи плазмид длиной 2,0; 7,4; 7,8; 8,2; 14,4; 45 и 71 т. п. н. Чтобы определить, в какой именно, проводили центрифугирование плазмидной ДНК в градиенте плотности сахарозы. Были выделены три фракции, в которых концентрировались малые (2,0 т. п. н.), средние (7,4; 7,8; 8,2 и 14,4 т. п. н.) и большие (45 и 71 т. п. н.) плазмиды. Малые плазмиды из рассмотрения были исключены, поскольку они не могли кодировать белок мол. массой 130 кДа. Длина нуклеотидной последовательности, кодирующей белок такого размера, должна превышать 4,0 т. п. н. Средние и большие плазмиды подвергли частичному гидролизу рестрицирующей эндонуклеазой Sau3АІ и фрагменты встроили в BamHI-сайт плазмиды pBR322. Полученными рекомбинантными плазмидами трансформировали клетки Е. coli, а затем провели иммунологический скрининг по следующей схеме:
1. Колонии клеток перенесли с агара на нитроцеллюлозный фильтр.
2. Перенесенные клетки частично лизировали органическими растворителями.
3. Все сайты неспецифического связывания первых и вторых антител на фильтре блокировали с помощью бычьего сывороточного альбумина (БСА).
4. Обработанные БСА фильтры инкубировали с кроличьими антителами к искомому инсектициду.
5. Отмывали фильтры от несвязавшихся антител и обрабатывали 1251-меченным А-белком Staphylococcus aureus, который взаимодействует с Fc-фрагментом связанных антител.
6. Области на фильтре, которые соответствуют колониям, активно синтезирующим инсектицид, выявляли с помощью радиоавтографии.
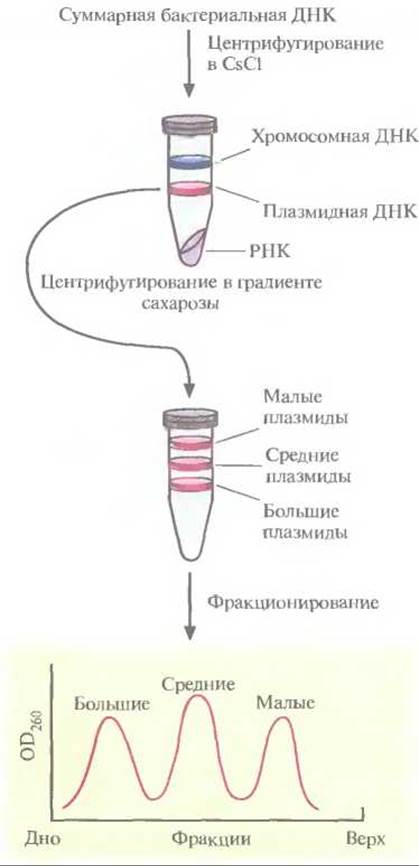
Рис. 15.3. Выделение и фракционирование плазмид, одна из которых несет ген протоксина.
Используя идентифицированный ген протоксина в качестве гибридизационного зонда, установили, что соответствующая нуклеотидная последовательность содержится в плазмиде В. thuringiensis subsp. kurstakiдлиной 71 т. и. н. Аналогичная схема клонирования и скрининга использовалась для идентификации генов токсинов, локализованных в плазмидах или (реже) в хромосомной ДНК других штаммов В. thuringiensis.
Генная инженерия генов токсинов В. thuringiensis
После идентификации токсинового гена В. thuringiensis была определена первичная структура кодируемого им белка. Сравнение аминокислотных последовательностей разных белковых токсинов показало, что белки некоторых штаммов имеют одинаковый домен, ответственный за токсичность. Кроме того, был субклонирован сегмент полной кодирующей последовательности, с которого синтезировался укороченный белок, в полной мере сохранивший свою токсичность. Таким образом, при последующих генноинженерных манипуляциях могут использоваться интактный ген токсина, его фрагмент или химически синтезированный олигонуклеотид.
В естественных условиях большинство протоксинов В. thuringiensis синтезируются только во время споруляции, т. е. параспоральный кристалл образуется только на определенной стадии развития микроорганизма. Если бы экспрессия гена токсина происходила во время всего жизненного цикла, можно было бы существенно увеличить количество получаемого токсина и уменьшить время его синтеза. Кроме того, это позволило бы сделать синтез токсина непрерывным процессом и тем самым значительно удешевить продукт, поскольку для непрерывной ферментации используют небольшие, а потому менее дорогие биореакторы и оборудование, чем для периодической (более подробно см. об этом в гл. 16).
Во время споруляции В. thuringiensis специфический фактор инициации транскрипции (сигма-фактор) связывается с промоторами генов, функционирующих только на этой стадии жизненного цикла бактерии, так что синтезируются матричные РНК (мРНК), специфичные для споруляции. Следовательно, чтобы добиться непрерывной экспрессии инсектицидного гена (генов) В. thuringiensis, необходимо поместить его (их) под контроль промотора, функционирующего в течение всего жизненного цикла.
Для этого фрагмент ДНК, содержащий ген токсина без его собственного промотора, встроили в плазмиду так, чтобы он находился под контролем активного конститутивного промотора гена устойчивости к тетрациклину, который ранее был вырезан из плазмиды Bacillus cerem и введен в В. thuringiensis. На всех этапах развития микроорганизма непрерывно синтезировался полноценный токсичный белок (рис. 15.4). Кроме того, когда этой конструкцией трансформировали мутантный штамм В. thuringiensis, не способный к споруляции, токсин все равно синтезировался. При этом процесс был гораздо более эффективным, чем в случае В. thuringiensis дикого типа: количество получаемого продукта было больше, а израсходованное количество субстрата и время синтеза — значительно меньше. Дальнейшее усовершенствование этой системы могло бы состоять во введении токсинового гена, экспрессирующегося в течение всего жизненного цикла, в хромосомную ДНК штамма В. thuringiensis, не способного к споруляции. Это гарантировало бы сохранность гена при непрерывной ферментации, что не всегда достигается при его плазмидной локализации вследствие нестабильности плазмиды.
Рис. 15.4. Клонирование фрагмента гена токсина В. thuringiensis subsp. kurstaki под контролем промотора гена устойчивости к тетрациклину (pTet). Из выделенного гена В. thuringiensis удаляют его собственный промотор с помощью рестриктаз RE1 и RE2. Полученный фрагмент встраивают в плазмидный вектор рядом с промотором рТet вместо гена устойчивости к тетрациклину, удаленного с помощью рестрикгаз RE1 и RE2, и лигируют при участии ДНК-лгазы фага Т4.
В отличие от большинства других токсиновых генов (cry) В. thuringiensis, экспрессия гена cryІІІA в норме контролируется «негативным» промотором, а не промотором, специфичным для споруляции. Ген сryІІІА кодирует токсин, эффективный в отношении личинок жесткокрылых. В результате трансформации мутантного штамма В. thuringiensis, не способного образовывать споры, плазмидой, несущей клонированный ген сrуIIIА, токсин синтезировался более эффективно и был более стабильным, чем при его синтезе в штамме дикого типа. Получив этот результат, ученые предположили, что суперэкспрессии других cry-генов, обычно экспрессирующихся только во время споруляции, можно достичь, если поместить их под контроль промотора сrуIIIА и трансформировать получившейся конструкцией мутантный штамм В. thuringiensis, не способный к споруляции.
Урожаю многих сельскохозяйственных культур наносят ущерб сразу несколько видов насекомых, поэтому чрезвычайно полезным было бы создание микробиологических инсектицидов, направленных против широкого спектра насекомых-вредителей. Токсин широкого спектра действия можно получить двумя путями: 1) переносом гена данного токсина (например, токсина, эффективного в отношении двукрылых) в штамм В. thuringiensis, синтезирующий другой видоспецифичный токсин (например, эффективный в отношении жесткокрылых); 2) соединением частей двух генов разных видоспецифичных токсинов с образованием последовательности, кодирующей уникальный токсин двойного действия (гибридный токсин).
Чтобы проверить возможность получения токсина с широким спектром действия, встроили гены токсинов В. thuringiensis subsp. aizawai и tenebrionis в челночные векторы, способные реплицироваться и в В. tfiuringiensis, и в Escherichia coli. Затем такие генетические конструкции ввели с помощью электропорации в В. thuringiensis subsp. aizawai, kurstaki, israelensis и tenebrionis. Токсичность полученных трансформированных штаммов проверяли на личинках трех отрядов насекомых.

Во всех случаях токсичность, обусловливаемая собственным хозяйским токсиновым геном (генами), сохранялась, а в большинстве случаев введенный ген обусловливал специфичность токсического действия, характерную для штамма, откуда он был выделен (табл. 15.2). Кроме того, один из экспериментов дал совсем уж удивительный результат: при введении гена токсина В. thuringiensis subsp. tenebrionis в В. thuringiensis subsp. israelensis получились трансформанты, в какой-то степени токсичные для Pieris brassicae (капустницы белой), на которую не действовал ни один из продуктов исходных генов.
Плазмидные векторы, несущие клонированные (crу-гены, часто оказываются нестабильными в В. thuringiensis: даже в отсутствие селективного давления все они или их часть утрачиваются. Интересно, что при этом в природе большинство cry-генов локализуются именно в плазмидах. Нестабильность плазмид еще раз убеждает в целесообразности интеграции клонированного cry-гена (генов) с хромосомной ДНК. Рассмотрим один успешный пример такой интеграции.
Таблица 15.2. Токсичность природных и рекомбинантных подвидов В. thuringiensis для насекомых Pieris brassicae (капустница), Aedes aegypti (комар) и Phaedon cochleariae (жук)1)
Токсичность для2)
|
Хозяйская ДНК |
Введенная ДНК |
Pieris |
Aedes |
Phaedon |
|
aizawai |
Нет |
++ |
+ |
- |
|
israelensis |
Нет |
- |
+ + |
- |
|
israelensis |
aizawai |
+ + |
- |
|
|
israelensis |
tenebrionis |
+ |
++ |
+ + |
|
kurstaki |
Нет |
++ |
+ |
- |
|
kurstaki |
tenebrionis |
++ |
+ |
+ + |
|
tenebrionis |
Нет |
- |
- |
+ + |
|
tenebrionis |
aizawai |
++ |
+ |
+ |
1) Из работы Crickmore et al., Blochem. J 270: 133—136, 1990.
2) Обозначения: ++ повреждены от 0 до 5% листьев (для Phaedon и Pieris) или наблюдается 100%-ная гибель насекомых в течение 1 ч (Aedes); + повреждены от 5 до 50% листьев (Phaedon и Pieris) или наблюдается гибель от 50 до 100% насекомых в течение 24 ч (Aedes); — повреждены более 50% листьев (Phaedon и Pieris) или ни одно насекомое не погибает в течение 24 ч (Aedes). Эксперименты проводили на листьях капусты (для Pieris) или репы (для Phaedon).
Штамм В. thuringiensis subsp. kurstaki обычно содержит пять разных генов токсинов: cryIA (а), crylA (b), cryIA (с), сrуIIА и сrуIIВ. Их продукты токсичны для различных чешуекрылых, но не эффективны против Spodoptera spp. В хромосомную ДНК штамма В. thuringiensis subsp. kurstaki встроили ген cryIC, обычно присутствующий только у В. thuringiensis subsp. aizawai и subsp. entomocidus. Трансформированный штамм В. thuringiensis subsp. kurstaki был в шесть раз более эффективен в отношении личинок Spodoptera exigua, чем штамм дикого типа.
Как мы уже говорили, другой способ получения токсина широкого спектра действия состоит в слиянии кодирующих участков генов двух разных токсинов. Эта возможность была проверена в лаборатории. Было создано несколько гибридных токсинов, действующих только на чешуекрылых; некоторые из этих токсинов были более эффективны, чем продукты каждого из исходных генов, а в одном случае гибридный белок обладал абсолютно новой биологической активностью.
За токсическое действие белка Cry ответственны три домена. Домен I, локализованный в N-концевой области белковой молекулы, обеспечивает специфическое связывание токсина с рецептором на поверхности эпителиальных клеток кишечника насекомого. Домен III, расположенный в С-концевой области молекулы, предположительно и отвечает за токсичность. Устойчивость к токсинам В. thuringiensis обычно обусловливается мутационным изменением (изменениями) рецепторного белка (белков) на поверхности клеток кишечника насекомого, приводящим к тому, что рецептор перестает узнавать Сrу-белок. Однако, если модифицировать ген токсина так, чтобы токсин мог связываться с другими поверхностными белками, то вероятность возникновения устойчивости уменьшится.
Белки СrуIС и СrуIE токсичны для чешуекрылых, но обладают разной видоспецифичностью: СrуІС действует на S. exigua, Mamestra brassicae и Manduca sexta, в то время как СrуІЕ — только на М. sexta. В одной из лабораторий был создан гибридный белок CryІC-CrІE, токсичность которого проверялась на разных насекомых. Была исследована также его способность связываться с различными рецепторами (рис. 15.5). Еибридный токсин G27, содержащий домен III белка СrуІС, был токсичен для личинок S. exigua, хотя связывался только с СrуIЕ-рецептором, но не с рецептором СrуІС. И наоборот, гибридный токсин F26 не оказывал действия на личинок S. exigua, хотя и связывался с СrуIС-рецептором. Поскольку токсичные для S. exigua белки СrуІС и G27 связываются с разными рецепторами на поверхности клеток кишечника насекомого, одновременная или поочередная обработка S. exigua двумя этими токсинами может уменьшить вероятность появления устойчивого к ним штамма, поскольку для этого необходимо, чтобы мутационные изменения произошли одновременно в двух разных белках.

Рис. 15.5. Токсичность белков СrуІС, СrуІЕ и гибридных токсинов G27 и F26 и специфичность их связывания с рецепторами. Специфичность связывания определяли в экспериментах по взаимодействию токсина с рецептором. К комплексу белкового рецептора на поверхности клеток кишечника S. exigua и изотопно меченного токсина добавляли немеченые СrуІС или СrуІЕ и определяли связывание меченого токсина. (Из работы Bosch et al., Bio/Technology 12:915-918, 1994.)
Инсектицид, продуцируемый В. thuringiemis subsp. israelensis, проявляет свои токсические свойства, когда он попадает в кишечник личинок комара. Если же этот токсин, находящийся в виде параспоральных кристаллов, распылить над водой, то кристаллы быстро утонут, и токсин будет исключен из пищевой цепи личинок комара. Чтобы решить эту проблему, можно ввести ген токсина в организм, который служит пищей для личинок комаров. Это могут быть, например, фотосинтезирующие цианобактерии Symechocystis и Synechococcus spp., которые размножаются в поверхностном слое воды, где достаточно солнечного света и где обычно обитают личинки.
Еще один организм, который можно использовать для экспрессии генов токсинов В. thuringiemis, — бактерия Caulobacter crescentus, широко распространенная в водной среде, где живут личинки комаров. Инсектицид, синтезированный трансформированными цианобактериями или С. crescentus, в лабораторных условиях был токсичен для личинок комара. Однако в полевых условиях трансформированные цианобактерии и С. crescentus быстро погибали, а уровень экспрессии клонированных генов был очень низок.
В качестве организма-хозяина для чужеродных cry-генов, кодирующих токсичные для комаров белки, можно использовать также грамот - рицательную аэробную бактерию Asticcacaulis excentricus, обитающую у поверхности водоемов. Были проведены эксперименты, в которых A. excentricus трансформировали плазмидным вектором с широким кругом хозяев, который нес гены белковых токсинов Bacillus sphaericus (бактерии, аналогичной В. thuringiemis). Гены находились под контролем промотора tacl, одного из вариантов tac-промотора. Полученный трансформант синтезировал белковые токсины мол. массой 51 и 42 кДа и был практически столь же токсичен для личинок комаров Anopheles и Culex, как природные высокотоксичные штаммы В. sphaericus. Однако в отличие от В. sphaericus в случае с А. excentricus не возникало проблем, связанных с распылением над водоемами. Кроме того, культивирование A. excentricus обходится гораздо дешевле, поскольку этот микроорганизм растет на более простой среде, чем В. sphaericus и В. thuringiemis. Для него характерна низкая протеиназная активность, так что токсин не подвергается немедленной деградации. A. excentricus хорошо адаптирована к таким условиям, как относительно высокая интенсивность УФ-света. Однако, прежде чем применять рекомбинантные бактерии A. excentricus для контроля популяций комаров в природных условиях, необходимо убедиться, что встроенные гены токсинов не содержат последовательностей, детерминирующих устойчивость к антибиотикам.
Инсектициды, продуцируемые В. thuringiemis, при их нанесении на листья и стебли не действуют на насекомых, повреждающих корни растений. Чтобы обойти эту трудность, можно ввести ген токсина В. thuringiemis в штамм одного из видов бактерий, которые обитают в слое почвы, непосредственно прилегающем к корням (в ризосфере). Такие рекомбинантные бактерии, внесенные в почву, будут секретировать инсектицидный токсин прямо в ризосферу и защищать корни от насекомых все то время, в течение которого они остаются в почве. Это устраняет необходимость многократной обработки растений биологическими или химическими инсектицидами.
Ген токсина В. thuringiemis subsp. kurstaki был встроен в хромосомную ДНК штамма Pseudomonas fluorescens, который образует колонии на корнях кукурузы, следующим образом (рис. 15.6).
1. Транспозон Тn5 встроили в плазмиду и генетически модифицировали его левую и правую фланкирующие последовательности и удалили ген транспозазы. Такой модифицированный транспозон не может вырезаться из плазмиды даже с помощью экзогенной транспозазы.
2. Ген токсина В. thuringiemis subsp. kurstaki встроили в середину модифицированного транспозона Тn5 так, чтобы он находился под контролем конститутивного промотора.
3. Транспозон Тn5 дикого типа встроили в хромосомную ДНК штамма Р. fluorescens, обитающего на корнях.
4. Плазмиду, несущую модифицированный транспозон Тn5 со встроенным геном токсина, ввели в бактерию, в хромосомную ДНК которой был встроен транспозон Тn5 дикого типа.
5. Осуществили гомологичную рекомбинацию с помощью двойного кроссинговера между не способным к транспозиции Тn5-элементом, несущим ген токсина, и «плазмидным» транспозоном Тn5 дикого типа, интегрированным в хромосому. В результате интеграции измененный транспозон Тn5 с геном токсина оказался встроенным в хромосомную ДНК, а транспозон Тn5 дикого типа был элиминирован.

Рис. 15.6. Получение рекомбинантного штамма Р. fluorescens, в хромосомную ДНК которого встроен ген токсина В. thuringiensis. Ген встраивают в не способный к вырезанию транспозон Тn5, локализованный в плазмиде. Такую конструкцию вводят в штамм Р. fluorescens, содержащий в своей хромосомной ДНК транспозон Тn5 дикого типа. В результате гомологичной рекомбинации не способный к вырезанию транспозон Тn5, несущий ген токсина В. thuringiensis, оказывается встроенным в хромосому Р. fluorescens.
В таком виде ген токсина вряд ли утратится при крупномасштабном выращивании рекомбинантных микроорганизмов в лабораторных условиях или после их переноса в окружающую среду. Кроме того, вероятность передачи такого гена другим микроорганизмам в окружающей среде очень мала. Как показали предварительные исследования, рекомбинантный штамм Р. fluorescens токсичен для личинок бражника. Теперь планируется проверить способность этого рекомбинантного микроорганизма минимизировать повреждения корней насекомыми-вредителями в оранжереях и в полевых условиях.
Гены токсинов В. thuringiensis вводили в хромосомную ДНК самых разных микроорганизмов. Так, гены сrуIA (с) были введены в ДНК Р. fluorescens, которые защищают растения сахарного тростника от Eldana saccharina. Трансформация этим геном бактерии Clavibacter xyli subsp. cynodontis, обычно обитающей в ксилеме бермудской травы, приводит к тому, что рекомбинантные бактерии приобретают способность защищать растения кукурузы от мотылька кукурузного (Ostrinia nubilalis).