Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Плазматическая мембрана
Липидный бислой
Первые сведения о том, что молекулы липидов в биологической мембране образуют бислой, были получены в ходе простых, но элегантных экспериментов, выполненных в 1925 году. Было показано, что липиды из мембран эритроцитов, экстрагированные ацетоном, всплывают на поверхность воды, образуя пленку. Площадь пленки уменьшали с помощью подвижного барьера до тех пор, пока не формировался сплошной мономолекулярный слой. При этом оказалось, что площадь монослоя примерно в два раза больше первоначальной площади поверхности клеток. Поскольку единственной мембраной эритроцитов является плазматическая мембрана, экспериментаторы заключили, что молекулы липидов в ней должны быть организованы в виде непрерывного бислоя. Это заключение имело глубокое влияние на всю клеточную биологию. В настоящее время наличие липидного бислоя в клеточных мембранах доказано и более тонкими методами. Например, с помощью рентгеноструктурного анализа было продемонстрировано существование липидных бислоев в высокоорганизованных складках клеточных мембран, которые формируют изолирующую миелиновую оболочку, окружающую нервные клетки (см. разд. 19.2.4). О том, что все биологические мембраны содержат липидные бислой, убедительно свидетельствуют и данные электронно-микроскопических исследований: при изучении образцов, приготовленных методом замораживания скалывания, оказалось, что все клеточные мембраны могут быть механически расщеплены как раз между двумя липидными монослоями (см. разд. 6.2.6). Самопроизвольное формирование бислоя является особым свойством молекул липидов, которое реализуется даже вне клетки.
6-4
6.1.1. Мембранные липиды - это амфипатические молекулы, самопроизвольно формирующие бислой [2]
Липиды нерастворимы в воде, но хорошо растворяются в органических растворителях. В большинстве животных клеток они составляют около 50% массы плазматической мембраны животных, а почти все остальное приходится на белки. На 1 мкм2 липидного бислоя расположено примерно 5 х 106 молекул липидов. Из этого следует, что в плазматической мембране небольшой животной клетки содержится около 109 молекул липидов. В клеточной мембране присутствуют липиды трех типов: фосфолипиды (наиболее распространенный тип), холестерол и гликолипиды. Все они представляют собой амфипатические молекулы, т. е. у них есть гидрофильный («любящий воду», или полярный) и гидрофобный («боящийся воды», или неполярный) концы. Типичная молекула фосфолипида изображена на рис. 6-2. Она имеет полярную голову и два гидрофобных углеводородных хвоста. Длина хвостов варьирует от 14 до 24 атомов углерода в цепи. Один из хвостов, как правило, содержит одну или более цис-двойных связей (т. е. это ненасыщенный углеводород), тогда как у другого (насыщенного углеводорода) двойных связей нет. Как показано на рис. 6-2, каждая двойная связь вызывает появление изгиба в хвосте. Различия в длинах хвостов и насыщенности углеводородных цепей имеют важное значение, поскольку именно они влияют на расположение фосфолипидных молекул друг против друга и, следовательно, обусловливают текучесть мембраны (см. ниже).
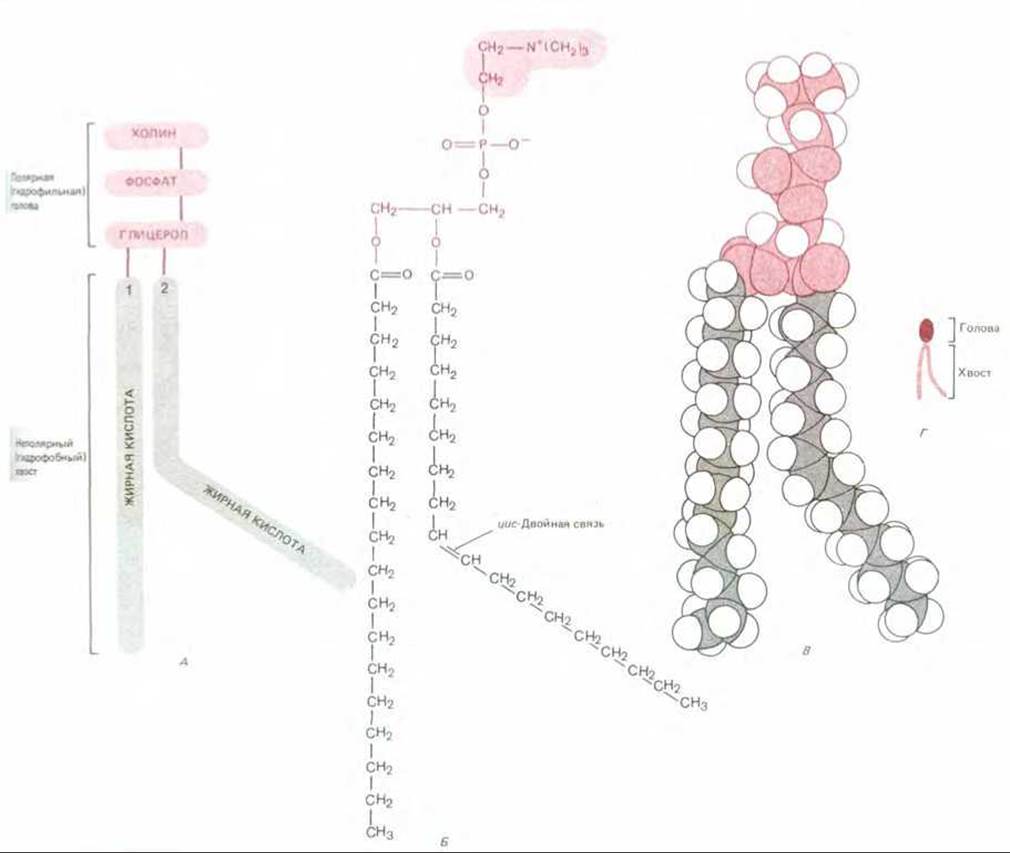
Рис. 6-2. Молекула фосфолипида фосфатидилхолина, представленная схематически (А), химической формулой (Б), в виде пространственной модели (В) и символом (Г). Чтобы отличить ненасыщенную цепь жирной кислоты от насыщенной, на этом рисунке (и далее везде) ненасыщенная цепь изображена с отчетливым изгибом. На самом же деле в ненасыщенной жирной кислоте жесткостью обладает только двойная связь. Вокруг всех одинарных связей возможно свободное вращение, поэтому в каждом липидном монослое обе цепи жирных кислот - как насыщенная, так и ненасыщенная - будут стремиться упаковаться параллельно.
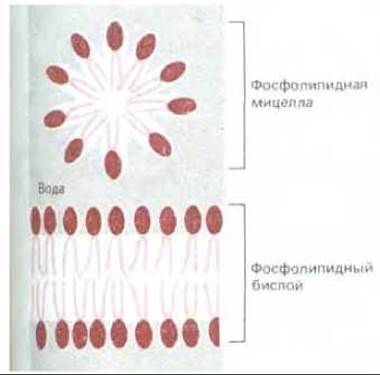
Рис. 6-3. Фосфолипидная мицелла и фосфолипидный бислой в поперечном разрезе. Фосфолипидные молекулы самопроизвольно образуют подобные структуры в воде.
Именно амфипатический характер молекул липидов заставляет их самопроизвольно формировать бислои в водных растворах. Когда амфипатические молекулы находятся в водном окружении, они стремятся агрегировать так, чтобы их гидрофобные хвосты были спрятаны от молекул воды, а гидрофильные головки оказались в контакте с молекулами воды. Агрегация такого типа осуществляется двумя способами: либо путем образования сферических мицелл, с хвостами, обращенными внутрь, либо путем формирования бимолекулярных пленок, или бислоев, в которых гидрофобные хвосты располагаются между двумя слоями гидрофильных голов. Обе эти возможности проиллюстрированы на рис. 6-3.
Большинство фосфолипидов и гликолипидов в водной среде самопроизвольно образуют бислои. Более того, эти липидные бислои имеют тенденцию к замыканию самих на себя, что приводит к формированию закрытых отсеков (компартментов). При этом устраняются свободные края, на которых гидрофобные хвосты могли бы соприкасаться с водой. По той же причине компартменты, построенные из липидных бислоев, стремятся сами залечить свои повреждения, смыкая края разорванных участков. Кроме способности к самосборке липидный бислой обладает и другими характеристиками, делающими его идеальным материалом для клеточных мембран. Важнейшее из этих свойств - текучесть, которая, как мы увидим в дальнейшем, обусловливает многие функции мембраны.
6-6
6-7
6.1.2. Липидный бислой - это двумерная жидкость [3]
О том, что отдельные молекулы липидов способны свободно диффундировать в пределах липидного бислоя, исследователи впервые узнали, как это ни странно, только в начале 1970-х годов. Первоначально это было показано на искусственных липидных бислоях. Для экспериментальных исследований оказались весьма полезными искусственные бислои двух типов: 1) липосомы, имеющие форму сферических пузырьков, диаметр которых варьирует от 25 нм до 1 мкм в зависимости от способа их получения (рис. 6-4), и 2) плоские бислои, называемые черными мембранами, «закрывающие» отверстие в перегородке между двумя отделениями сосуда, заполненными водой (рис. 6-5).
Для измерения подвижности отдельных липидных молекул и их частей используются разнообразные методы. Так, к полярной голове молекулы липида можно присоединить «спиновую метку», например нитроксильную группу (= N — О), имеющую неспаренный электрон. Спин этого электрона порождает парамагнитный сигнал, обнаруживаемый методом электронного парамагнитного резонанса (ЭПР) (принципы этого метода сходны с принципами ядерного магнитного резонанса. ЯМР). Этот метод позволяет легко определить движение и ориентацию в бислое подобного спин-меченного липида. Такие исследования показывают, что липидные молекулы в синтетических мембранах чрезвычайно редко перескакивают из одного монослоя мембраны в другой. Любая индивидуальная молекула липида осуществляет подобный перескок (флип-флоп) реже, чем один раз в две недели (рис. 6-6). С другой стороны, липидные молекулы без труда меняются местами со своими соседями в пределах одного монослоя (примерно 107 раз в 1 с), что приводит к быстрой латеральной диффузии, причем коэффициент диффузии D составляет около 10-8 см2 с-1. Это означает, что липидная молекула средних размеров диффундирует на расстояние, равное длине большой бактериальной клетки (~ 2 мкм), приблизительно за 1 с. Кроме того, подобные исследования показывают, что молекулы липидов очень быстро вращаются вокруг своих продольных осей, а их углеводородные цепи обладают гибкостью; при этом наибольшая подвижность наблюдается у центра бислоя, а наименьшая - около полярной головы (рис. 6-6).
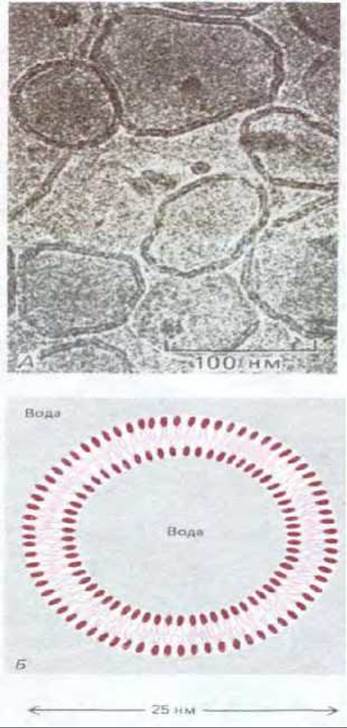
Рис. 6-4, А. Электронная микрофотография нефиксированных неокрашенных фосфолипидных пузырьков (липосом) в воле. Обратите внимание, что бислойная структура везикул легко различима. Б. Схематическое изображение небольшой сферической липосомы в поперечном разрезе. Липосомы обычно используются в экспериментальных исследованиях в качестве модельных мембран. (А - с любезного разрешения Jean Lepault.)

Рис. 6-5. Схематическое изображение искусственного липидного бислоя, называемого черной мембраной, в поперечном разрезе. Мембрана закрывает небольшое отверстие в перегородке между двумя отделениями сосуда, заполненными водой. Черные мембраны используются для измерения проницаемости искусственных мембран.
Изучение меченых липидных молекул в изолированных биологических мембранах и относительно простых целых клетках, таких как микоплазма, бактерии и эритроциты, показало, что поведение липидных молекул в клеточных мембранах в основном сходно с поведением этих молекул в искусственных бислоях. Липидный компонент биологической мембраны представляет собой двумерную жидкость, в которой отдельные молекулы липидов могут свободно передвигаться в плоскости мембраны. Как и в синтетических бислоях, индивидуальные молекулы липидов обычно не выходят за пределы своего монослоя. Однако существуют исключения: в таких мембранах, в которых липиды активно синтезируются (например, в мембранах эндоплазматического ретикулума) должен идти быстрый флип-флоп специфических липидов. Для ускорения этого процесса имеются даже специальные мембраносвязанные ферменты - транслокаторы фосфолипидов (см. разд. 8.6.14).
6.1.3. Текучесть липидного бислоя зависит от его состава [4]
Синтетический липидный бислой, состоящий из фосфолипидов одного типа, при понижении температуры до строго определенного значения (точки замерзания) переходит из жидкого состояния в кристаллическое (или гелеобразное). Это изменение состояния называется фазовым переходом. Температура перехода оказывается ниже (т. е. мембрану трудно заморозить), если углеводородные цепи короткие или в них содержатся двойные связи. При меньшей длине цепи взаимодействие углеводородных хвостов становится менее вероятным, а изломы, вызванные наличием цис-двойных связей, мешают более компактной упаковке хвостов (рис. 6-7).
В синтетическом бислое, содержащем смесь фосфолипидов с различной степенью насыщенности (и, следовательно, с различными температурами фазового перехода), может происходить разделение фаз: при снижении температуры до точек замерзания фосфолипидные молекулы определенного типа спонтанно агрегируют внутри бислоя, образуя «замороженные» частицы. Поскольку в биологических мембранах в одной и той же липидной молекуле обычно содержится как насыщенная, так и ненасыщенная цепь жирной кислоты, в клетке такое разделение фаз невозможно.
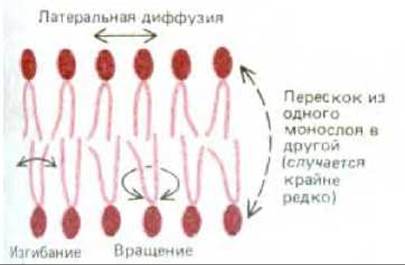
Рис. 6-6. Типы движений фосфолипидных молекул в липидном бислое.
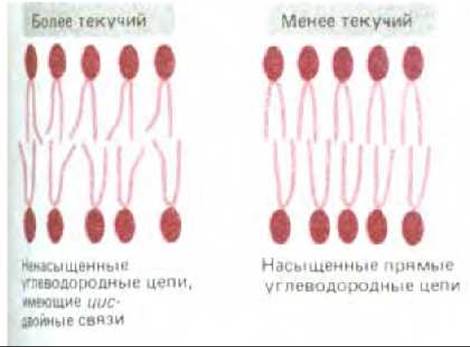
Рис. 6-7. Двойные связи в ненасыщенных углеводородных цепях увеличивают текучесть липидного бислоя, затрудняя совместную упаковку гидрофобных хвостов.
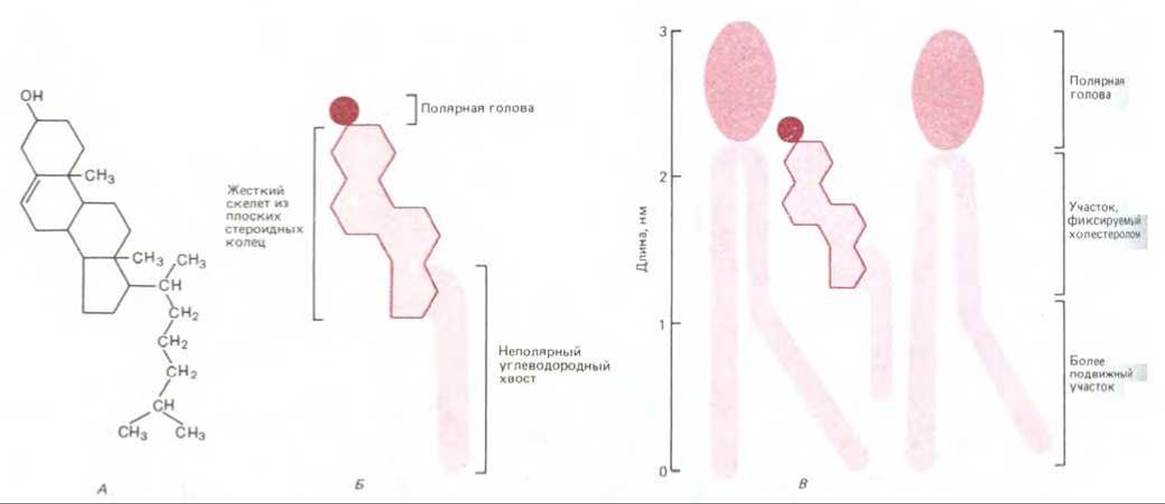
Рис. 6-8. Молекула холестерола, представленная в виде химической формулы (А), схематического изображения (Б) и в процессе взаимодействия с двумя фосфолипидными молекулами в монослое (В).
Другим фактором, влияющим на текучесть мембраны, служит холестерол. Плазматические мембраны эукариот содержат довольно большое количество холестерола - приблизительно одну молекулу на каждую молекулу фосфолипида. Молекулы холестерола ориентируются в бислое таким образом, чтобы их гидроксильные группы примыкали к полярным головам фосфолипидных) молекул. При этом их жесткие, плоские стероидные кольца частично иммобилизуют участки углеводородных цепей, непосредственно примыкающих к полярным головам. Остальные части углеводородных цепей не утрачивают своей гибкости (рис. 6-8). Хотя холестерол делает липидный бислой менее текучим, при его высоких концентрациях (что характерно для большинства плазматических мембран эукариотических клеток), он предотвращает слипание и кристаллизацию углеводородных цепей. Таким образом, холестерол также ингибирует возможные фазовые переходы.
Холестерол уменьшает не только текучесть липидного бислоя, такое же действие он оказывает на его проницаемость для малых водорастворимых молекул. Кроме того, холестерол увеличивает упругость и механическую прочность бислоя. Именно благодаря холестеролу мембрана может менять свою форму в ответ на приложенную к ней силу. Дело в том, что в отличие от фосфолипидов, холестерол может быстро перераспределяться между монослоями. Объясняется это тем, что маленькая полярная голова холестерола (гидроксильная группа) относительно легко проходит через центр бислоя, энергетический барьер для флип-флоп молекул холестерола оказывается низким, и, следовательно, его перераспределение осуществляется быстро.
О важности холестерола для поддержания механической прочности мембран говорят данные по изучению мутантных линий животных клеток, не способных его синтезировать. При отсутствии холестерола в культуральной жидкости такие клетки быстро лизируются (разрываются с высвобождением их содержимого). Добавленный в среду холестерол встраивается в плазматическую мембрану, тем самым стабилизируя липидный бислой; в результате клетки выживают.
Определенная текучесть плазматической мембраны имеет важное биологическое значение. Об этом свидетельствует тот факт, что бактерии, дрожжи и другие пойкилотермные организмы, принимающие температуру окружающей среды, изменяют жирнокислотный состав своих плазматических мембран таким образом, чтобы текучесть мембраны оставалась примерно постоянной. Например, при падении температуры начинают синтезироваться жирные кислоты с большим числом цис-двойных связей, для того чтобы предотвратить уменьшение текучести бислоя, которое может при этом произойти. Было показано, что некоторые процессы мембранного транспорта приостанавливаются и определенные ферментативные активности исчезают как только вязкость бислоя превышает некое пороговое значение. Остается установить, какие именно процессы, связанные с мембранами, наиболее сильно зависят от текучести бислоя.
6.1.4. Липидный бислой служит растворителем для мембранных белков [5]
Липидные составы различных биологических мембран сравниваются в табл. 6-1. Плазматические мембраны бактерий обычно имеют фосфолипид только одного типа и не содержат холестерол; в отсутствие холестерола механическая прочность обеспечивается окружающей клеточной стенкой (см. рис. 5-54). В то же время в большинстве плазматических мембран эукариотических клеток имеется не только значительное количество холестерола, но и множество различных фосфолипидов. Например, в плазматической мембране многих животных клеток обнаруживаются четыре основных фосфолипида: фосфатидилхолин, сфингомиелин, фомфатидилсерин и фосфатидилэтаноламин. Структуры этих молекул приведены на рис. 6-9; отметим, что из них только фосфатидилсерин имеет отрицательный заряд, а остальные три при физиологических рН оказываются электрически нейтральными. Эти четыре фосфолипида вместе составляют более половины всей массы липидов для большинства мембран (табл. 1-6). Другие фосфолипиды, такие, как инозитолфосфолипиды (см. разд. 12,3.9), тоже важны в функциональном отношении, но представлены в относительно малых количествах. Исключительная роль инозитолфосфолипидов в передаче клеточных сигналов обсуждается в гл. 12.
Таблица 6-1. Примерный липидный состав различных клеточных мембран
|
Липиды |
Процент от общего содержания липидов (по весу) |
|||||
|
Плазматическая мембрана клеток печени |
Плазматическая мембрана эритроцитов |
Миелин |
Внешняя и внутренняя мембрана митохондрий |
ЭР |
Е. coli |
|
|
Холестерол |
17 |
23 |
22 |
3 |
6 |
0 |
|
Фосфатидилэтаноламин |
7 |
18 |
15 |
35 |
17 |
70 |
|
Фосфатидилсерин |
4 |
7 |
9 |
2 |
5 |
следы |
|
Фосфатидилхолин |
24 |
17 |
10 |
39 |
40 |
0 |
|
Сфингомиелин |
19 |
18 |
8 |
0 |
5 |
0 |
|
Гликолипиды |
7 |
3 |
28 |
следы |
следы |
0 |
|
Другие |
22 |
13 |
8 |
21 |
27 |
30 |
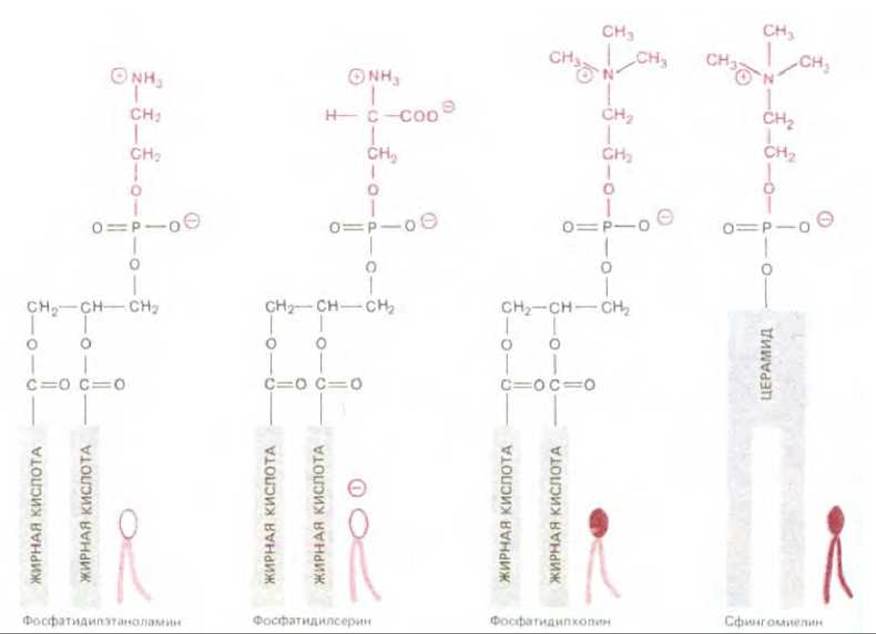
Рис. 6-9. Формулы и символы четырех главных фосфолипидов, содержащихся в плазматических мембранах. Обратите внимание, что различные полярные головы обозначены разными символами (на этом и следующем рисунке). Все представленные липидные молекулы построены на основе глицерола, за исключением сфингомиелина, происходящего от серина. Структура и формула церамида представлены на рис. 6-11.
Возникает вопрос; с чем связано такое разнообразие фосфолипидов в плазматических мембранах эукариот? Возможно, липидный бислой является двумерным растворителем для белков в составе мембраны, подобно тому как вода служит трехмерным растворителем в водном растворе. Можно предположить также, что некоторые мембранные белки функционируют только в присутствии специфических фосфолипидных полярных групп, напоминая в этом отношении многие ферменты, для активирования которых в водном растворе необходим какой-либо определенный ион. Это предположение подтверждается данными о том, что в искусственных липидных бислоях для оптимальной активности функционирующих мембранных белков требуются определенные специфические фосфолипиды.
6-5
6-6
6.1.5. Липидный бислой асимметричен [6]
Во всех изученных плазматических мембранах две половины бислоя поразительно различаются по липидному составу. Например, в мембране эритроцитов человека большинство липидных молекул, оканчивающихся холином (СН3)3 N+ СН2 СН2 ОН - т. е. фосфатидилхолин и сфингомиелин, располагаются во внешней половине бислоя, а основная часть фосфолипидов, несущих на конце аминогруппу (фосфатидилэтаноламин и фосфатидилсерин), - во внутренней (рис. 6-10). Хвосты жирных кислот, входящих в состав фосфатидилхолина и сфингомиелина более насыщенны, чем те, которые находятся в составе фосфатидилэтаноламина и фосфатидилсерина. В связи с этим асимметрия в распределении полярных голов сопровождается асимметрией распределения углеводородных хвостов. Это может привести к тому, что текучесть внутреннего монослоя будет несколько больше, чем внешнего. Известно также, что отрицательно заряженный фосфатидилсерин локализован во внутренней половине бислоя; следовательно, две стороны бислоя существенно различаются и по заряду.
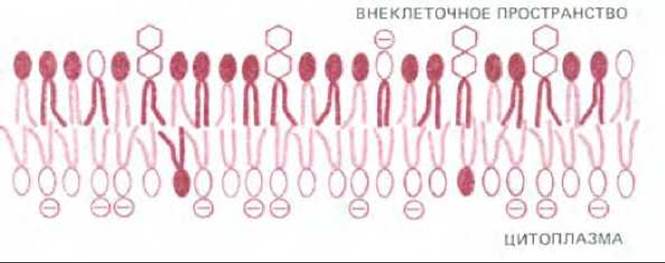
Рис. 6-10. Асимметрическое распределение фосфолипидов и гликолипидов в липидном бислое эритроцитов человека. Символы, используемые для обозначения фосфолипидов, те же, что и на рис. 6-9. Полярные головы гликолипидов изображены в виде шестиугольников. Холестерол (не показан), по-видимому, распределяется между монослоями примерно одинаково.
Большинство мембран эукариотических клеток, включая плазматическую мембрану, синтезируется в эндоплазматическом ретикулуме (ЭР). Это значит, что асимметрия в распределении фосфолипидов является следствием работы транслокаторов фосфолипидов в ЭР, которые переносят специфические молекулы фосфолипидов из одного монослоя в другой (см. разд. 8.6.14). Несмотря на то что функциональный смысл асимметричного распределения липидов во многом непонятен, показано, что существуют мембраносвязанные ферменты, использующие этот феномен. Например, при активации протеинкиназы С она связывается с цитоплазматической стороной плазматической мембраны, где концентрируется фосфатидилсерин - отрицательно заряженный фосфолипид, необходимый для работы фермента (см. разд. 12.3.10). Важность существования специфических инозитолфосфолипидов, сконцентрированных на цитоплазматической стороне бислоя, где они могут использоваться для генерации внутриклеточных медиаторов в ответ на внеклеточные сигналы, обсуждается в гл. 12.
6.1.6. Гликолипиды обнаруживаются на поверхности всех плазматических мембран, однако их функция неизвестна [7]
В плазматических мембранах животных клеток наиболее асимметрично распределены липидные молекулы, принадлежащие к классу олигосахаридсодержащих липидов, называемых гликолипидами. Эти удивительные молекулы обнаруживаются только в наружной половине бислоя, а их сахарные группы ориентированы к поверхности клетки (рис. 6-10), что свидетельствует об участии данных молекул во взаимодействии клетки с ее окружением. Асимметричное распределение гликолипидов в бислое создается при присоединении сахарных остатков к молекулам липидов, происходящем в цистернах аппарата Гольджи.
Гликолипиды, вероятно, присутствуют в плазматических мембранах всех животных клеток и составляют обычно около 5% липидных молекул наружного монослоя. Они сильно различаются у разных видов и даже в разных тканях одного и того же вида. У бактерий и растений почти все Гликолипиды - это производные липидов на основе глицерола, например, широко распространенного фосфатидилхолина. В животных клетках Гликолипиды построены на основе церамида, каковым является, например, фосфолипид сфингомиелин (см. рис. 6-9). Структура гликосфинголипидов в целом аналогична структуре фосфолипидов, образованных из глицерола. Они также имеют полярную голову и две гидрофобные цепи жирных кислот. Однако одна из цепей жирных кислот первоначально соединяется с серином, образуя аминоспирт сфингозин, с которым затем связывается вторая цепь жирной кислоты, образуя церамид (рис. 6-11).
Все гликолипидные молекулы различаются по числу сахарных остатков в их полярных головах. Среди множества гликолипидов плазматических мембран эукариотических и прокариотических клеток можно выделить группу нейтральных гликолипидов. Их полярные головы содержат от 1 до 15 и более нейтральных (незаряженных) Сахаров, в зависимости от организма и типа клеток. Пример - галактоцереброзид, один из простейших гликолипидов, полярная голова которого состоит только из одной галактозы. Галактоцереброзид - это главный гликолипид миелина, многослойной мембранной оболочки, окружающей аксоны. Миелин представляет собой плазматическую мембрану специализированной миелинообразующей клетки, уложенную в виде множества концентрических слоев вокруг нервного волокна. Отличительная особенность этих клеток заключается в высоком содержании галактоцереброзида в их плазматической мембране (до 40% массы наружного монослоя). В мембранах других клеток галактоцереброзида мало. Это. возможно, означает, что он играет важную роль в специфическом взаимодействии миелинообразующей клетки и аксона.

Рис. 6-11. Заключительные этапы биосинтеза простого гликосфинголипида - галактоцереброзида. Сфингозин образуется при конденсации аминокислоты серина с одной молекулой жирной кислоты. Затем присоединяется вторая молекула жирной кислоты. При этом образуется церамид. Синтез церамида идет в ЭР, а углевод присоединяется в аппарате Гольджи. Церамид используется и при синтезе основного фосфолипида - сфингомиелина (см. рис. 6-9).

Рис. 6-12. Структура сиаловой кислоты (N-ацетилнейраминовой кислоты, или NANА). В клетках она существует, как изображено на рисунке, в ионизованной форме (—СОС-).
Самые сложные из гликолипидов - ганглиозиды - содержат один или более остатков сиаловой кислоты (N-ацетилнейраминовой кислоты, или NANA), которые придают молекулам ганглиозидов отрицательный заряд (рис. 6-12). Особенно много ганглиозидов содержится в плазматической мембране нервных клеток, где они составляют 5-10% от общей массы липидов, однако в большинстве типов клеток они встречаются в гораздо меньших количествах. В настоящее время идентифицировано более 40 различных ганглиозидов. Некоторые из них представлены на рис. 6-13, где приводится и номенклатура, используемая для описания этих соединений.

Рис. 6-13. Некоторые типичные ганглиозиды и их структурные обозначения. В GМ1, GМ2, GМ3, GD1, GТ1, буквы M, D и Т обозначают число остатков сиаловой кислоты - один, два и три соответственно, а цифры 1, 2 и 3 представляют собой разность, полученную вычитанием числа незаряженных углеводных остатков из 5. NANA-N-ацетилнейраминовая (сиаловая) кислота, Gal-галактоза, Glc-глюкоза, GalNAc-N-ацетилгалактозамин. GaJ, Glc и GalNAc не заряжены, a NANA несет отрицательный заряд (см. рис. 6-12).
О функциях гликолипидов известно мало. Установлено, например, что ганглиозид GМ1 (рис. 6-13) действует как поверхностный рецептор для бактериального токсина, вызывающего изнурительный понос при холере. Холерный токсин, связывается с поверхностью и попадает внутрь только тех клеток, у которых в плазматической мембране присутствует GМ1 (к ним относятся, например, эпителиальные клетки кишечника). Проникновение холерного токсина внутрь клетки приводит к долговременному увеличению концентрации внутриклеточного сАМР, которое обусловливает сильный приток Na+ и воды внутрь кишечника. Конечно, связывание бактериальных токсинов не может быть нормальной функцией ганглиозидов. Можно предположить, что они выступают в роли рецепторов для определенных медиаторов, осуществляющих нормальную связь между клетками.
Заключение
Биологические мембраны состоят из непрерывного двойного слоя липидных молекул с погруженными в него различными белками. Липидный бислой представляет собой жидкость, в которой отдельные молекулы липидов способны быстро диффундировать в пределах своего монослоя, но чрезвычайно редко спонтанно перемещаются из одного монослоя в другой. Мембранные липиды - амфипатические молекулы и в водной среде самопроизвольно образуют бислой. Эти бислой самоорганизуются в закрытые компартменты, которые способны самопроизвольно восстанавливаться при повреждениях. В плазматической мембране имеются три основных класса липидных молекул - фосфолипиды, холестерол и гликолипиды, причем составы внутреннего и наружного монослоев отличаются друг от друга. Разный липидный состав характерен как для плазматических мембран различных типов клеток, так и для разных мембран одной и той же эукариотической клетки. Функциональное значение различных компонентов разных мембран в большинстве случаев остается неизвестным.