Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Введение в биологию клетки
Малые молекулы, энергия и биосинтез
Химические компоненты клетки
«Хочу сообщить, что я научился получать мочевину, не используя для этого изолированную почку или животное, будь то человек или собака». Эти слова, написанные 150 лет назад молодым немецким химиком Вёлером (Wohler), ознаменовали собой конец веры в особую жизненную силу (vital force), присущую живым организмам и обусловливающую характер их отличительных особенностей. Однако то, что было откровением во времена Вёлера, сегодня звучит вполне обыденно - живые существа состоят из химических соединений. В современном представлении о жизни нет места ни для витализма, ни для чего бы то ни было, выходящего за рамки законов химии и физики. Из этого отнюдь не следует, что в биологии не осталось тайн: как покажут следующие главы, в ней еще много «белых пятен». Тем не менее следует сразу же подчеркнуть, что объем накопленных знаний поистине колоссален.
Сейчас мы располагаем подробными сведениями о важнейших молекулах клетки, причем не о каком-то небольшом их числе, а почти обо всех. Во многих случаях нам точно известна их химическая структура, так же как и пути их образования и распада. В общих чертах мы представляем себе, как химическая энергия поддерживает процессы биосинтеза в клетке, как на основе законов термодинамики создается молекулярная упорядоченность и как регулируются и координируются мириады непрерывно протекающих внутри клетки химических превращений.
В этой и следующей главах мы познакомимся вкратце с химическими свойствами живой клетки. Здесь будут рассматриваться процессы, протекающие с участием малых молекул: механизмы, с помощью которых клетка синтезирует свои главные химические компоненты и получает необходимую энергию. В гл. 3 речь пойдет о гигантских молекулах (полимерах), чьи свойства определяют специфичность биологических процессов и передачу биологической информации.
2.1.1. Основа клеточной химии - соединения углерода [1]
Живая клетка состоит из ограниченного набора элементов, причем на долю шести из них (С, Н, N, О, Р, S) приходится более 99% ее общей массы. Такой состав, заметно отличающийся от состава земной коры, свидетельствует о химизме особого типа (рис. 2-1). В чем же своеобразие химии живого и как оно возникло в процессе эволюции?
Соединение, которое живая клетка содержит в наибольшем количестве, - это вода. Она составляет около 70% массы клетки, и большинство внутриклеточных реакций протекает в водной среде. Жизнь на нашей планете возникла в океане, и условия этой первобытной среды наложили неизгладимый отпечаток на химию живых существ. «Конструкция» всех живых организмов связана с уникальными свойствами воды, такими, как полярный характер ее молекул, способность к образованию полярных связей и большое поверхностное натяжение (схема 2-1).
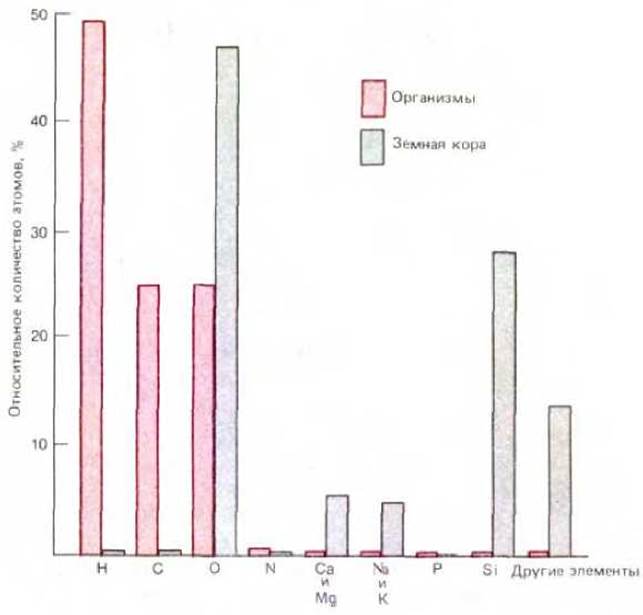
Рис. 2-1. Относительное количество химических элементов, обнаруженных в земной коре (неживой мир), по сравнению с количеством тех же элементов в мягких тканях живых организмов. Относительное количество выражено в процентах к общему числу имеющихся атомов. Так, например, на долю водорода приходится около 50% от числа всех атомов, присутствующих в живых организмах.
Если не считать воды, можно сказать, что почти все молекулы клетки, за небольшим исключением, относятся к соединениям углерода, которые рассматриваются в курсе органической химии. Среди всех элементов Земли углерод занимает особое место по способности к образованию больших молекул; до некоторой степени аналогичной способностью обладает кремний, однако он сильно уступает углероду в этом отношении. Благодаря малому размеру и наличию на внешней оболочке четырех электронов атом углерода может образовать четыре прочные ковалентные связи с другими атомами. Наиболее важное значение имеет способность атомов углерода соединяться друг с другом. образуя цепи и кольца и создавая в результате большие и сложные молекулы, на размеры которых не накладывается никаких видимых ограничений. Другие атомы, широко представленные в клетке (Н, N и О), имеют, как и углерод, небольшие размеры и способны образовать очень прочные ковалентные связи (схема 2-2).
В принципе простые правила образования ковалентной связи между углеродом и другими элементами допускают существование астрономически большого числа соединений. Количество различных углеродных соединений в клетке действительно очень велико, но это лишь крошечная часть теоретически возможного. В некоторых случаях мы можем довольно убедительно обосновать, почему то или иное соединение выполняет именно данную биологическую функцию; однако чаще возникает ощущение, что выбор пал на один из многих приемлемых вариантов и свою роль здесь сыграл случай (рис. 2-2). Определенные типы реакций и химические мотивы, однажды установившись, сохранили (с некоторыми вариациями) свой характер в ходе эволюции. Появление новых классов соединений было, очевидно, необходимым или целесообразным лишь в редких случаях.
2.1.2. Клетки используют четыре основных типа молекул [2]
Определенные простые комбинации атомов, такие, как метальные (—СН3), гидроксильные (—ОН), карбоксильные (—СООН) группы и аминогруппы (—NH2), неоднократно повторяются в биологических молекулах. Каждая такая группа обладает определенными химическими и физическими свойствами, которые оказывают влияние на поведение любых молекул, содержащих такие группы. Общие сведения об основных типах химических групп и их отдельных характерных свойствах приведены на схеме 2-2.
Так называемые малые органические молекулы клетки представляют собой соединения углерода с мол. массой от 100 до 1000, содержащие до 30 атомов углерода. Молекулы такого рода обычно находятся в свободном состоянии в цитоплазматическом растворе, образуя пул промежуточных продуктов, дающих начало крупным молекулам, называемым макромолекулами. Они служат также важнейшими промежуточными продуктами в химических реакциях, преобразующих извлеченную из пищи энергию в пригодную для использования форму (см. ниже).
На долю малых молекул приходится около одной десятой всего клеточного органического вещества, причем в клетке присутствует (по приближенным оценкам) около тысячи различных видов таких молекул. Расщепляясь, все биологические молекулы распадаются до тех простых соединений, из которых они и синтезируются, причем синтез и распад происходят в результате ограниченного количества химических превращений, которые подчиняются определенным правилам. Следовательно, все имеющиеся в клетке соединения можно разбить на небольшое число отдельных семейств. Крупные макромолекулы (они рассматриваются в гл. 3) строятся из малых молекул и относятся, таким образом, к тем же семействам.
Вообще говоря, содержащиеся в клетках малые органические молекулы образуют четыре семейства: простые сахара, жирные кислоты, аминокислоты и нуклеотиды. В состав каждого из этих семейств входит много различных соединений, имеющих общие химические свойства. Хотя некоторые соединения клетки не попадают в эти категории, на упомянутые четыре семейства, включающие как малые молекулы, так и построенные из них макромолекулы, приходится удивительно большая часть клеточной массы (табл. 2-1).
2.1.3. Сахара как пища для клеток [3]
Сахара простейшего типа - моносахариды - представляют собой соединения с общей формулой (СН2О)n, где n - любое целое число от трех до семи. Глюкоза, например, имеет формулу С6Н12О6 (рис. 2-3). Как показано на рис. 2-3, сахара могут существовать либо в форме кольца, либо в виде открытой цепи. Сахара, имеющие структуру открытой цепи, содержат гидроксильные группы и, кроме того, либо альдегидную группу, либо кетогруппу. Альдегидная группа и кетогруппа играют особую роль. Во-первых, они могут вступить в реакцию с гидроксильной группой той же молекулы, что приводит к переходу последней в форму кольца. Углеродный атом исходной альдегидной или кетогруппы можно узнать по тому признаку, что это единственный в молекуле атом углерода, связанный с двумя атомами кислорода. Во-вторых, после образования кольца к этому углеродному атому может присоединиться один из атомов углерода гидроксильной группы молекулы другого сахара, в результате чего образуется дисахарид (схема 2-3). Присоединение аналогичным путем большего числа моносахаридов приводит к образованию олигосахаридов все возрастающей длины (трисахаридов, тетрасахаридов и т. д.) вплоть до очень больших молекул полисахаридов, содержащих тысячи моносахаридных остатков. Поскольку у каждого моносахарида имеется несколько свободных гидроксильных групп, способных образовать связь с другим моносахаридом или каким-либо иным соединением, число возможных структур полисахаридов исключительно велико. Даже простой дисахарид, состоящий из двух остатков глюкозы, может существовать в 11 разновидностях (рис. 2-4), а три различные гексозы (С6Н12О6), соединяясь между собой, способны образовать несколько тысяч различных трисахаридов. Поэтому определение структуры любого конкретного полисахарида - дело исключительно сложное; определение имеющимися методами расположения полудюжины связанных Сахаров (например, в гликопротеине) занимает больше времени, чем выяснение нуклеотидной последовательности молекулы ДНК, состоящей из многих тысяч нуклеотидов.
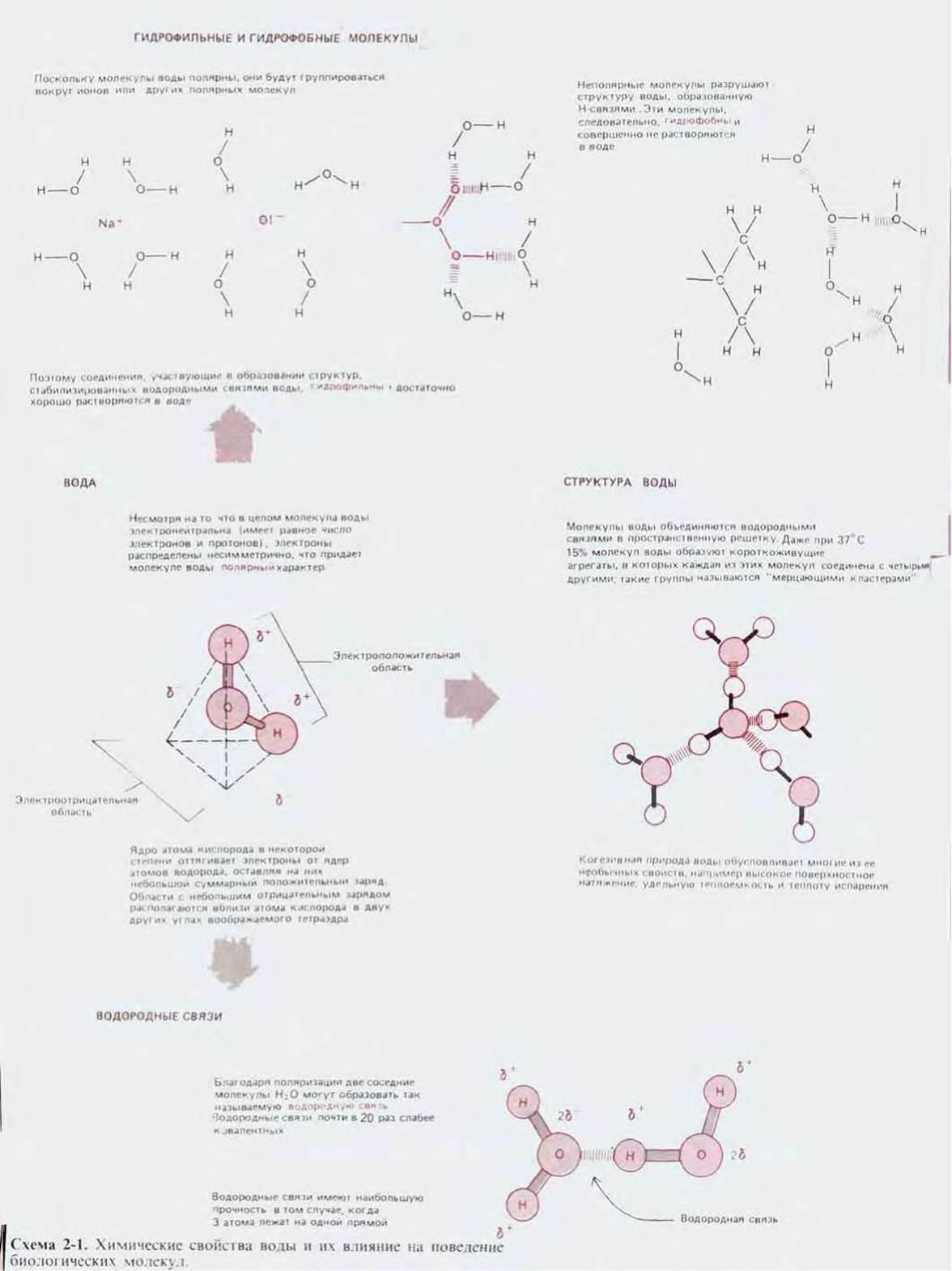
Схема 2-1. Химические свойства воды и их влияние на поведение биологических молекул.
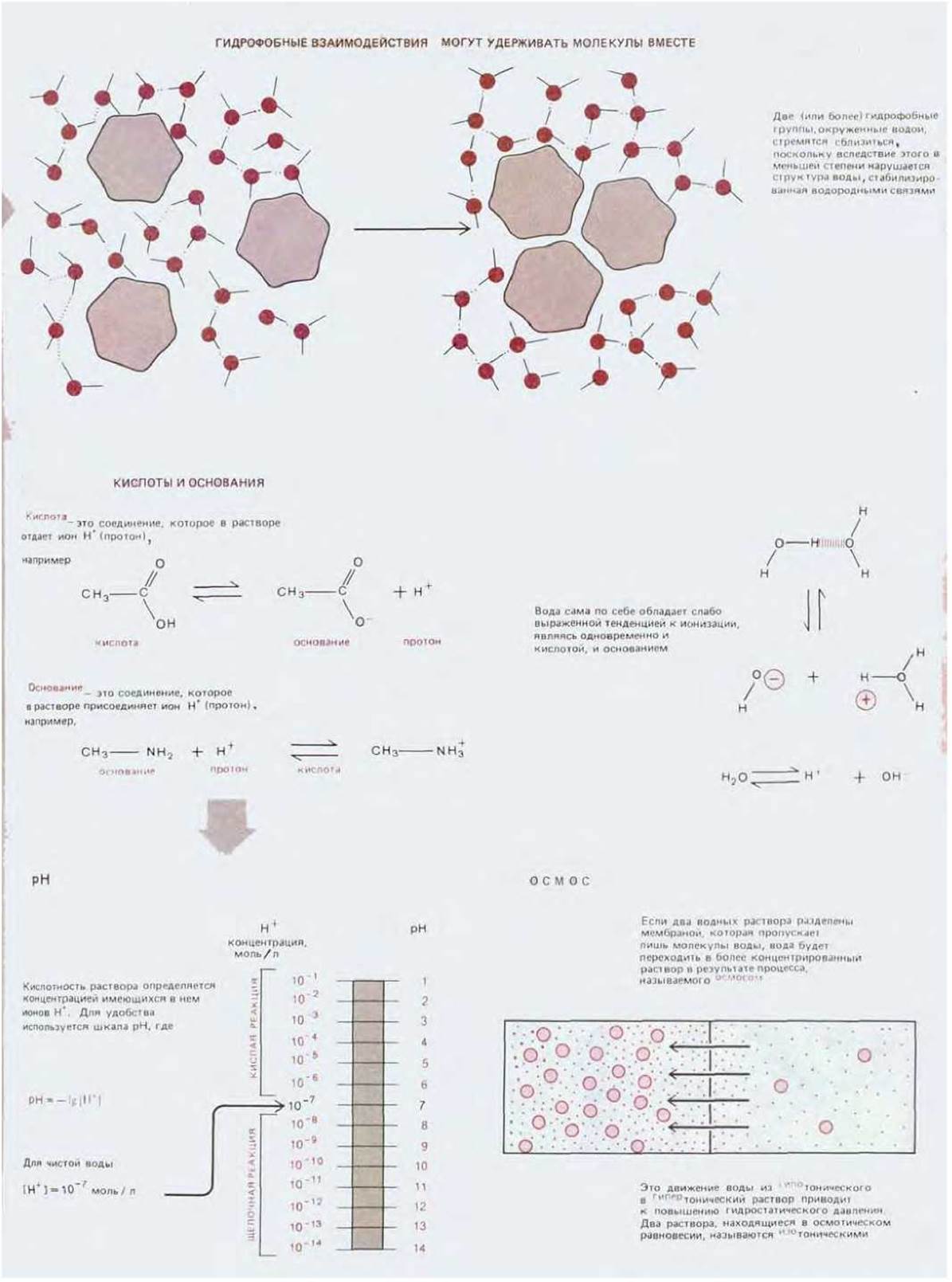
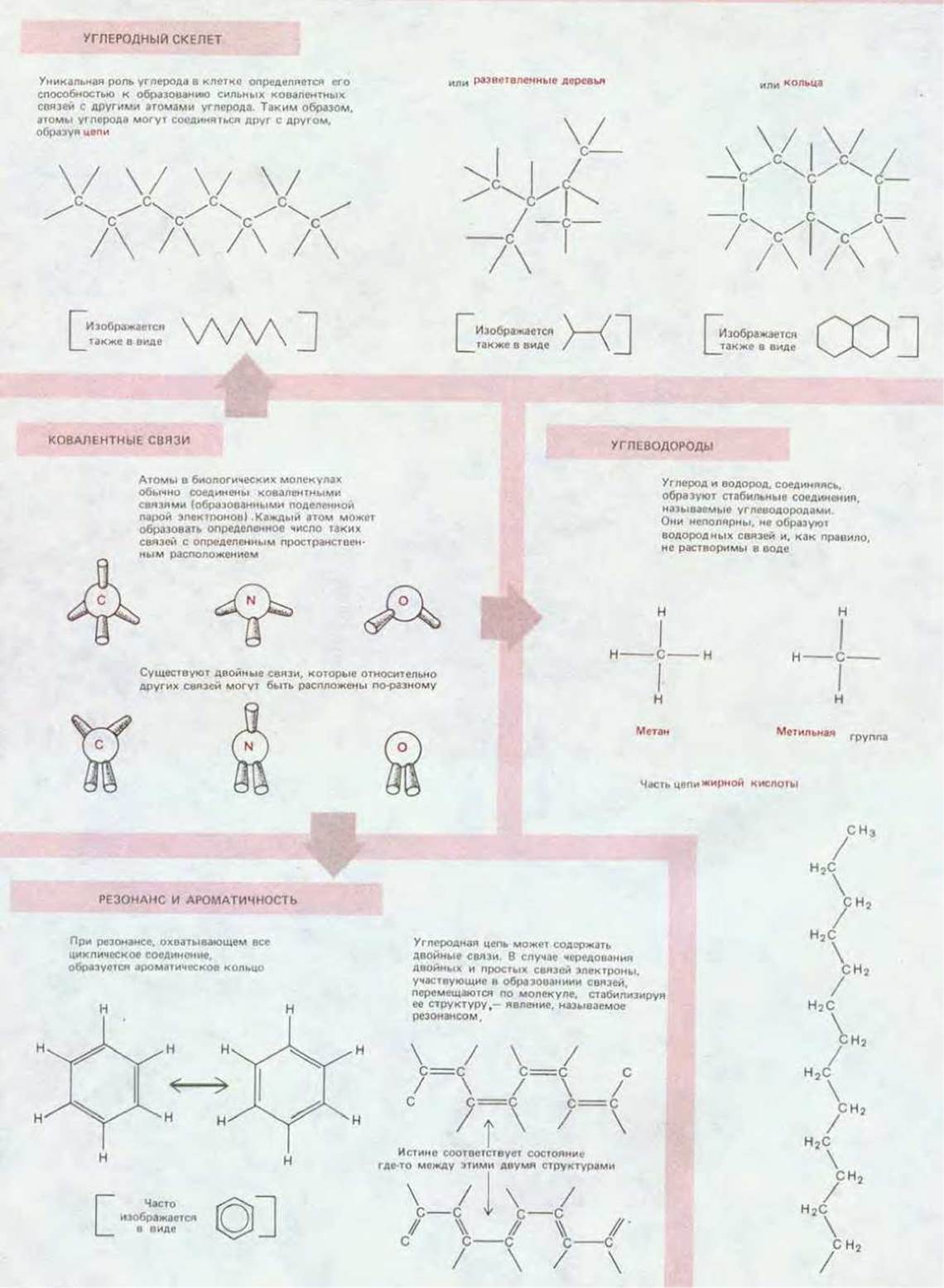
Схема 2-2. Ковалентные связи и группы, встречающиеся в биологических молекулах.
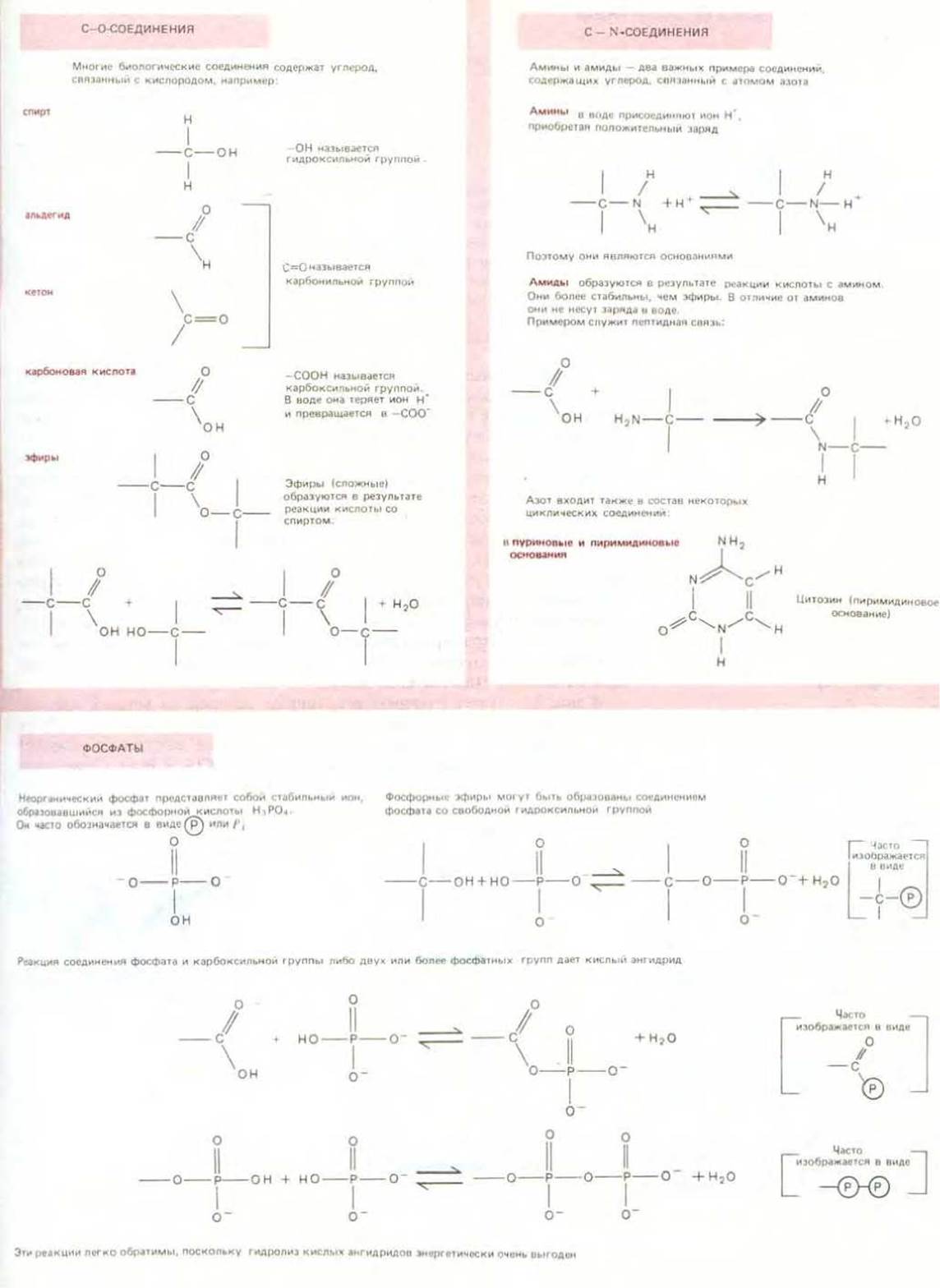

Рис. 2-2. Живые организмы синтезируют лишь небольшую часть органических молекул из всех тех, которые они в принципе могли бы образовать. Из шести изображенных на рисунке аминокислот в клетках синтезируется только самая верхняя - триптофан.
Таблица 2-1. Примерный химический состав бактериальной клетки
|
Доля от общей массы клетки, % |
Число типов молекул |
|
|
Вода |
70 |
1 |
|
Неорганические ионы |
1 |
20 |
|
Сахара и их предшественники |
1 |
250 |
|
Аминокислоты и их предшественники |
0,4 |
100 |
|
Нуклеотиды и их предшественники |
0,4 |
100 |
|
Жирные кислоты и их предшественники |
1 |
50 |
|
Другие малые молекулы |
0,2 |
~300 |
|
Макромолекулы (белки, нуклеиновые кислоты и полисахариды) |
26 |
~3000 |
Глюкоза служит главным источником энергии во многих клетках. В результате последовательного ряда реакций окисления (разд. 2.3.2) эта гексоза превращается в различные производные Сахаров с меньшей длиной цепи и в конечном итоге распадается до СО2 и Н2О. Суммарное уравнение реакции можно записать Следующим образом: С6Н12О6 + СО2 + 6СО2 + 6Н2О + Энергия.
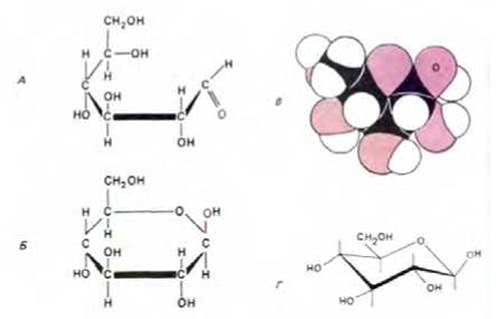
Рис. 2-3. Строение моносахарида глюкозы, простого сахара - гексозы. А. Форма открытой цепи находится в равновесии (в растворе) с более стабильной циклической структурой, представленной ниже (Б). В. Пространственная модель циклической структуры (p-D-глюкоза). Еще один из возможных вариантов изображения циклической структуры-конфигурация кресла (Г); широкое использование такого представления обусловлено тем, что оно наиболее точно отражает структуру сахара. На всех четырех изображениях цветной буквой О обозначен атом кислорода альдегидной группы. Структура и химизм Сахаров представлены на схеме 2-3.
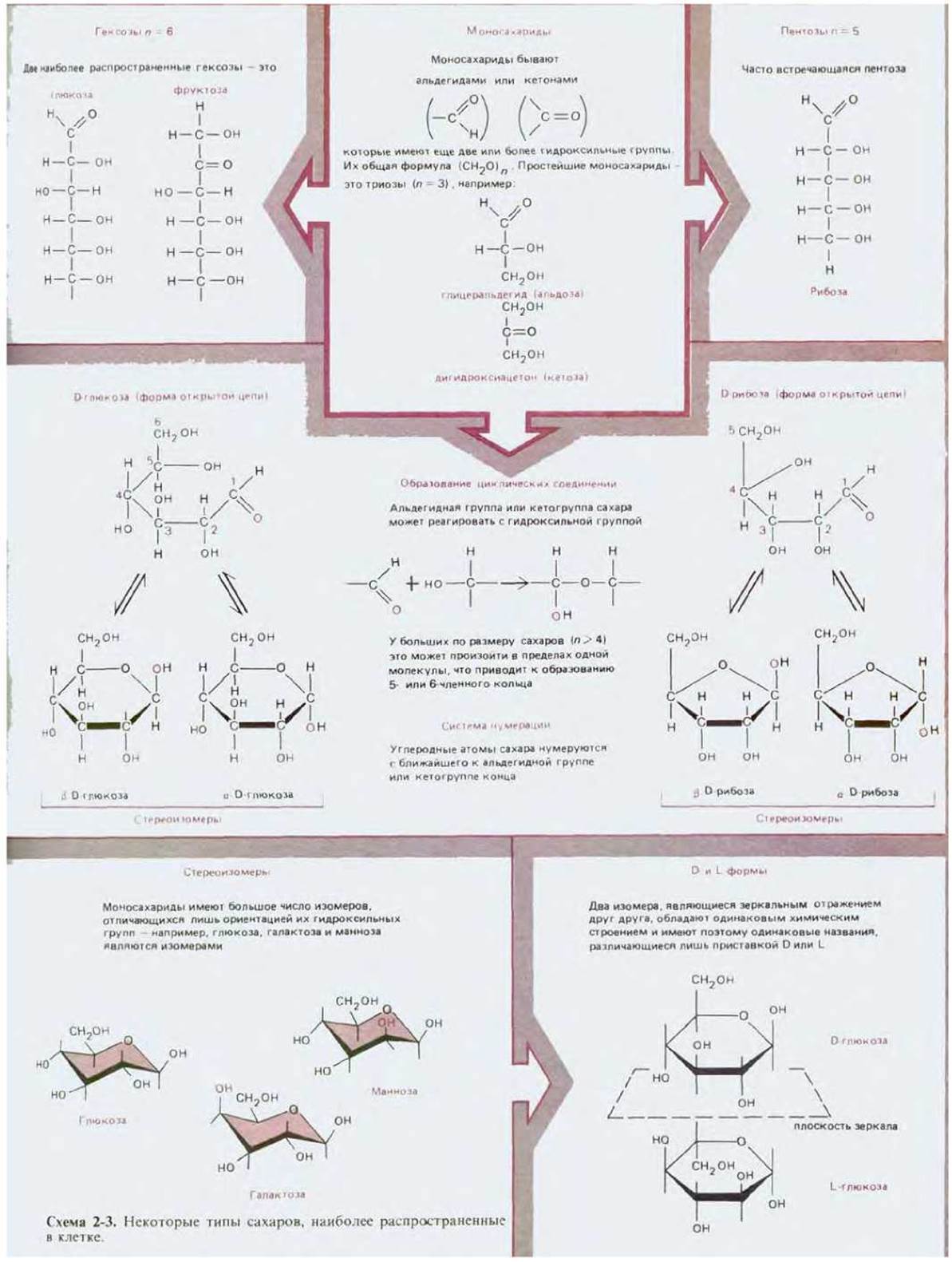

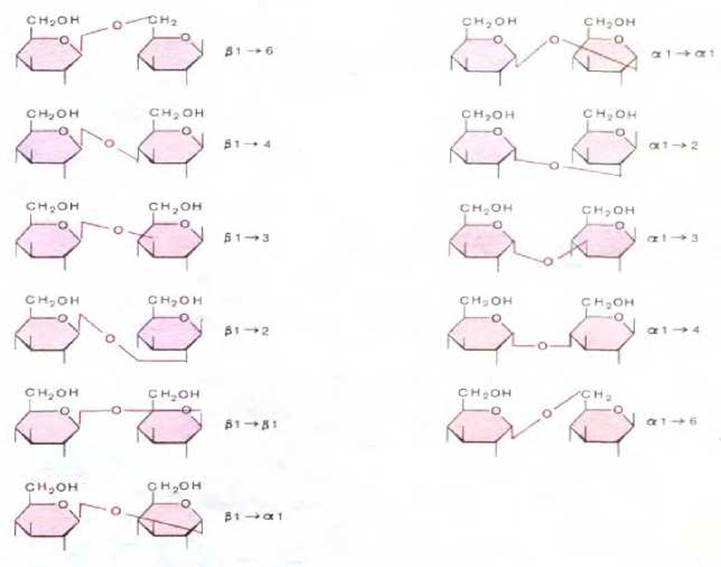
Рис. 2-4. Одиннадцать дисахаридов, построенных из двух остатков D-глюкозы. Хотя разница между ними состоит лишь в тине связи между двумя остатками глюкозы, в химическом отношении они различны. Олигосахариды, связанные с белками и липидами, могут включать в себя шесть и более разных видов Сахаров, которые имеют как линейное, так и разветвленное строение благодаря связям, подобным тем, которые показаны на этом рисунке. Следовательно, число возможных различных типов олигосахаридов необычайно велико.
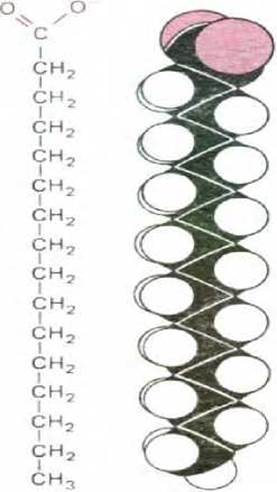
Рис. 2-5. Пальмитиновая кислота. Карбоксильная группа (выделена цветом) изображена в ионизированной форме. Справа показана пространственная модель молекулы.
В ходе распада глюкозы высвобождается энергия и генерируется восстановительная способность, без чего невозможно протекание биосинтетических реакций. Высвобождающаяся энергия и генерируемая восстановительная сила запасаются в форме двух важнейших соединений - АТР и NADH (см. разд. 2.3.1).
Простые полисахариды, построенные из повторяющихся остатков глюкозы (в животных клетках это главным образом гликоген, а в растительных - крахмал), используются для запасания энергии впрок. Однако нельзя считать, что сахара служат исключительно для получения и запасания энергии. Так, из простых полисахаридов состоит важный внеклеточный структурный материал (например, целлюлоза), а цепочки неповторяющихся молекул Сахаров часто бывают ковалентно связаны с белками в гликопротеинах и с липидами в гликолипидах.
2.1.4. Жирные кислоты - компоненты клеточных мембран
В молекуле жирной кислоты, например в пальмитиновой кислоте (рис. 2-5), имеются две различные части: длинная углеводородная цепь, которая имеет гидрофобный характер (водонерастворима) и химически мало активна, и карбоксильная группа, ионизирующаяся в растворе, крайне гидрофильная (водорастворимая) и легко образующая эфиры и амиды. Действительно, почти во всех случаях молекулы жирных кислот клетки ковалентно связаны с другими молекулами именно своими карбоксильными группами. Многие жирные кислоты, обнаруживаемые в клетках, отличаются друг от друга такими химическими свойствами, как длина углеводородной цепи, число и положение имеющихся в них двойных связей углерод—углерод (схема 2-4).
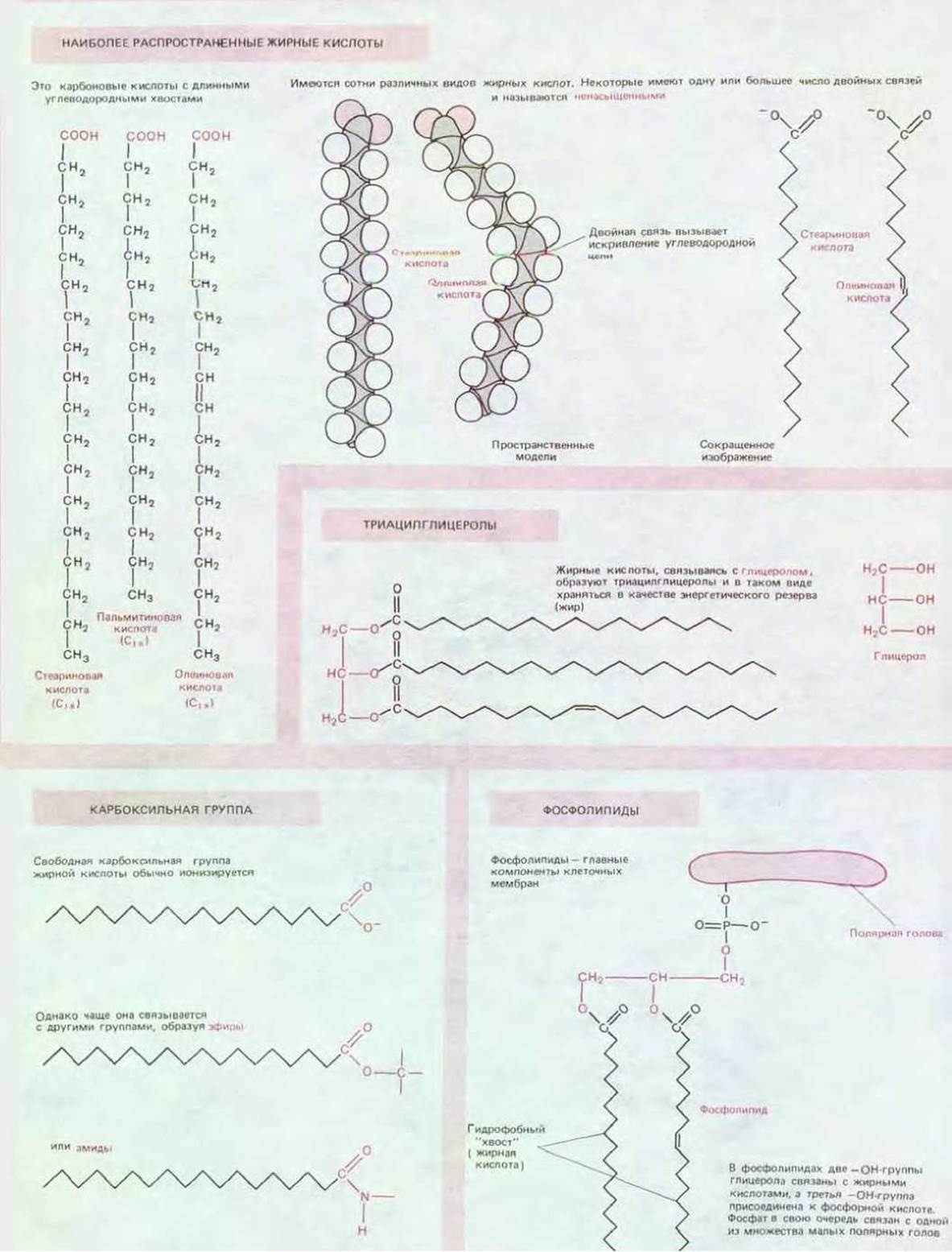
Схема 2-4. Некоторые типы жирных кислот, часто встречающихся в клетках, и образованные ими структуры.

Жирные кислоты являются ценным источником энергии, поскольку их расщепление сопровождается образованием такого количества АТР, которое в два раза превышает образование АТР при расщеплении такого же количества (по массе) глюкозы. Жирные кислоты запасаются в цитоплазме многих клеток в виде капелек триацилглицеролов (триглицеридов). Молекулы триацилглицеролов состоят из трех цепей жирных кислот, каждая из которых присоединена к молекуле глицерола (схема 2-4); именно так устроены животные жиры, с которыми мы имеем дело в повседневной жизни. При необходимости цепи жирных кислот могут высвобождаться из триацилглицеролов и распадаться до двухуглеродных единиц. Такие двухуглеродные единицы, выходящие в виде ацетогруппы в водорастворимую молекулу, называемую ацетил-СоА, подвергаются дальнейшему расщеплению в различных экзергонических реакциях, которые рассматриваются в последующих разделах.
Но самая важная функция жирных кислот - участие в построении клеточных мембран. Эти тонкие плотные пленки, которыми одеты все клетки и внутриклеточные органеллы, состоят главным образом из фосфолипидов - небольших молекул, сходных с триацилглицеролами наличием таких компонентов, как жирные кислоты, связанные с глицеролом. Однако в фосфолипидах глицерол чаще связан не с тремя, а лишь с двумя цепями жирных кислот. Оставшееся свободное место в молекуле глицерола обычно занимает фосфатная группа, которая в свою очередь соединена с другими небольшими гидрофильными группами - этаноламином, холином или серином.
У каждой фосфолипидной молекулы имеется гидрофобный хвост, состоящий из цепей двух жирных кислот, и гидрофильная полярная голова, в которой располагается фосфатная группа. Такие фосфолипидные молекулы, в сущности, представляют собой детергенты, о чем свидетельствуют их свойства. Небольшое количество фосфолипидов будет распределяться по водной поверхности с образованием фосфолипидного монослоя. В таком тонком слое очень тесно сближенные хвосты обращены в сторону воздуха, а головы погружены в воду (схема 2-4). Два подобных слоя могут соединяться «хвост к хвосту», образуя в результате фосфолипидный «сандвич», или липидный бислой, служащий структурной основой всех клеточных мембран.
2.1.5. Аминокислоты - субъединицы белков
Аминокислоты, содержащиеся в биологических тканях, различаются по химическому составу. Однако все они имеют ту общую особенность, что содержат карбоксильную группу и аминогруппу, связанные с одним и тем же углеродным атомом (рис. 2-6). Аминокислоты служат строительными блоками при синтезе белков - длинных линейных полимеров аминокислот, соединенных «хвост к голове» при помощи пептидной связи между карбоксильной группой одной аминокислоты и аминогруппой другой (рис. 2-7). В белках встречается обычно 20 аминокислот с разными боковыми цепями, связанными с а-углеродным атомом (схема 2-5). Одни и те же 20 аминокислот неоднократно повторяются во всех белках, в том числе в белках бактериального, животного и растительного происхождения. Возможно, тот факт, что именно эти 20 аминокислот были отобраны в ходе эволюции, - один из примеров роли случая, но их химическое разнообразие имеет жизненно важное значение.
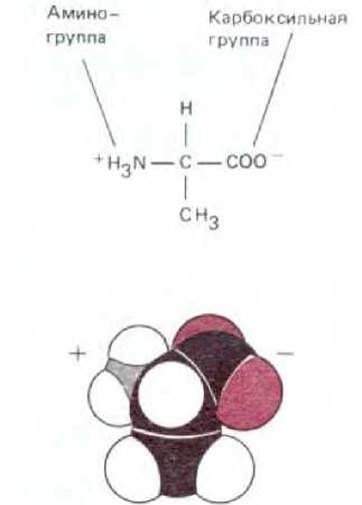
Рис. 2-6. Аминокислота аланин в ионизированной форме, в которой она находится при рН 7. При включении аланина в полипептидную цепь заряды амино- и карбоксильной групп, имеющиеся у свободной аминокислоты, исчезают. В нижней части рисунка представлена пространственная модель.
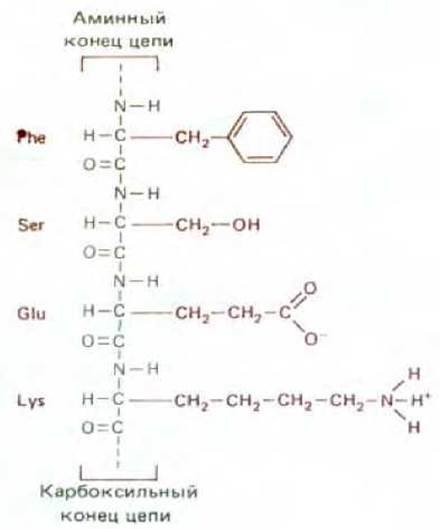
Рис. 2-7. Небольшая часть белковой молекулы. Четыре показанные на рисунке аминокислоты связаны друг с другом ковалентными связями, называемыми пептидными связями. Поэтому белок можно называть полипептидом. Боковые цепи аминокислот выделены цветом.
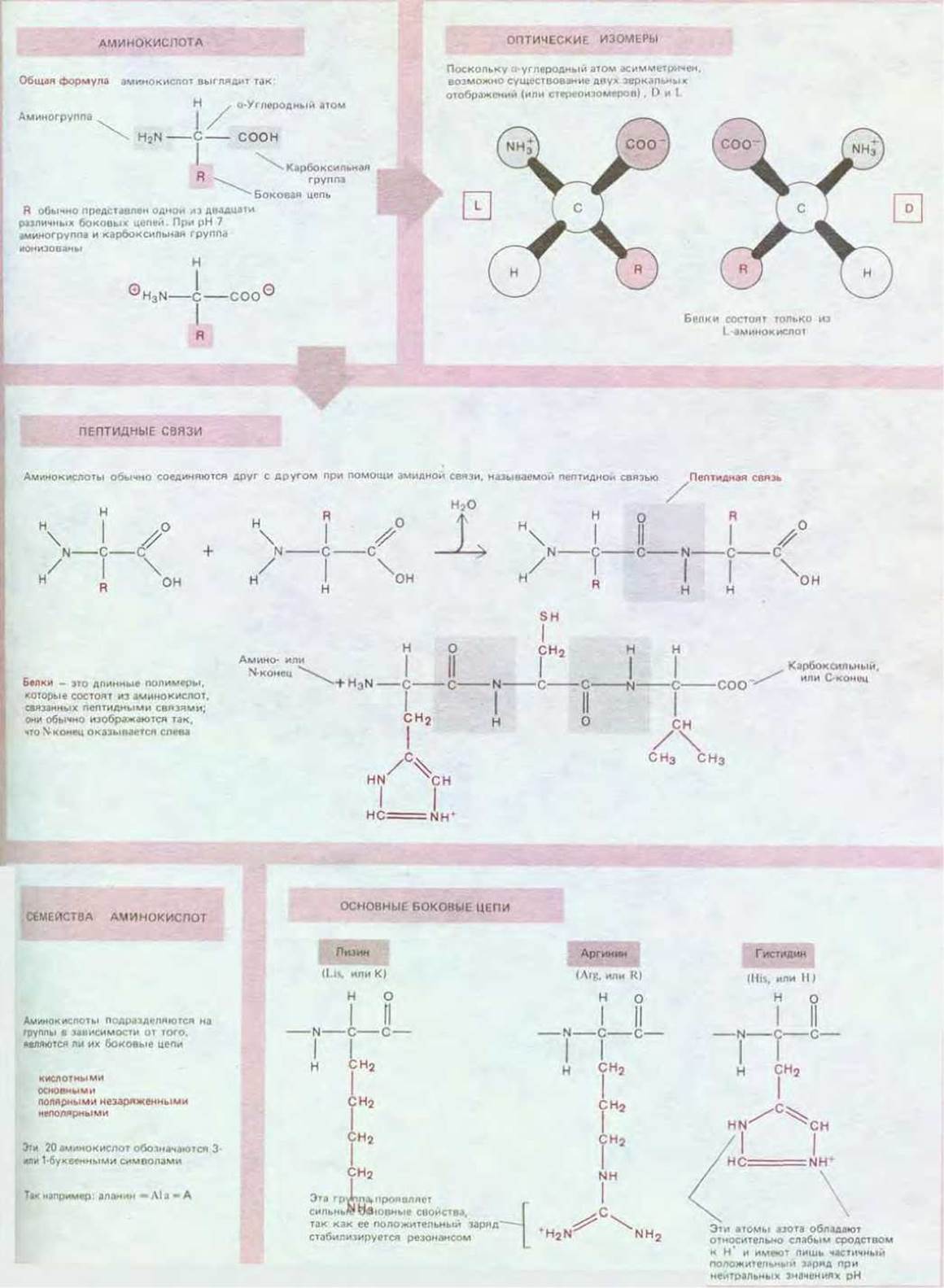
Схема 2-5. 20 аминокислот, участвующих в синтезе белка.
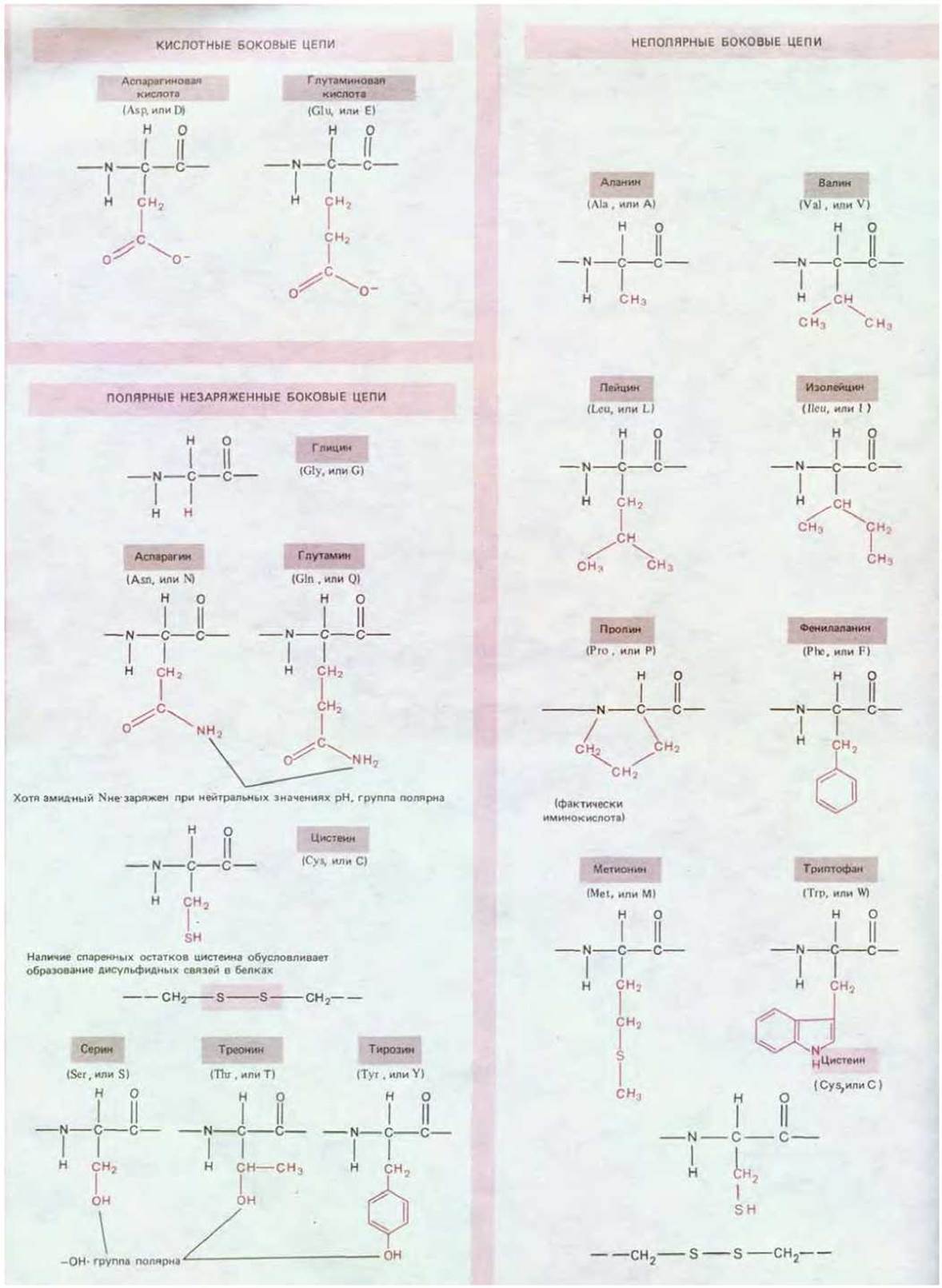
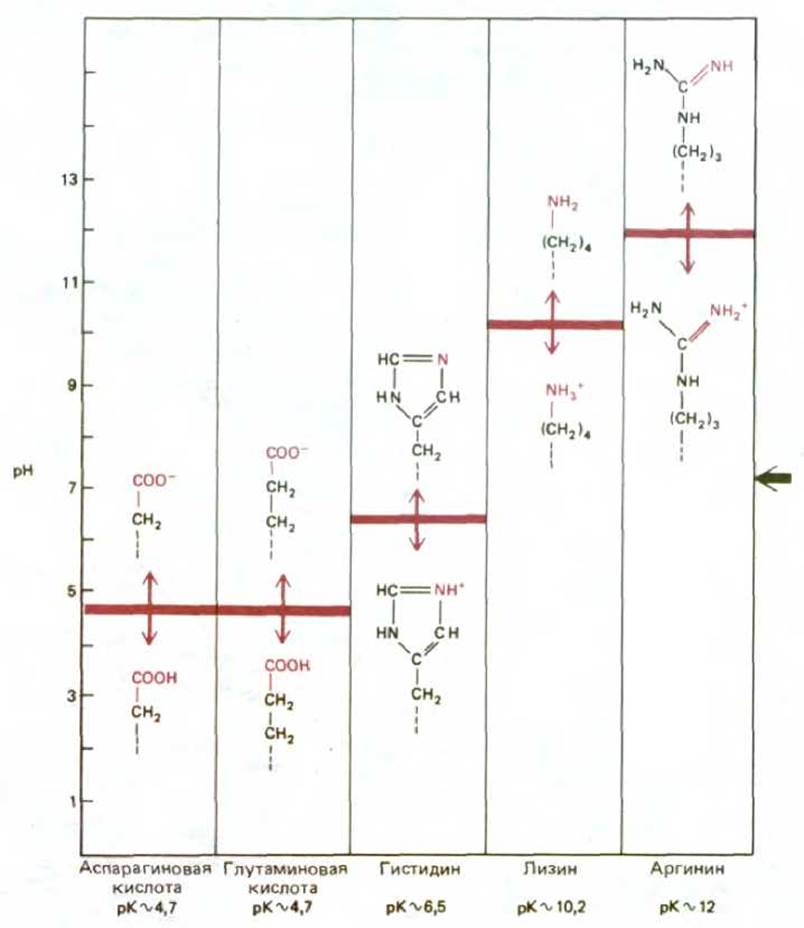
Рис. 2-8. Заряд боковых цепей аминокислот зависит от значения рН. Карбоновые кислоты в водном растворе легко теряют Н+, образуя отрицательно заряженный ион, обозначаемый с помощью суффикса «ат», например аспартат или глутамат. Сравнимая ситуация имеет место в случае аминов, которые, захватывая в водном растворе ион Н+, превращаются в положительно заряженный ион (он не имеет специального названия). Эти реакции легко обратимы, и количество двух форм (заряженной и незаряженной) зависит от рН раствора. При высоких значениях рН карбоновые кислоты имеют тенденцию к приобретению заряда, а у аминов заряд отсутствует. При низких значениях рН наблюдается обратная ситуация: карбоновые кислоты не несут заряда, а амины заряжены. рН, при котором ровно половина остатков карбоновых кислот или аминов заряжена, называют рК аминокислоты. В клетке рН близко к 7 и почти все карбоновые кислоты и амины находятся в заряженном состоянии.
Например, у 5 из 20 аминокислот боковые цепи могут нести заряд (рис. 2-8), тогда как боковые цепи других аминокислот электронейтральны, но обладают способностью вступать в реакции посредством образования специфических связей (схема 2-5). Как мы увидим, особенности боковых цепей всех аминокислот, входящих в состав данного белка, определяют его свойства и лежат в основе всех сложных и разнообразных функций белковых молекул.
2.1.6. Нуклеотиды субъединицы ДНК и РНК [5]
В нуклеотидах одно из нескольких азотсодержащих циклических соединений (называемых часто основаниями, поскольку они способны присоединять в кислой среде ион Н+) связано с пятиуглеродным сахаром (рибозой или дезоксирибозой), который несет еще и фосфатную группу. Между азотсодержащими кольцами, встречающимися в нуклеотидах, имеется близкая родственная связь. Цитозин (С), тимин (Т) и урацил (U) называются пиримидиновыми основаниями, так как они представляют собой простые производные шестичленного пиримидинового кольца; гуанин (G) и аденин (А) - пуриновые основания, второе пятичленное кольцо которых сконденсировано с шестичленным циклом. Каждому нуклеотиду присвоено название, соответствующее названию входящего в его состав уникального основания (схема 2-6).

Схема 2-6. Основные типы нуклеотидов и их производные, встречающиеся в клетках.

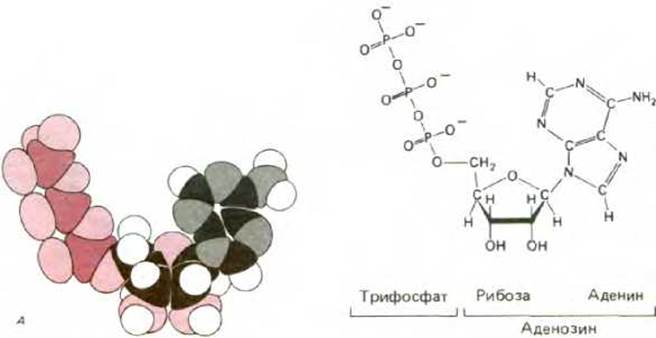
Рис. 2-9. Химическое строение аденозинтрифосфата (АТР). Показаны пространственная модель (А) и структурная формула (Б) молекулы.
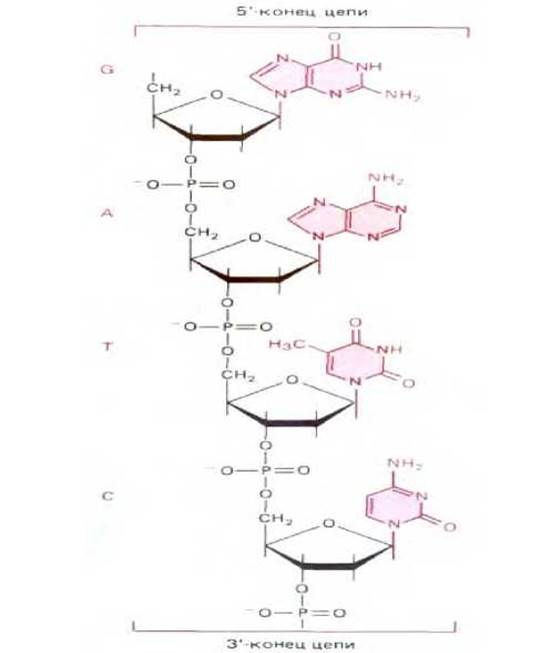
Рис. 2-10. Короткий отрезок дезоксирибонуклеиновой кислоты, или ДНК. ДНК и близкородственная ей РНК - нуклеиновые кислоты клетки.
Показанный на рисунке отрезок цепи ДНК содержит нуклеотидную последовательность G-A-T-C.
Нуклеотиды могут выступать в качестве переносчиков энергии. При этом трифосфатный эфир аденина АТР (рис. 2-9) гораздо чаще, чем другие нуклеотиды, участвует в переносе энергии между сотнями индивидуальных внутриклеточных реакций. Концевой фосфат АТР образует ковалентную связь в процессе окисления питательных веществ; энергия, высвобождаемая при гидролизе этой фосфатной группы, может использоваться в любом другом месте для осуществления биосинтетических процессов, протекающих с затратой энергии. Другие производные нуклеотидов служат переносчиками отдельных химических групп, таких, как атомы водорода или остатки Сахаров, с одной молекулы на другую. Кроме того, циклическое фосфорилированное производное аденинациклический AMP (cAMP) - служит универсальным внутриклеточным сигналом и регулирует скорость множества различных внутриклеточных реакций.
Как уже упоминалось в гл. 1, особенно велика роль нуклеотидов в хранении биологической информации. Нуклеотиды служат строительными блоками для синтеза нуклеиновых кислот - длинных полимеров, в которых нуклеотидные субъединицы соединяются между собой ковалентной связью, образуя фосфорный эфир между 3'-гидроксильной группой остатка сахара одного нуклеотида и 5'-фосфатной группой следующего (рис. 2-10). Существуют два основных типа нуклеиновых кислот, различающихся видом сахара, который входит в состав их полимерного остова. Нуклеиновые кислоты, сахар которых представлен рибозой, называются рибонуклеиновыми кислотами или РНК; они содержат основания A, U, G и С. Те нуклеиновые кислоты, в состав которых входит дезоксирибоза (в ней гидроксильная группа при С-2 рибозы замещена на атом водорода), называются дезоксирибонуклеиновыми кислотами или ДНК; они содержат основания А, Т, G и С. В последовательности оснований в полимерных молекулах ДНК и РНК заключена генетическая информация живой клетки. Способность азотистых оснований молекул различных нуклеиновых кислот «узнавать» друг друга путем нековалентного взаимодействия (называемого спариванием оснований) - G с С и А с Т или U - лежит в основе механизмов наследственности и эволюции. Этот вопрос рассматривается в следующей главе.
Заключение
Живые организмы - это автономные самовоспроизводящиеся химические системы. Они построены из специфического и вместе с тем ограниченного набора углеродсодержащих малых молекул, как правило, одних и тех же для всех видов живых существ. Основные группы этих молекул представлены сахарами, жирными кислотами, аминокислотами и нуклеотидами. Сахара служат важнейшим источником энергии для клеток и запасают ее, образуя резервные полисахариды. Жирные кислоты, как и сахара, имеют важное значение для запасания энергии, но самая главная их функция - образование клеточных мембран. Полимеры, построенные из аминокислот, представлены удивительно разнообразными и многофункциональными молекулами белков. Нуклеотиды участвуют во внутриклеточной передаче сигналов и играют центральную роль в переносе энергии, однако их уникальное значение состоит в том, что они являются субъединицами информационных молекул РНК и ДНК.