Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Цитоскелет
Промежуточные филаменты
Промежуточные филаменты (ПФ) - это жесткие и прочные белковые волокна в цитоплазме большинства клеток высших эукариот. Структура их напоминает переплетенные канаты, а толщина составляет 8-10 нм, т. е. промежуточная между толщиной толстых и тонких филаментов в мышцах, где ПФ были впервые описаны; по толщине они занимают также промежуточное место между актиновыми филаментами и микротрубочками. В большинстве животных клеток они формируют характерную «корзинку» вокруг ядра, откуда по слегка искривленным путям тянутся к периферии клетки. Особенно много ПФ там, где клети подвергаются механическим нагрузкам, например в эпителиях, где это нити участвуют в соединении клеток друг с другом (при помощи десмосом, см. разд. 14.1.4), в нервных волокнах и во всей цитоплазме гладкомышечных клеток. При экстракции клеток растворами с высокой и низкой ионной силой и солюбилизации неионными детергентами ПФ остаются целыми, тогда как большая часть остальных цитоскелетных структур разрушается. Фактически термин «цитоскелет» был первоначально введен именно для обозначения этих чрезвычайно стойких и нерастворимых волокон.
11.5.1. Промежуточные филаменты образуются из фибриллярных полипептидов четырех типов [51, 52]
В отличие от мономеров актина и тубулина, которые представляют собой глобулярные белки, субъединицы ПФ имеют вытянутую, фибриллярную форму. Они объединяются в продольные пучки, где перекрываются по длине, так что образуют длинные нити с высокой механической прочностью. В латеральных взаимодействиях, за счет которых строятся ПФ, нередко участвует лишь часть молекулы белковой субъединицы ПФ, поэтому структура остальной ее части может значительно варьировать, не изменяя общего строения нити. В связи с этим ПФ в отличие от актиновых филаментов и микротрубочек построены из полипептидов с весьма различной молекулярной массой - от 40 до 130 тыс. в зависимости от типа клеток.
Промежуточные филаменты по их первичной структуре делят на четыре большие группы (табл. 11-5). Белки ПФ типа I наиболее характерны для эпителиальных клеток и включают два подсемейства кератинов: кислые кератины и нейтральные или основные кератины. Кератиновые филаменты - всегда гетерополимеры, образованные поровну субъединицами каждого из этих двух подсемейств. Вообще кератины - самая обширная группа белков ПФ; известно уже не менее 19 различных форм в составе эпителиев человека и еще 8 в волосах и ногтях. Многие типы эпителиев, различающихся морфологически и функционально, синтезируют также разные формы кератинов.
Таблица 11-5. Главные типы белков промежуточных филаментов
|
Образующий полипептид (мол. масса) |
Локализация |
|
|
Тип І |
Кислые кератины (40000-70000) Нейтральные и основные кератины (40 000-70 000) |
Эпителиальные клетки и производные эпидермиса (волосы, ногти и т.п.) |
|
Тип II |
Виментин (53000) |
Многие клетки мезенхимного происхождения; часто экспрессируется клетками в культуре Мышечные клетки |
|
Десмин (52000) Глиальный фибриллярный кислый белок (45000) |
Глиальные клетки (астроциты и некоторые шванновские клетки) |
|
|
Тип III |
Белки нейрофиламентов (около 1300001), 1000001) и 60000) |
Нейроны |
|
Типы IV |
Ядерные ламины А, В и С (65000 -75000) |
Ядерная ламина во всех клетках |
1) Из-за того, что эти белки при электрофорезе в гелях с додецилсульфатом натрия мигрируют аномально медленно, раньше их молекулярную массу считали большей.

Рис. 11-73. Иммунофлуоресцентная микрофотография эпителиальных клеток кенгуровой крысы (PtK2) в интерфазе. Клетки окрашены одновременно антителами к виментину (А) и к кератину (Б). Обратите внимание, что содержащиеся в клетке системы виментиновых и кератиновых филаментов существуют раздельно, хотя и имеют сходное распределение. (С любезного разрешения Магу Osborn.)
К белкам ПФ типа II относятся 1) виментин, 2) десмин и 3) глиальный фибриллярный кислый белок. Виментин широко распространен в клетках мезенхимного происхождения, включая фибробласты, клетки эндотелия кровеносных сосудов и лейкоциты; он часто образуется в культивируемых клетках и временно появляется в различных клетках в ходе онтогенеза. Десмин содержится в клетках мышц, как гладких, так и поперечнополосатых, а глиальный фибриллярный кислый белок образует глиальные филаменты в определенного рода клетках глии (астроцитах и некоторых шванновских клетках) в нервной системе. Все эти белки способны in vitro к самосборке с образованием гомополимеров, а также к образованию гетерополимеров с другими белками типа II. Последняя способность проявляется и in vivo: в клетках некоторых типов были обнаружены сополимеры виментина с десмином и виментина с глиальным фибриллярным кислым белком.
Из белков ПФ типа III построены нейрофиламенты - важный компонент цитоскелета в аксонах и дендритах нервных клеток. У позвоночных три таких белка, их называют «нейрофиламентным триплетом». И наконец, белки ПФ типа lV-это ядерные ламины (разд. 11.5.5); они сходны с другими белками ПФ по аминокислотной последовательности, но имеют несколько характерных отличий. Наиболее примечательно то, что они образуют высокоупорядоченные двумерные сети из филаментов, подвергающиеся быстрой разборке и сборке на определенных стадиях митоза.
Все клетки эукариот синтезируют ядерные ламины и по крайней мере один тип цитоплазматических белков ПФ. В некоторых клетках есть цитоплазматические ПФ двух типов, образующие раздельные структуры. Таковы, например, некоторые эпителиальные клетки, содержащие отдельные системы кератиновых и виментиновых филаментов (рис, 11-73). 11-28
11.5.2. Промежуточные филаменты образуются из димерных субъединиц со стержневидным срединным доменом [53]
Несмотря на значительную разницу в размерах, все белки ПФ цитоплазмы кодируются генами одного мультигенного семейства. У всех этих белков в первичной структуре полипептида есть гомологичный срединный участок примерно из 310 аминокислот, образующий протяженную а-спираль с тремя короткими не-а-спиральными вставками (рис. 11-74). Кроме того, большие отрезки этой срединной области имеют последовательность, характерную для полипептидов, способных к образованию спирали из двух спиралей (см. разд. 11.1.6). Подобно тропомиозину или хвосту мышечного миозина, эта двухцепочечная спираль представляет собой димер из двух одинаковых полипептидов ПФ. Эти две цепи в гомодимере ПФ уложены параллельно друг другу, причем к срединному стержневидному домену примыкают на обоих концах глобулярные домены. При сборке ПФ стержневидные домены взаимодействуют друг с другом и формируют однородную сердцевину филамента, а глобулярные, величина которых сильно варьирует у разных белков ПФ, выступают с поверхности филамента наружу. Одна из моделей сборки ПФ из димерных субъединиц показана на рис. 11-75.
11.5.3. Промежуточные филаменты простираются от ядерной оболочки до периферии клетки [54]
Если окрасить культивируемые клетки антителами к одному из цитоплазматических белков ПФ (например, виментину), то обычно будет видна ажурная сеть нитей, окружающая ядро и охватывающая всю, цитоплазму (см. рис. 11-73). По структуре эта сеть отлична от других компонентов цитоскелета, хотя местами ее нити, по-видимому, идут параллельно микротрубочкам цитоплазмы. Вероятно, организация цитоплазматических ПФ зависит от взаимодействия с микротрубочками, так как деполимеризация микротрубочек при обработке веществами типа колхицина ведет к «осаждению» всей сети ПФ в виде околоядерной «шапки». Можно думать, что многие ПФ цитоплазмы связаны с ядерной оболочкой и в норме оттягиваются от нее к периферии клетки микротрубочками, с которыми они соединены.
Организация ПФ в цитоплазме может также определяться их взаимодействием с плазматической мембраной. В эритроцитах птиц (которые в отличие от эритроцитов млекопитающих имеют ядро и ПФ) виментин, как полагают, связан с плазматической мембраной через анкирин (разд. 6.2,4). В эпителиальных клетках кератиновые ПФ присоединены к плазматической мембране в десмосомах - специализированных межклеточных соединениях, помогающих удерживать соседние клетки вместе (разд. 14.1.4). Так как кератиновые филаменты каждой клетки через десмосомы соединены с такими же филаментами соседних клеток, они образуют непрерывную сеть, охватывающую весь эпителий.
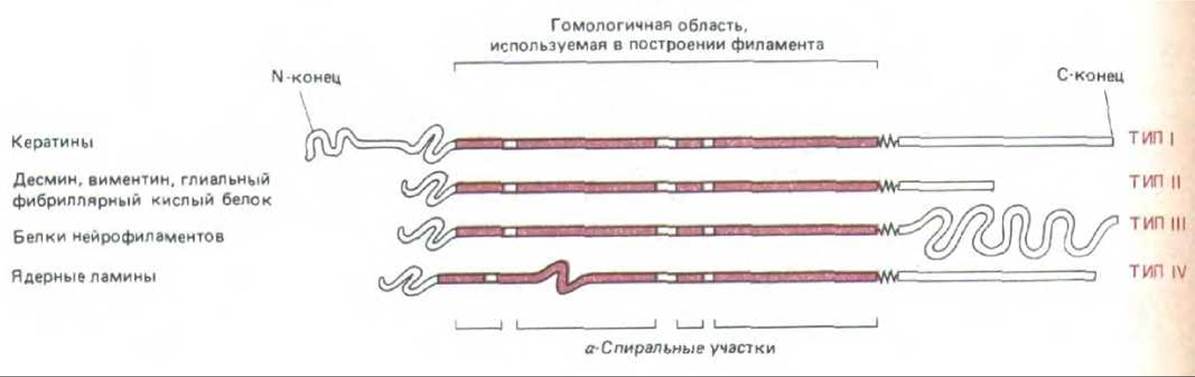
Рис. 11-74. У всех белков промежуточных филаментов имеется гомологичная центральная область (около 310 аминокислотных остатков), формирующая протяженную а-спираль с тремя короткими участками иной структуры. N-концевой и С-концевой домены не состоят из а-спирали и сильно варьируют по размерам и последовательности аминокислот у белков разных промежуточных филаментов.
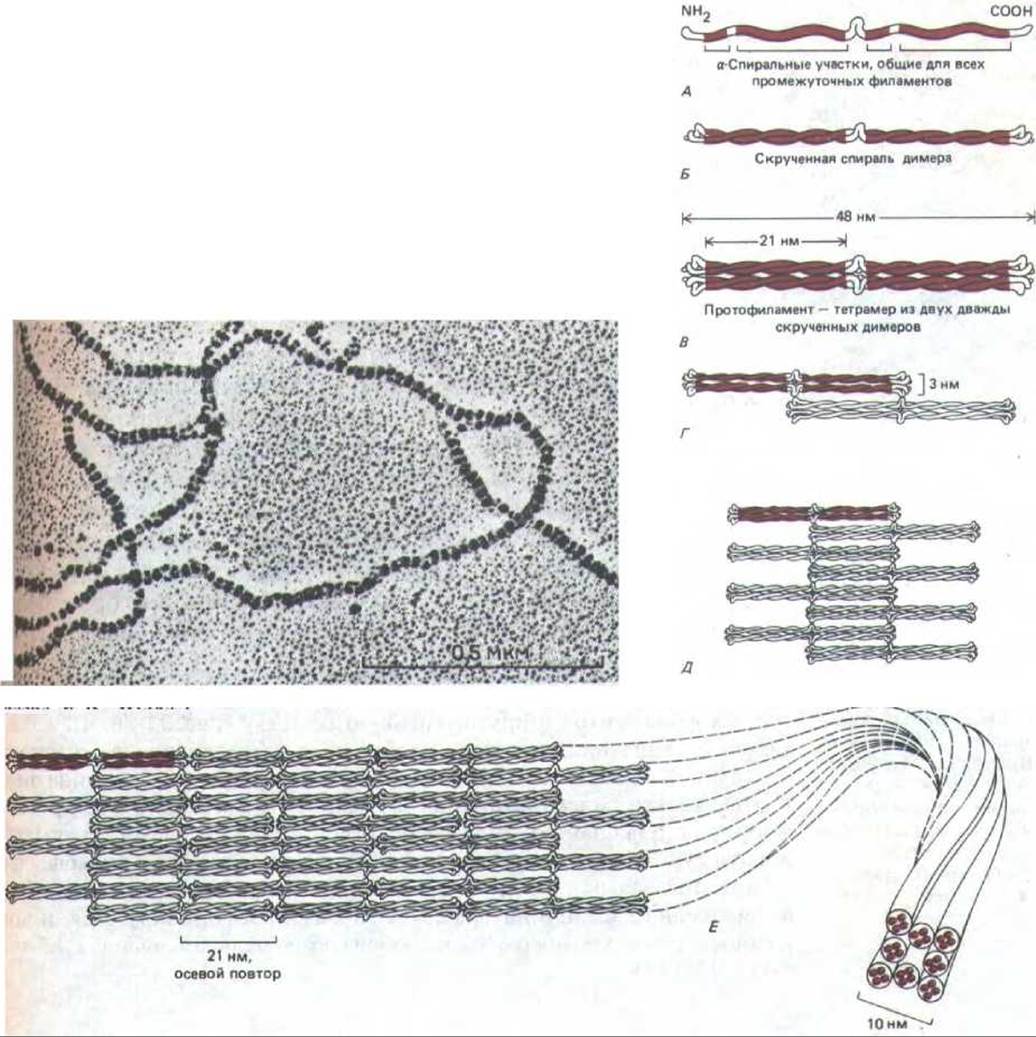
Рис. 11-75. Одна из современных моделей сборки промежуточных филаментов (ПФ). Мономер (А) объединяется с таким же мономером, образуя димер (Б), в котором консервативные а-спиральные участки лежат параллельно, обвиваясь друг около друга. Затем два таких димера укладываются бок о бок, образуя протофиламент длиной 48 нм и толщиной 3 нм, который состоит из четырех полипептидных цепей (В). Такие протофиламенты затем образуют все более крупные структуры, укладываясь с продольным сдвигом (Г и Д). Окончательная структура промежуточного филамента толщиной 10 нм состоит из восьми рядов протофиламентов (32 полипептидных цепей), соединенных в длинный тяж, похожий на канат (Е). Вверху представлена электронная микрофотография такого «окончательного» филамента. Неизвестно, являются ли ПФ полярными структурами, как актин и тубулин, или неполярными, как двойная спираль ДНК (или, что то же самое, лежат ли две скрученные спирали в составе протофиламента в параллельной ориентации или же в антипараллельной. (Микрофотография любезно предоставлена N. Geisler и К. Weber.)
11-29
11.5.4. Сборка промежуточных филаментов может контролироваться с помощью фосфорилирования [55]
Изолированные промежуточные филаменты (ПФ) в ионной среде, соответствующей цитоплазме, чрезвычайно стабильны; более того, сколько-нибудь значительного пула неполимеризованных белков ПФ (какой имеется в случае актина и тубулина) в клетке нет. И все же клетка явно может регулировать число, длину и расположение своих промежуточных филаментов, что указывает на ее способность контролировать их сборку и разборку. Важный фактор этого контроля-фосфорилирование определенных остатков в белках ПФ. Виментин, например, существует как в нефосфорилированной, так и в фосфорилированной форме. Если фосфорилировать изолированные виментиновые нити с помощью протеинкиназы, они распадаются на меньшие фрагменты. Однако самый впечатляющий пример того, насколько важную роль играет в контроле разборки ПФ фосфорилирование, - это ядерные ламины, которые подвергаются деполимеризации всякий раз, когда клетка вступает в митоз,
11.5.5. Ядерная ламина образована особым классом промежуточных филаментов [56]
Ядерная ламина - это белковая сеть (обычно толщиной от 10 до 20 нм), подстилающая изнутри поверхность внутренней ядерной мембраны (см. рис. 9-1). Она представляет собой прямоугольную решетку из промежуточных филаментов (рис. 11-76, Д), построенных у млекопитающих из трех белков ПФ типа Vl-ламинов А, В и С (см. рис. 11-74 и табл. 11-3), Ламины образуют димеры, у которых имеется стержневидный домен и две глобулярные головки на одном из концов (рис. 11-76, Б). При подходящих рН и ионной силе димеры самопроизвольно ассоциируют, образуя филаменты, которые по толщине и повторяющейся структуре сходны с цитоплазматическими ПФ.
Однако по ряду признаков ядерные ламины отличаются от белков ПФ цитоплазмы. Наиболее очевидное отличие-это организация образуемых филаментов в прямоугольную решетку (рис. 11-76, А), хотя для такой организации, видимо, необходимо объединение их с другими белками. Кроме того, ядерная ламина - структура очень динамичная. Когда клетки млекопитающих вступают в митоз, кратковременное фосфорилирование нескольких остатков серина в ламинах вызывает обратимую диссоциацию ядерной ламины на тетрамеры гиперфосфорилированных ламинов А и С и связанного с мембраной ламина В. При возвращении клетки в интерфазу ламины дефосфорилируются, и вокруг разошедшихся хромосом вновь образуется цельная ядерная оболочка (разд. 13.5.11).
11.5.6. Кератиновые филаменты удивительно разнообразны [52]
Из всех типов промежуточных филаментов наиболее стабильные и долгоживущие - кератиновые, они же и самые разнообразные. Эпителии с примитивной организацией, например в развивающемся эмбрионе, а также некоторые зрелые ткани (такие, как печень) содержат кератины двух типов - один кислый и один нейтральный. В эпителиях других органов (например, языка, мочевого пузыря, потовых желез) имеются шесть или больше различных кератинов, причем их конкретный спектр зависит от анатомической локализации. Кератиновые филаменты ввиду их многообразия и стабильности могут служить своего рода «отпечатками пальцев», позволяющими уточнить происхождение некоторых опухолей эпителиальной природы. Еще разнообразнее кератины в эпидермисе, который представляет собой плотный многослойный эпителий (разд. 17.4.2). В клетках разных слоев эпидермиса экспрессируются разные наборы кератинов. Кератиновые филаменты в них постепенно сшиваются поперечными ковалентными связями друг с другом и с ассоциированными белками, и по мере гибели клеток в самых наружных слоях эпидермиса поперечносшитый кератиновый скелет становится важнейшим защитным барьером на поверхности тела. Специализированные эпителиальные клетки, образующие такие поверхностные структуры, как волосы, когти и перья, обеспечивают дополнительные локальные вариации в наборе кератинов. Таким образом, промежуточные филаменты защищают животное от потери тепла и воды, предоставляют ему «оружие» и средства камуфляжа или, наоборот, привлечения партнера (окраска).
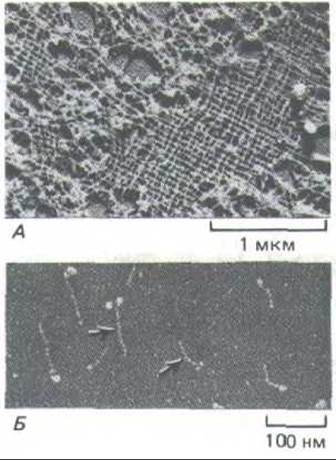
Рис. 11-76. А. Электронная микрофотография участка ядерной ламины в ооците Xenopus (препарат получен методом лиофилизации и напыления металлом). Ламину образует высокоупорядоченная прямоугольная сеть из промежуточных филаментов, состоящих из ядерных ламинов. Б. Изолированные димеры ламина (L) (электронная микрофотография, напыление металлом). По форме они напоминают мышечный миозин (М): у них есть стержневидный хвост и две глобулярные головки, но они гораздо меньше. Глобулярные головки образованы двумя большими С-концевыми доменами. (С любезного разрешения Ueli Aebi.)
11.5.7. Какова функция промежуточных филаментов?
Животные клетки могут обходиться и без промежуточных филаментов. В ЦНС глиальные клетки, вырабатывающие миелин, совершенно лишены их. Если культивируемым фибробластам сделать внутриклеточную инъекцию антител к белкам промежуточных филаментов, то последние разрушатся, и это не окажет заметного влияния на организацию или поведение клеток. Кажется вероятным, что главная функция большинства ПФ состоит в чисто механической «поддержке» клетки и ее ядра. Промежуточные филаменты в эпидермальных пластах образуют «трансклеточную» (соединяющую множество клеток воедино) сеть, роль которой, скорее всего, заключается в противодействии внешним нагрузкам. Нейрофиламенты в нервных волокнах противостоят механическим деформациям, возникающим при движении животного, иначе эти длинные тонкие цилиндры из цитоплазмы легко рвались бы. Десминовые нити в клетках мышц создают механическую опору для саркомеров, а виментиновые окружают (и, вероятно, поддерживают) крупные жировые капли в жировых клетках. Но если функция промежуточных филаментов сводится всего лишь к сопротивлению растягивающим силам, для чего нужно так много различных вариантов их белковых субъединиц? Какова роль вариабельных частей их молекул - ведь они как будто бы не участвуют в построении самого филамента? Детальных ответов на эти вопросы пока нет, но ясно, что как характер опорной функции промежуточных филаментов, так и способ их соединения с другими компонентами клетки сильно различаются в клетках разного типа. Например, десминовые филаменты, скрепляющие края Z-дисков в поперечнополосатых мышцах, по-видимому, имеют участки для связывания специфических белков Z-диска; нейрофиламенты подвергаются меньшим нагрузкам, но они могут соединяться вместе боковыми поверхностями, образуя непрерывный «трос» до метра и больше длиной; вероятно, именно поэтому нейрофиламенты имеют по всей своей длине большие выступы, которых нет у других промежуточных филаментов (рис. 11-77).
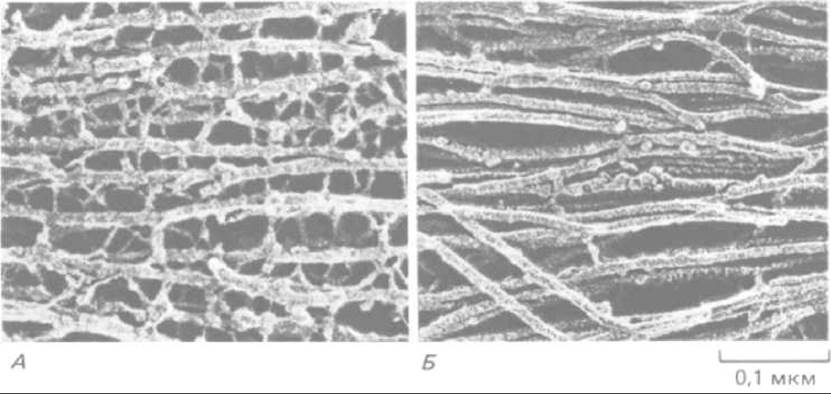
Рис. 11-77. Электронная микрофотография промежуточных филаментов двух типов, встречающихся в нервной ткани (препарат после быстрого замораживания и глубокого травления). А. Нейрофиламенты в аксоне соединены многочисленными поперечными белковыми сшивками; как полагают, такая организация придает этому длинному клеточному отростку большую прочность на разрыв. По-видимому, сшивки образованы длинными неспиральными участками С-концевой части наиболее крупного белка нейрофиламентов (см. рис. 11-74). Б. Промежуточные филаменты (называемые глиальными филаментами) в астроците. Они подвергаются меньшим механическим нагрузкам. Их поверхность довольно гладкая, и поперечных сшивок между ними мало. (С любезного разрешения N. Hirokawa.)
Различные потенции к связыванию других белков могут обеспечиваться вариабельными участками белков промежуточных филаментов, Влияя на свойства филамента, эти вариабельные участки определяют не только его способность к самосборке, но и то, как он будет взаимодействовать с другими компонентами клетки (например, с микротрубочками и плазматической мембраной). Это совершенно иная стратегии чем в случае двух других важнейших элементов цитоскелета - актиновных филаментов и микротрубочек; как мы уже знаем, эти полимеры в основном инвариантны по структуре, а к выполнению различных функций они приспосабливаются с помощью разных наборов актин-связывающих белков и белков, ассоциированных с микротрубочками. Таким образом, роль вариабельных участков в белках промежуточных филаментов та же, что и у вспомогательных белков актиновых филаментов и микро-трубочек, - разница лишь в том, что одни ковалентно связаны с субъединицами филамента, а другие представляют собой отдельные молекулы.
Заключение
Промежуточные филаменты (ПФ) - это полимеры, по структуре подобные канатам, собранным из нитевидных полипептидов. По- видимому, они поддерживают структуру клеток или противостоят растягивающим нагрузкам. Существует много тканеспецифических форм ПФ, построенных из различных полипептидов: кератиновые филаменты эпителиальных клеток, нейрофиламенты нейронов, глиальные филаменты астроцитов и шванновских клеток, десминовые филаменты мышечных волокон и виментиновые филаменты фибробластов и клеток многих других типов. Отдельное семейство белков ПФ составляют ядерные ламины, из которых построена волокнистая пленка (ламина), выстилающая изнутри оболочку ядра; они имеются во всех эукариотических клетках.
Полипептиды, входящие в состав промежуточных филаментов различных типов, различаются по аминокислотной последовательности, а также - и очень сильно - по молекулярной массе. Однако у всех имеется гомологичный центральный домен, который при димеризации белка образует жесткую структуру из обвивающих друг друга спиралей. Такие димерные субъединицы складываются в большие пучки «внахлест», формируя промежуточные филаменты. Стержневидные домены субъединиц при этом создают структурную сердцевину ПФ, а глобулярные домены на обоих концах выступают наружу и обусловливают разнообразие свойств ПФ. Именно благодаря этой вариабельности механические свойства ПФ и взаимодействия их с другими клеточными компонентами приспособлены к специфическим нуждам клеток того или иного типа.