Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Внутриклеточная сортировка макромолекул и сохранение клеточных компартментов
Эндоплазматический ретикулум
Все эукариотические клетки имеют Эндоплазматический ретикулум (ЭР). Его чрезвычайно извилистая мембрана обычно составляет более половины общего количества клеточных мембран (см. табл. 8-2). Полагают, что хотя мембрана ЭР имеет многочисленные складки и изгибы, пронизывающие всю цитоплазму, она образует непрерывную поверхность, ограничивающую единое внутреннее пространство. Это внутреннее пространство, называемое полостью ЭР, часто занимает более 10% общего объема клетки (см. табл. 8-1). Полость ЭР отделяется от цитозоля одиночной мембраной (мембраной ЭР), служащей связующим звеном между этими двумя компартментами. Наоборот полости ЭР и каждой цистерны аппарата Гольджи отделены друг от друга двумя мембранами и цитозолем, поэтому транспорт макромолекул между этими органеллами осуществляется при помощи транспортных пузырьков (рис. 8-36), ЭР играет важнейшую роль в клеточных биосинтезах. На мембранах ЭР начинается синтез трансмембранных белков и липидов ЭР, аппарата Гольджи, лизосом и плазматической мембраны. Здесь же производится большинство липидов для мембран митохондрий и пероксисом (см. разд. 8.6.14). Кроме того, все вновь синтезированные белки, независимо от их места назначения (полость ЭР, аппарат Гольджи, лизосомы или внеклеточное пространство), сначала поступают в полость ЭР. Так как ЭР служит отправной точкой для синтеза всех секретируемых белков, он также является местом, где начинается формирование внеклеточного матрикса.
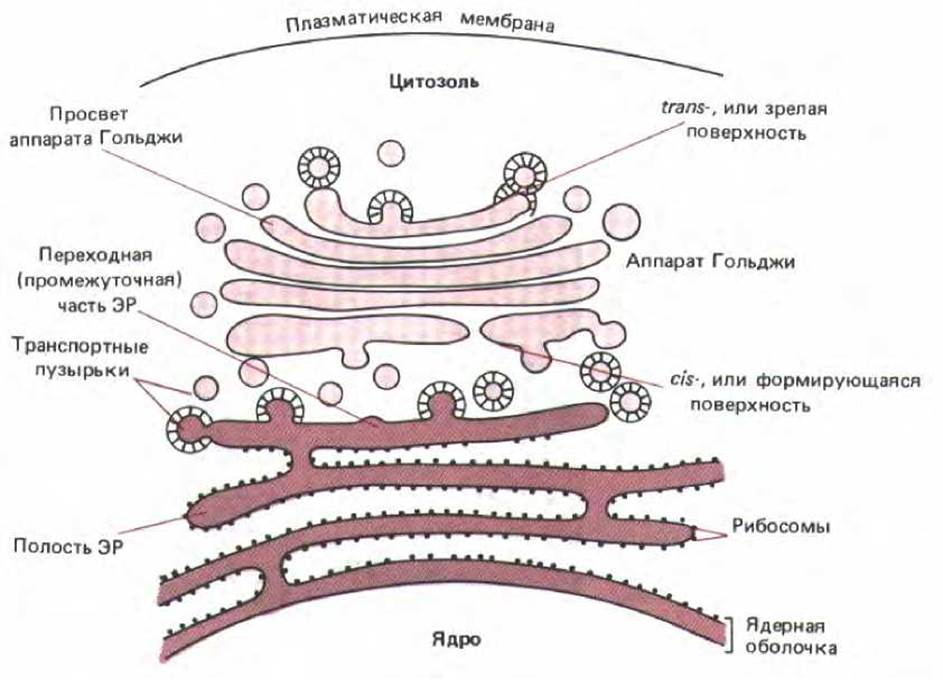
Рис. 8-36. Связь полости ЭР с другими внутриклеточными компартментами, с которыми ЭР контактирует. Просвет ЭР отделен как от ядра, так и от цитозоля всего одной мембраной, тогда как от собранных в стопку цистерн аппарата Гольджи он отделен двумя мембранами. В большинстве случаев ЭР и аппарат Гольджи можно рассматривать как единую функциональную единицу, части которой связаны с помощью транспортных пузырьков.
8.6.1. Прикрепленные к ЭР рибосомы определяют границы его гранулярных (шероховатых) областей [32]
ЭР удаляет некоторые белки из цитозоля сразу после их синтеза. Это белки двух типов: 1) трансмембранные, которые лишь частично переносятся через мембрану ЭР и остаются заключенными в нее, и 2) водорастворимые, которые полностью переносятся через мембрану ЭР и освобождаются в его полость. Трансмембранные белки предназначены для плазматической мембраны или для мембран других органелл, а водорастворимые направляются либо в полость органелл, либо секретируются. Все эти белки переносятся через мембрану ЭР с помощью одного и того же механизма и одного и того же вида сигнального пептида.
В клетках млекопитающих импорт белков в ЭР начинается еще до того, как полипептидная цепь полностью синтезирована, т. е. он происходит одновременно с трансляцией (котрансляционно). Этим он отличается от импорта в митохондрии, хлоропласты, ядра и пероксисомы, который является посттрансляционным и требует различных сигнальных пептидов. Так как белок переносится внутрь ЭР сразу после образования полипептидной цепи, рибосомы, на которых происходит его синтез, должны быть прикреплены к мембране ЭР. Области ЭР, покрытые связанными с мембраной рибосомами, называют гранулярным (шероховатым) эндоплазматическим ретикулумом (рис. 8-37).
Таким образом, в цитоплазме имеется две пространственно изолированные популяции рибосом. Одни из них (связанные с мембраной рибосомы) расположены на обращенной к цитоплазме поверхности мембраны ЭР и заняты синтезом белков, которые сразу же переносятся внутрь ЭР. Другие (свободные рибосомы) не прикреплены ни к какой мембране и производят все остальные белки, кодируемые ядром. Связанные и свободные рибосомы идентичны по строению и функции. Они различаются только по белкам, которые синтезируются на них в каждый данный момент. Если рибосоме достается синтез белка с сигнальным пептидом для ЭР, то такой сигнал направляег рибосому к мембране ЭР. Поскольку с одной молекулой мРНК может связаться много рибосом, обычно образуется полнрибосома, которая прикрепляется к мембране сразу многими растущими полипептидными цепями. Отдельные рибосомы, связанные с такой молекулой мРНК, могут возвращаться в цито-золь, как только они закончат трансляцию вблизи ее З'-конца. Сама мРНК, однако, стремится остаться связанной с мембраной ЭР через меняющуюся популяцию связанных с мембраной рибосом (рис. 8-38). Напротив, если мРНК кодирует белок, не имеющий сигнального пептида для ЭР, то образующаяся полирибосома остается в цитозоле и ее белковый продукт остается там же. Следовательно, с мембранами шероховатого ЭР связываются только те мРНК, которые кодируют белки, несущие сигнальные пептиды ЭР; те же молекулы мРНК, которые кодируют все остальные белки, остаются в цитозоле. Считают, что отдельные рибосомы случайным образом перемещаются между этими двумя различными популяциями молекул мРНК.
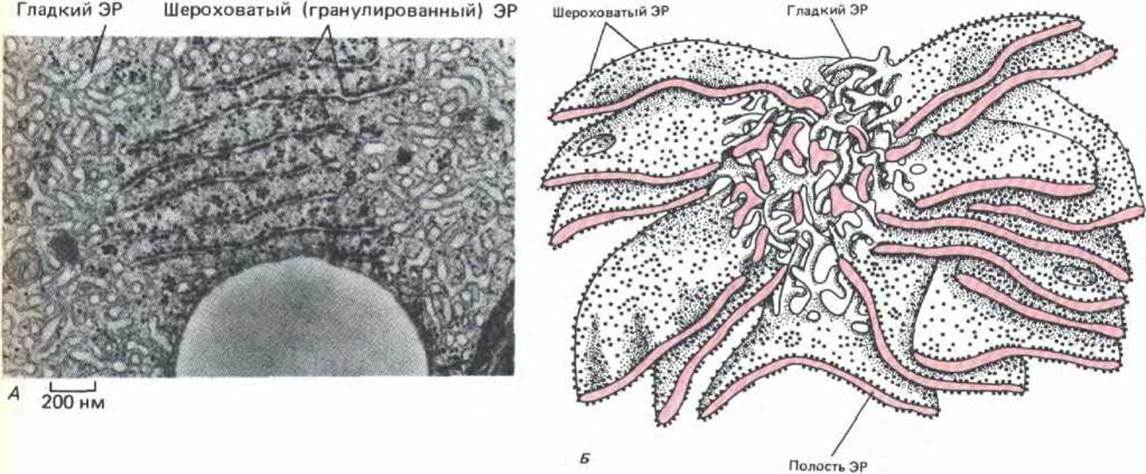
Рис. 8-37. А. Электронная микрофотография, на которой видны значительные различия в морфологии шероховатого и гладкого ЭР. Показанная здесь клетка Лейдига вырабатывает стероидные гормоны в семеннике и имеет поэтому необычно развитый гладкий ЭР. Видна также часть большой сферической липидной капли. Б. Трехмерная реконструкция участков гладкого и шероховатого ЭР в клетке печени. Шероховатый ЭР получил свое название из-за множества рибосом, расположенных на его цитоплазматической поверхности; он образует поляризованные стопки уплощенных цистерн, каждая из которых имеет просвет (полость) шириной от 20 до 30 нм. С этими цистернами соединены мембраны гладкого ЭР, который представляет собой сеть тонких трубочек диаметром от 30 до 60 нм. Считается, что мембрана ЭР непрерывна и ограничивает единую полость. (А-с любезного разрешения Daniel S. Friend; Б- по R. Krstic, Ultrastructure of the Mammalian Cell. New York: Springer-Verlag, 1979.)
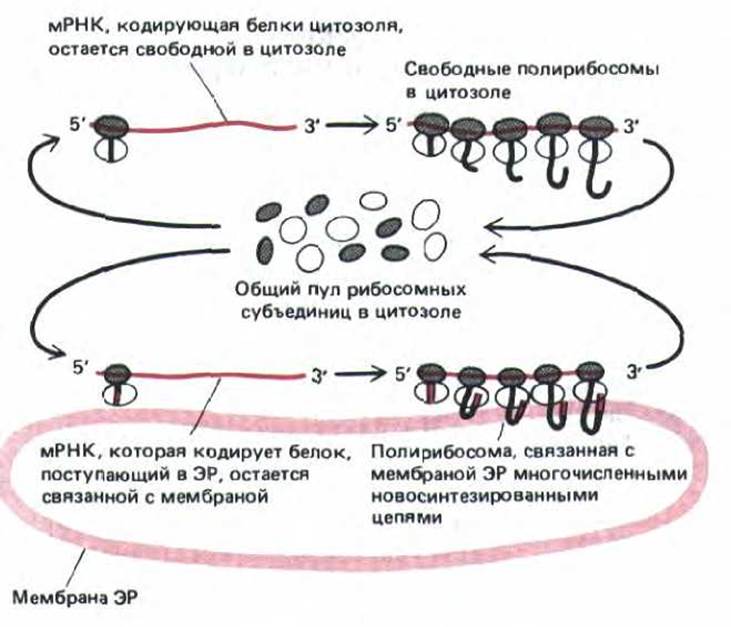
Рис. 8-38. Для синтеза белков цитозоля и белков, поступающих в ЭР, используются одни и те же рибосомы. Если на вновь синтезированной молекуле белка имеется сигнальный пептид, то он направляет связанную с этой молекулой рибосому к мембране ЭР. Молекула мРНК может все время оставаться связанной с мембраной ЭР, тогда как рибосомы, движущиеся вдоль нее, постоянно рециркулируют; в конце каждого цикла белкового синтеза субъединицы рибосом освобождаются и возвращаются в общий пул рибосом в цитозоле.
8.6.2. Некоторые специализированные клетки изобилуют гладким ЭР [33]
Участки ЭР, не несущие связанных рибосом, называются гладким ЭР. Как правило, если клетки и содержат настоящий гладкий ЭР, то в очень малых количествах; в действительности большинство областей ЭР частично являются гладкими, а частично-гранулярными. Их называют промежуточным ЭР. Именно от этих районов отшнуровываются транспортные пузырьки, переносящие вновь синтезированные белки в аппарат Гольджи (см. рис. 8-9). Однако существуют специализированные клетки, в которых гладкий ЭР хорошо развит и выполняет особые функции. В частности, гладкий эндоплазматический ретикулум преобладает в клетках, специализирующихся на метаболизме липидов. Например, клетки, синтезирующие стероидные гормоны из холестерола, имеют обширный гладкий ЭР, предназначенный для «расквартирования» ферментов, участвующих в синтезе холестерола и его преобразовании в гормоны (см. рис. 8-37, А).
Еще одним примером клеток, богатых гладким ЭР, являются гепатоциты. Это главное место, где образуются липопротеиновые частицы, предназначенные «на экспорт». Ферменты, синтезирующие липидные компоненты липопротеинов, локализованы на мембранах гладкого ЭР. На этих же мембранах расположены ферменты, катализирующие ряд реакций детоксикации, в результате которых обезвреживаются как лекарственные препараты, так и вредные соединения, образующиеся в процессе метаболизма. Наиболее широко изучены реакции детоксикации, катализируемые ферментами семейства цитохрома Р450. Эти белки используют высокоэнергетические электроны, полученные от NADPH, для присоединения гидроксильных групп к любому из множества потенциально вредных водонерастворимых углеводородов, попадающих в бислой. Другие ферменты на мембране ЭР добавляют затем к этим гидроксильным группам отрицательно заряженные растворимые в воде молекулы (такие, как сульфат или глюкуроновая кислота). После нескольких подобных реакций тот нерастворимый в воде лекарственный препарат (или метаболит), который в противном случае мог бы накапливаться в клеточных мембранах, становится достаточно растворимым, чтобы покинуть клетку и выделиться с мочой. Поскольку один только шероховатый ЭР не может вместить все эти и другие необходимые ферменты, значительная часть мембран гепатоцита в норме представлена гладким ЭР (см. табл. 8-2).
Если в кровоток попадают большие количества некоторых соединений, таких, как фенобарбитал, то в печени в необычно больших количествах синтезируются ферменты детоксикации, и поверхность гладкого ЭР может за несколько дней удвоиться. После удаления лекарственного вещества избыток мембран гладкого ЭР разрушается с помощью лизосом (при участии особых образований, называемых аутофагосомами - см. разд. 8.8.3), и через 5 дней гладкий ЭР приобретает нормальный объем. Как регулируются все эти изменения, неизвестно.
Мышечные клетки имеют специализированную, подобную гладкому ЭР, органеллу, называемую саркоплазматическим ретикулумом, которая захватывает из цитозоля Са2+. Основной мембранный белок саркоплазматического ретикулума-Са2+-АТРаза, накачивающая внутрь ионы Са2+. Быстрое сокращение и расслабление миофибрилл в каждом цикле мышечного сокращения опосредуется высвобождением Са2+ из саркоплазматического ретикулума и затем повторным захватом его из цитозоля. Захватывающие Са2+ органеллы меньшего объема имеются в большинстве эукариотических клеток, где они высвобождают Са2+ в цитозоль в ответ на внеклеточные сигналы. Раньше считалось, что они являются частью ЭР, но теперь кажется более вероятным, что это самостоятельный мембранный компартмент неизвестного происхождения.
Перейдем теперь к обсуждению двух основных функций ЭР: синтеза и модификации белков и синтеза липидов.
8.6.3. Гранулярные и гладкие области ЭР могут быть разделены центрифугированием [34]
Чтобы изучать функции и биохимию эндоплазматического ретикулума, необходимо сначала отделить его мембраны от других компонентов клетки. На первый взгляд эта задача кажется невыполнимой, поскольку ЭР как бы прослаивает все другие компоненты цитоплазмы (см. рис. 8-35). К счастью, когда ткани или клетки разрушают гомогенизацией, ЭР распадается на множество мелких («100 нм в диаметре) замкнутых пузырьков, называемых микросомами, которые относительно легко очистить.
Микросомы, полученные из гранулярного (шероховатого) ЭР, усеяны рибосомами и называются шероховатыми микросомами. Рибосомы всегда расположены на их внешней поверхности; это свидетельствует о том, что пространство внутри микросом с биохимической точки зрения эквивалентно полости ЭР (рис. 8-39). В таких гомогенатах обнаруживается также множество пузырьков, сходных по размерам с шероховатыми микросомами, но лишенных рибосом. Такие гладкие микросомы образуются частично из гладких участков ЭР, частично - из фрагментов плазматической мембраны, аппарата Гольджи, эндосом и митохондрий (соотношение их зависит от ткани, из которой получают фракцию микросом). Таким образом, если шероховатые микросомы можно отождествить с шероховатым ЭР, то происхождение гладких микросом нельзя установить с такой же легкостью. Исключением является печень. Так как в гепатоцитах содержится чрезвычайно много гладкого ЭР, источником большинства гладких микросом в гомогенатах печени служит гладкий ЭР.
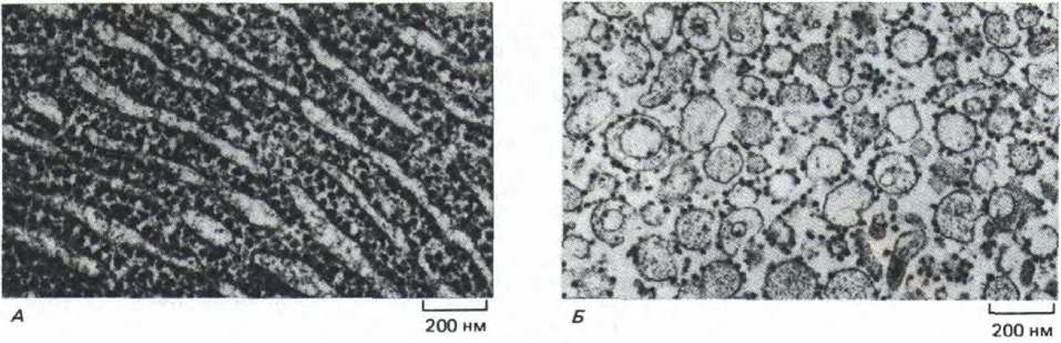
Рис. 8-39. Когда клетки разрушают гомогенизацией, цистерны шероховатого ЭР (А) распадаются на маленькие замкнутые пузырьки, называемые шероховатыми микросомами (Б). Сходным образом, гладкий ЭР распадается на маленькие пузырьки, лишенные рибосом и называемые гладкими микросомами. (А-электронная микрофотография любезно предоставлена Daniel S. Friend; электронная микрофотография любезно предоставлена George Palade.)
Рибосомы, содержащие большое количество РНК, придают шероховатым микросомам большую плотность по сравнению с гладкими. Поэтому гладкие и шероховатые микросомы можно отделить друг от друга путем седиментации их смеси в градиенте плотности сахарозы (рис. 840). Если сравнить шероховатые и гладкие микросомы печени по таким параметрам как ферментативная активность или полипептидный состав, они окажутся чрезвычайно схожими (но не идентичными). Отсюда следует, что большинство компонентов мембраны ЭР может свободно перемещаться между ее гладкими и шероховатыми областями, чего и следовало ожидать, принимая во внимание текучесть и непрерывность мембранной системы.
Поскольку шероховатые микросомы легко поддаются очистке и сохраняют при этом свою функциональную активность, они исключительно полезны для изучения множества процессов, происходящих в ЭР.
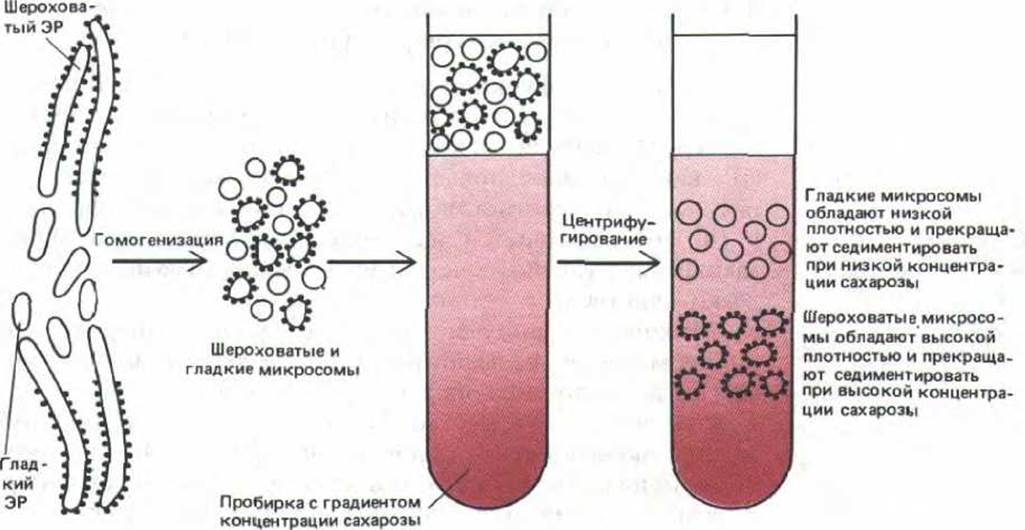
Рис. 8-40. Процедура, используемая для выделения шероховатых и гладких микросом из ЭР.
Эти органеллы топологически устроены таким же образом, как и шероховатый ЭР; их поверхность, обращенная в сторону цитоплазмы, легко доступна для ингредиентов, которые можно добавить in vitro. Для биохимика шероховатые микросомы есть не что иное, как уменьшенный вариант шероховатого эндоплазматического ретикулума, способный к синтезу белка, гликозилированию и синтезу липидов.
8.6.4. Гранулярные (шероховатые) участки ЭР содержат белки, ответственные за связывание рибосом [35]
Поскольку мембрана ЭР, как и все мембраны, представляет собой двумерную жидкость, большинство белков и липидов должно свободно распределяться в ней (при отсутствии специальных ограничений) между шероховатыми и гладкими участками. Тем не менее оказалось, что шероховатые микросомы, выделенные из печени, содержат более 20 белков, отсутствующих в гладких микросомах. Этот факт говорит о существовании определенных ограничивающих механизмов. Некоторые из таких «неравновесных» белков мембраны шероховатого ЭР
помогают связывать рибосомы, другие, вероятно, определяют ее уплощенную форму (см. рис. 8-37). Неясно, каким образом эти белки удерживаются в мембране: образуют ли они большие двумерные агрегаты или взаимодействуют с сетью структурных белков на той или другой поверхности мембраны ЭР (см. разд. 6.2.10).
Рибосомы шероховатого ЭР удерживаются на мембране частично благодаря растущим полипептидным цепям, продвигающимся сквозь мембрану по мере своего синтеза (см. ниже). Однако, если образование полипептидных цепей прерывается под действием какого-либо ингибитора (например, пуромицина), то рибосомы все равно остаются связанными с мембраной шероховатых микросом. Это сродство значительно повышается в растворах с низкими концентрациями солей. Если в таких условиях смешать очищенные рибосомы с мембранами шероховатых микросом, предварительно лишенными рибосом, то такие «ободранные» мембраны вновь приобретают то же количество рибосом, которое было на них после выделения из клеток. Участок связывания с мембраной находится на большой субъединице рибосомы, но до сих пор еще неясно, с каким из многочисленных белков мембраны шероховатого ЭР связывается рибосома. Установлено, однако, что для связывания рибосом с мембраной ЭР в физиологических условиях требуется дополнительное, более специфическое прикрепление, для которого необходим вновь созданный белок, несущий сигнальный пептид.
8.6.5. Впервые сигнальные пептиды были обнаружены в белках, попадающих в ЭР [36]
Сигнальные пептиды (и способ переноса белков с их помощью) были открыты в начале 70-х гг. при изучении секреторных белков, которые перед переносом в аппарат Гольджи и выведением из клетки, попадают в ЭР. Суть эксперимента заключалась в следующем: мРНК, кодирующую секреторный белок, транслировали в системе in vitro. Когда из этой бесклеточной системы исключали микросомы, синтезированный белок оказывался немного больше, чем нормальный секреторный продукт. Избыток длины можно было объяснить наличием N-концевого лидерного пептида. Однако в присутствии микросом, полученных из шероховатого эндоплазматического ретикулума, белок имел нормальный размер. Эти результаты были объяснены с помощью сигнальной гипотезы. Она постулирует, что лидерный участок служит сигнальным пептидом, который направляет секреторный белок к мембране ЭР и затем отрезается специальной протеазой на мембране ЭР еще до того, как полипептидная цепь будет синтезирована полностью (рис. 8-41).

Рис. 8-41. Упрощенная схема переноса белков в ЭР, согласующаяся с исходной «сигнальной гипотезой». Как только на рибосоме синтезируется сигнальный пептид, он направляет рибосому к белку-рецептору на мембране ЭР. Считается, что по мере синтеза полипептидная цепь переносится через мембрану сквозь белковую пору, связанную с этим рецептором. В процессе трансляции сигнальный пептид отрезается, и сразу после синтеза в просвет ЭР высвобождается зрелый белок.
В соответствии с сигнальной гипотезой секреторный белок в процессе его синтеза in vitro должен проникать в полость микросом. Чтобы убедиться в этом, применили протеазную обработку. Оказалось, что вновь синтезированный белок, образованный в отсутствие микросом, при добавлении протеазы деградирует. Тот же белок, синтезированный в присутствии микросом, остается интактным благодаря защите микросомной мембраны. Когда в бесклеточной системе транслировали белки, лишенные сигнального пептида, эти белки не попадали в микросомы и поэтому оставались чувствительными к протеазной обработке.
Сигнальная гипотеза была проверена и в генетических, и в биохимических экспериментах. Доказана ее справедливость и для растительных, и для животных клеток. Эта гипотеза подтверждается и для случая переноса белков через плазматическую мембрану прокариот. Более того, N-концевые лидерные пептиды были обнаружены не только у секреторных белков, но и у предшественников белков плазматической мембраны и лизосом, которые также переносятся с помощью ЭР. Как отмечалось ранее, сигнальная роль этих лидерных пептидов была напрямую продемонстрирована с использованием техники рекомбинантных ДНК при присоединении сигнальных последовательностей к белкам, в норме их лишенных; полученные гибридные белки направлялись в ЭР.
Бесклеточная система для переноса белков in vitro обеспечила мощную экспериментальную базу для изучения молекулярного механизма импорта белков в ЭР.
8-25
8.6.6. Частица, распознающая сигнал, направляет сигнальный пептид ЭР к специфическому рецептору в мембране ЭР [37]
В направлении сигнального пептида к мембране ЭР участвуют 1) частица, распознающая сигнал (a signal-recognition particle, SRP), связывающая сигнальный пептид, и ее рецептор, известный также как стыкующий белок. Частицы, распознающие сигнал, были открыты в ходе экспериментов, которые показали, что отмывка микросом в растворах солей уничтожает их способность импортировать секреторные белки. Эту способность можно восстановить, добавляя супернатант, содержащий солевой экстракт. Впоследствии «фактор переноса» был выделен. Он оказался сложной частицей, состоящей из шести различных полипептидных цепей, связанных с одной молекулой 7SL-PHK (рис. 8-42).
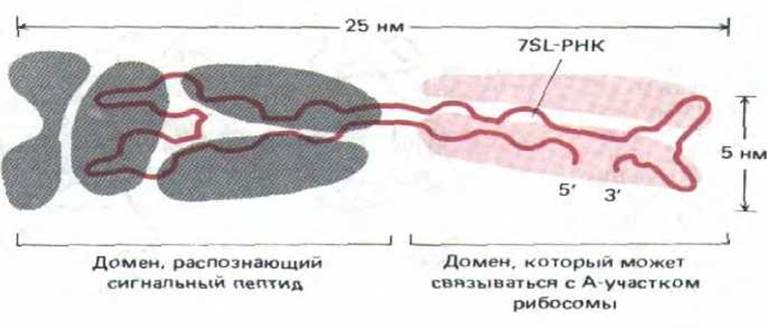
Рис. 8-42. Сильно упрощенная схема частицы, распознающей сигнал (SRP). Она представляет собой вытянутый комплекс, состоящий из шести полипептидных цепей (закрашенные участки) и одной молекулы 7SL-PHK. Один конец этой частицы связывается с рибосомой, а другой-с сигнальным пептидом вновь синтезированной полипептидной цепи. Было сделано предположение, что часть 7SL-PHK может сворачиваться в тРНК-подобную структуру, которая конкурирует в А-участке рибосомы с поступающими аминоацил-тРНК, вызывая, таким образом, паузу в трансляции. (По V. Stegel и P. Walter, Nature 320: W-84, 1986.)
Частица, распознающая сигнал, связывается с сигнальным пептидом, как только он «сходит» с рибосомы. Это приводит к временной остановке синтеза белка, а иногда полностью прерывает его. Возникшая пауза в трансляции, вероятно, дает возможность рибосоме связаться с мембраной ЭР до того, как синтез полипептидной цепи будет завершен. Благодаря этому ненужного высвобождения белка в цитозоль не происходит.
SRP состоит из двух групп белков, соединенных единым РНК-каркасом (см. рис. 8-42). В соответствии с одной из моделей, эта частица плотно захватывает рибосому, присоединяясь и к сигнальному пептиду (как только он появляется на большой субъединице рибосомы), и к рибосомному участку связывания аминоацил-тРНК. В результате трансляция останавливается, поскольку блокируется связывание следующей аминоацил-тРНК с рибосомой (рис. 8-43).
Пауза в трансляции длится до тех пор, пока захватившая рибосому частица не свяжется с SRP-рецептором, находящимся на цитоплазматической стороне мембраны шероховатого ЭР. Рецептор, как и сама частица, был вначале идентифицирован in vitro как необходимый компонент для переноса белка в ЭР. Теперь известно, что это интегральный мембранный белок, состоящий из двух цепей. Он взаимодействует с SRP-связанными рибосомами таким образом, что частица меняет свое положение и трансляция возобновляется. Одновременно рибосома связывается с мембраной ЭР, и растущая на ней полипептидная цепь переносится к системе транслокации в мембране. Эта система изучена плохо, известно только, что она включает белок-рецептор второго сигнального пептида, отличающийся от SRP (см. рис. 8-43). По-видимому, ее роль заключается в связывании рибосомы, на которой синтезировался сигнальный пептид ЭР, с мембраной ЭР; участвует она и в последующем переносе белка через мембрану.

Рис. 8-43. Полагают, что частица, распознающая сигнал, и белок-рецептор SRP действуют согласованно, направляя в ЭР белок с сигнальным пептидом ЭР. SRP связывается с экспонированным сигнальным пептидом и с рибосомой, возможно закрывая А-участок. Поскольку поступление очередной аминоацил-тРНК блокируется, трансляция прерывается. Рецептор SRP в мембране ЭР связывает комплекс SRP-рибосома; затем, в процессе сложной и плохо изученной реакции, SRP удаляется, и трансляция возобновляется, теперь уже на рибосоме, расположенной на мембране ЭР. Для механизма, с помощью которого полипептидная цепь исходно встраивается в мембрану, необходим еще отдельный трансмембранный белок, который связывается с сигнальным пептидом (рецептор сигнального пептида), а также другие белковые компоненты, вовлеченные в перенос и пока как следует не охарактеризованные.
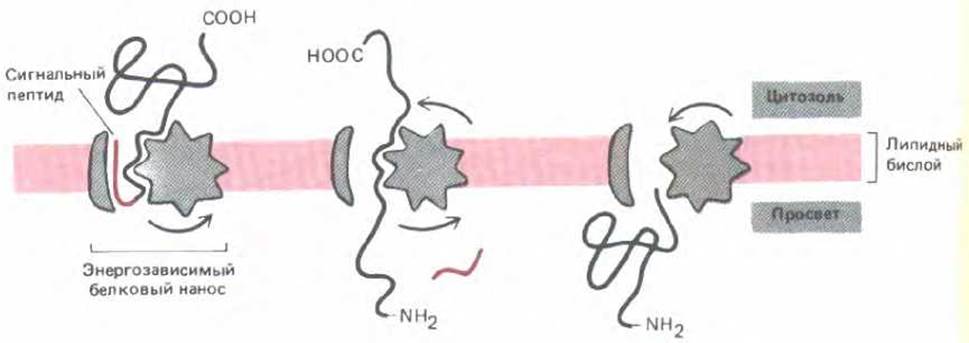
Рис. 8-44. Одно из представлений о транспорте белка через мембрану. После того, как рецептор распознает N-концевой сигнальный пептид, активируется энергозависимый белковый насос, который проталкивает весь белок сквозь мембрану; при этом полипептидная цепь временно разворачивается. Альтернативная возможность состоит в том, что разворачивание белка происходит с цитозольной стороны мембраны и является АТР-зависимым, а белок направляется сквозь мембрану только за счет энергии, высвобождаемой при обратном сворачивании.
8-26
8.6.7. При переносе через мембрану ЭР не всегда продолжается удлинение полипептидной цепи [38]
Выше шла речь о том, что перенос белков в митохондрии, хлоропласти и пероксисомы происходит после трансляции (посттрансляционно), когда белок синтезирован и поступил в цитозоль, между тем перенос через мембрану ЭР протекает одновременно с трансляцией (котрансляционно). Именно поэтому рибосомы связываются с мембраной ЭР, а не с цитоплазматической поверхностью других органелл. В течение многих лет считалось, что рибосомы шероховатого ЭР могут использовать энергию, освобождающуюся при синтезе белка, для «протаскивания» растущих полипептидных цепей сквозь мембрану ЭР. Однако последние исследования in vitro показали, что предшественники некоторых белков могут поступать в ЭР уже после того, как их синтез закончен. Этот перенос требует гидролиза АТР, но не продолжения синтеза белка (рис. 8-44). Считается, что, как и при переносе в митохондрии, гидролиз АТР необходим для разворачивания белка при прохождении его через мембрану. Об этом свидетельствуют как генетические, так и биохимические эксперименты на дрожжах.
Большинство белков-предшественников не могут проникнуть в ЭР, если они синтезировались в другом месте. Либо они сворачиваются таким образом, что маскируется сигнальный пептид, либо аппарат переноса на ЭР оказывается неспособным развернуть данный белок. Возможно, котрансляционный перенос позволяет этим белкам созревать без свертывания их молекулы, что характерно для белков, переносимых в другие органеллы.
8-27
8.6.8. Различные пространственные структуры трансмембранных белков могут определяться комбинациями пептидов, детерминирующих начало и конец переноса [39]
Большинство сигнальных пептидов удаляется специальной сигнальной пептидазой, связанной с мембраной ЭР. Однако само по себе присутствие сигнального пептида еще недостаточно для работы этой пептидазы: необходимо наличие no-соседству сайта разрезания, который не требуется для переноса. Показано, что у некоторых белков сигнальные пептиды расположены внутри полипептидной цепи и никогда не вырезаются.
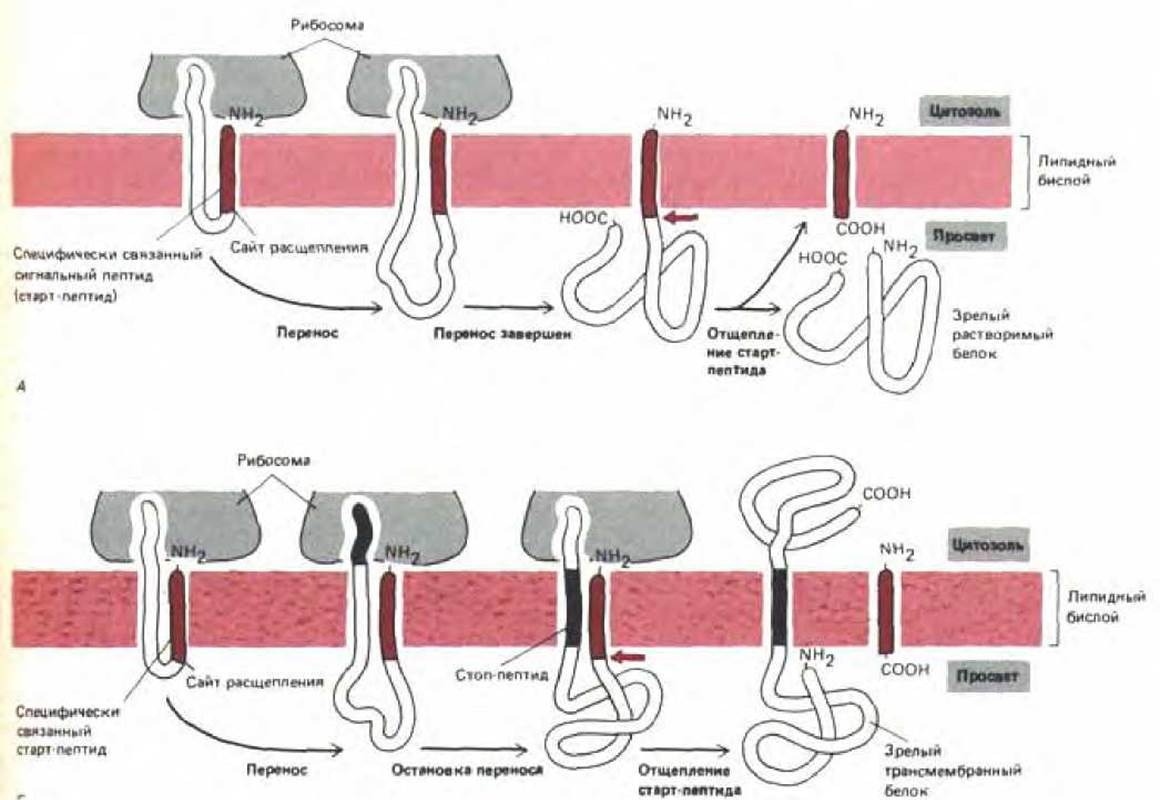
Рис. 8-45. Топология переноса белка через мембрану ЭР, проиллюстрированная для двух простых случаев. Считается, что промежуточный продукт переноса содержит петлю полипептидной цепи, в которой сигнальный пептид (называемый также сигналом начала переноса) формирует половину вертикального участка петли, а вторая половина в каждый данный момент образована переносимым участком полипептида. В случае, когда имеется только старт-пептид, а стоп-пептид отсутствует, полипептид переносится через мембрану целиком, и после отрезания стартового пептида в просвет (полость) ЭР высвобождается зрелый растворимый белок (А). Если имеется один старт-пептид и один стоппептид, перенос прекращается, когда стоп-пептид достигнет вертикального участка петли, в то время как синтез белка с цитозольнои стороны мембраны продолжается; после отрезания сигнала начала переноса зрелый белок остается в мембране, он пронизывает липидный бислой ЭР, и с каждой стороны мембраны выступает по домену (Б).
Полагают, что неудаленные сигнальные пептиды играют важную роль в реализации различных способов встраивания в мембрану, обнаруженных у трансмембранных белков. Все эти способы можно рассматривать как варианты той последовательности событий, в результате которой растворимый белок переносится в полость ЭР. В соответствии с современными представлениями, гидрофобный сигнальный пептид растворимого белка, кроме прочих функций, служит сигналом начала переноса и остается погруженным в мембрану все то время, пока остальная часть молекулы белка протаскивается сквозь нее в виде большой петли (рис. 8-45, А). Когда через мембрану проходит карбоксильный конец молекулы, белок остается связанным с ней только сигнальным пептидом. Следовательно, если этот пептид отрезается, белок высвобождается в полость ЭР.
Для мембранных белков ситуация сложнее, поскольку часть их полипептидной цепи переносится через мембрану, а часть - нет. В простейшем случае такой белок переносится таким же способом, какой только что был описан для растворимых белков (кроме того, что его сигнальный пептид не несет участка разрезания и поэтому не удаляется сигнальной пептидазой). В результате белок становится трансмембранным, пронизывающим мембрану один раз. В мембрану погружен N-конец, на котором сигнальный пептид образует сегмент из 20-30 гидрофобных аминокислот, находящийся в форме а-спирали (см. рис. 8-48, А).
Для трансмембранных белков, пересекающих мембрану один раз, (однопроходные белки) и имеющих в просвете ЭР не С-конец, а N-конец, необходим более сложный механизм переноса. Известно, что у этих белков перенос также инициируется N-концевым сигнальным пептидом, но в молекуле присутствует дополнительный гидрофобный сегмент, останавливающий процесс до того, как вся полипептидная цепь пройдет через мембрану. В таких белках именно этот сигнал конца переноса удерживает белок в мембране, а сигнал начала переноса отрезается (рис. 8-45, Б).
Известно множество белков, полипептидная цепь которых пронизывает липидный бислой несколько раз в противоположных направлениях (многопроходные белки). Полагают, что в таких белках внутренний сигнальный пептид служит сигналом начала переноса, который длится до следующего сигнала остановки. Таким образом, основной единицей при транслокации является полипептидная петля между двумя гидрофобными сегментами (одним пептидом начала переноса и одним останавливающим пептидом). Оба этих сегмента в зрелом белке представляют собой а-спиральные мембраносвязанные домены. Гипотетический механизм, с помощью которого может происходить встраивание такой петли в мембрану, представлен на рис. 8-46. Для сложного трансмембранного белка, у которого липидный бислой пронизывает много гидрофобных сс-спиралей, транслокация должна вновь запускаться вторым стартовым пептидом и продолжаться до тех пор, пока следующий стоппептид не прервет ее, и так далее для последующих старт- и стоп-пептидов (см. рис. 8-48, Г).

Рис. 8-46. Гипотетическая модель встраивания внутренней петли полипептидной цепи в липидный бислой ЭР. Считают, что белок- переносчик может находиться в двух конформациях, «закрытой» и «открытой». Связывая сигнальный пептид начала переноса, он переходит в закрытое состояние и начинает работать как переносчик. Но как только к его участку связывания подходит сигнальный стоп-пептид, он вновь переключается на неактивную, открытую конформацию и отделяется от белка.
8-28
8.6.9. Общую конформацию трансмембранного белка можно предсказать по положению его гидрофобных аминокислот [40]
Обычно пептиды, останавливающие перенос белка через мембрану, более гидрофобны, чем стартовые пептиды, однако, если изменить их положение в белке, иногда они могут выполнять роль старт-сигналов. Отсюда следует, что различие между гидрофобными старт- и стоп-пептидами отчасти определяется местом их расположения в полипептиднои цепи. По-видимому, существует механизм, анализирующий развернутую полипептидную цепь на наличие гидрофобных сегментов в том же направлении, в котором синтезируется белок (от NH2- к СООН-концу). Частица, распознающая сигнал, выявляет первый подходящий сегмент и тем самым устанавливает «рамку считывания». Участок полипептиднои цепи между этим старт-сегментом и следующим за ним стоп-сигналом переноса протаскивается сквозь мембрану (см. рис. 8-46). По-видимому, процесс переноса продолжается до тех пор, пока все гидрофобные участки не встроятся в мембрану.
Такой механизм встраивания в мембрану означает, что топография мембранного белка может быть предсказана по его аминокислотной последовательности. Для этого выявляют участки длиной 20-30 аминокислотных остатков с высокой степенью гидрофобности. Они достаточно длинны, чтобы пронизывать мембрану в виде а-спирали, и для их идентификации можно исследовать профиль гидрофобности (рис. 8-47). На рис. 8-48 представлено четыре варианта топологии белка, реконструированной на основе приведенного анализа.
Мембранные белки всегда встраиваются в ЭР со стороны, обращенной к цитозолю. В результате мембрана ЭР оказывается асимметричной: белковые домены, расположенные с одной ее стороны, отличаются от доменов, расположенных с другой стороны. Эта асимметрия сохраняется при многочисленных отпочковываниях и слияниях мембран, с помощью которых белки, синтезированные на ЭР, доставляются к другим клеточным мембранам (см. рис. 8-10).
Когда белки отделяют от мембраны и заключают в искусственные липидные пузырьки, часть из них оказывается в правильной ориентации, а часть в обратной. Поэтому считают, что асимметрия белков, наблюдаемая в клеточных мембранах, целиком обусловлена процессом встраивания белков в мембрану ЭР.
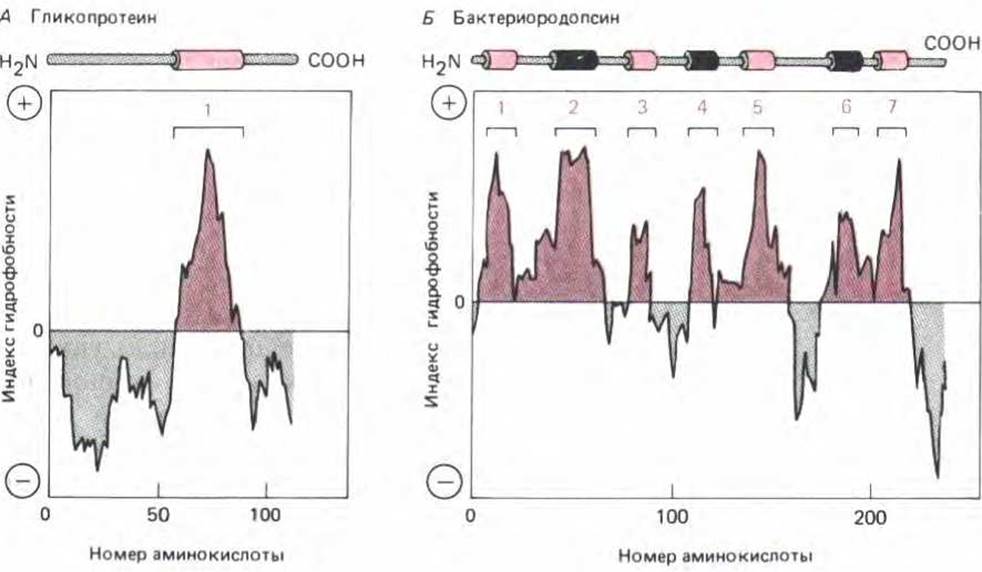
Рис. 8-47. Локализация потенциально гидрофобных (трансмембранных) сегментов полипептиднои цепи с помощью профилей гидрофобности. Свободная энергия, необходимая для переноса последовательных сегментов полипептиднои цепи из неполярного растворителя в воду, рассчитывается по аминокислотному составу с использованием данных по модельным соединениям. Такой расчет делается для сегментов фиксированного размера (обычно около 10 аминокислотных остатков), начиная с каждой последующей аминокислоты в цепи. «Индекс гидрофобности» данного сегмента откладывается по оси Y как функция от его положения в цепи. Положительные значения соответствуют случаю, когда для переноса в воду требуется свободная энергия (т. е. данный сегмент является гидрофобным), а величина пика соответствует количеству требуемой энергии. Пики индекса гидрофобности показывают положение гидрофобных сегментов в аминокислотной последовательности. Здесь приведены два примера: гликофорин имеет единственный трансмембранный гидрофобный домен и один соответствующий ему пик на профиле гидрофобности (А); бактериородопсин содержит семь трансмембранных спиральных участков, которым соответствуют семь пиков на профиле гидрофобности (Б) (С изменениями по D. Eisenberg, Ann. Rev. Biochem. 53: 595-624, 1984.)

Рис. 8-48. Топология мембранного белка определяется чередованием сигнальных стоп- и старт-пептидов. Во всех приведенных примерах сигнальный пептид не отрезается. Гипотетический белок-переносчик, вероятно, функционирует по схеме, изображенной ранее на рис. 8-46. А.
Когда N-концевой сигнальный пептид не удаляется, а стоп-пептид отсутствует, получается мембранный белок с единственным С-концевым доменом, обращенным в просвет ЭР. Б. Когда сигнальный пептид расположен внутри цепи, образуется белок с N-концевым цитоплазматическим доменом и С-концевым доменом, обращенным в просвет ЭР. Б. Когда за внутренним сигнальным пептидом следует стоп-пептид, то получается мембранный белок с тремя отдельными выступающими из мембраны доменами. Г. Мембранный белок, который пронизывает бислой множество раз, может быть образован путем простого удлинения того же самого процесса, включающего чередование сигнальных пептидов и стоп-пептидов, прерывающих перенос белка через мембрану.
8.6.10. Перенесенные в полость ЭР белки сворачиваются вновь [41]
Сворачивание полипептидных цепей в пространстве ЭР представляет собой особую проблему; с ней не сталкиваются белки, сворачивающиеся в цитозоле. Пространство ЭР заполнено непостоянными для этого компартмента сворачивающимися белками, тогда как в цитозоле в основном присутствуют постоянные для него свернувшиеся белки. Когда белок свернут, он имеет гидрофобную сердцевину (см. разд. 3.3.1), но, пока этого не произошло, гидрофобные остатки, из которых состоит сердцевина, обращены к водной фазе. Если в растворе присутствуют даже в низкой концентрации несвернутые полипептидные цепи, они имеют тенденцию агрегировать друг с другом и с другими белками; образовавшиеся агрегаты выпадают в осадок. Вполне возможно, что в такой сложной смеси несвернутых белков, которая имеется в полости ЭР, будут образовываться аморфные и гетерогенные преципитаты.

Рис. 8-49. Так как восстанавливающие агенты, такие, как трипептид глутатион и маленький белок тиоредоксин, присутствуют в высоких концентрациях в цитозоле и отсутствуют в просвете таких органелл, как ЭР, дисульфидные связи могут образовываться в просвете ЭР, но не в цитозоле. Глутатион и тиоредоксин сохраняются в цитозоле в сильно восстановленной форме при помощи ферментов, которые переносят электроны от NADPH, превращая образующиеся дисульфидные связи в цистеины. Представленная здесь трехмерная структура тиоредоксина Е. coli была определена в ходе рентгено-структурного анализа. Она содержит два близко расположенных цистеина, показанных здесь связанными дисульфидной связью.
Известно, что время, которое белок проводит в ЭР перед тем, как попасть в аппарат Гольджи, сильно варьирует. Вероятно, эти различия в большой степени зависят от того, как долго данный белок отделяется от преципитата (переходит в растворимое состояние) и свертывается.
В полости ЭР содержится большое количество связывающего белка (ВіР), который, по-видимому, узнает неправильно свернутые белки, связываясь с их наружными гидрофобными участками. На карбоксильном конце молекулы ВіР имеется сигнальный пептид из четырех аминокислот, благодаря которому белок остается в ЭР (см. табл. 8-3). Существует гипотеза, согласно которой ВІР способствует тому, что неправильно свернутые белки остаются в ЭР (и, следовательно, не попадают в аппарат Гольджи). Возможно, также, что ВіР является одним из катализаторов сворачивания белков. Показано, что этот белок связывает АТР и структурно родствен белкам теплового шока, которые участвуют в импорте белков.
8.6.11. Дисульфидизомераза способствует образованию в полости ЭР правильных дисульфидных связей [42]
В цитозоле содержится смесь восстанавливающих агентов, содержащих SH-группы. Эти вещества предотвращают образование —S—S-мостиков (дисульфидных связей), поддерживая остатки цистеина в цитозольных белках в восстановленной (—SH) форме (рис. 8-49). В полости ЭР таких восстанавливающих агентов нет, и поэтому —S—S-мостики там образуются. При обилии сворачивающихся белков этот процесс, по-видимому, иногда идет неправильно. В полости ЭР имеется фермент, помогающий исправлять такие ошибки. Дисульфидизомераза - это белок, который в большом количестве содержится в полости ЭР и прикреплен к внутренней стороне его мембраны. Он имеет тот же сигнал удержания в ЭР, что и ВіР. Механизм действия дисульфидизомеразы состоит в том, что разрезая S—S-связи, она дает белку возможность быстро поменять множество конформаций, пока не будет достигнута конформация с наименьшей общей свободной энергией (рис. 8.50). На этом этапе вновь синтезированный белок сворачивается правильно. Правильная конформация может быть выбрана и случайно, но Дисульфидизомераза значительно ускоряет процесс поиска.

Рис. 8-50. В просвете ЭР фермент дисульфидизомераза белков многократно разрезает -S-S-связи внутри полипептидной цепи, до тех пор, пока не будет достигнуто их расположение, обладающее минимальной общей свободной энергией. В этих условиях белок сворачивается правильно. Таким образом фермент облегчает сворачивание вновь синтезированных белков, которые попадают в ЭР.
8.6.12. Большинство белков, синтезированных в шероховатом ЭР, гликозилированы с помощью N-связанного олигосахарида [43]
Одна из главных функций ЭР - ковалентное присоединение Сахаров к белкам. Большинство белков, поступивших в полость ЭР, перед тем, как попасть в аппарат Гольджи, лизосомы, плазматическую мембрану или внеклеточное пространство, становятся гликопротеинами (рис. 8-51). Напротив, в цитозоле очень немногие белки гликозилированы, а те, которые гликозилированы, несут различные модификации Сахаров (см, разд. 8.2.2).
Весьма существенным для понимания процесса гликозилирования белков было открытие того факта, что к белкам в ЭР присоединяется всего лишь один олигосахарид, состоящий из N-ацетилгликозамина, маннозы и глюкозы и содержащий всего 14 остатков. Так как этот олигосахарид всегда присоединяется к NН2-группе боковой цепи остатка аспарагина, его называют N-связанным или аспарагин-связанным (рис. 852). Присоединение катализируется связанным с мембраной ферментом, активный центр которого обращен в полость ЭР. Это объясняет, почему белки цитозоля не гликозилируются таким способом. Заранее сформированный предшественник олигосахарида переносится целиком к нужному остатку аспарагина. Это одностадийная реакция, и она происходит практически сразу после того, как остаток аспарагина появится в полости ЭР в процессе переноса белка через мембрану (рис. 8-53). Поскольку большинство белков импортируется в ЭР котрансляционно, N-связанный олигосахарид почти всегда добавляется в процессе синтеза белка, что обеспечивает наилучший доступ к нужным остаткам аспарагина. Сигналами для N-гликозилирования служат две последовательности Asn-X-Ser или Asn-X-Thr (где Х - любая аминокислота, кроме пролина). Они встречаются а гликопротеинах гораздо реже, чем в негликозилированных белках цитозоля. Очевидно, что давление отбора было направлено против этих последовательностей, возможно потому, что гликозилирование в слишком многих участках могло бы помешать сворачиванию белка.
Один осахарид-предшественник удерживается в мембране ЭР молекулой специального липида-долихола. Олигосахарид связан с долихолом высокоэнергетической фосфатной связью, обеспечивающей энергию активации для реакции гликозилирования. Прежде чем присоединиться к белку, олигосахарид строится из моносахаридов на этой связанной с мембраной молекуле липида. Вначале сахара активируются в цитозоле путем образования промежуточных продуктов - нуклеотид-сахаров, которые затем (прямо или косвенно) передают свой сахар молекуле липида в определенной последовательности. Пройдя этот путь, предшественник олигосахарида перескакивает с цитозольной стороны мембраны ЭР в его полость (рис. 8-54). Долихол - это длинная и очень сильно гидрофобная молекула; ее 22 пятиуглеродных остатка могут пронизывать липидный бислой более трех раз, поэтому присоединенный олигосахарид прочно «заякорен» в мембране.

Рис. 8-51. Трехмерная структура мембранного гликопротеина-гемагглютинина вируса гриппа, показывающая расположение в нем ковалентно присоединенных олигосахаридов (выделенные темным атомы). Гликопротеины либо встраиваются в клеточные мембраны, либо выводятся из клеток при секреции; они могут содержать от 1 до 85% углеводов по весу. Некоторые богатые углеводами гликопротеины содержат десятки или даже сотни присоединенных олигосахаридных цепей на молекулу. Пронизывающие мембрану участки этого белка вирусной оболочки, состоящие из трех идентичных полипептидных цепей, могут служить основанием представленной здесь структуры. Они не изображены на рисунке, т. к. этот участок белка отрезается при приготовлении образца для рентгено-структурного анализа. (Фотографию любезно предоставил Richard J. Feldmann.)
Все разнообразие N-связанных олигосахаридных структур возникает в результате модификаций молекулы исходного предшественника. Еще в ЭР у большинства гликопротеинов от олигосахарида отщепляется три остатка глюкозы и один остаток маннозы (см. рис. 8-63). «Доделка» или «процессинг» олигосахарида продолжается в аппарате Гольджи (см. разд. 8.7.1).
Наиболее широко распространены в гликопротеинах N-связанные олигосахариды. Гораздо реже олигосахариды связываются с гидроксильной группой боковой цепи остатка серина, треонина или гидроксилизина. Такие О-связанные олигосахариды образуются в аппарате Гольджи способом, который еще полностью не изучен (см. разд. 8.7.4).
8.6.13. У некоторых трансмембранных белков вскоре после их поступления в ЭР С-концевой трансмембранный участок обменивается на ковалентно связанный фосфолипид инозитол [44]
Как обсуждалось ранее, некоторые ферменты цитозоля катализируют ковалентное присоединение к определенным белкам единичной жирной кислоты (см. разд. 8.2.3). Недавно было обнаружено, что сходный процесс имеет место и в ЭР: карбоксильный конец некоторых белков плазматической мембраны с помощью специфических ферментов ковалентно присоединяется к остатку сахара в гликолипиде. Механизм образования этой связи представлен на рис. 8-55. Установлено, что при этом к белку добавляется гликозилированная молекула фосфатидилинозитола, содержащая две жирных кислоты. Такая модификация обнаружена для большого числа белков плазматической мембраны, включая одну из форм адгезивного белка нейронов и главный белок оболочки трипаносомы. Поскольку оба эти белки связаны с плазматической мембраной только указанным выше способом, в принципе они могут отделяться от клетки в растворимой форме в ответ на сигнал, активирующий специфическую фосфолипазу в плазматической мембране, однако до сих пор подтвердить эту гипотезу экспериментально не удалось.
8.6.14. Большая часть липидных бислоев мембран собирается в ЭР [45]
В мембране ЭР образуются почти все липиды, необходимые для построения новых клеточных мембран, включая фосфолипиды и холестерол. Основной синтезируемый фосфолипид - это фосфатидилхолин (называемый еще лецитином), который может образовываться в три этапа из двух жирных кислот, глицерофосфата и холина (рис. 8-56). Каждый этап катализируется в мембране ЭР ферментами, активные центры которых обращены в цитозоль (именно там находятся все необходимые метаболиты). На первом этапе ацилтрансфераза добавляет к глицерофосфату две жирных кислоты с образованием фосфатидиловой кислоты, соединения достаточно гидрофобного, чтобы остаться после синтеза в липидном бислое. Именно на этом этапе липидный бислой увеличивается. На последующих стадиях формируется «голова» вновь образованной молекулы липида и, следовательно, химическая природа бислоя, но роста мембраны по объему при этом не происходит (см. рис. 8-56). Все основные фосфолипиды мембраны - фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭ), фосфатидилсерин (ФС) и фосфатидилинозитол (ФИ) - синтезируются таким способом.

Рис. 8-52. Структура связанного с аспарагином олигосахарида, который добавляется к большинству белков на внутренней стороне мембраны ЭР. Сахара, выделенные цветом, образуют «сердцевину», или кор, этого олигосахарида. Во многих гликопротеинах после разнообразной «доделки» олигосахарида в аппарате Гольджи в нем остаются от первоначальной структуры только сахара, составляющие кор (см. рис. 8-63). Обратите внимание, что аспарагин находится в последовательности Asp-X-Ser или Asp-X-Thr, где X может быть любой аминокислотой, кроме пролина.

Рис. 8-53. N-связанное гликозилирование белков в ЭР. Почти тотчас после того, как полипептидная цепь попадает в просвет ЭР, она гликозилируется по доступным остаткам аспарагина. Олигосахарид, показанный на рис. 8-52, переносится к аспарагину как целая единица; эту реакцию катализирует связанный с мембраной фермент гликозил-трансфераза.

Рис. 8-54. Синтез липид-связанного олигосахарида, который переносится к остаткам аспарагина на внутренней стороне мембраны ЭР. Этот олигосахарид собирается сахар за сахаром на каркасе из молекулы липида долихола (полиизопреноид-см. схему 2-4). Первый сахар присоединяется к долихолу пирофосфатным мостиком. Эта высокоэнергетическая связь затем активирует олигосахарид для переноса его от молекулы липида к боковой цепи аспарагина. Синтез олигосахарида начинается на цитозольной стороне мембраны ЭР. После того, как промежуточный продукт -липид-MansGlcNAc2 «перепрыгнет» через мембрану, синтез продолжается на внутренней ее стороне. Сокращения: GlcN Ac-N-ацетил глюкозамин, Man - манноза, Glc-глюкоза.
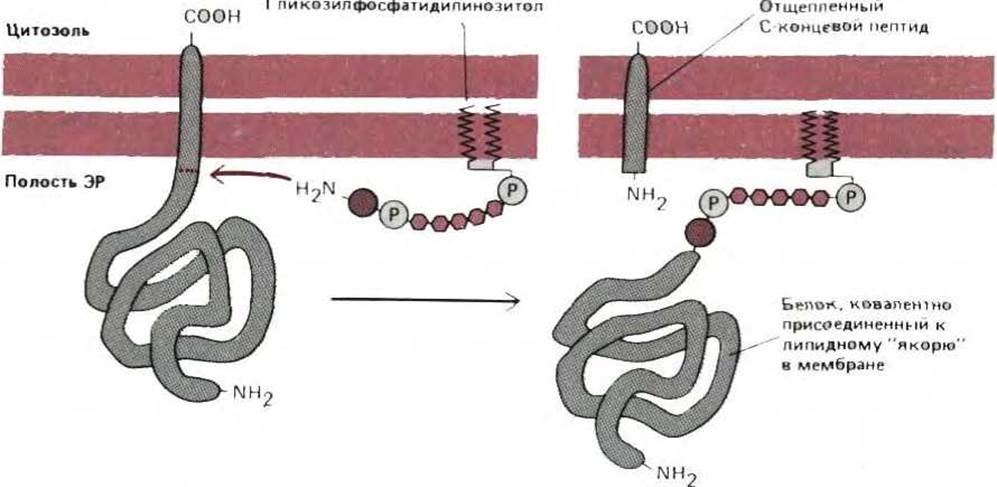
Рис. 8-55. Синтез белков, связанных с мембраной при помощи «якоря» из фосфатидилинозитола. Сразу после завершения синтеза белок остается связанным с мембраной только своим гидрофобным С-концом, состоящим из 15-20 аминокислот, а остальная часть молекулы находится в просвете ЭР. Меньше чем через минуту фермент в ЭР отрезает белок от его мембранной С-концевой части, и одновременно новый карбоксильный конец присоединяется к образовавшемуся ранее интермедиату -гликозилфосфатидилинозитолу. За счет этого ковалентно присоединенного липидного якоря белок остается связанным с мембраной. Все его аминокислоты находятся на внутренней стороне мембраны ЭР, а если белок будет транспортирован к плазматической мембране, они окажутся обращенными во внеклеточное пространство. Точная структура этого гликолипидного головного участка неизвестна.
Как исходное образование фосфатидиловой кислоты, так и ее последующие модификации с формированием различных типов молекул фосфолипидов происходят в той половине липидного бислоя ЭР, которая обращена к цитозолю. Этот процесс мог бы в конце концов превратить липидный бислой в монослой, если бы не существовало механизма для переноса части вновь образованных молекул фосфолипидов в другую половину бислоя ЭР. В искусственных липидных бислоях липиды не совершают таких «флип-флоп»-переходов. В ЭР же количество фосфолипидов выравнивается с двух сторон мембраны за минуты, что почти в 100000 раз быстрее, чем скорость, рассчитанная для спонтанного «флип-флопа». Полагают, что столь быстрое перемещение поперек бислоя происходит при участии транслокаторов фосфолипидов, которые специфичны для каждого их типа (в зависимости от головной группы). По-видимому, в мембране ЭР имеется транслокатор («флип-паза»), который способен переносить холин-содержащие фосфолипиды (но не этаноламин-, серин- или инозитол-содержащие) из одной половины бислоя в другую. Это означает, что ФХ достигает внутренней поверхности бислоя гораздо легче, чем ФЭ, ФС или ФИ. Таким образом транслокатор отвечает за асимметричное расположение липидов в бислое (рис. 8-57).
Известно, что в ЭР образуются также холестерол и церамид. Церамид экспортируется в аппарат Гольджи, где он служит предшественником двух типов липидов: к одним молекулам церамида присоединяются олигосахаридные цепи с образованием гликосфинголипидов, а к другим - головная фосфохолиновая группа от фосфатидилхолина, и получается сфингомиелин. Таким образом, и гликолипиды, и сфингомиелин в процессе формирования мембран образуются сравнительно поздно. Расположены они исключительно в нецитозольной половине липидного бислоя, поскольку именно там находятся синтезирующие их ферменты.

Рис. 8-56. Синтез фосфолипидов протекает на цитоплазматической стороне мембраны ЭР. Каждый фермент, участвующий в этом синтезе, представляет собой интегральный мембранный белок ЭР, активный центр которого обращен к цитозолю. В цитозоле есть все соединения, необходимые для сборки фосфолипидов. В процессе, изображенном здесь, из комплекса жирная кислота - кофермент А, глицерол-3-фосфата и цитидиндифосфохолина образуется фосфатидилхолин (CDF-холин).
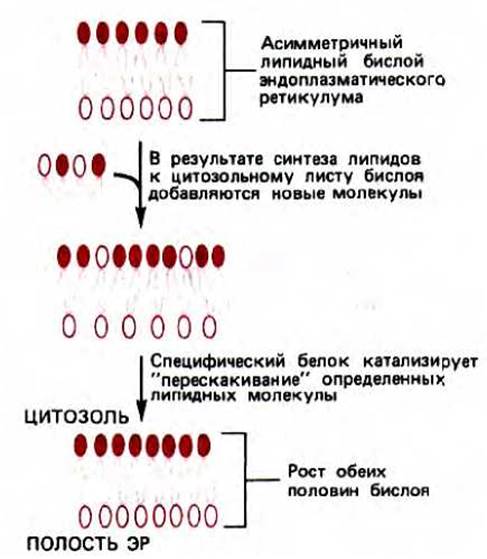
Рис. 8-57. Рост обеих половин липидного бислоя мембраны ЭР требует каталитического «флиппинга» молекул фосфолипидов из одного монослоя в другой. Так как новые молекулы липидов добавляются только к цитоплазматическому монослою и липиды не перескакивают из одного монослоя в другой спонтанно, требуются связанные с мембраной переносчики фосфолипидов («флиппазы»), чтобы переносить определенные молекулы липидов во внутренний слой мембраны. В результате мембрана растет равномерно, как бислой. Поскольку эти ферменты избирательно узнают и переносят только некоторые типы липидов, в ЭР образуется асимметричный бислой. В частности, внутренний слой (из которого образуется внешняя половина бислоя плазматической мембраны) обогащен фосфатидилхолином.
8-29
8.6.15. Белки-переносчики фосфолипидов могут доставлять их из ЭР в митохондрии и пероксисомы [46]
Плазматическая мембрана, мембраны аппарата Гольджи и лизосом - это части мембранной системы, связанной с ЭР с помощью транспортных пузырьков, поставляющих в нее и белки, и липиды. Митохондрии и пероксисомы не принадлежат к этой системе и нуждаются в других механизмах для импорта белков и липидов мембран. Мы уже убедились в том, что большинство белков этих органелл доставляется из цитозоля посттрансляционно. Хотя некоторые липиды модифицируются в митохондриях, сами митохондрии все равно должны получить их либо прямо из ЭР, где они синтезируются, либо через другие клеточные мембраны.
В экспериментах in vitro было показано, что специальные водорастворимые белки обладают способностью переносить индивидуальные молекулы фосфолипидов от одной мембраны к другой. Эти белки называют белками-переносчиками фосфолипидов (или белками, обменивающими фосфолипиды). Перенос между мембранами осуществляется так: белок «экстрагирует» молекулу фосфолипида из мембраны и отсоединяется от нее, неся в участке связывания прикрепленный липид. Когда этот белок достигает другой мембраны, он стремится «выгрузить» связанную молекулу липида в новый липидный бислой (рис. 8-58). Предполагают, что таким способом переносится в митохондрии фосфатидилсерин, затем он декарбоксилируется, образуя фосфатидилэтаноламин; фосфатидилхолин, по всей вероятности, импортируется в виде интактной молекулы.
Белки-переносчики распределяют фосфолипиды между органеллами случайным образом. В принципе, такой случайный обмен может приводить к транспорту липидов из мембраны, богатой липидами, к мембране, обедненной ими, при этом молекулы фосфатидилхолина и фосфатидилсерина переносились бы из ЭР, где они синтезируются, в мембрану митохондрий и пероксисом. Возможно, митохондрии и пероксисомы являются единственными в цитоплазме «обедненными липидами» органеллами, и такого «случайного» переноса достаточно, хотя наличие специфических механизмов переноса фосфолипидов в эти органеллы тоже вполне реально.
Заключение
ЭР служит фабрикой для производства белковых и липидных компонентов многих органелл. Его обширная мембрана содержит множество ферментов биосинтеза. Среди них те, которые ответственны за синтез почти всех клеточных липидов и за присоединение N-связанного олигосахарида к множеству белков. Вновь синтезированные белки, предназначенные как для секреции, так и для самого ЭР, аппарата Голъджи, лизосом и плазматической мембраны, сначала должны поступить из цитозоля в ЭР. В ЭР переносятся только те белки, которые имеют специфические гидрофобные сигнальные пептиды. Сигнальный пептид узнается сигнал-распознающей частицей (SRP), которая связывает новую цепь белка и рибосому и направляет их к белку-рецептору на поверхности мембраны ЭР. Это связывание с мембраной запускает АТР-зависимый перенос, при котором петля полипептидной цепи протаскивается через мембрану ЭР.
Растворимые белки, предназначенные для полости ЭР, секреции или для переноса в другие органеллы, целиком проникают в полость ЭР. Трансмембранные белки, предназначенные для мембраны ЭР или других клеточных мембран, переносятся через мембрану, но не высвобождаются в полость ЭР. Вместо этого они остаются заякоренными в бислое при помощи одного или нескольких пронизывающих мембрану а-спиральных участков полипептидной цепи. Эти гидрофобные участки белка могут выступать в качестве сигнальных пептидов, определяющих начало или конец переноса. Если полипептид содержит множество чередующихся старт- и стоппептидов, он может проходить бислой в противоположных направлениях много раз.
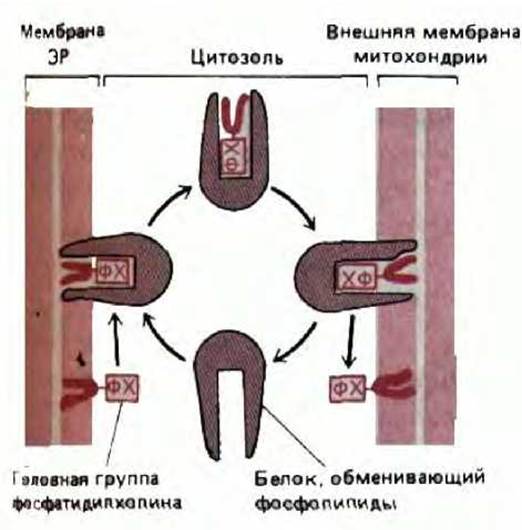
Рис. 8-58. Растворимые белки-переносчики фосфолипидов могут перераспределять фосфолипиды между мембранными органеллами. Фосфолипиды нерастворимы в воде, поэтому их переходы между мембранами требуют белка-носителя. Эти белки переносят одну молекулу фосфолипида за один раз, и могут захватывать молекулу липида из одной мембраны и высвобождать ее в другую. Перенос фосфатидилхолина (ФХ) из ЭР к митохондриям в принципе может протекать спонтанно, потому что концентрация ФХ в мембране ЭР (где он синтезируется) высокая, а во внешней митохондриальной мембране -низкая.
Ассиметрия процессов встраивания белков в мембраны ЭР и их гликозилирования в этих мембранах обеспечивает полярность расположения мембранных белков во всех других органеллах.
8-32