ЭКОЛОГИЧЕСКАЯ МИКРОБИОЛОГИЯ - М. И. Чернявская - 2016
ТЕМА 2. АУТЭКОЛОГИЯ. ВЛИЯНИЕ ФИЗИЧЕСКИХ ФАКТОРОВ СРЕДЫ ОБИТАНИЯ НА ЖИЗНЕДЕЯТЕЛЬНОСТЬ МИКРООРГАНИЗМОВ
В естественных условиях микроорганизмы подвергаются воздействию абиотических факторов, значительно различающихся по своей природе и механизму действия. Тем не менее характер зависимости показателей жизнедеятельности микроорганизмов от уровня различных внешних факторов сходен. Для любого абиотического фактора существует диапазон изменений, в пределах которого показатели жизнедеятельности микроорганизма практически не изменяются, оставаясь на уровне, называемом оптимальным. Данный интервал получил название зона оптимума. Более низкие уровни фактора не обеспечивают полноценное функционирование микроорганизма, ограничивая интенсивность процессов его жизнедеятельности, и соответствующий интервал называют зоной лимитирования. Избыточные уровни фактора подавляют жизнедеятельность микроорганизмов, и этот интервал называют зоной ингибирования. Существуют экстремально высокие и экстремально низкие уровни фактора, при которых жизнедеятельность микроорганизма становится невозможной. Крайние пределы изменений фактора, которые организм способен перенести, принято называть пределами толерантности. Разные микроорганизмы имеют значительно отличающиеся пределы толерантности к одному и тому же экологическому фактору.
В большинстве случаев отношение микроорганизма к тому или иному абиотическому фактору отражают на графике зависимости роста от интенсивности фактора. При этом определяют так называемые кардинальные точки: оптимальное значение (или область значений), обеспечивающее наилучший рост, минимальное и максимальное значения, при которых рост прекращается. Диапазон между минимальным и максимальным значениями составляет область толерантности, в ней (вне зоны оптимума) микроорганизм активен, но имеет низкую конкурентоспособность и может быть вытеснен другими организмами. Область толерантности микроорганизма к определенному фактору может быть узкой или широкой. Организмы с широкими пределами толерантности называют эврибионтами, а организмы, способные существовать в относительно узких пределах изменений экологического фактора, — стенобионтами. Для стенобионтов следует принимать во внимание положение зоны их оптимума на шкале возможных изменений данного фактора. Например, среди стенотермных микроорганизмов различают психрофилы, температурный оптимум которых находится в области низких температур (0 — 4 °С), и термофилы с высокой оптимальной температурой роста (70 °С и выше).
Физико-химические условия обитания микроорганизмов в природе имеют достаточно широкий диапазон. Повсеместно распространенные условия называют обычными, или нормальными, а крайние значения факторов — экстремальными.
Температура — один из важнейших факторов внешней среды, влияющий на микроорганизмы. Действие температуры на рост микроорганизмов обусловлено ее воздействием на скорость химических реакций в клетке и состояние клеточных макромолекул (вязкость мембран, конформация белков и др.). Повышение температуры выше критического уровня ведет к необратимой инактивации клеточных компонентов, в первую очередь денатурации белков и нуклеиновых кислот, и гибели микроорганизма. Для оценки летального эффекта температуры на клетки микроорганизмов используют количественные параметры: термическую точку отмирания (ТТО) — температуру, при которой данный организм погибает за 10 минут, и термическое время отмирания (ТВО) — время, за которое данный организм погибает при определенной температуре. Нижние пределы роста микроорганизмов ограничены температурой «застывания» мембраны, когда она теряет текучесть и перестает выполнять свои функции. При снижении температуры ниже минимального уровня микроорганизмы не погибают и могут в течение длительного времени сохранять жизнеспособность. При пониженной температуре снижается не только скорость роста, но и скорость отмирания микроорганизмов, и, соответственно, увеличивается их выживаемость. Поэтому замораживание микроорганизмов при низкой и сверхнизкой температуре (-20, -70, -196 °С) широко используется для длительного хранения.
Микроорганизмы встречаются в местах с различными температурными режимами. К низкотемпературным местам обитания микроорганизмов относятся регионы Арктики, Антарктики, тундра, глубины океанов, где температура имеет постоянное значение около 4 °С. Высокотемпературные места обитания — гейзеры, вулканические источники, горячие источники, «черные курильщики» (гидротермальные источники срединно-океанических хребтов) — выход вулканических горячих газов на разломах земной коры, где температура при высоком давлении может достигать 360 °С.
По отношению к температуре микроорганизмы подразделяют на несколько групп (рис. 2):
Рис. 2. Кривые роста различных групп микроорганизмов по отношению к температуре

• мезофилы — растут при умеренной температуре. У многих из них температурный оптимум близок к температуре тела теплокровных животных (30 — 37 °С) или немного ниже (20 —25 °С). Максимальная температура роста свободноживущих мезофилов составляет 45 — 50 °С и близка к максимальной температуре нагрева почвы. Большинство известных микроорганизмов являются мезофилами, в том числе излюбленный объект микробиологических исследований Escherichia coli;
• психрофилы — растут при температуре ниже 20 °С, вплоть до отрицательной температуры, оптимальная температура роста у них ниже 15 °С. К психрофильным микроорганизмам можно отнести представителей вида Bacillus psychrophilus, железобактерии рода Galionella. Псих- рофилы обитают в стабильно холодных условиях и чрезвычайно чувствительны даже к незначительному повышению температуры. Одна из причин психрофилии — тепловая денатурация клеточных белков при умеренной температуре (выше 20 °С). Для психрофилов характерен особый состав мембран с пониженной точкой замерзания. Они содержат больше ненасыщенных, короткоцепочечных и разветвленных жирных кислот, и меньше циклических жирных кислот. Температурный оптимум активности ферментов у психрофилов ниже, чем у мезофильных микроорганизмов, а белоксинтезирующий аппарат способен функционировать при низких температурах;
• психротрофы — способны расти при 0 °С, однако по сравнению с психрофилами имеют более высокую оптимальную (20 — 30 °С) и максимальную (35 °С) температуру роста. К данной группе относят представителей некоторых видов Pseudomonas и Arthrobacter. Психротрофы приспособлены к сезонным изменениям климата и имеют селективные преимущества перед стенотермными видами, поскольку метаболически активны и в теплое, и в холодное время года. Многие из них — типичные обитатели холодильников, вызывающие порчу замороженных продуктов. Приспособление психротрофов к пониженной температуре проявляется в изменении состава мембран (увеличение содержания ненасыщенных жирных кислот) и синтезе внутриклеточных криопротекторов (например, глицерола). Другой механизм адаптации связан с накоплением в клетках психротрофов больших количеств жизненно важных ферментов, функционирование которых позволяет клетке поддерживать достаточную активность даже при неоптимальной температуре. Психрофильные и психротрофные микроорганизмы играют важную роль в природных процессах в зоне холодного и умеренного климата. При исследовании метаногенного сообщества тундры группой российских ученых впервые обнаружено переключение трофического маршрута сообщества в зависимости от температуры, обусловленное сменой доминирующей группы микроорганизмов. При температуре выше 15 °С основным конечным процессом в сообществе был метаногенез, а ниже 15 °С — образование ацетата;
• термофилы — микроорганизмы, оптимальная температура роста которых выше 50 °C. В зависимости от «кардинальных» точек температурного диапазона их подразделяют на следующие группы: термотолерантные (температурный максимум — 45 — 50 °С), факультативные (максимум — 50 — 65 °С), облигатные (максимальная температура роста до 70 °С) и экстремальные (оптимальная температура роста — 70 — 75 °С, максимальная — 90 °С) термофилы. Примером термотолерантных микроорганизмов являются бактерии вида Methylococcus capsulatus; факультативных термофилов — гомоферментативные молочнокислые бактерии рода Lactobacillus; облигатных термофилов — представители вида Bacillus stearothermophilus; экстремальных термофилов — бактерии родов Thermus, Thermomicrobium, Thermoplasma. Рекорд выживаемости при повышенной температуре отмечается у архей, отдельные культуры которых растут на питательных средах при температуре выше 110 °C. Например, Methanopyrus kandleri растет при 122 °С — рекордно высокой температуре для всех известных организмов. У термофилов обнаружены высокотемпературные стабильные белки, термостабильные рибосомы, мембранные липиды содержат больше гликолипидов и тугоплавких насыщенных жирных кислот, ДНК и РНК ГЦ-типа. Ферменты термофилов более устойчивы к нагреванию по сравнению с аналогичными ферментами мезофилов, что в большинстве случаев обусловлено изменением первичной структуры белковой молекулы.
Термофильные микроорганизмы имеют огромное практическое значение. Они являются активными продуцентами ферментов, витаминов, органических кислот, кормового белка, используются для биологической очистки бытовых отходов с образованием биогаза.
Гидростатическое давление. Большинство микроорганизмов, живущих на поверхности земли или воды, не подвергаются значительным изменениям давления и растут при давлении около 1 атм. Однако существуют места, где давление значительно отличается от атмосферного. Повышенное давление в природе наблюдается в глубоких нефтяных скважинах (как правило, с высоким содержанием серы) и в глубинных зонах океанов, которые обычно характеризуются низкой температурой и малым содержанием питательных веществ. Микроорганизмы обнаружены в самом глубоком месте Мирового океана — Марианской впадине — при давлении ~1016 атм. Самое высокое искусственно созданное давление, при котором сохраняются микроорганизмы, — 1400 атм.
Повышение гидростатического давления приводит к разрушению клеточных структур и денатурации белков. В условиях повышенного давления клетки микроорганизмов перестают делиться, не расходятся после деления и приобретают нитевидную форму.
По отношению к высокому давлению микроорганизмы подразделяют на следующие группы:
• пьезочувствительные (барочувствительные) — микроорганизмы (обычно с газовыми вакуолями), которые при повышенном гидростатическом давлении перестают расти;
• пьезотолерантные (баротолерантные) — микроорганизмы, выдерживающие давление до 400 атм., способные расти при обычном давлении;
• пьезофильные (барофильные) — микроорганизмы, нуждающиеся для роста в повышенном давлении. Умеренные барофилы выдерживают давление до 850 атм., а экстремальные— выше 1000 атм.
Микроорганизмы подвержены действию различных видов электромагнитных излучений. В зависимости от длины волны электромагнитные излучения подразделяют на ионизирующее (до 10 нм), ультрафиолетовое (10 — 400 нм), инфракрасное (700 — 1100 нм) и видимую область (300 — 700 нм). Излучение может оказывать на микроорганизмы следующее воздействие:
1) физиологическое;
2) летальное и мутогенное;
3) тепловое и механическое.
Физиологическое действие оказывают ближний ультрафиолет, видимый свет и инфракрасные лучи (350 — 400 — 800 — 1100 нм). Инфракрасные лучи проявляют тепловое действие на микроорганизмы и используются зелеными и пурпурными бактериями в процессе фотосинтеза. Видимая часть спектра применяется для фотосинтеза цианобактериями и другими фототрофными бактериями. Разные фототрофные микроорганизмы поглощают свет различной длины волны. Пределы используемого спектра света определяются, с одной стороны, необходимостью наличия энергии для фотохимических реакций, с другой — необходимостью предотвращения деструкции пигментов. Электромагнитные волны важны для проявления фототаксиса. Существуют фотозависимые синтезы и у нефотосинтезирующих микроорганизмов (например, образование каротиноидов у микобактерий). Однако видимый свет и инфракрасное излучение не всегда положительно влияют на микроорганизмы. Под воздействием инфракрасных лучей может происходить перегрев клетки, а видимый свет в аэробных условиях приводит к образованию синглетного кислорода, что вызывает фотоокисление клеточных ферментов. В качестве защиты микроорганизмы синтезируют каротиноиды, служащие «тушителями» синглетного кислорода.
Ультрафиолет в зависимости от длины волны и дозы может оказывать на микроорганизмы летальный или мутагенный эффект. Наибольший летальный эффект УФ-лучей наблюдается при длине волны 260 нм, при которой происходит максимальное поглощение данного излучения молекулами ДНК. Летальное действие ультрафиолета обусловлено в первую очередь изменениями структуры ДНК (разрывом водородных связей, расщеплением связей между дезоксирибозой и фосфатом, образованием циклобутановых димеров тиминовых оснований, располагающихся в одной цепи), приводящими к ингибированию процессов репликации и транскрипции. Тиминовые димеры могут быть устранены двумя путями: фотореактивацией и темновой репарацией. В первом случае повреждения ДНК исправляются одним ферментом, активируемым видимым светом и устраняющим связи между тиминовыми основаниями в димерах. Во втором случае свет не нужен, и работают несколько ферментов: нуклеаза (вырезает поврежденный участок), ДНК-полимераза (синтезирует правильную структуру по комплементарной цепи) и лигаза (восстанавливает фосфодиэфирную связь).
Ультрафиолет с длиной волны 325 — 400 нм также вреден для микроорганизмов, поскольку наряду с формированием тиминовых димеров происходит разрушение триптофана и образование его токсичных фотопродуктов, действующих как химические мутагены. К воздействию ультрафиолета наиболее устойчивы микроорганизмы, в клетках которых содержатся каротиноиды. У гетеротрофных микроорганизмов каротиноиды служат защитной системой, уменьшающей повреждения нуклеиновых кислот, а у фототрофных бактерий они предохраняют бактериохлорофилл от фотоокисления.
При оценке зависимости выживаемости микроорганизмов от дозы УФ-облучения большое значение имеет плотность бактериальной суспензии. УФ-лучи интенсивно поглощаются бактериальной клеткой, поэтому при высокой концентрации клетки могут экранировать друг друга. Последнее обстоятельство не играет существенной роли в бактериальных суспензиях, в которых плотность не превышает 108 клеток/мл. При использовании густой бактериальной суспензии во время облучения ее необходимо постоянно перемешивать. Бактериальную суспензию следует распределять тонким слоем, поскольку УФ-лучи характеризуются низкой проникающей способностью, в силу чего клетки, располагающиеся более глубоко, не подвергаются их воздействию. Выживаемость клеток при действии УФ-излучения зависит от состава среды, используемой для их суспендирования. Облучение лучше всего проводить в буферных растворах. Жидкая полноценная питательная среда поглощает УФ-лучи интенсивнее, чем буферные растворы, поэтому получаемая клетками доза облучения уменьшается. В то же время при облучении в питательной среде могут образовываться токсические продукты, увеличивающие летальный эффект УФ-лучей, что затрудняет интерпретацию результатов. Летальный эффект УФ-лучей зависит от физиологического состояния, прежде всего возраста, бактериальной культуры. Клетки более чувствительны к действию УФ-лучей в экспоненциальной стадии роста.
Ионизирующее излучение — очень короткие волны с высокой энергией. Низкие уровни ионизирующего излучения могут вызывать у микроорганизмов мутации, а высокие почти всегда приводят к гибели. Основные повреждения клеток вследствие ионизирующего излучения включают разрушения водородных связей и кольцевых структур биологических молекул, их полимеризацию. В отличие от УФ-лучей ионизирующее излучение действует на биополимеры не напрямую, а опосредованно, вызывая образование свободных радикалов и органических перекисей, которые реагируют с нуклеиновыми кислотами и белками, приводя к однонитевым и двунитевым разрывам цепей ДНК, изменениям азотистых оснований, окислению сульфгидрильных групп белков в дисульфидные. Присутствие кислорода значительно усиливает действие ионизирующего излучения, вероятнее всего, из-за образования гидроксил-радикалов (ОН•). Микроорганизмы различных таксономических групп существенно отличаются чувствительностью к ионизирующему излучению. Например, бактерии Clostridium botulinum сохраняют жизнеспособность при дозе 1,5 Мрад. Escherichia coli — 0,18 Мрад. Существуют микроорганизмы, выделенные из облученных продуктов, воды атомных реакторов, залежей урановых руд, — Deinococcus radiodurans, Shizosaccharomycespombe, устойчивые к дозе ионизирующего излучения в 2 — 3 Мрад, что объясняется наличием в их клетках мощных репарационных систем, исправляющих повреждения ДНК. Поскольку ультрафиолет и ионизирующее излучение в определенных дозах губительны для микроорганизмов, их используют для стерилизации.
Ультразвук — высокочастотные (~25 кГц) механические колебания упругой среды, не воспринимаемые органами слуха. При воздействии на микроорганизмы ультразвук создает большую разницу в давлении на отдельные части клетки, повреждая ее: разжижается и вспенивается цитоплазма, содержимое клетки смешивается с внешней средой. Чувствительность микроорганизмов к ультразвуку пропорциональна частоте колебаний, длительности воздействия и зависит от структурных особенностей и физиологического состояния клетки. Чем крупнее клетка, тем более она чувствительна к ультразвуку; палочки и извитые формы более чувствительны, чем кокки. При длительном воздействии ультразвука наблюдается полная гибель микроорганизмов, что используется в целях стерилизации. Ультразвук применяют также для разрушения бактериальных клеток с целью извлечения из них биологически активных веществ.
На развитие микроорганизмов оказывает воздействие изменение напряжения магнитного поля. Этот фактор в настоящее время рассматривается как экологический, определяющий протекание многих биологических процессов. Особенно чувствительны к изменению напряжения магнитного поля микроорганизмы, содержащие в клетках магнитосомы.
Следует отметить, что в природе микроорганизмы испытывают влияние не одного, а множества абиотических факторов (температура, свет, давление и др.), поэтому необходимо учитывать взаимодействие факторов друг с другом. Для каждого абиотического фактора, вызывающего необратимые изменения биомолекул большинства микроорганизмов, существует группа высокоспециализированных прокариот, оптимально развивающихся при экстремальных значениях определенного фактора.
Контрольные вопросы
1. На какие физиологические группы по отношению к температуре делят микроорганизмы?
2. Приведите пример низкотемпературных и высокотемпературных мест обитания микроорганизмов.
3. Каков механизм действия на микроорганизмы высокой и низкой температуры?
4. Перечислите морфологические и биохимические особенности термофилов и психрофилов.
5. На какие группы по отношению к гидростатическому давлению делятся микроорганизмы?
6. Перечислите повреждения клеток микроорганизмов, вызываемые повышенным гидростатическим давлением.
7. Какое действие оказывают на микроорганизмы излучения с разной длиной волны?
8. Перечислите основные повреждения прокариотической клетки, вызываемые УФ-излучением, и механизмы их репарации.
9. Назовите основные механизмы повреждающего действия ионизирующего излучения на микроорганизмы.
10. Какие факторы влияют на чувствительность микроорганизмов к ультразвуку?
11. Какие микроорганизмы наиболее чувствительны к изменению напряжения магнитного поля?
12. Приведите пример природного местообитания микроорганизмов, в котором сочетаются экстремальные значения нескольких абиотических факторов.
Лабораторная работа 2. Влияние температуры на рост и метаболизм микроорганизмов
Цель работы: изучить влияние температуры культивирования на рост и метаболизм микроорганизмов разных систематических групп.
Материалы и оборудование: пептонно-дрожжевой агар (ПДА), пептонно-дрожжевой бульон (ПДБ), стерильные чашки Петри, стерильные пробирки, стерильные пипетки на 1 — 2 и 5— 10 мл, автоматический дозатор на 2 — 20 мкл, наконечники на 2 — 200 мкл, микробиологическая петля, стерильные шпильки, спиртовка, термостаты на 4, 10, 18, 28, 37, 42, 55 °С, вортекс, спектрофотометр или фотоколориметр.
Ход работы
1. Продукция красного пигмента (продигиозина) бактериями Serratia marcescens в зависимости от температуры культивирования.
1) Культуру S. marcescens засевают в две пробирки со скошенным ПДА.
2) Одну пробирку помещают в термостат при 28 °C, вторую — при 37 °C, инкубируют в течение 24 — 48 ч.
3) Продукцию красного пигмента (продигиозина) сравнивают при различной температуре культивирования.
4) Результаты записывают в лабораторный журнал, делают вывод о влиянии температуры культивирования на продукцию продигиозина.
2. Определение температурного диапазона и оптимальной температуры роста бактерий.
1) Накануне занятия в 2 мл ПДБ засевают исследуемые культуры бактерий родов Bacillus, Enterobacter, Pseudomonas, Rhodococcus, Serratia, Sarcina. Инкубируют их при 28 — 37 °С в течение 18 ч.
2) В шесть стерильных пробирок вносят по 2 мл ПДБ.
3) По 20 мкл бактериальной культуры, тщательно перемешанной на вортексе, вносят в пробирки с ПДБ. Исходная концентрация клеток в каждой из 6 пробирок должна быть одинаковой для объективной оценки скорости роста бактерий при различной температуре культивирования.
4) Засеянные пробирки помещают в термостаты с соответствующей температурой (4, 10, 18, 28, 37, 42, 55 °C) и инкубируют в течение 24 — 48 ч.
5) Определяют оптическую плотность культуры при длине волны X = 600 нм (ОП600). За положительный рост принимают значение оптической плотности ОП600 ≥ 0,2.
6) По результатам спектрофотометрических измерений строят график зависимости роста бактериальной культуры от температуры культивирования (рис. 3).
Рис. 3. Зависимость роста исследуемых культур бактерий от температуры культивирования:
— культура 1; ...культура 2; ---культура 3
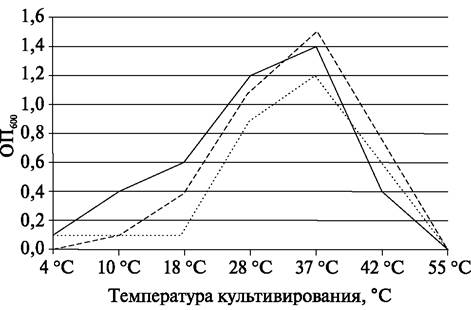
7) Делают вывод о температурном диапазоне и оптимальной температуре роста исследуемых культур бактерий.
3. Определение температурного диапазона роста бактерий.
1) Чашки с ПДА подписывают в соответствии с температурой инкубации (4, 10, 18, 28, 37, 42, 55 °C) и делят на сектора, на каждом из которых указывают название исследуемой культуры бактерий. Перед посевом чашки помещают в термостат с соответствующей температурой на 15 — 20 мин.
2) Бактериальные культуры с помощью бактериологической петли или шпилек засевают на соответствующий сектор чашки Петри.
3) Чашки помещают в термостаты с соответствующей температурой, инкубируют в течение 7 суток.
4) Результаты учитывают ежедневно, сравнивая рост бактерий при разной температуре. Результаты вносят в таблицу (табл. 1).
Таблица 1. Рост исследуемых культур микроорганизмов при разной температуре
Микроорганизм |
Температура культивирования, °С |
||||||
4 |
10 |
18 |
28 |
37 |
42 |
55 |
|
Примечание: «++++» — обильный рост, «+++» — хороший рост, «++» — умеренный рост, «+» — слабый рост, «-» — отсутствие роста.
Лабораторная работа 3. Действие теплового стресса на микроорганизмы
Цель работы: изучить действие экстремально высокой температуры (теплового стресса) на микроорганизмы разных систематических групп.
Материалы и оборудование: ПДБ, ПДА, стерильные пипетки на 1 — 2 мл, микробиологическая петля, шпатель, водяная баня, термометр, спиртовка, термостаты на 28 и 37 °С.
Ход работы
1. Накануне занятия культуры бактерий Bacillus licheniformis, Staphylococcus aureus, Escherichia coli засевают в 10 мл ПДБ и культивируют при 28 — 37 °С в течение 24 ч.
2. Перед началом эксперимента исследуемые культуры (по 0,1 мл) высевают шпателем на чашки Петри с ПДА (контроль).
3. Изучаемые культуры в количестве 2 мл вносят в шесть стерильных пробирок и помещают на водяную баню при 60, 80 или 100 °С (по две пробирки на каждую температуру). Одну из пробирок открывают и помещают в нее термометр для контроля температуры (контрольная пробирка), вторую оставляют для отбора проб (опытная пробирка).
4. Когда температура в контрольной пробирке достигнет необходимого значения, отмечают время начала эксперимента.
5. Через 10, 20, 30 и 40 мин после начала эксперимента из опытной пробирки отбирают пробы (по 0,1 мл) и высевают шпателем на чашки Петри с ПДА.
6. Засеянные чашки инкубируют при 28 — 37 °С в течение 48 ч.
7. Проводят учет результатов (табл. 2), определяют ТТО и ТВО исследуемых бактерий.
Таблица 2. Выживаемость исследуемых культур бактерий при действии теплового стресса
Микроорганизм |
Температура, °С / время инкубации, мин |
|||||||||||
60 °С |
80 °С |
100 °С |
||||||||||
10 |
20 |
30 |
40 |
10 |
20 |
30 |
40 |
10 |
20 |
30 |
40 |
|
B. licheniformis |
||||||||||||
S. aureus |
||||||||||||
E. coli |
||||||||||||
Примечание: «+++» — хороший рост, «++» — умеренный рост, «+» — слабый рост, «-» — отсутствие роста.
Лабораторная работа 4. Действие ультрафиолетового излучения на микроорганизмы
Цель работы: исследовать чувствительность к УФ-излучению микроорганизмов различных систематических групп, определить зависимость выживаемости микроорганизмов от продолжительности УФ-облучения.
Материалы и оборудование: ПДБ, ПДА, физиологический раствор, пипетки на 1 — 2 мл, микробиологическая петля, шпатель, пинцет, стерильные диски плотной бумаги, бактерицидная лампа ДБ-15, термостат.
Ход работы
1. Изучение чувствительности бактерий к УФ-излучению.
1) Накануне занятия культуры бактерий засевают в 5 мл ПДБ и культивируют с аэрацией при 28 — 37 °С в течение 24 ч.
2) Исследуемые бактериальные культуры (0,1 мл) шпателем засевают на чашки Петри с ПДА.
3) На поверхность среды в центре чашки Петри помещают диск плотной бумаги, служащий экраном, защищающим клетки бактерий от воздействия УФ-лучей.
4) Облучение проводят в открытых чашках Петри с помощью бактерицидной лампы ДБ-15 в течение 3 мин на расстоянии 40 см.
5) По окончании облучения диск бумаги снимают стерильным пинцетом, чашки Петри закрывают и помещают в термостат для инкубации при оптимальной температуре.
6) Учет результатов проводят через 24 ч культивирования. Бактериальная культура чувствительна к УФ-свету, если сплошной рост наблюдается только в зоне помещенного диска, а на остальной поверхности среды отмечаются единичные колонии или отсутствие роста.
2. Зависимость выживаемости бактерий от дозы УФ-облучения.
1) Накануне занятия исследуемые культуры бактерий засевают в 5 мл ПДБ и культивируют с аэрацией при 28 — 37 °С в течение 18 ч.
2) Отдельно в колбочку наливают 27 мл стерильного ПДБ и помещают ее в термостат при соответствующей температуре.
3) Бактериальную культуру (3 мл) переносят в колбочку с 27 мл ПДБ и культивируют с аэрацией в течение 2 ч.
4) Клетки бактерий отмывают от питательной среды центрифугированием, ресуспендируют в 30 мл физиологического раствора.
5) По 5 мл бактериальной суспензии переносят в пять стерильных чашек Петри, которые помещают под УФ-лампу на расстоянии 40 см.
6) Чашки Петри открывают, включают УФ-лампу. Начало эксперимента отмечают сразу после включения лампы.
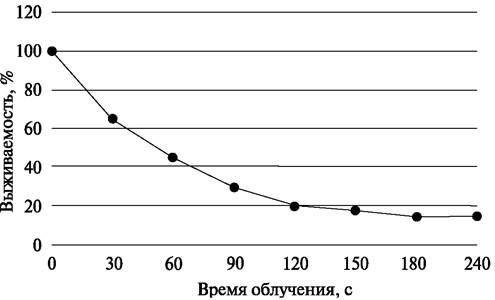
7) Бактериальную культуру облучают заданное время (30, 60, 90, 120 и 240 с), перемешивая содержимое чашек путем легкого покачивания.
8) Для определения количества жизнеспособных клеток из каждой чашки и необлученной суспензии отбирают пробы по 0,5 мл. Вносят в 4,5 мл физиологического раствора и готовят десятикратные разведения.
9) По 0,1 мл из 10-3 — 10-5 разведений бактериальной культуры (в соответствии с табл. 3) высевают на поверхность ПДА в двух чашках Петри.
Таблица 3. Жизнеспособность бактерий при действии УФ-излучения
Время облучения, с |
Разведение |
Количество жизнеспособных клеток, КОЕ/мл |
Выживаемость, % |
0 (контроль) |
10-5 |
100 |
|
30 |
10-5 |
||
60 |
10-4 |
||
90 |
10-3 |
||
120 |
10-3 |
||
150 |
10-2 |
||
180 |
10-2 |
||
240 |
10-2 |
10) Чашки инкубируют при оптимальной температуре в течение 48 ч.
11) Подсчитывают количество сформировавшихся колоний, определяют титр клеток и выживаемость облученных УФ-светом клеток.
12) Результаты вносят в таблицу (см. табл. 3). Строят график зависимости выживаемости бактерий от времени облучения (рис. 4).
Рис. 4. Зависимость выживаемости исследуемых культур бактерий от продолжительности УФ-облучения