Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Нуклеиновые кислоты и белки
Иерархия белковых структур
5.5.1. Первичная структура белка. Первичной структурой белка (рисунок 101(a)) называется последовательность расположения аминокислотных остатков в полипептидной цепи.

Рисунок 101 - Строение белковых структур: а - первичная структура белковой цепи; б - а-спираль; в - ß-структура
Макромолекулы белков состоят из одной или нескольких полипептидных цепей, построенных из аминокислотных остатков. На одном, N-конце цепи находится NH2-гpyппa, на другом, С-конце - группа СООН. Аминокислоты соединяются в полипептид с помощью ковалентных пептидных связей.
Пептидная связь является жёсткой, причем четыре атома, её образующие (H-N-C=0), лежат в одной плоскости (рисунок 102).
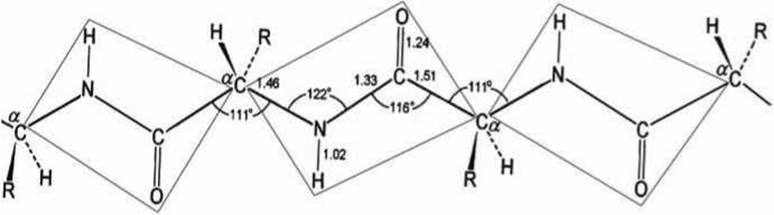
Рисунок 102 - Пептидная связь. Межатомные расстояния даны в ангстремах
Электронная структура пептидной связи имеет характер резонанса, охватывающего все четыре атома пептидной группы и обеспечивающего её жесткость, как если бы все связи имели свойства двойных.
В результате пептидная цепь может относительно свободно вращаться только относительно связей а-углеродов, обозначенных "А" и "В" на рисунке 103.

Рисунок 103 - Резонансы в пептидной связи
Вследствие образования пептидной связи группа H-N становится потенциальным донором водородной связи, а группа 0=С - её акцептором. Наглядно этот процесс можно представить как "перенос" электрона с азота на кислород.
5.5.2. Вторичная структура белка. Вторичной структурой называется упорядоченное строение полипептидных цепей, обусловленное водородными связями между группами С=0 и N-H разных аминокислот.
Жесткость пептидных связей между аминокислотами и топологические отличия в структуре аминокислотных остатков накладывают определенные стерические ограничения на вторичную структуру пептидной цепи.
Торсионные углы вращения вокруг связей N-Cа и Са—С главной цепи, показанные на рисунке 104(a), называют соответственно углами φ и ψ.
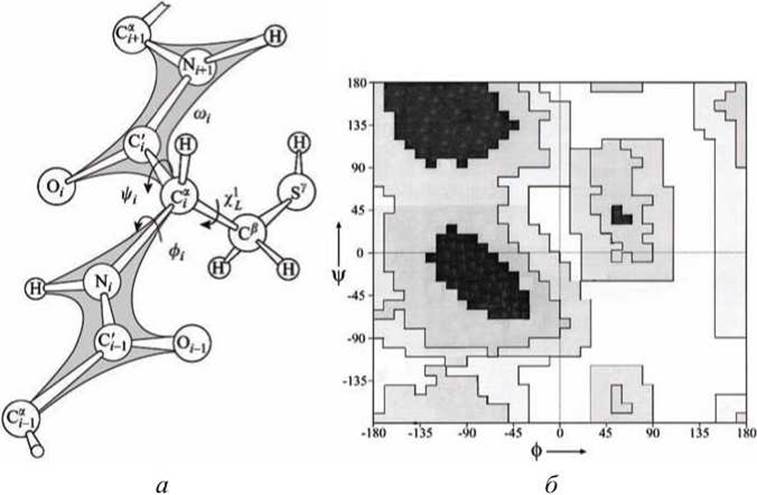
Рисунок 104 - Конформации полипептидной цепи: а - главная цепь полипептида и боковая группа цистеина на ней; б - карта Рамачандрана. Интенсивность окраски пропорциональна "разрешённости" соответствующей комбинации торсионных углов поворота ф и ψ в главной цепи (глубине энергетической "долины")
Стрелки на рисунке указывают направление вращения, ведущее к росту угла поворота ближней к нам части цепи относительно более отдаленной её части.
Для описания стереометрии аминокислотных остатков в белках используют так называемые карты Рамачандрана - геодезическое изображение "разрешённых" и "запрещенных" комбинаций углов ф и ψ для конкретных белковых конформаций (рисунки 104 и 105).
Пример такого "картографического" изображения показан на рисунке 104(6). Если бы не накладывалось никаких ограничений на стереометрию полипептидной цепи, то торсионные углы ф и ψ могли бы принимать любые значения. В этом случае точка, соответствующая конформации того или иного аминокислотного остатка могла бы оказаться в любом месте карты Рамачандрана.
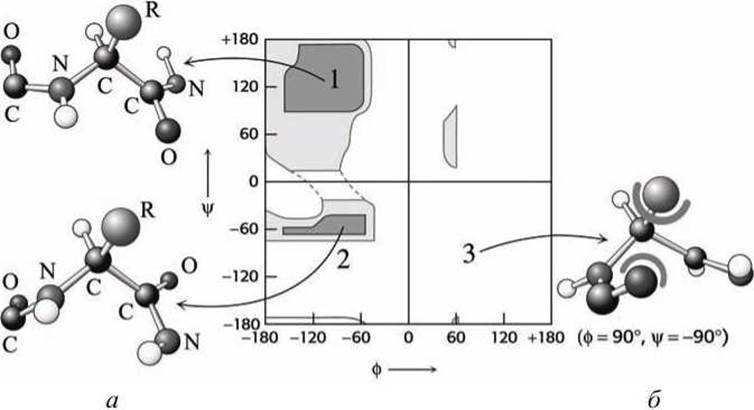
Рисунок 105 - Стерические ограничения в пептидной цепи: а - "разрешённые" конформации; б - "запрещенная" конформация. 1 - ф = -90°, ψ = 120°; 2 - ф = -90°, ψ = -60°; 3 - ф = +90°, ψ = -90°
В действительности допустимы вовсе не любые комбинации углов ф и ψ. Это связано с тем, что при изменении обоих углов изменяется и положение атомов в соседних аминокислотных остатках друг относительно друга.
Сближение в пространстве атомов, особенно объемистых (кислорода, углерода, азота) приводит к их взаимному отталкиванию. Преодоление этого отталкивания требует значительных энергетических затрат, что делает такую конфигурацию полипептидной цепи неустойчивой, а соответствующую конформацию "запрещённой".
Стерические ограничения - тот факт, что два атома не могут быть в одно и то же время в одном и том же месте - существенно уменьшает число возможных комбинаций торсионных углов ф и ψ.
На рисунке 105(a) показаны примеры "разрешённых" конформаций, соответствующих глубоким "долинам" на карте Рамачандрана, а на рисунке 105(б) энергетически невыгодная "запрещённая" конформация, соответствующая "плато" на карте Рамачандрана.
Периодичность чередования пептидных связей существенным образом определяет геометрию образуемых белковых структур. Именно свойства периодичности пептидных связей в аминокислотной цепи и то, каким образом располагаются наружу белковой цепочки атомы водорода и кислорода, определяют существование только ограниченного количества стабильных конформаций белковой цепи.
В частности, две конформации, представленные на рисунке 101, являются стабильными. В них сочетается минимальность длины цепи с максимальностью числа водородных связей между атомами разных пептидных групп.
Первая конформация - это а-спираль (рисунки 101(6), 106 и 108(a)). Цепь свернута в спираль таким образом, что каждый кислород пептидной группы образует водородную связь с атомом водорода пептидной группы, расположенной через три аминокислоты от данной (рисунки 106 и 108(a)).
Карта Рамачандрана для а-спиралей представлена на рисунке 107(a).
Вторая конформация - это ß-структура, образованная несколькими, расположенными параллельно, цепями (рисунок 101(b)). Каждая из цепей вытянута ровно, а стабильность всей ß-структуре обеспечивают водородные связи между цепями, которые могут формировать как параллельные, так и антипараллельные структуры (рисунок 108(б,в)).

Рисунок 106 - Водородные связи в а-структуре
ß-Структуры могут взаимодействовать между собой, образуя целые белковые листы. Карта Рамачандрана для ß-структур представлена на рисунке 49(6). Карты Рамачандрана допускают существование двух типов а-спиралей - как правозакрученных (абсолютно доминируют в белках), так и левозакрученных (практически не встречающихся).
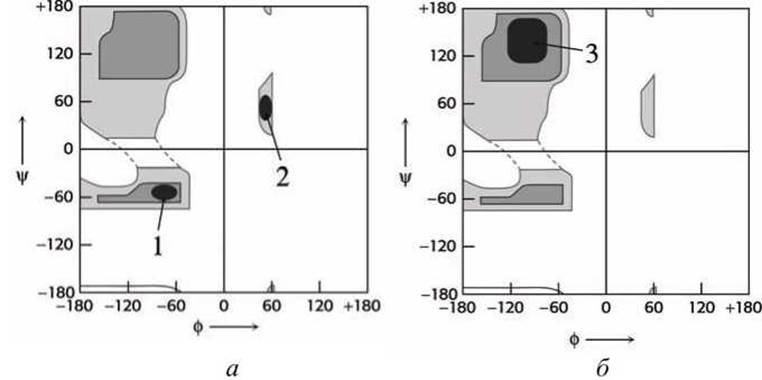
Рисунок 107 - Карты Рамачандрана: а - для а-спиралей; б - для ß-структуры. Цифрами указаны минимумы: 1 - правая а-спираль (основная); 2 - левая а-спираль (редкая); 3 - ß-структура
Левые спирали энергетически менее предпочтительны вследствие дополнительных стерических проблем, возникающих из-за наличия боковых L-радикалов аминокислот.
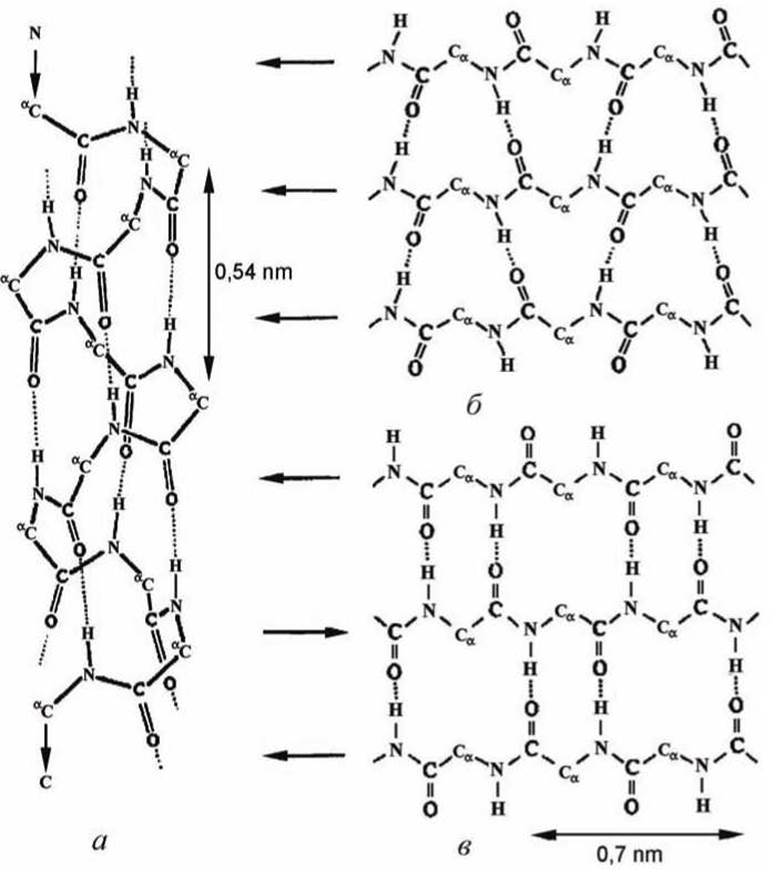
Рисунок 108 - Вторичная структура белков: а - а-спираль; б - параллельная ß-структура; в - антипараллельная ß-структура
а-Спирали образуют достаточно жесткие цилиндрические структуры. На рисунках а-спирали изображаются или как спиральные ленты или как цилиндры, а ß-структуры изображаются как плоские полосы (рисунок 109).

Рисунок 109 - Схематическое изображение вторичных структур: а - а-спирали; б - ß-структуры
Выделяют надвторичные (супервторичные) структуры (элементарные комплексы) - термодинамически или кинетически стабильные комплексы а-спиралей и ß-структур. В глобулярных белках обнаружены, например, (ßxß)-элементыi (два параллельных ß-слоя, соединенных сегментом "х"), складка Россмана (ßaßaß-элемент, который образуют два сегмента a-спирали, вставленные между тремя параллельными ß-цепями) и ß-меандр (слой из трех и более антипараллельных ß-цепей; "Меандр" - это название очень извилистой реки в Греции).
5.5.3. Третичная структура белка. Основой функциональности белка, которая требует точной пространственной организации больших ансамблей аминокислот является третичная структура.
Третичной структурой называют распределение в пространстве всех атомов белковой молекулы.
Стабильность третичной структуры обусловлена четырьмя типами взаимодействиями между радикалами.
1. Ковалентные связи между остатками двух цистеинов (дисульфидные мостики) (рисунок 110).
2. Электростатические (ионные) взаимодействия между противоположно заряженными аминокислотными остатками (три радикала со знаком "+" и два со знаком "-"). Например, положительно заряженная аминогруппа лизина (NH3+) притягивается отрицательно заряженной карбоксильной группой (СОО-) глутаминовой или аспарагиновой кислоты.
3. Водородные связи, в которых участвуют все аминокислоты, имеющие гидроксильные, амидные или карбоксильные группы.
4. Гидрофобные взаимодействия между неполярными радикалами и водным окружением.
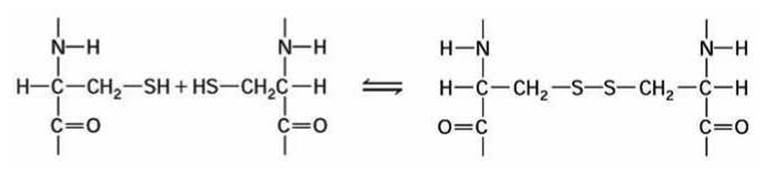
Рисунок 110 - Образование дисульфидного мостика
Некоторые комбинации а- и ß-структур, обеспечивающие функциональную специфичность белков, приведены на рисунке 111.
Третичная структура полностью задается первичной.
Определяющими при образовании третичной структуры являются гидрофобные взаимодействия в силу неизбирательности (неспецифичности) и многочисленности.
Гидрофобное ядро существует у большинства белков. Решающую роль в стабилизации третичной структуры играет увеличение энтропии воды (растворителя) при сворачивании глобулы.

Рисунок 111 - Комбинации а-спиралей, ß-структур и соединяющих белковых нитей определяют топологию белков: (1-5) - комбинации а-спиралей; (6-15) - комбинации ß-структур; (16-20) - a/ß комбинированные третичные структуры белков
Свойственный белкам способ организации пространственной структуры - формирование гидрофобного ядра и мозаичной поверхности, содержащей как гидрофильные, так и гидрофобные элементы, - ограничивает размеры глобулы, поскольку с увеличением её объема труднее сформировать строго гидрофобное ядро. Начиная примерно с молекулярной массы 14-16 кДа, полипептидная цепь формирует два (или более) домена.
Доменами называют области в третичной структуре белка с определенной структурной автономией. Часто структурная автономия доменов дополняется функциональной. Так в ферментах зачастую каталитические домены структурно отделены от регуляторных доменов.
Наличие доменов создает структурные предпосылки для большей внутренней гибкости, динамики, белковых молекул, достигаемой смещением доменов относительно друг друга.
5.5.4. Четвертичная структура белка. Четвертичной структурой белка называется агрегация двух или большего числа полипептидных цепей, имеющих третичную структуру, в олигомерную функционально значимую композицию.
Связи, образующие и поддерживающие четвертичную структуру, те же самые, что и при образовании третичной структуры, кроме гидрофобных.
Четвертичную структуру имеют около половины белков, в том числе гемоглобин, иммуноглобулин, инсулин. Почти все ДНК- и РНК- полимеразы имеют четвертичную структуру. Множество ферментов имеют четвертичную структуру. Примеры белков, имеющих четвертичную структуру, — глобулярный актин (G-актин, рисунок 22) и тубулин (рисунок 26).
Основные функции четвертичной структуры белка.
1. Объединение нескольких взаимосвязанных функций в единой структуре. Например, фермент протеинкиназа А (см. п.6.6.4) состоит из двух субъединиц, одна из которых катализирует перенос фосфата АТФ на белок, а другая является регуляторной.
2. Архитектурная функция. В той же протеинкиназе А зона связывания субстрата образована двумя доменами, которые при взаимодействии с фосфатной группой субстрата сближаются, закрывая его от окружающего растворителя, так что реакция протекает при полном его отсутствии.
3. Обеспечение множественных взаимодействий белка с протяженными структурами. За счет существования четвертичной структуры иммуноглобулины объединяют в одной молекуле два идентичных центра связывания антигена. Кооперативность взаимодействия таких центров с макромолекулярными антигенами, например бактериальными стенками, делает комплексы антиген-иммуноглобулин гораздо более прочными, чем это наблюдалось бы для мономерного белка.
4. Регуляторная функция. Главная функциональная особенность четвертичной структуры, по-видимому, смысл её существования, состоит в том, что относительно слабые взаимодействия между субъединицами, характер которых существенно зависит от третичной структуры каждой из них, особенно удобны для регуляторных воздействий, управления активностью белков. Изменения в третичной структуре какого-либо домена, вызванные его взаимодействием с субстратом или иным лигандом, вследствие относительной слабости междоменных контактов, передаются на зону его контакта с другим доменом, изменяя характер этой зоны. Такое изменение приводит к перестройке всей четвертичной структуры и обеспечивает передачу эффекта от одного домена к другим.
Таким образом, иерархию белковых структур можно изобразить в виде схемы, представленной на рисунке 112.
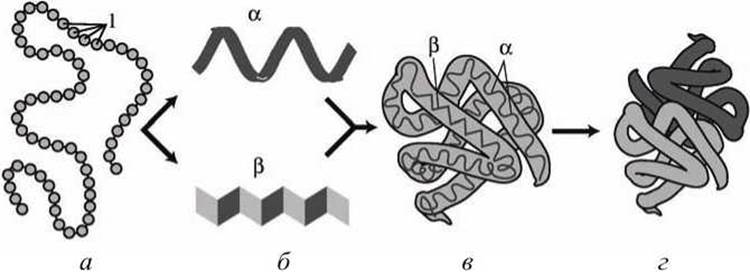
Рисунок 112 - Иерархия белковых структур: а - первичная структура; 1 - аминокислоты; б - вторичные структуры; в - третичная структура; г - четвертичная структура