Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Молекулярные основы функционирования белков
Молекулярное узнавание
Еще до того, как была определена атомная структура первых биомолекул, физик Г.Р. Крейн (H.R. Crane) сформулировал два принципа, в соответствии с которыми должно происходить макромолекулярное узнавание в самоассемблирующихся системах.
Во-первых, для обеспечения высокой специфичности между интерфейсными поверхностями обеих взаимодействующих частей должно образовываться много слабых взаимодействий.
Этот принцип совсем не очевиден. Может показаться, что, наоборот, лучше использовать одну, но сильную связь. Использование одной или нескольких прочных связей, действительно, обеспечит высокую стабильность. Но не обеспечит специфичность. Поскольку одинаковое пространственное расположение всего двух (или нескольких) атомов может быть (случайно) достигнуто для, вообще говоря, произвольной комбинации взаимодействующих частиц, то это увеличивает риск образования случайных неверных комплексов. А вот использование целого массива слабых парных взаимодействий гарантирует специфичность, ибо каждая пара взаимодействующих атомов вносит свой вклад в суммарное взаимодействие, обеспечивая тем самым необходимую силу связи между двумя биомолекулярными объектами.
Во-вторых, взаимодействующие поверхности двух биомолекул должны быть геометрически (топологически) подобны, точнее, должны быть комплементарны друг другу.
Именно такая комплементарность обеспечит правильное взаимное расположение атомов так, чтобы сформировалась система множественных взаимодействий. В биологических молекулах эта комплементарность включает в себя как геометрическую комплементарность, когда выступы на поверхности одной молекулы точно совпадают с впадинами на поверхности другой молекулы, так и "химическую комплементарность", при которой в нужных позициях оказываются именно те атомы и функциональные группы, которые и формируют водородные связи или электростатическое притяжение. Такая комплексная геометрически-химическая комплементарность является важной для реализации специфичности взаимодействий.
Так выступ на одной из поверхностей не только должен точно подходить к впадине на другой, комплементарной, поверхности, но и не даст сформировать связь с поверхностью, у которой нет соответствующей впадины. Добавление одной метальной группы в роли такого выступа на одной из взаимодействующих поверхностей может быть достаточно для того, чтобы исключить связывание макромолекул. Например, метилирование рестрикционных сайтов защищает ДНК бактерий от действия рестрикционных ферментов.
С другой стороны, если по какой-либо причине одна из множества водородных связей не будет сформирована, это не дестабилизирует фатально процесс межмолекулярного связывания. Как правило, белки имеют уникальные интерфейсные поверхности, обеспечивающие связь только с необходимым партнером и исключающие связи с любыми другими конкурирующими молекулами.
Биомолекулы взаимодействуют через развитые интерфейсные поверхности, формируя множественную систему слабых взаимодействий, расположенных вдоль идеально комплементарных поверхностей. В молекулярном узнавании в большинстве случаев используются нековалентные взаимодействия, а ковалентное связывание происходит достаточно редко. Ковалентное связывание используется только при необходимости образования прочных (неразъемных) структур. Вместо ковалентного связывания обычно используется комбинация водородных связей, электростатических взаимодействий между заряженными атомами и гидрофобные взаимодействия.
Два принципа Крейна работают в сотнях исследованных природных системах. Особенно важно учитывать эти принципы при изучении строения и функционирования активных центров ферментов и интерфейсных областей комплементарности таких белков, как иммуноглобулины.
Функционирование практически всех белков обусловлено их способностью связываться, причем с высокой степенью специфичности, с другими молекулами (от простых ионов до макромолекул - белков и нуклеиновых кислот), которые называют лигандами.
Ферменты связываются только со своими субстратами (например, гормональные мембранные рецепторы — со специфическими гормонами).
Связывание белковых факторов со специфическими нуклеотидными последовательностями в молекуле ДНК является основным механизмом регуляции экспрессии генов.
Связывание с лигандами часто вызывает изменение конформации белка, и такой конформационный переход является неотъемлемой составной частью сложного механизма белковой активности.
Специфичностью (specificity’) называется свойство белка связываться преимущественно с данной молекулой.
Сродством (affinity) называется величина, которая характеризует силу связывания белка с лигандом.
Чем точнее "подогнаны" друг к другу лиганд и место связывания лиганда в белковой молекуле как геометрически, так и химически, тем выше специфичность и сродство взаимодействия белка с лигандом.
6.6.1. Антитела. Способность белков различать различные молекулы по-видимому наиболее ярко выражена в антителах (иммуноглобулинах) - белках крови, которые животные вырабатывают в ответ на появление антигенов, таких как инфицирующие агенты (например, бактерии и вирусы) или определенные чуждые вещества (например, белки или полисахариды в пыльце растений) (рисунок 125).

Рисунок 125 - Антитело: а - схема молекулы; 6 - специфичность антител; в - структура антитела; г - В-клетки; 1 - антиген; 2 - Н-цепь; 3 - L-цепь; 4 - CDR
В ответ на появление антигенов организм вырабатывает большое количество антител, каждое из которых может присоединяться к различным определенным выступающим участкам — антигенным детерминантам или эпитопам - антигенов.
Антитела работают как специфические сенсоры для антигенов, образуя комплексы антитело-антиген, которые стимулируют каскад защитных реакций в клетках иммунной системы.
Все антитела имеют Y-образную форму и образованы из двух идентичных "тяжелых" Н-цепей (heavy) и двух идентичных "легких" L-цепей (light) (рисунок 125). Каждая "рука" (arm) молекулы антитела образована одной Н-цепью и одной L-цепью, связанных между собой дисульфидными мостиками. На конце каждой руки расположены шесть полипептидных петель, образующих область связывания антигена - участок комплементарности, CDR (complementery-determinig region), к эпитопу антигена.
Структура и последовательность этих шести петель у разных антител чрезвычайно разнообразна, что обеспечивает высокую специфичность связывания антитела именно с комплементарным антигеном. Взаимодействие CDR антитела с эпитопом антигена является комплементарным во всех отношениях - форма поверхности эпитопа точно совпадает с формой поверхности CDR (рисунок 125(6)), и такой совершенный контакт между поверхностями, стабилизированный системой нековалентных связей, обеспечивает превосходную специфичность связывания антигенов антителами.
Специфичность антител настолько высока, что они могут различать отдельные клетки и, в некоторых случаях, белки, которые отличаются единственной аминокислотой.
Антитела синтезируются белыми кровяными тельцами, называемыми В-лимфоцитами или В-клетками (рисунок 125(г)). Антитела расположены на поверхности этих клеток и являются рецепторами, распознающими специфический антиген.
Связывание этих присоединенных антител данной В-клетки с соответствующим антигеном стимулирует В-клетку к началу размножения и активного синтеза антител, которые выводятся в плазму крови и обладают той же специфичностью, что и "сигнальные" антитела на поверхности В-клетки. Антитела связываются с инфицирующими агентами, затем такие агрегаты либо поглощаются фагоцитами для протеолитической деградации ("клеточного переваривания"), либо деградируют в кровотоке с помощью специфических ферментов.
В процессе размножения В-клеток у антител может происходить модификация центров связывания. Те дочерние клетки, у антител которых центры связывания более эффективны, чаще и прочнее связываются с антигенами и, тем самым, имеют преимущество в дальнейшем росте и размножении. Те же дочерние клетки, центры связывания которых связываются с антигенами слабее, размножаются хуже. Так осуществляется отбор и "подгонка» иммунной системы под ксенобиотики.
Согласно клонально-селекционной теории чрезвычайное разнообразие антител объясняется тем, что в зародышевых клетках представлены не целые гены легких и тяжелых цепей антител, а части, фрагменты этих генов. Там эти части собраны в "кассеты" - отдельно много сортов для каждого из трех фрагментов вариабельного домена тяжелой цепи, отдельно - для легкой цепи; отдельно - константные домены каждой цепи; отдельно - гибкие линкеры, связывающие домены антитела. При образовании соматических иммунных клеток эти фрагменты генов всячески перетасовываются, а кроме того ещё каким-то неизвестным образом мутируют в своих гипервариабельных участках, после чего соединяются в целые гены легких и тяжелых цепей антител.
6.6.2. Моноклональные антитела. В-клетки животного, инфицированного данным антигеном, синтезируют множество различных антител, связывающихся с различными участками (антигенными детерминантами или эпитопами) этого антигена. В большинстве случаев использование такой однородной смеси разных антител не целесообразно, необходимо выделить лишь одно характеристическое антитело. Для этого надо выделить ту единственную В-клетку, которая синтезирует это антитело, и, затем, культивировать её. Однако число актов деления В-клеток ограничено, поэтому не удается синтезировать необходимое количество антител.
В конце 70-х годов XX века эта проблема была решена. В-клетки были соединены с "бессмертными" раковыми клетками. Такие комбинированные клетки можно культивировать, синтезируя нужное количество антител. Такие антитела называются моноклональными антителами, поскольку они произведены клонированием идентичных комбинированных клеток. Сегодня моноклональные антитела могут быть синтезированы для практически любого мыслимого антигена.
6.6.3. Ферменты. В отличие от антител, которые связывают лиганды и просто передают их другим компонентам иммунной системы, ферменты химически изменяют свои лиганды, которые в случае ферментативных реакций называют субстратами.
Ферментом называется белок, который участвует в биохимической реакции и изменяет её скорость, но не входит в состав как исходных веществ, так и продуктов реакции и остается неизменным после завершения химической реакции.
Практически все химические реакции в клетке катализируются ферментами. Также как и неорганические катализаторы, ферменты, поскольку они не входят в состав реагентов, не могут повлиять на движущую силу химической реакции - изменение свободной энергии ∆G в ходе реакции. Они не могут вызвать протекание реакций, для которых в данных условиях ∆G > 0, а могут лишь ускорять реакции в том случае, если ∆G < 0.
Механизм действия ферментов связан с тем, что они образуют промежуточные соединения с субстратами и тем самым изменяют путь реакции, причем новый путь характеризуется меньшей высотой энергетического барьера, т.е. меньшей энергией активации Е'А по сравнению с ЕА в исходной (некатализируемой) реакции (рисунок 126).
Традиционные катализаторы работают в экстремальных условиях — при высоких температурах и давлениях, при экстремальной кислотности среды или в органических растворителях. Ферменты же функционируют в водном растворе при физиологических условиях - температура 37°С, давление 1 атмосфера, pH = 6,5-7,5.
Ферменты характеризуются высокой активностью и высокой специфичностью.
Каталитическая активность фермента характеризует изменение скорости данной реакции при введении в реакционную систему фермента. Колоссальная активность ферментов позволяет им ускорять реакции в 10б-1012 раз, по сравнению со скоростью некаталитических реакций в тех же условиях.

Рисунок 126 - Влияние фермента на величину энергетического барьера
На сегодняшний день известно более 10000 ферментов. Их классификация приведена в Каталоге ферментов (Enzyme Catalog, ЕС) Номенклатурного комитета Международного общества биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology): http://www.chem.qmul.ac.uk/iubmb/enzyme/.
Ферменты обеспечивают не только синтез и деградацию макромолекул, но и клеточную сигнализацию, и трансмембранный транспорт веществ. Большинство ферментов работает в клетке, но есть и ферменты, секретируемые клеткой во внеклеточное пространство для работы в кровотоке, пищеварительном тракте и даже за пределами организма.
Правильность сворачивания (фолдинг) белковой цепи определяется тем, насколько точно радикалы необходимых аминокислот расположатся в пространстве, обеспечивая как однозначную фиксацию молекулы субстрата на ферменте, так и активацию необходимого химического превращения.
В нативной (функциональной) конформации фермента эти радикалы аминокислот формируют активный центр фермента - область ферментативной молекулы, в которой происходит связывание и превращение субстрата (рисунок 127).
Каталитические участки и участки связывания субстрата могут быть как объединены в единую область, так и разнесены пространственно.
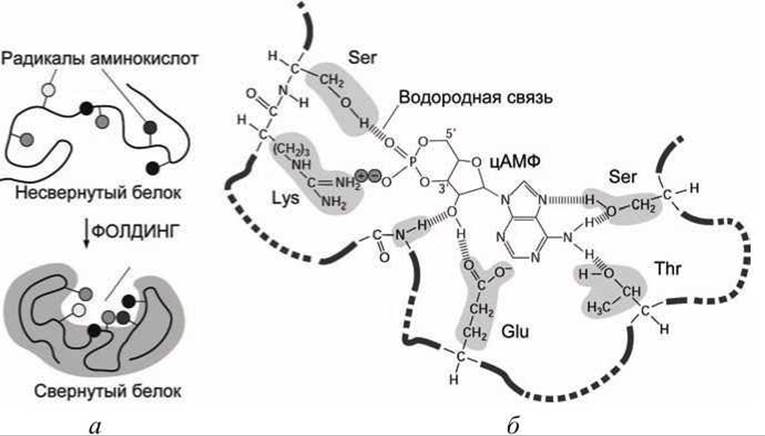
Рисунок 127 - Образование активного центра фермента: а - сворачивание белковой цепи; б - система водородных и ионных связей между ферментом и субстратом (цАМФ)
6.6.4. Протеин-киназа А. В качестве примера рассмотрим работу протеин-киназы А, РКА (protein kinase А) - цАМФ-зависимой протеин-киназы.
цАМФ - циклический аденозин монофосфат, который образуется из АТФ в процессе реакции, катализируемой ферментом аденилатциклазой, и выполняет роль медиатора внеклеточных сигналов в клетке животных (рисунок 128). В нашем случае цАМФ активирует протеин-киназу А.
Протеин-киназа А, как и остальные протеин-киназы, переносит фосфатную группу (фосфорилирует) с АТФ на серин, треонин или тирозин, тем самым изменяя активность необходимых белков, в том числе и в ответ на внешнее воздействие. Все протеин-киназы принадлежат к одному белковому семейству, поэтому структура активного центра и механизм фосфорилирования у них подобны.
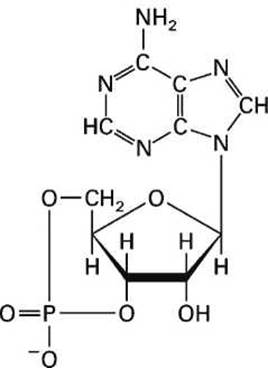
Рисунок 128 - Циклический аденозин монофосфат (цАМФ)
Активный центр протеин-киназы А расположен на каталитической субъединице, построенной из 240 аминокислот, которая называется киназное ядро (kinase core). Киназное ядро, состоящее из двух доменов - большого и малого, разделенных глубокой щелью ("карманом") - связывает АТФ и белок-субстрат и активирует перенос фосфатной группы с АТФ на белок-субстрат. Активный центр формируют аминокислотные остатки обоих доменов киназного ядра.
Адениновое кольцо АТФ точно укладывается в основание щели между двумя доменами и фиксируется там "глициновой крышкой", которая образована последовательностью Gly-X-Gly-X-X-Gly-X-Val (X - любая аминокислота) (рисунок 129).
АТФ является общим субстратом для всех протеин-киназ, однако каждая протеин-киназа распознает специфический белок-субстрат по специфической для него последовательности аминокислот. Для протеин-киназы А такая последовательность: Arg-Arg-X-Ser-Y, где X - любая аминокислота, Y - гидрофобная аминокислота.
Каталитическое ядро протеин-киназы А может принимать одну из двух конформаций - "открытый карман" или "закрытый карман". В "открытой" конформации субстраты могут "погрузиться" в карман и связаться с активным центром.
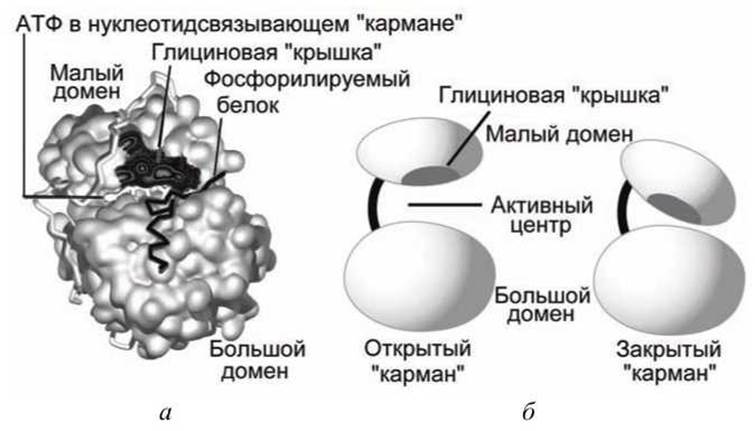
Рисунок 129 - Протеин-киназа А: а - схема киназного ядра; б - конформации киназного ядра
Связывание субстратов стимулирует конформационный переход молекулы фермента, карман закрывается глициновой крышкой и активируется перенос фосфатной группы с АТФ на белок-субстрат.
Это пример механизма "индуцированного соответствия" (induced fit) фермента и субстрата, когда топология активного центра фермента "подгоняется" под топологию субстрата.
Молекулы АДФ и фосфорилированного белка-субстрата теряют сродство к ферменту после фосфорилирования, фермент претерпевает конформационный переход в "открытую" форму, "поднимается" глициновая крышка, карман открывается, и модифицированные субстраты выходят из него. Кинетические исследования показали, что "движение" глициновой крышки представляет собой процесс в 20 раз более медленный, чем перенос фосфатной группы с АТФ на белок.
Ферменты, участвующие в общем метаболическом пути, часто объединяются друг с другом в молекулярные конвейеры, либо связываясь в белковые ассоциаты, либо располагаясь на общем "кронштейне"- носителе, либо объединяясь на генетическом уровне в единый ген, что превращает их в субъединицы одного олигомерного фермента (рисунок 130).
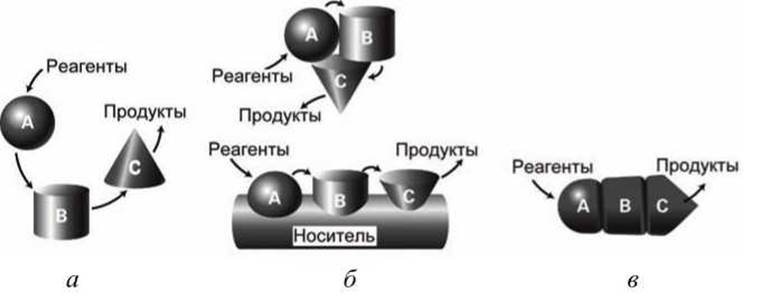
Рисунок 130 - Молекулярные конвейеры ферментов: а - диффузионный механизм работы конвейера; б - образование ассоциатов ферментов или фиксация ферментов на общем кронштейне; в - слияние генов в один общий приводит к синтезу единого олигомерного многофункционального белка