Основы молекулярной биологии - В.И. Резяпкин 2009
Трансляция
Стадии биосинтеза белка
Различают несколько стадий биосинтеза белка: активация аминокислот, инициация, элонгация и терминация. Рассмотрим каждую из них.
Активация аминокислот
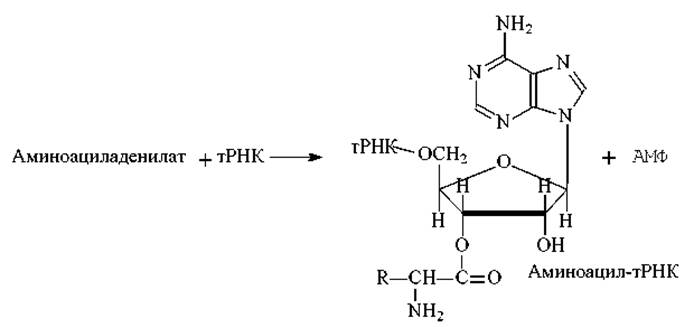
На этой стадии каждая из 20 аминокислот присоединяется к определенной тРНК. Эти реакции катализируются 20 различными ферментами - аминоацил-тРНК-синтетазами. Аминоацил-тРНК-синтетазы обладают тройной специфичностью, они способны узнавать три различных субстрата: АТФ, аминокислоту и тРНК. При этом каждая аминоацил-тРНК-синтетаза узнает только одну определенную аминокислоту и соответствующие ей изоакцепторные тРНК. Эти ферменты присоединяют аминокислотный остаток к 2’- или 3’-гидроксильной группе 3’ - концевого нуклеотида. Реакция протекает в две стадии:
стадия 1
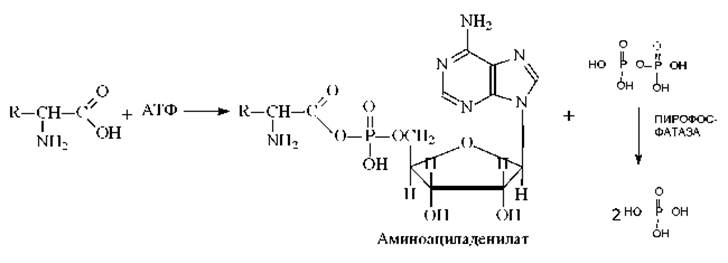
стадия 2
Суммарная реакция активации аминокислоты выглядит так:
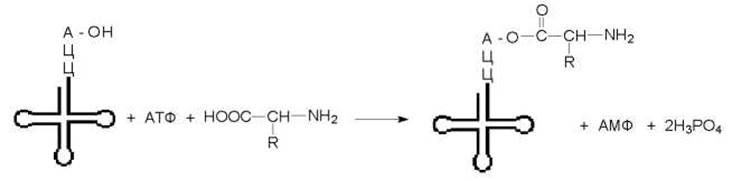
Как видно из схемы на синтез аминоацил-тРНК затрачиваются две богатые энергией фосфатные связи. Одна из них расходуется на образование сложноэфирной связи между аминокислотой и тРНК, а другая (при гидролизе пирофосфата) сдвигает равновесие всей реакции в сторону образования продукта реакции. Энергия сложноэфирной связи достаточна для образования пептидной связи в процессе биосинтеза белка.
Как отмечалось выше аминоацил-тРНК-синтетазы распознают не только свою аминокислоту, но и набор своих изоакцепторных тРНК. От точности такого распознавания зависит точность реализации генетической информации на этапе биосинтеза белка. Аминоацил-тРНК-синтетазы также способны распознавать свои ошибки и вырезать неправильно присоединенный ими же остаток аминокислоты к тРНК, т.е. они обладают корректирующей активностью. Если же аминоацил-тРНК-синтетаза все-таки ошибется, то будет синтезирована аминоа- цил-тРНК с ошибочно присоединенным аминокислотным остатком. Такая аминоацил-тРНК будет участвовать в биосинтезе белка и будет обеспечивать ошибочное встраивание аминокислотного остатка в растущую полипептидную цепь.
Инициация белкового синтеза
Процессы трансляции эукариотической и прокариотической иРНК имеют много общего, но в то же время им присущи и определенные отличия.
Инициирующими аминоацил-тРНК (рис. 6.3) у эукариот является метионил-тРНК (мет-тРНК), у прокариот - формилметионил-тРНК (фмет-тРНК). В митохондриях инициирующей аминокислотой является формилметионин.
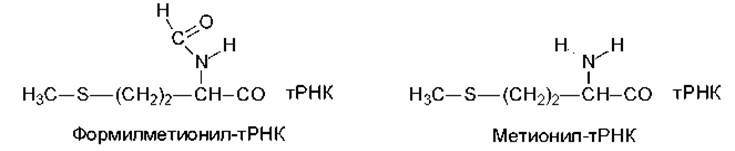
Рис. 6.3. Инициирующие тРНК
Формилметионин и метионин кодируются одним и тем же кодоном АУГ. В процессе синтеза белка эти аминокислоты требуют различные тРНК: формилметионин - тРНКфмет, метионин - тРНКмет. Соответственно для инициации синтеза белка у прокариот используется фмет-тРНКфмет, для встраивания метионина внутрь цепи белка - мет-тРНКмет.
Образование фмет-тРНКфмет у прокариот происходит в две стадии, на первой стадии происходит присоединение метионина к тРНКфмет :
![]()
на второй мет-тРНКфмет модифицируется с образованием фмет- тРНКфмет:
![]()
У эукариот для инициации синтеза белка используется специальная инициирующая мет-тРНКмет.
Инициация трансляции начинается с присоединения к малой субъединице рибосомы иРНК и первой аминоацил-тРНК, антикодон которой комплементарен инициирующему кодону АУГ. Комплементарное взаимодействие актикодона инициирующей аминоацил-тРНК с инициирующим кодоном АУГ (у бактерий таким кодоном иногда является ГУГ) определяет правильную рамку считывания полинуклеотидной последовательности иРНК (рис. 6.4, А) и в конечном итоге синтез «правильного» полипептида. Сдвиг рамки считывания приводит нарушению экспрессии генов, к синтезу других функционально неактивных полипептидов (рис. 6.4) и появлению преждевременных терминирующих кодонов (рис. 6.4, В).

Рис. 6.4. Альтернативные рамки считывания нуклеотидной последовательности иРНК
У прокариот правильная ориентация инициирующего кодона на малой субъединице рибосомы определяется последовательностью Шайна-Дальгарно, расположенной за 3 - 8 нуклеотидов перед триплетом АУГ. Последовательность Шайна-Дальгарно связывается комплементарно с 16 S рРНК, обеспечивая тем самым начало синтеза белка с инициирующего кодона.
После образования комплекса, состоящего из малой субъединицы рибосомы, иРНК и тРНК, к нему присоединяется большая субъединица рибосомы. В результате образуется инициирующий комплекс, в котором выделяют 2 центра: Р-центр (пептидильный) и А-центр (аминоацильный). В Р-центре находится инициирующая аминоацил-тРНК, а А-центр свободен (рис. 6.5).
В инициации трансляции прокариот участвуют также белковые факторы инициации: IF-1, IF-2 и IF-3. Факторы IF-1 и IF-3 влияют на организацию рибосомы в процессе инициации трансляции. Фактор IF-2 в комплексе с ГТФ взаимодействует с инициирующей аминоацил-тРНК, обеспечивая ее взаимодействие с инициирующим кодоном. Этот фактор обладает ГТФазной активностью, т.е. он катализирует гидролиз ГТФ до ГДФ и фосфата. Высвобождаемая при этом энергия используется для осуществления инициации трансляции.
Инициация трансляции у эукариот обеспечивается большим числом факторов инициации. Среди них выделяют собственно факторы инициации, обозначаемые eIF1 - eIF5. Факторы eIF1 - eIF3 в комплексе с дополнительными факторами (eIF-2B и eIF-S) обеспечивают присоединение инициирующей аминоа- цил-тРНК и иРНК к субъединицам рибосомы. Факторы IF4, eIF5 и некоторые дополнительные факторы осуществляют подготовку иРНК к инициации трансляции.
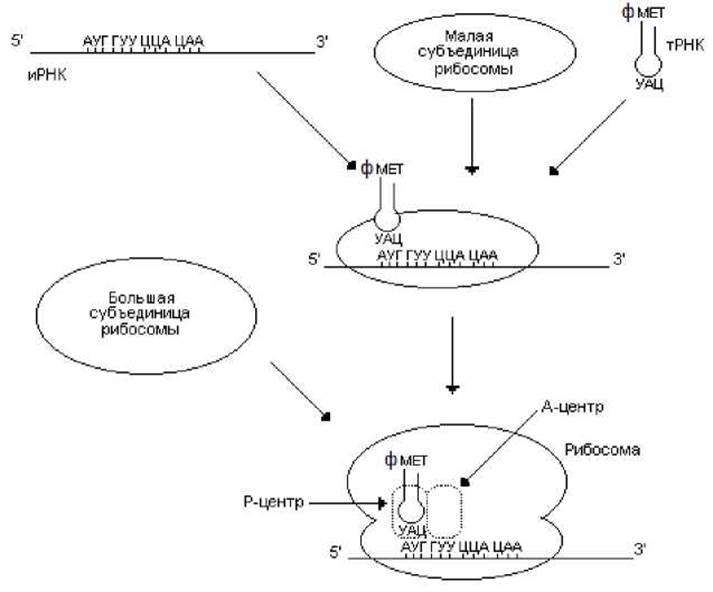
Рис. 6.5. Инициации биосинтеза белка
Элонгация белкового синтеза
В процессе элонгации происходит наращивание полипептидной цепи.
На первом этапе элонгации с А-центром связывается следующая аминоацил-тРНК, антикодон которой комплементарен следующему триплету (рис. 6.6). Далее происходит перенос аминокислотного остатка с фмет-тРНКфмет на аминогруппу аминокислотного остатка следующий аминоацил-тРНК, связанной с А-центром. В результате возникает первая пептидная связь и образуется дипетидил-тРНК. Реакция образования пептидной связи в процессе трансляции получила название пептидил-трансферазной реакции, которая в общем виде может быть представлена так:

Катализирует эту реакцию рРНК большой субъединицы рибосомы.
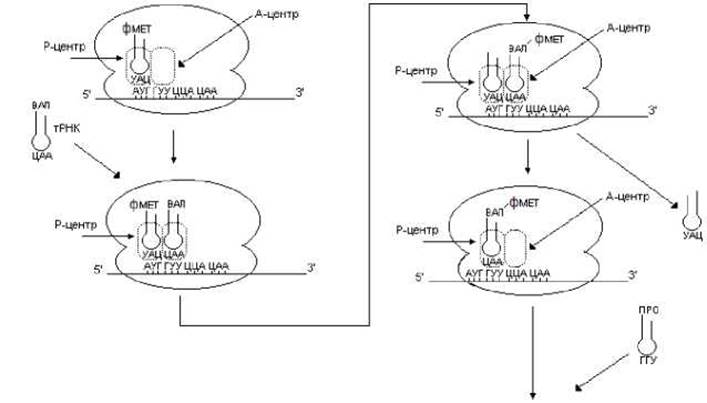
Рис. 6.6. Элонгация биосинтеза белка
Далее рибосома перемещается на один кодон в направлении от 5’- к 3’-концу иРНК. Инициирующая тРНК покидает рибосому. Дипептидил-тРНК перемещается из А-центра в Р- центр. При этом А-центр освобождается, здесь оказывается следующий триплет. Теперь рибосома готова к новому циклу элонгации. Дипептид с дипептидил-тРНК переносится на следующую аминоацил-тРНК, находящуюся в А-центре, что приводит к образованию трипептидил-тРНК. Последняя вступает в следующий цикл элонгации. Рассмотренные циклы продолжаются до тех пор, пока рибосома не достигнет терминирующих кодонов.
В элонгации трансляции у прокариот участвуют белковые факторы EF-Tu, EF-Ts и EF-G. Фактор EF-Tu, образуя комплекс с ГТФ, взаимодействует с аминоацил-тРНК. Образовавшийся тройной комплекс соединяется с рибосомой. Далее происходит гидролиз ГТФ и комплекс EF-Tu-ГДФ покидает рибосому. Фактор EF-Ts ответственен за восстановление комплекса EF-Tu-ГТФ из EF-Tu-ГДФ. Фактор EF-G обеспечивает перемещение (транслокацию) иРНК относительно рибосомы. Такое перемещение связано с гидролизом еще одной молекулы ГТФ. Таким образом, образование одной пептидной связи сопровождается гидролизом двух молекул ГТФ до ГДФ и фосфата.
У эукариот в элонгации участвуют два фактора eEF-1 и eEF-2, являющиеся аналогами факторов прокариот EF-Tu и EF-G.
Терминация
Как только в А-центре окажется один из терминирующих кодонов: УАГ, УГА, УАА, наступает терминация белкового синтеза: происходит гидролитическое отщепление полипептида от тРНК, тРНК отделяется от рибосомы, рибосома диссоциирует на субъединицы. В этом процессе участвуют специфические белки - факторы терминации. У бактерий они обозначаются как RF-1, RF-2 и RF-3. Указанные факторы связываются с терминирующим кодоном, как только он окажется в пределах А-центра рибосомы, и запускают процесс терминации синтеза белка. У эукариот в терминации трансляции участвует один фактор - R, его функция аналогична функции факторов терминации бактерий.
Высокая скорость биосинтеза белка может быть обеспечена одновременным участием многих рибосом в трансляции одной иРНК. Комплекс, состоящий из иРНК и рибосом, называется полисомой.
Биосинтез белка является одним из конечных этапов реализации генетической информации. Это обстоятельство обуславливает жесткие требования к точности трансляции. Высокая точность трансляции обеспечивается большими затратами энергии. На включение одного аминокислотного остатка в полипептидную цепь расходуются 4 макроэргические связи, две при активации аминокислот и две при образовании пептидной связи.
Для приобретения специфической функции новосинтезированный полипептид должен приобрести определенную трехмерную структуру. Важную роль в формировании такой структуры играют особые белки шапероны. Они осуществляют укладку полипептидов сразу же после их выхода с рибосом.
Новосинтезированные белки в клетке могут подвергаться химическим модификациям, в результате которых они становятся биологически активными.