Общая микробиология - Шлегель Г. 1987
Рост микроорганизмов
Подавление роста и гибель микроорганизмов под действием различных агентов
Ряд химических агентов замедляет или полностью тормозит рост микроорганизмов. Если то или иное вещество подавляет рост бактерий, а после его удаления рост вновь возобновляется, то говорят о бактериостатическом действии. Бактерицидные вещества вызывают гибель клеток. Тот или другой эффект, однако, зависит от концентрации действующего вещества. Кроме того, среди бактерий существуют формы, устойчивые к общим клеточным и метаболическим ядам (таким, как сероводород, фенол или окись углерода) и даже способные использовать их как источники энергии. Для многих антимикробных агентов удалось в той или иной мере выяснить субклеточную мишень и механизм действия.
Повреждение поверхностных структур или слоев клетки. Этанол в достаточно высокой концентрации (70%) вызывает коагуляцию белков и оказывает бактерицидное действие. Фенолы, крезолы, нейтральные мыла и поверхностно-активные вещества (детергенты) действуют на наружные слои клеток и нарушают избирательную проницаемость плазматической мембраны. Клеточные мембраны состоят главным образом из липидов и белков. Детергенты имеют полярную структуру, причем их молекулы содержат как липофильные группы (длинные углеводородные цепи или ароматические кольца), так и гидрофильные ионизированные группы. Накапливаясь в липопротеиновых мембранах (тоже имеющих полярную структуру), детергенты нарушают их функции. Поскольку эти вещества обладают широким спектром антимикробного действия, их обычно применяют для дезинфекции различных поверхностей и одежды. С детергентами сходны по своему действию некоторые полипептидные антибиотики (полимиксин, колистин, бацитрацин, субтилин) и антимикробные вещества растительного происхождения.
Повреждение ферментов и нарушение метаболизма. Некоторые тяжелые металлы (медь, серебро, ртуть и др.) действуют как сильные ферментные яды даже в малых концентрациях (так называемое «олигодинамическое действие»). Как в виде солей (HgCl2, CuCl, AgNO3), так и в форме органических соединений (таких, как n-гидроксимеркурибензоат) они связывают SH-группы и тем самым глубоко изменяют третичную и четвертичную структуру ферментных белков. Блокируется также функциональная сульфгидрильная группа кофермента А. Цианид действует как дыхательный яд - связывая железо, он блокирует функцию терминального дыхательного фермента цитохромоксидазы. Окись углерода подавляет дыхание, конкурируя со свободным кислородом за цитохромоксидазу, т. е. действует путем «конкурентного торможения». Антимицин А нарушает перенос электронов по дыхательной цепи, ингибируя цитохром-с-редуктазу. 2,4-Динитрофенол разобщает процессы окисления и фосфорилирования в митохондриях. Арсенат ингибирует фосфорилирование на уровне субстрата. Фторацетат блокирует цикл трикарбоновых кислот. Сначала он, подобно ацетату, активируется и используется как предшественник цитрата (так называемый летальный синтез), а образовавшийся фторцитрат ингибирует аконитазу и тем самым тормозит дальнейшие превращения цитрата.
Конкурентное ингибирование. Примером конкурентного торможения может служить действие малоната, который подавляет превращение сукцината в фумарат. Это действие чрезвычайно специфично и проявляется уже при низких концентрациях малоновой кислоты. В то время как подавление, вызванное цианидом (в известной концентрации) нельзя устранить повышением концентрации субстрата, т. е. парциального давления О2, подавление, вызванное малонатом, можно частично или полностью снять, повысив концентрацию сукцината. Как полагают, нормальный метаболит - сукцинат - конкурирует со своим структурным аналогом, или антиметаболитом, - малонатом - за каталитический центр фермента сукцинатдегидрогеназы. В основе конкурентного ингибирования лежит структурное сходство ингибиторов с нормальными клеточными метаболитами. Проникший в клетку антиметаболит может различными путями воздействовать на процессы биосинтеза. В приведенной ниже схеме три метаболита представлены черным цветом, а три антиметаболита - красным.
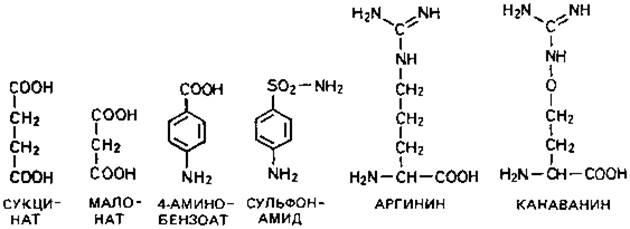
Нарушение синтеза клеточных компонентов. Самым известным примером торможения роста в результате включения структурного аналога в один из клеточных компонентов служит действие производных сульфаниловой кислоты. Антибактериальное действие сульфонамидов было обнаружено чисто эмпирически (Домач); лишь позднее ключ к пониманию механизма этого действия был найден в структурном сходстве между сульфонамидами и n-аминобензойной кислотой (см. приведенные выше структурные формулы). n-Аминобензойная кислота входит в состав одного из коферментов, а именно тетрагидрофолиевой кислоты. У большинства бактерий тетрагидрофолиевая кислота синтезируется из более простых компонентов. Однако при добавлении к питательной среде n-аминобензойной кислоты или сульфонамидов эти вещества беспрепятственно проникают в клетку и включаются в фолиевую кислоту. Когда включается сульфонамид, это приводит к синтезу нефункционирующего кофермента и в конечном счете к остановке роста клеток. Действие сульфонамидов можно снять повышением концентрации n-аминобензойной кислоты: в основе подавления лежит конкурентный механизм. В организме животного фолиевая кислота не образуется de novo и не синтезируется из более простых компонентов: животные должны получать ее в готовом виде с пищей. Поэтому в их организме сульфонамид не может включаться в этот кофермент и не может, таким образом, оказывать вредное воздействие. Возможность использовать сульфонамиды в качестве лечебного средства связана с тем, что синтетические способности животного организма ограниченны.
Ингибирование сукцинатдегидрогеназы малонатом и торможение роста бактерий производными сульфаниловой кислоты -примеры антагонистических отношений между нормальными клеточными метаболитами и их структурными аналогами. Антагонизм между метаболитами и антиметаболитами (структурными аналогами) может проявляться на разных уровнях. Структурные аналоги могут препятствовать включению нормальных метаболитов и тем самым синтезу отдельных клеточных компонентов. Они могут также включаться в полимеры, а это может приводить к снижению активности и даже к полной инактивации какого-либо фермента или нарушать функцию нуклеиновой кислоты.
Подавление синтеза белков антибиотиками. Белковый синтез у прокариот специфически подавляется рядом антибиотиков. Действие их направлено на функцию 70S-pибocoм. Стрептомицин и неомицин тормозят процесс связывания аминокислот между собой. Эритромицин нарушает функцию субъединиц 50S. Тетрациклины препятствуют присоединению аминоацил-тРНК к рибосомам. Хлорамфеникол подавляет включение аминокислот в белки, так как, по-видимому, создает препятствие для связывания аминокислот при участии пептидилтрансферазы. Хлорамфеникол (левомицетин) применяется в медицине как весьма действенный бактериостатик, а в биохимических исследованиях - как селективный ингибитор синтеза белка, не влияющий на другие метаболические процессы. Упомянутые антибиотики, конечно, действуют на рибосомы митохондрий и хлоропластов также и в клетках эукариот. Но, так как, например, наружная мембрана митохондрий очень мало проницаема для стрептомицина, этот антибиотик в тех низких концентрациях, в которых его применяют в терапии, почти не действует на эукариотические клетки. Деление названных органелл у эукариот прекращается лишь при использовании в 1000 раз более высоких его концентраций. Если воздействовать высокими концентрациями стрептомицина на эукариот (дрожжи, эвглену, точки роста высших растений), то в процессе их роста число митохондрий и хлоропластов будет уменьшаться, и можно получить клетки и ткани с сильно пониженным числом этих органелл.
Подавление синтеза нуклеиновых кислот антибиотиками. Некоторые антибиотики подавляют синтез нуклеиновых кислот. Митомицин С избирательно препятствует синтезу ДНК, не оказывая на первых порах влияния на синтез РНК и белков. Полагают, что действие его основано на образовании поперечных сшивок в двойной спирали ДНК и на разрыве ее цепей. Актиномицин D образует с двухцепочечной ДНК комплекс, присоединяясь к остаткам гуанина; он нарушает синтез РНК всех трех типов, но не влияет на репликацию ДНК. Рифампицин воздействует на ДНК-зависимую РНК-полимеразу и подавляет тем самым синтез мРНК у бактерий.
Торможение синтеза клеточных стенок. О подавлении синтеза пептидогликана у прокариот пенициллином, цефалоспорином и другими веществами, действующими на клеточные стенки, уже говорилось в разделе 2.2.3.
Гибель и уничтожение микроорганизмов. Под гибелью микроорганизмов имеют в виду необратимую утрату способности к росту и размножению; в лабораторных условиях это обычно означает потерю способности к образованию колоний. Многие повреждения, как правило приводящие к гибели клетки, в определенных условиях могут быть обратимы. Хорошо известно явление реактивации после облучения ультрафиолетом или воздействия высоких температур (разд. 15.2.2). Количественные данные относительно гибели микроорганизмов (естественной или вызванной каким-либо агентом) можно получить только для популяции, но не для отдельных клеток. В некоторых случаях скорость уменьшения числа живых клеток в популяции в любой момент времени пропорциональна числу имеющихся жизнеспособных клеток; процесс отмирания клеток подчиняется тогда кинетике реакций первого порядка N = N0 ∙ e-kt (где k - коэффициент, характеризующий скорость отмирания). Это относится, например, к стерилизации облучением.
6.6.1 Методы стерилизации
Уничтожение микроорганизмов - один из необходимых элементов микробиологической работы и основа консервирования пищевых продуктов; поэтому стоит остановиться на нем подробнее. Освобождение какого-либо материала от живых микроорганизмов или их покоящихся форм называют обеспложиванием или стерилизацией. От стерилизации следует отличать частичное обеспложивание (пастеризацию), а также консервирование. Если стерильная среда или микробная культура загрязняется случайно попавшими в нее микроорганизмами, то говорят о контаминации, или загрязнении. Такие понятия, как дезинфекция (уничтожение всех патогенных микроорганизмов), асептика и антисептика, а также инфекция, употребляются главным образом в гигиене, а не в микробиологии.
Микроорганизмы проявляют разную чувствительность к средствам, применяемым для их уничтожения. Существуют видовые различия в чувствительности, а также различия, зависящие от влажности и pH среды, от возраста вегетативных клеток или спор и т.д. Эффективность различных агентов, применяемых для уничтожения микроорганизмов, характеризуют величиной D10 (время, необходимое для того, чтобы в определенной популяции при определенных условиях среды вызвать гибель 90% клеток (см. табл. 6.5).
Полная или частичная стерилизация осуществляется с помощью влажного жара, сухого жара, фильтрации, облучения или различных химических средств.
Влажный жар. Вегетативные клетки большинства бактерий и грибов гибнут через 5-10 мин уже при температуре около 60°С, споры дрожжей и мицелиальных грибов - лишь при температурах выше 80°С, а споры бактерий - выше 120°С (15 мин). Время воздействия влажным жаром, необходимое для уничтожения спор некоторых видов бактерий, отличающихся чрезвычайной термоустойчивостью, можно вывести из данных, приведенных в табл. 6.5. При этом следует учитывать, что окончательный результат стерилизации зависит также от степени загрязнения обрабатываемого материала, т. е., например, от числа терморезистентных спор: чем их больше, тем длительнее должен быть нагрев.
Таблица 6.5. Величины D10 (в секундах) для суспензий спор трех аэробных видов бактерий (по I. Miller, О. Kandier, Milchwiss., 22 [1967], 686, с изменениями)
|
Вид |
D10при разных температурах |
|||||
|
100°С |
120° С |
130°С |
140°С |
150°С |
160°С |
|
|
Bacillus cereus |
12,1 |
4,2 |
2,6 |
1,3 |
1,0 |
0,7 |
|
В. subtilis |
27,8 |
4,5 |
3,1 |
2,1 |
1,1 |
0,5 |
|
В. stearothermophilus |
2857,0 |
38,6 |
8,8 |
3,9 |
2,4 |
1,4 |
Для достижения температур выше точки кипения воды пользуются автоклавом. Температура насыщенного пара зависит от давления (рис. 6.12). При доступе воздуха определенному давлению соответствует значительно более низкая температура. Поскольку гибель микроорганизмов под действием влажного жара зависит от температуры, а не от давления, необходимо закрывать автоклав лишь после того, как воздух будет из него вытеснен водяным паром. Воздух удаляется вместе с выходящим паром или в результате отсасывания. При автоклавировании следует измерять температуру, а не давление, хотя по соображениям простоты и безопасности обычно все еще измеряют давление. Продолжительность стерилизации, естественно, зависит от объема (теплоемкости) сосудов, в которых ее проводят (табл. 6.6).
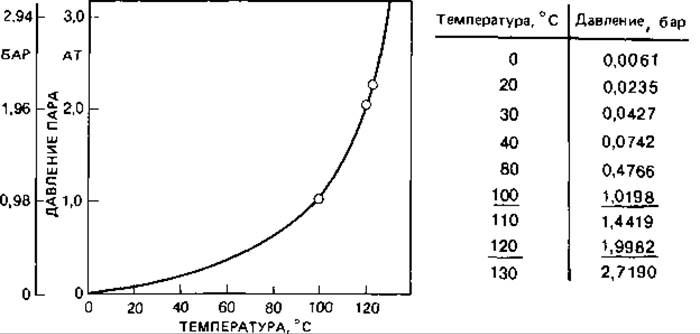
Рис. 6.12. Давление водяных паров при насыщении.
Таблица 6.6. Длительность стерилизации жидкостей в разных сосудах в автоклаве (121—123°С)
|
Сосуды |
Объем, мл |
Длительность стерилизации, мин |
|
Пробирки |
20 |
12-14 |
|
Колбы Эрленмейера |
50 |
12-14 |
|
Колбы Эрленмейера |
200 |
12-15 |
|
Колбы Эрленмейера |
1000 |
20-25 |
|
Колбы Эрленмейера |
2000 . |
30-35 |
|
Бутыли |
9000 |
50-55 |
Нередко удается достичь того же эффекта дробной стерилизацией в текучем паре при 100°С (тиндализация). Жидкость стерилизуется в этом случае при 100°С три дня подряд по 30 мин ежедневно; в промежутках между нагреваниями ее хранят в термостате, для того чтобы споры проросли, а затем вегетативные клетки были уничтожены при следующем нагревании.
Для многих целей довольствуются частичной стерилизацией, т. е. уничтожением вегетативных форм микроорганизмов. Такого эффекта обычно достигают путем пастеризации - выдерживания в течение 5-10 мин при 75 или 80°С. Пастеризацией частично стерилизуют, в частности, молоко; однако, чтобы не испортить его вкуса, время воздействия в этом случае сокращают. Применяют два метода пастеризации молока: кратковременное нагревание (20 с при 71,5-74°С) и сильное нагревание (2-5 с при 85-87°С). Стерилизации молока добиваются в результате сверхсильного нагревания. При этом в молоко вводят перегретый водяной пар, доводя температуру смеси до 135-150°С. Молоко подвергается действию этой температуры в течение 1-2 с. Затем, пропуская молоко через форсунку, понижают давление и одновременно охлаждают молоко; при этом из него удаляется вода, введенная в виде пара.
Способы консервирования ягод и косточковых плодов тоже следует рассматривать как частичную стерилизацию. При обычном нагревании консервных банок в течение 20 мин при 80°С гибнут только вегетативные клетки и споры многих грибов, в то время как споры бактерий остаются жизнеспособными. Прорастанию бактериальных спор препятствуют низкие значения pH, обусловленные присутствием кислот во фруктовом соке. На пастеризованной клубнике часто появляется так называемый «клубничный гриб» Byssochlamys nivea. Его аскоспоры выдерживают 86°С; при этой температуре D10 составляет 14 мин.
Сухой жар. При стерилизации сухим жаром бактериальные споры переносят более высокие температуры и притом дольше, чем при стерилизации влажным жаром. Поэтому жаростойкую стеклянную посуду, порошки, масла и т. п. стерилизуют в течение 2 ч при 160°С в сухом стерилизаторе. В случае стерилизации материалов с высокой теплоемкостью или термоизоляционными свойствами следует учитывать время прогрева. В любом случае рекомендуется контролировать температуру с помощью индикаторов или проверять полноту стерилизации (для этого в аппарат помещают также пробу почвы, содержащей споры, которую потом высевают). В тех случаях, когда это позволяет стерилизуемый материал, в настоящее время применяют 30-минутный нагрев при 180°С. Как показывает опыт, при этом погибают все споры. Стерилизация жаром основана на коагуляции клеточных белков.
Фильтрация. Растворы, содержащие термолабильные вещества, удобнее всего стерилизовать фильтрованием. Неглазурованные фарфоровые цилиндры (свечи Шамберлана) применялись уже в лаборатории Пастера. В лабораториях и для стерилизации питьевой воды используют фильтры Беркефельда (из прессованного кизельгура). Часто употребляют также асбестовые пластинки (в фильтрах Зейца), стеклянные фильтры и мембранные фильтры. Некоторые из них выпускаются с различной величиной пор, что позволяет даже разделять организмы разной величины и формы.
Облучение. Для полной или частичной стерилизации применяют ультрафиолетовые, рентгеновские и гамма-лучи. В лабораторных условиях наибольшее значение имеют ультрафиолетовые лучи. В спектре УФ-ламп преобладает излучение в области 260 нм, поглощаемое главным образом нуклеиновыми кислотами и при достаточно длительном воздействии вызывающее гибель всех бактерий (см. разд. 15.2.2 и рис. 15.5). УФ-облучение используется для частичной стерилизации помещений; при этом бактерии погибают очень быстро, а споры грибов, гораздо менее чувствительные к ультрафиолету,-значительно медленнее. Ионизирующее излучение применяют для стерилизации пищевых продуктов и других компактных материалов.
Химические средства. При стерилизации пищевых продуктов, лекарственных препаратов и разного рода приборов, а также в лабораторной практике оправдало себя применение окиси этилена, которая убивает и вегетативные клетки, и споры, но действует только в том случае, если подвергаемые стерилизации материалы содержат некоторое количество (5-15%) воды. Окись этилена применяют в виде газовой смеси (с N2 или СO2), в которой ее доля составляет от 2 до 50%.
Для сохранения термолабильных веществ, содержащихся в питательных средах, в практику была введена стерилизация ß-пропиолактоном. Он значительно активнее окиси этилена, но обладает, видимо, довольно сильным канцерогенным действием и вызывает ряд других побочных физиологических эффектов. Его добавляют в количестве 0,2% в готовые питательные среды, которые затем инкубируют 2 ч при 37°С. Если оставить среду на ночь, пропиолактон полностью разложится.
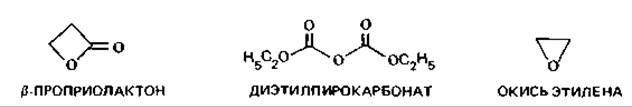
Углеводы при этом не затрагиваются. Напитки стерилизуют также диэтилпирокарбонатом (0,003-0,02%).
Для стерилизации семян, используемых при выращивании стерильных растений, пригодны такие обычные антимикробные средства, как бромная вода (1%), сулема (HgCl2; 1%-ный раствор в спирте), AgNO3(0,05%), гипохлорит кальция [1% Са(СlO)2], успулун и др., которыми воздействуют в течение 5-30 мин. Перед этим семена следует обработать мылом или другим поверхностно-активным веществом, чтобы обеспечить полное смачивание поверхности.
6.6.2 Методы консервирования
Органические материалы разлагаются микроорганизмами, если только против этого не приняты специальные меры. Для сохранения органических веществ (для их консервирования) можно использовать ряд средств. Наибольшее значение имеют методы, обеспечивающие сохранность пищевых продуктов. Этими вопросами занимается пищевая микробиология.
Пищевые продукты становятся негодными к употреблению не только в результате их разложения микроорганизмами (аэробного окисления или анаэробного гниения), но и вследствие того, что на них поселяются бактерии и грибы, образующие токсины. Важнейшими продуцентами токсинов, попадающими в пищевые продукты, являются Clostridium botulinum и различные виды стафилококков. С. botulinum выделяет экзотоксин, чрезвычайно сильно действующий даже в малых количествах и поражающий нервную систему. Стафилококки образуют энтеротоксин, вызывающий так называемые пищевые отравления. Некоторые грибы образуют микотоксины, из которых наиболее известен афлатоксин (продукт жизнедеятельности гриба Aspergillus flavus).
Методы консервирования, применяемые для защиты пищевых продуктов от микроорганизмов, весьма разнообразны. Используются как физические, так и химические методы.
Физические методы. Мы уже говорили о стерилизации с помощью высокой температуры. Металлические консервные банки в большинстве случаев прогревают в автоклаве. Для консервирования кислых плодовых соков достаточно пастеризации, при которой гибнут лишь вегетативные клетки, а споры сохраняют жизнеспособность; эндоспоры бактерий в кислых средах не прорастают.
Плодовые соки, минеральные воды и лекарственные препараты стерилизуют, пропуская через мелкопористые асбестовые или целлюлозные фильтры. При производстве вина прибегают к центрифугированию и фильтрации, чтобы прервать брожение на нужной стадии (для сохранения «остаточного сахара»).
Старый и широко распространенный способ консервирования пищевых продуктов путем сушки основан на том, что для роста микроорганизмов необходима определенная влажность (обычно более 10% воды). Овсяные хлопья, сушеные фрукты, сено, зерно в элеваторах сохраняются именно благодаря своему сухому состоянию; во влажном воздухе, отсырев, они быстро портятся под воздействием грибов и бактерий.
Возможности консервирования облучением пока еще ограниченны. Ультрафиолетовые лучи используют главным образом для стерилизации воздуха на молочных заводах, промышленных холодильниках, хлебозаводах и в других аналогичных местах. Консервирование пищевых продуктов с помощью ионизирующих излучений в принципе возможно, так как эти излучения обладают высокой проникающей способностью; однако такой метод не получил еще широкого распространения. Надежным способом, начинающим даже в домашнем хозяйстве конкурировать с квашением и другими способами домашнего консервирования, является хранение продуктов при низкой температуре. В камерах для глубокого замораживания продукты хранят при температуре ниже — 20°С. При такой температуре жизнеспособность микроорганизмов заметно не снижается и разрушения их токсинов не происходит, однако рост полностью прекращается. Даже психрофильные бактерии не могут расти при температуре ниже — 12°С.
Химические методы. Консервирование путем подкисления основано на том, что при низких pH без доступа воздуха растут лишь немногие микроорганизмы. Для их уничтожения достаточно простой пастеризации. Термоустойчивые споры при pH ниже 5,0 не прорастают. Естественное подкисление, происходящее в результате молочнокислого брожения, используют для приготовления кислой капусты, силоса, соленых огурцов и сырокопченых колбас (салями, сервелата). Нередко для консервирования к продукту добавляют уксусную, молочную, винную или лимонную кислоту. При доступе воздуха непастеризованные кислые продукты разлагаются под действием дрожжей и других грибов.
Мясные и рыбные продукты консервируют копчением. Копчение связано с воздействием содержащихся в коптильном дыму продуктов возгонки - фенолов, крезолов, альдегидов, уксусной и муравьиной кислот. Все эти вещества обладают антисептическими свойствами. Действие их усиливается благодаря удалению из обрабатываемого продукта части влаги.
Для соления продукты помещают в 14-25%-ный раствор поваренной соли. В результате снижается содержание воды в продукте и подавляется рост микроорганизмов, вызывающих порчу. Способность к размножению сохраняют в таких условиях лишь немногие галофильные бактерии.
Сахар в высокой концентрации (примерно 50% сахарозы) также подавляет рост микроорганизмов. Мармелад и различные сиропы сохраняются в первую очередь благодаря высокому содержанию кислот и сахара.
Для сохранения ряда пищевых продуктов приходится применять химические консерванты. К вину с этой целью ранее добавляли сернистую кислоту; вино и фруктовые соки можно (если это вообще необходимо) консервировать добавлением диэтилпирокарбоната.
Для консервирования пищевых продуктов используют также сорбиновую, бензойную или муравьиную кислоту. Плоды цитрусовых обрабатывают дифенилом или о-фенилфенолатом. Делаются попытки применять для консервирования антибиотики.