Общая микробиология - Шлегель Г. 1987
Основные механизмы обмена веществ и преобразования энергии
Дыхательная цепь и фосфорилирование, сопряженное с транспортом электронов
В то время как большинство анаэробных организмов способно синтезировать АТР только путем фосфорилирования на уровне субстрата, аэробы могут осуществлять несравненно более эффективную регенерацию АТР. Они обладают особым аппаратом: дыхательной (электрон-транспортной) цепью и ферментом АТР-синтазой; обе системы у прокариот находятся в плазматической мембране, а у эукариот - во внутренней мембране митохондрий. Ведущие свое происхождение от субстратов восстановительные эквиваленты (Н или электроны) в этих мембранах поступают в дыхательную цепь, и электроны переносятся на O2 (или другие терминальные акцепторы электронов). В дыхательной цепи происходят реакции, представляющие собой биохимический аналог сгорания водорода. От химического горения молекулярного водорода они отличаются тем, что значительная часть свободной энергии переводится при этом в биологически доступную форму, т. е. в АТР, и лишь небольшая доля рассеивается в виде тепла.
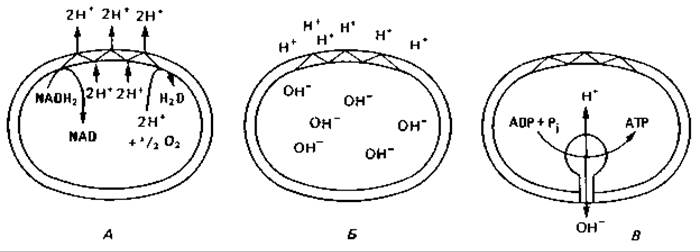
Рис. 7.8. Схема окислительного фосфорилирования в плазматической мембране бактериальной клетки и во внутренней мембране митохондрии. А. Окисление NADH2 и выведение протонов. Б. Электрохимический градиент между внутренней и наружной сторонами. В. Регенерация АТР как следствие обратного тока протонов.
Механизм окислительного фосфорилирования. Отданные субстратами восстановительные эквиваленты (протоны и электроны) переносятся на плазматическую мембрану или на внутреннюю мембрану митохондрий. Через мембрану они транспортируются таким образом, что между внутренней и внешней сторонами мембраны создается электрохимический градиент с положительным потенциалом снаружи и отрицательным внутри (рис. 7.8). Этот перепад заряда возникает благодаря определенному расположению компонентов дыхательной цепи в мембране.
Некоторые из этих компонентов переносят электроны, другие переносят водород. Взаиморасположение переносчиков в мембране таково, что при транспорте электронов от субстрата к кислороду протоны (Н+) связываются на внутренней стороне мембраны, а освобождаются на внешней. Можно представить себе, что электроны в мембране проходят зигзагообразный путь и при этом переносят протоны изнутри наружу. Эта система, транспортирующая электроны и протоны, получила название дыхательной или электрон-транспортной цепи. Иногда ее образно называют «протонным насосом», так как главная функция этой системы — перекачивание протонов.
Неравновесное распределение зарядов, т. е. электрохимический градиент, служит движущей силой для процесса регенерации АТР (и других процессов, требующих затраты энергии). Мембрана содержит специальный фермент ATP-синтазу, синтезирующий АТР из ADP и Р. Этот фермент выступает из мембраны с ее внутренней стороны. В процессе синтеза АТР протоны переходят обратно с наружной стороны мембраны на внутреннюю. Синтез АТР за счет энергии транспорта электронов через мембрану называют окислительным фосфорилированием или фосфорилированием в дыхательной цепи.
Для того чтобы понять механизм дыхания, необходимо знать
1) компоненты дыхательной цепи, 2) их окислительно-восстановительные потенциалы и 3) их взаиморасположение в мембране.
Мембраны как место осуществления дыхания. Компонентами дыхательной цепи являются ферментные белки с относительно прочно связанными низкомолекулярными простетическими группами. Давнюю мысль о том, что «дыхание» - это катализ, осуществляемый железом на поверхностях» (О. Варбург), можно считать справедливой. Действительно, ферменты дыхательной цепи структурно связаны. У эукариот они локализуются во внутренней мембране митохондрий, а у прокариот - в плазматической мембране. Механизм действия и локализация компонентов дыхательной цепи в тех и других мембранах во многом сходны. Дыхательная цепь Alcaligenes eutrophus и Paracoccus denitrificans почти идентична дыхательной цепи митохондрий.
Компоненты дыхательной цепи погружены в двойной липидный слой. Речь идет о большом числе ферментов, коферментов и простетических групп, различных дегидрогеназ и транспортных систем, участвующих в переносе электронов и водорода. Белковые компоненты могут быть выделены из мембраны. Важнейшие из компонентов, участвующих в окислении водорода, - это флавопротеины, железосерные белки, хиноны и цитохромы.
Флавопротеины представляют собой ферменты, содержащие в качестве простетических групп флавинмононуклеотид (FMN) или флавин-адениндинуклеотид (FAD). Эти ферменты переносят водород. Активной группой в них является изоаллоксазиновая система (рис. 7.9, А), которая действует как обратимая окислительно-восстановительная система. Реагирующими центрами служат два атома азота, каждый из которых может связаться с одним [Н]. Связывание может происходить в два этапа через состояние семихинона. Благодаря способности переносить то по два атома водорода, то по одному флавопротеины могут быть посредниками между двумя типами процессов переноса водорода.
Железосерные белки-это окислительно-восстановительные системы, переносящие электроны. Они содержат атомы железа, связанные, с одной стороны, с серой аминокислоты цистеина, а с другой - с неорганической сульфидной серой (рис. 7.9, Б). Последняя очень легко отщепляется в виде сероводорода при подкислении. Остатки цистеина входят в состав полипептидных цепей; Fe - S-центры можно рассматривать как простетические группы полипептида. Участвующие в дыхательной цепи [2Fe + 28]-центры способны переносить только один электрон. Железосерные белки типа [2Fe + 2S], имеющие по два атома лабильной серы и железа, содержатся в нескольких ферментных комплексах дыхательной цепи. Из общего количества находящегося в плазматической мембране железа 80% содержится в Fe - S-белках и только 20%-в цитохромах.
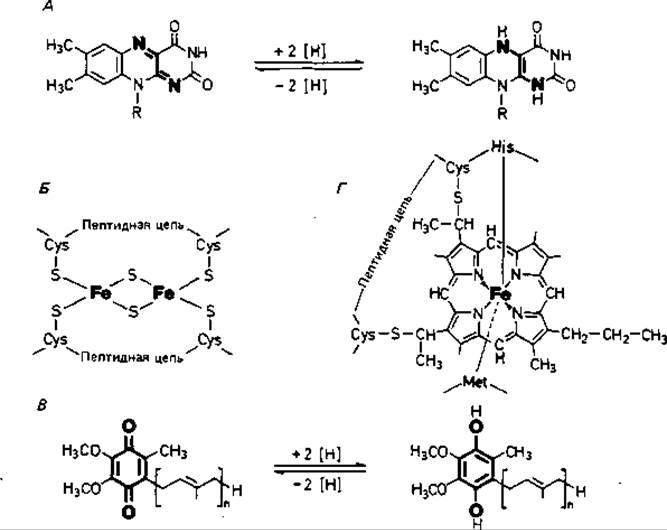
Рис. 7.9. Структурные формулы некоторых важнейших компонентов дыхательной цепи. А. Изоаллоксазиновая кольцевая система FMN или FAD в окисленной и восстановленной форме. Б. [2Fe + 28]-центр железосерного белка. В. Восстановление убихинона до убигидрохинона. Г. Активный участок цитохрома с.
Помимо транспорта электронов в мембранах Fe - S-белки участвуют в фиксации молекулярного азота, в восстановлении сульфита и нитрита, в фотосинтезе, в освобождении и активации молекулярного водорода и в окислении алканов. Fe - S-белки имеют относительно низкую молекулярную массу и сильно отрицательный окислительно-восстановительный потенциал; величины Е'0 находятся в пределах от — 0,2 до — 0,6 В. Помимо железосерных белков с [2Fe + 2S]-центрами (в хлоропластах, у аэробных бактерий) существуют и другие - с [4Fe + 4S]-центром (у Clostridium, Chromatium). а также такие, которые содержат по два [4Fe + 4S]-центра (у Clostridium, Azotobacter). Некоторые железосерные белки получили название по своему происхождению или по функции: ферредоксин, путидаредоксин, рубредоксин, адренодоксин.
Еще одну группу окислительно-восстановительных систем в дыхательной цепи составляют хиноны. Во внутренней мембране митохондрий и у грам-отрицательных бактерий имеется убихинон (кофермент Q; рис. 7.9, В), у грам-положительных бактерий-нафтохиноны, а в хлоропластах - пластохиноны. Хиноны, в частности убихинон, липофильны и поэтому локализуются в липидной фазе мембраны. Они способны переносить водород или электроны. Перенос может осуществляться в два этапа, при этом в качестве промежуточной формы выступает семихинон. По сравнению с другими компонентами дыхательной цепи хиноны содержатся в 10-15-кратном избытке. Они служат «сборщиками» водорода, поставляемого различными коферментами и простетическими группами в дыхательной цепи, и передают его цитохромам.
Цитохромы - окислительно-восстановительные системы, переносящие только электроны; водород они не транспортируют. К цитохромам электроны поступают от пула хинонов. При переносе электронов эквивалентное им число протонов переходит в раствор. В качестве простетической группы цитохромы содержат гем (рис. 7.9, Г). Центральный атом железа геминового кольца участвует в переносе электронов, изменяя свою валентность. Цитохромы окрашены; они отличаются друг от друга спектрами поглощения и окислительно-восстановительными потенциалами. Различают цитохромы а, а3, b, с, о и ряд других. В цитохроме с группы гема ковалентно связаны с цистеиновыми остатками апопротеина; благодаря такой прочной связи он растворим в воде и его можно экстрагировать из мембраны солевыми растворами. Цитохром с найден почти у всех организмов, обладающих дыхательной цепью. Что касается распространенности других цитохромов, то тут существуют заметные различия.
Цитохромы участвуют также в переносе электронов на кислород. Цитохромоксидаза (цитохром аа3) - терминальная оксидаза, реагирующая с кислородом и передающая ему четыре электрона:
![]()
Часто встречающийся у бактерий цитохром о также может реагировать с молекулярным кислородом. Эта терминальная оксидаза может быть ингибирована цианидом или окисью углерода.
Наличие цитохромов долгое время рассматривалось как признак принадлежности к аэробным или фототрофным организмам. Открытие цитохрома с3 у Desulfovibrio вначале казалось неожиданным, но затем стало понятно, что воестановление сульфата этими сульфатредуцирующими бактериями позволяет им осуществлять окислительное фосфорилирование в анаэробных условиях и, таким образом, формально соответствует дыханию. Недавно выявилось, что аэротолерантные молочнокислые бактерии Streptococcus lactis и Leuconostoc mesenteroides и анаэроб Bifidobacterium тоже синтезируют цитохромы, если растут на средах, содержащих гемин или кровь. Цитохромы были обнаружены также у строгих анаэробов Selenomonas ruminantium, Veillonella alcalescens, Vibrio succinogenes, Clostridium formicoaceticum и C. thermoaceticum. Вполне возможно, что и у некоторых других строго анаэробных бактерий будут найдены цитохромы и способность в какой-то мере осуществлять фосфорилирование, сопряженное с транспортом электронов.
Окислительно-восстановительный потенциал. Транспорт водорода и транспорт электронов - процессы эквивалентные. Дыхательная цепь может рассматриваться как цепь переноса электронов. Компоненты дыхательной цепи переходят попеременно из окисленного состояния в восстановленное и обратно, т. е. ведут себя как типичные окислительно-восстановительные катализаторы. Они обладают окислительно-восстановительным потенциалом, который может быть измерен непосредственно (у цитохромов) или косвенно (у NAD, FAD).
Окислительно-восстановительный потенциал служит количественной мерой способности тех или иных соединений или элементов отдавать электроны. Этот потенциал отсчитывается относительно потенциала молекулярного водорода. Согласно определению, водородный полуэлемент - платинированный или платиновый электрод, погруженный в раствор кислоты и обтекаемый газообразным Н2 при давлении 1,013 бар и pH 0, имеет потенциал, равный нулю:
![]()
Подобно химическим элементам, биологические вещества также можно расположить в ряд по величине их окислительно-восстановительного потенциала при степени восстановления 1/2 (равные концентрации окисленной и восстановленной форм); эту величину обозначают Е0. В биохимии пользуются величиной E0', приведенной к pH 7. При этом pH водородный электрод имеет потенциал равный — 0,42 В. На рис. 7.10, А показана зависимость потенциала, отнесенного к потенциалу водородного полуэлемента, от величины pH. Из уравнения Нернста
![]()
следует, что зависимость измеряемого потенциала окислительно-восстановительной системы Е' от концентраций окисленной и восстановленной форм выражается формулой
![]()
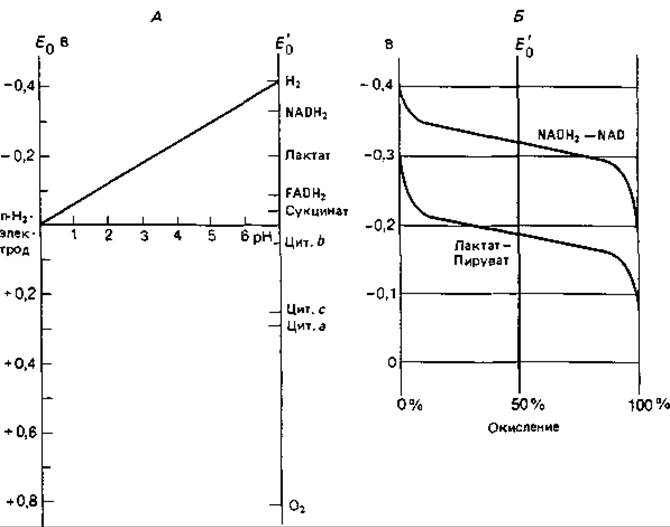
Рис. 7.10. Окислительно-восстановительные потенциалы. А. Зависимость окислительно-восстановительного потенциала (отнесенного к потенциалу водородного полуэлемента (n-Н2-электрода) от величины pH; для некоторых соединений указаны нормальные потенциалы Е'0. Б. Зависимость измеряемого потенциала Е'0 от концентраций окисленной и восстановленной форм соединения для двух окислительно-восстановительных систем.
Значение Е' тем более отрицательно, чем меньше отношение концентрации окисленной формы к концентрации восстановленной формы (рис. 7.10, Б).
Окислительно-восстановительный потенциал служит мерой максимальной полезной работы, которую может выполнить система, т. е. мерой изменения свободной энергии (AG0) в данной реакции. По разности окислительно-восстановительных потенциалов двух реагирующих друг с другом систем АЕ0 можно вычислить изменение свободной энергии при данной реакции:
∆G0= - n ∙ F∙ ∆Е0 = - n ∙ 96,5 ∙ ∆E0 (кДж/моль)
Значения E'0 отдельных компонентов дыхательной цепи лежат в пределах от — 0,32 В для NADH2/NAD [— 0,08 В для флавопротеина (FADH2/FAD); — 0,04 В для цитохрома b (Fe2 + /Fe3 +)] до + 0,81 В для O2-/1/2O2. Можно также привести значения для ряда субстратов: лактат/пируват — 0,186 В; малат/оксалоацетат — 0,166 В; сукцинат/фурамат — 0,03 В.
Таблица 7.4. Окислительно-восстановительные потенциалы компонентов дыхательной цепи. Разности потенциалов между отдельными компонентами и эквивалентные изменения свободной энергии
|
Компоненты дыхательной цепи |
E'0, В |
Разность величин Е'0, В |
-∆ G'0 |
|
|
кДж/моль |
ккал/моль |
|||
|
Водород |
- 0,42 |
0,10 |
19,3 |
4,61 |
|
NAD |
-0,32 |
0,24 |
46,4 |
11,1 |
|
Флавопротеин |
-0,08 |
0,04 |
7,7 |
1,84 |
|
Цитохром Ь |
-0,04 |
0,31 |
59,8 |
14,30 |
|
Цитохром с |
+ 0,27 |
0,02 |
3,8 |
0,92 |
|
Цитохром а |
+ 0,29 |
0,52 |
100,4 |
24,0 |
|
Кислород |
+ 0,81 |
Поскольку разность между величинами E'0для Н2 и O2 составляет — 0,42-0,81 = — 1,23 В, изменение свободной энергии в реакции гремучего газа AG0' должно быть равно — 2∙96,5∙1,23 = — 237,4 кДж/моль. В клетке при переносе водорода от NADH2 разность потенциалов составляет только [(+ 0,81 В) - (- 0,32 В)] = 1,13 В, т. е. ∆G0 = - 218 кДж/моль. Аналогичным образом по разности потенциалов можно вычислить соответствующий выход энергии для любых двух переносчиков электронов в дыхательной цепи (табл. 7.4).
Расположение и функции окислительно-восстановительных систем в дыхательной цепи. По окислительно-восстановительному потенциалу компоненты дыхательной цепи можно расположить в ряд, который начинается с NAD (наиболее отрицательный потенциал) и оканчивается цитохромоксидазой и кислородом (рис. 7.11). Хиноны и цитохромы служат вспомогательными субстратами. Эти компоненты восстанавливаются водородом, доставляемым различными донорами. Получаемый через NAD водород с помощью NADH-дегидрогеназы переносится на хинон; аналогичным образом на хинон переносится водород от сукцината (через сукцинатдегидрогеназу) и водород, полученный при дегидрировании жирных кислот (через другие специфические дегидрогеназы). Хинон служит сборным резервуаром водорода из субстратов в дыхательной цепи. Некоторые из ферментов, участвующих в переносе водорода, содержат FMN или FAD, а также железосерные белки.
Восстановленные хиноны вновь окисляются системой цитохромов. Цитохромы принимают электроны и передают их кислороду; водород же ионизируется и покидает мембрану (рис. 7.8 и 7.12, Г). Последовательность окислительно-восстановительных систем, выведенная из соответствующих потенциалов, была подтверждена экспериментально с помощью спектрометрии и специфических ингибиторов.
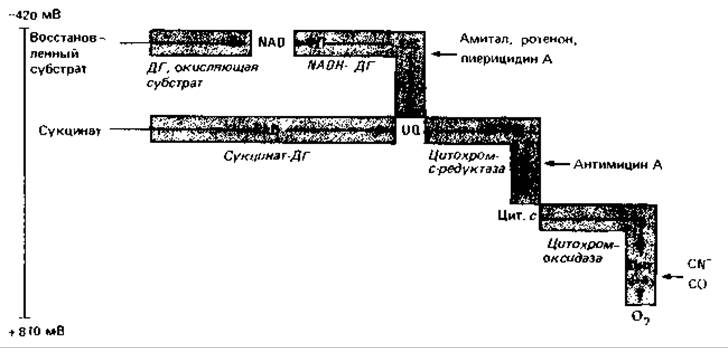
Рис. 7.11. Основная схема дыхательной цепи в митохондриях эукариот и в мембранах многих бактерий. ДГ - дегидрогеназа; UQ - убихинон; ФП - флавопротеин.
Ингибиторы дыхательной цепи. Дыхательная цепь ингибируется или блокируется различными клеточными ядами. Амитал, ротенон и пиерицидин А подавляют активность NADH-дегидрогеназы; антимицин А блокирует перенос электронов между цитохромами b и с. Цианид и окись углерода ингибируют только цитохромоксидазу; в цитохроме с ион железа, по-видимому, так спрятан в глубине белка, что не взаимодействует ни с CN-, ни с СО. Специфическое действие этих ядов и изменения характерных спектров поглощения компонентов дыхательной цепи послужили индикаторами, с помощью которых была изучена эта цепь.
Коэффициент P/О и энергетический баланс. Рассмотрение окислительно-восстановительных потенциалов (табл. 7.4) показывает, что в дыхательной цепи имеются только три этапа окисления, на которых освобождается по меньшей мере столько энергии, сколько содержится в одной «высокоэнергетической» связи. При переносе 2 [Н] от NADH2 на кислород только три электронных перехода могут быть сопряжены с фосфорилированием ADP в АТР, так что в лучшем случае лишь три молекулы фосфата могут быть включены в органическое соединение. Эту связь окисления с фосфорилированием обычно выражают в виде коэффициента P/О (число молекул АТР, образующихся на 1 атом затраченного кислорода). Для митохондрий животных, используя в качестве доноров водорода изоцитрат или малат (переносящие свой водород на NAD), можно экспериментально получить коэффициент P/О, равный 3; для сукцината, от которого водород может быть включен в цепь дыхания только на уровне флавопротеинов, коэффициент P/О составляет лишь 2.
Знание того факта, что при переносе двух эквивалентов водорода по дыхательной цепи образуются три молекулы АТР, позволяет составить энергетический баланс для случая окисления глюкозы. Если катаболизм глюкозы идет по фруктозобисфосфатному пути и через цикл трикарбоновых кислот и при этом весь водород сжигается в дыхательной цепи до воды, то на 1 моль использованной глюкозы образуются: а) по фруктозобисфосфатному пути-2 моля NADH2; б) при дегидрировании пирувата-2 моля NADH2; в) в цикле трикарбоновых кислот-2∙3 моля NADH2 и 2 моля FADH2; всего-10 молей NADH2 и 2 моля FADH2. При коэффициентах P/О, равных 3 и 2, число синтезируемых молей АТР составит 10∙3 + 2∙2 = 34. Если к этому добавить два моля АТР, синтезируемых во фруктозобисфосфатном пути, и два моля, образующиеся при окислении 2-оксоглутарата, то получим в общем итоге 38 молей АТР.
Этот расчет справедлив для митохондрий и многих бактерий. Однако у бактерий часто имеются только два пункта фосфорилирования, т. е. и для водорода, поставляемого NADH2, коэффициент P/О равен всего лишь двум. Так обстоит дело, например, у растущих в аэробных условиях клеток Escherichia coli, в которых окисление 1 моля глюкозы приводит к образованию только 26 молей АТР.
Фосфорилирование в дыхательной цепи. Регенерация АТР при фосфорилировании в дыхательной цепи и фотосинтетическом фосфорилировании протекает в мембранах. ATP-синтаза, так же как и компоненты дыхательной цепи, является составной частью мембраны. Каким образом происходящий в дыхательной цепи перенос водорода и электронов сопряжен с синтезом АТР, до конца еще не выяснено. Однако многочисленные эксперименты показали, что регенерация АТР происходит только в пространствах, окруженных со всех сторон мембранами, - в пузырьках, или везикулах. Процессы переноса водорода и электронов теснейшим образом сопряжены с перемещением протонов, а этот процесс в свою очередь необходим для регенерации АТР.
Транспорт протонов. Добавляя молекулярный кислород к суспензии аэробных бактерий или митохондрий, находившихся перед тем в анаэробных условиях, можно заметить снижение pH среды. Это позволяет заключить, что во время дыхания из бактериальных клеток и митохондрий выводятся протоны (рис. 7.12, А и Б). Если из мембран бактерий или митохондрий приготовить пузырьки, у которых прежняя внутренняя сторона обращена наружу (вывернутые везикулы), то при дыхании будет наблюдаться «обращенный» перенос протонов, приводящий к подщелачиванию суспензионной среды (рис. 7.12, В). В результате перемещения протонов создается градиент электрохимического потенциала. Внутреннее пространство интактных митохондрий или бактерий электроотрицательно по отношению к суспензионной среде и отличается более высоким pH. Оба трансмембранных градиента - градиенты pH и электрического потенциала - стремятся вернуть перенесенный наружу протон обратно внутрь. Эта разность электрохимических протонных потенциалов (называемая также протонным потенциалом или «протонодвижущей силой») складывается из электрического мембранного потенциала (∆ψ) и разности pH между наружной и внутренней сторонами мембраны (∆рН) в соответствии с уравнением
![]()
где Z = 2,3∙R∙T/F, т. е. 59 мВ при 25°С. Протонный потенциал может быть обусловлен только разностью pH, только электрическим мембранным потенциалом или тем и другим одновременно.
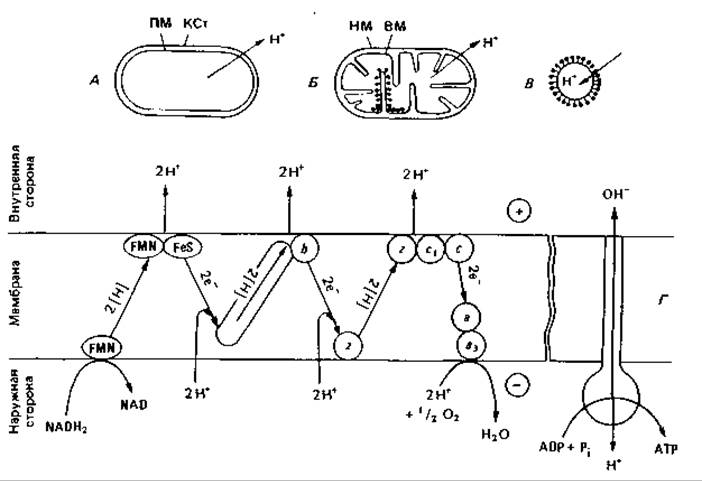
Рис. 7.12. Транспорт протонов при субстратном дыхании. Из бактериальной клетки (А) или из митохондрии (Б) в суспензионную среду выходят протоны. У «субмитохондриальных частиц» (В) мембраны вывернуты (внутренней стороной наружу), поэтому протоны транспортируются внутрь. Г. Путь переноса протонов и электронов при окислении NADH2 согласно хемиосмотической гипотезе. KCт - клеточная стенка; ПМ - плазматическая мембрана; ВМ и НМ - внутренняя и наружная мембраны митохондрий; Q - кофермент Q; Z - гипотетический переносчик водорода; FeS - железосерные белки; b, с, а, a3-цитохромы.
С экспериментальными данными согласуются следующие представления. Плазматическая мембрана бактерий и внутренняя мембрана митохондрий непроницаемы для ионов, в том числе Н+ и ОН-; электрическая проводимость мембран низка. Мембрана асимметрична; хотя двойной липидный слой кажется симметричным, топография функциональных белков (электрон-транспортных компонентов, АТФ-синтазы, пермеазы и др.) придает мембране асимметричный характер. Пространственная ориентация ферментных молекул обусловливает направленный обмен веществами. Согласно предположению Митчелла, дыхательная цепь состоит из чередующихся переносчиков водорода и переносчиков электронов, расположенных в мембране таким образом (рис. 7.12, Г), что окисление субстрата приводит к потреблению протонов на внутренней стороне мембраны и освобождению их на наружной стороне. Если цепь образует три петли, то при окислении NADH2 наружу выводятся шесть протонов. Такой перенос протонов за счет энергии дыхания ведет к созданию электрохимического градиента между наружной и внутренней сторонами мембраны. Протонный потенциал - это и есть та сила, которая в конечном счете осуществляет фосфорилирование, т. е. обеспечивает синтез АТР. Биохимическое преобразование энергии путем регенерации АТР является, таким образом, результатом создания протонного градиента и сопровождается уменьшением потенциала на мембране. Такова суть «хемиосмотической теории» Митчелла.
Регенерация АТР из ADP и Рi. Синтез АТР из ADP и неорганического фосфата (Р;) катализируется ATP-синтазой. Этот фермент преобразует доставляемую потоком электронов энергию в энергию фосфо-эфирных связей АТР. Фермент найден во всех мембранах, участвующих в преобразовании энергии, а именно в мембранах митохондрий, хлоропластов и бактерий. Он достаточно велик (мол. масса 350∙103) и имеет сложное строение (рис. 7.12, Г) - состоит из головки, построенной из нескольких субъединиц, ножки и основания; последнее погружено в липидный слой плазматической мембраны. ATP-синтаза катализирует присоединение фосфата к ADP с отщеплением молекулы воды, в результате чего образуется АТР. Каким образом поток протонов или протонный градиент осуществляет эту реакцию фосфорилирования, пока еще неизвестно; возможно, что протоны по какому-то каналу или поре в молекуле фермента оттекают обратно внутрь митохондрии или бактерии, а освобождающаяся при этом энергия используется для фосфорилирования.
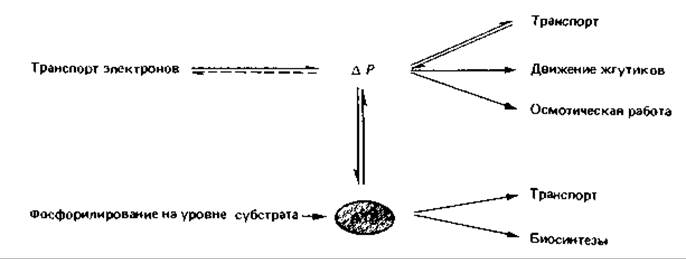
ATP-синтаза идентична Fi-АТРазе, поэтому ее активность можно обнаружить по гидролизу АТР: АТР + Н2O → ADP + Рi + Н+. Обратимость реакции ATP-синтазы имеет чрезвычайно важное значение для клетки. Например, образовавшийся в результате субстратного фосфорилирования АТР может быть использован ATP-синтазой для создания протонного градиента. Таким образом, этот фермент может также играть роль «протонного насоса». Благодаря обратимости процессов, протекающих при этом в плазматической мембране, протонный градиент и АТР могут как бы взаимно превращаться друг в друга. Это имеет большое значение для ряда других процессов, таких как транспорт веществ, движение жгутиков, процессы биосинтеза, что можно пояснить следующей схемой:
Обратный перенос электронов за счет энергии АТР. Особые проблемы встают перед бактериями, использующими такой донор электронов, у которого окислительно-восстановительный потенциал более положителен, чем у пиридиннуклеотидов. Восстановленные пиридиннуклеотиды необходимы для процессов синтеза, в частности для восстановления 3-фосфоглицерата при автотрофной фиксации СO2. Поэтому восстановление пиридиннуклеотидов требуется и в тех случаях, когда донорами электронов служат сульфид, тиосульфид, сера, нитрат или Fe2+. Так как прямое восстановление NAD такими донорами невозможно по термодинамическим причинам, приходится предположить, что NAD восстанавливается здесь путем переноса электронов в обратном направлении за счет энергии АТР и что регенерация АТР происходит только на конечном (кислородном) участке дыхательной цепи. Такой АТР-зависимый обратный транспорт электронов, сопровождающийся восстановлением NAD, уже обнаружен у Nitrobacter и Thiobacillus.
Токсическое действие молекулярного кислорода на аэробные и анаэробные организмы. Кислород служит конечным акцептором электронов при аэробном дыхании и поэтому нужен всем аэробным организмам. Еще со времен Пастера, изучавшего образование масляной кислоты бактериями, известно, что кислород токсичен для строго анаэробных видов. Неожиданностью явилось то, что кислород может оказывать токсическое действие и на аэробные организмы. Поэтому у большинства организмов имеются ферменты, способные защищать клетку от токсичных продуктов, образующихся из O2.
В биологических средах следует различать три вида активации кислорода в зависимости от числа электронов, одновременно переносимых на молекулу O2:
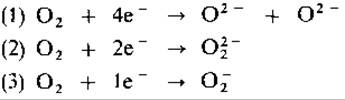
Реакцию (1) катализирует цитохромоксидаза - конечный фермент электрон-транспортной цепи. Зжесь одновременно происходит перенос
четырех электронов, и в результате получаются два иона О2-, каждый из которых при взаимодействии с двумя протонами образует воду. Из всех ферментов только цитохромоксидаза и некоторые «синие ферменты», содержащие медь (тирозиназа, лакказа), способны переносить сразу четыре электрона на O2.
Реакция (2) характерна для некоторых ферментов, содержащих флавин (глюкозооксидаза, оксидазы аминокислот, ксантиноксидаза). Эти ферменты одновременно переносят два электрона и восстанавливают O2 до иона пероксида O2-, который, реагируя с протонами, образует Н2O2. Перекись водорода для клетки токсична, так как окисляет, например, SH-группы; защитное действие в этом отношении оказывают каталаза и пероксидаза:

Так как ферменты, содержащие флавин, есть у многих анаэробных и аэробных бактерий, становится понятным, почему большинство аэробных организмов обладает каталазой. В реакции (3), катализируемой многими оксидазами (ксантиноксидазой, альдегидоксидазой, NADPH- оксидазой и др.), переносится только один электрон. При этом образуется супероксид-ион O2, который, будучи радикалом, очень реакционноспособен. Мы имеем здесь дело только с побочной реакцией названных ферментов; однако супероксид-радикал и продукт его реакции с Н2O2(O2 + Н2O2 + Н2→ O2 + Н2O + ОН) - гидроксил- радикал, будучи весьма реакционноспособны, вызывают образование в клетке высокореактивных соединений. Защитное действие оказывает супероксиддисмутаза:
![]()
Таким образом, супероксиддисмутаза совместно с каталазой превращает супероксид-радикалы в безвредный кислород (в основном состоянии).
Как полагают, присутствие кислорода переносят только те организмы, у которых имеется супероксиддисмутаза. Этот фермент найден почти у всех до сих пор изученных аэротолерантных бактерий. Однако делать обобщения еще рано, так как интенсивные исследования продолжаются.
Электрон-транспортные процессы у анаэробных бактерий. В анаэробных условиях, т. е. в отсутствие кислорода, хемоорганотрофные организмы могут получать биохимическую энергию (в форме АТР) двумя способами - путем брожения и путем фосфорилирования, сопряженного с переносом электронов. В распоряжении организмов, осуществляющих брожение, имеется мало реакций, служащих для синтеза АТР. Это реакции фосфорилирования на уровне субстрата (разд. 7.21).
Многие бактерии, однако, и в анаэробных условиях используют окислительное (электрон-транспортное) фосфорилирование; при этом происходит перенос электронов, получаемых при расщеплении субстрата, по (укороченной) электрон-транспортной цепи на экзогенные (добавленные в питательную среду) или эндогенные (образующиеся при разложении субстрата) акцепторы. Акцепторами электронов могут быть ионы нитрата, сульфата, карбоната и фумарата, а также сера; соответствующие виды бактерий объединяют в физиологические группы нитратвосстанавливающих, денитрифицирующих, сульфатредуцирующих, метаногенных и ацетогенных бактерий, а также бактерий, восстанавливающих серу. Все эти бактерии играют важную роль в природном балансе. Так как фосфорилирование, сопряженное с транспортом электронов, долгое время считалось характерной принадлежностью аэробного дыхания, то, говоря о преобразовании энергии при окислительном фосфорилировании в анаэробных условиях, в настоящее время пользуются также термином «анаэробное дыхание» (см. гл. 9).
Электрон-транспортное фосфорилирование с фумаровой кислотой в качестве акцептора электронов встречается не только у бактерий, но и у червей и даже млекопитающих. Реакцию, катализируемую фумарат-редуктазой, можно выявить по накоплению или выделению янтарной кислоты.