Общая микробиология - Шлегель Г. 1987
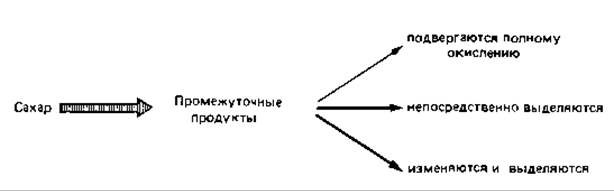
Неполные окисления
Образование других органических кислот
Многие органические кислоты, в том числе и аминокислоты, получают в промышленных масштабах с помощью микроорганизмов, осуществляющих неполные окисления. Преимущества использования грибов для получения лимонной, итаконовой, глюконовой, яблочной и других кислот выяснились уже в начале нашего столетия. Что касается бактерий, то еще десять лет назад с их помощью получали только уксусную и глюконовую кислоты; однако теперь они играют большую роль и как продуценты аминокислот.
10.2.1 Образование кислот грибами
Для грибов характерен окислительный тип метаболизма. Это не означает, что грибы не способны к анаэробному расщеплению углеводов, т. е. не могут их сбраживать (ведь спиртовое брожение осуществляется как раз дрожжами!); однако в анаэробных условиях сколько-нибудь длительный рост грибов невозможен. Кроме того, основными продуктами брожения оказываются этанол или молочная кислота. Другие органические кислоты образуются только в аэробных условиях.
В естественных местах обитания грибов, т. е. в почве, никогда не бывает заметного накопления промежуточных продуктов их жизнедеятельности. При недостатке питательных веществ грибы получают максимум энергии и образуют клеточные вещества за счет полного окисления и ассимиляции субстрата. Если в лабораторных условиях и в промышленной практике дело обстоит иначе и многочисленные продукты обмена выделяются в среду, то это следует объяснить избыточным снабжением грибов углеводами и известной «дезорганизацией» их метаболизма, которой часто способствует исключение из среды некоторых микроэлементов.
Известно, что грибы обладают мощной гликолитической системой. В «узких местах» метаболических путей происходит накопление промежуточных продуктов, которые прямо или после назначительных химических изменений выделяются в среду. Дж. Фостер особо подчеркивал отклонения в обмене веществ, возникающие при избытке субстрата. В конечном счете большинство неполных окислений связано с нарушением регуляции метаболизма.
Во многих случаях достаточно удалить какой-нибудь необходимый микроэлемент, чтобы промежуточные продукты начали выделяться в среду. Значительное влияние оказывает изменение концентрапии цинка, железа, марганца, меди, а также магния, калия и кальция (см. рис. 10.1).
Молочную кислоту выделяют главным образом представители порядка Mucorales (Rhizopus nodosus, R. oryzae, R. arrhizus, R. nigricans) и другие фикомицеты (Allomyces, Saprolegnia, Blastocladiella). Однако у грибов она никогда не бывает единственным продуктом, как у гомоферментативных молочнокислых бактерий. Наряду с молочной кислотой грибы образуют в небольших количествах фумаровую, янтарную, яблочную, муравьиную и уксусную кислоты, а также этанол. Для получения максимального выхода молочной кислоты необходимо присутствие О2. Поскольку грибы не нуждаются в сложных питательных средах и в качестве источника азота довольствуются мочевиной, получать молочную кислоту в особо чистом виде с помощью грибов проще, чем использовать молочнокислое брожение, осуществляемое лактобациллами.
Способность к образованию фумаровой кислоты характерна для многих родов Mucorales (Mucor, Cunninghamella, Circinella, Phizopus).
Глюконовую кислоту образуют многие аспергиллы и пенициллы. Это продукт ферментативного окисления глюкозы глюкозооксидазой, выделяемой грибами в питательную среду. У Aspergillus niger этот процесс может идти с высоким выходом даже в 30-35%-ных растворах глюкозы, если выделяющуюся кислоту нейтрализовать карбонатом кальция.
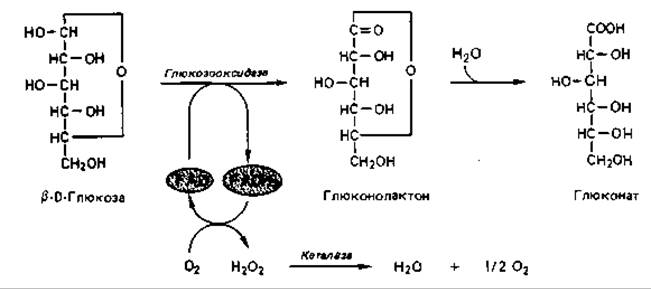
Глюкозооксидаза представляет собой фермент, содержащий в качестве простетической группы FAD. При окислении глюкозы под действием этого фермента как промежуточный продукт образуется ß-D- глюконо-5-лактон, который затем спонтанно или же с помощью другого фермента - глюконолактоназы - присоединяет воду и превращается в глюконовую кислоту. Восстановленная глюкозооксидаза переносит водород на кислород воздуха с образованием перекиси водорода, которая затем под действием каталазы может расщепляться на воду и кислород.
Щавелевую кислоту выделяют многие грибы. Ее образованию способствует щелочная реакция питательной среды.
Много работ посвящено образованию лимонной кислоты, особенно техническим и экономическим аспектам ее производства. После того как Вемер в 1893 году обнаружил лимонную кислоту в культурах грибов (Citromyces pfefferianus), Кюрри в 1917 году разработал основы получения ее в промышленном масштабе; он установил, что Aspergillus niger превосходно растет на средах с начальными значениями pH от 2,5 до 3,5 и выделяет при этом большие количества лимонной кислоты. С повышением pH появляется сначала глюконовая кислота, а затем щавелевая. Низкое начальное значение pH имеет то преимущество, что позволяет не опасаться бактериального загрязнения.
Промышленное производство лимонной кислоты до сих пор часто ведется без соблюдения стерильности, поверхностным способом в кюветах. В бродильные камеры помещают алюминиевые кюветы (размером 2 х 2,5 х 0,15 м), заполненные на высоту 8 см раствором мелассы, и после инокуляции спорами гриба выдерживают их 9-11 дней при 30°С. Выход продукта получается весьма значительным. После спуска питательной среды можно снова подвести под мицелий гриба свежий раствор. Лимонную кислоту осаждают из переработанного раствора, добавляя карбонат кальция, а затем перекристаллизовывают и выделяют с помощью серной кислоты. В настоящее время при производстве лимонной кислоты все более широко применяют глубинный метод.
Зависимость образования лимонной кислоты от состава среды особенно четко выражена у Aspergillus niger. В этом легко убедиться, изменяя содержание одного из компонентов среды при сохранении всех прочих условий. Если к простой среде с глюкозой после удаления микроэлементов (их осаждают гидроокисью алюминия) прибавлять определенные компоненты в известных концентрациях, а затем инокулировать среду и после 9-дневной инкубации в колбах со встряхиванием определять массу мицелия, остаточное количество сахара и количество образовавшейся лимонной кислоты, то можно установить ряд интересных соотношений (рис. 10.1). Приведенные кривые позволяют сделать следующие выводы: а) нитрат аммония и сульфат магния не оказывают какого-либо специфического влияния на выход лимонной кислоты - они влияют только на рост мицелия; б) кривые для цинка, железа и фосфора характеризуются четким пиком. При концентрациях, обеспечивающих лишь субоптимальный рост мицелия, отмечается более высокий выход лимонной кислоты; однако при дальнейшем снижении концентрации этих трех элементов торможение роста мицелия ограничивает и выработку кислоты; в) особенно высокие выходы можно получить в тех случаях, когда два компонента - железо и цинк-присутствуют в лимитирующих количествах. Марганец оказывает отчетливое подавляющее действие: 3 мкг Мn2 + на 1 л среды уже снижают выход кислоты (между тем при использовании очищенной продажной глюкозы на каждый литр среды вместе с 140 г этого сахара вносится 10 мкг Мn2 + !).
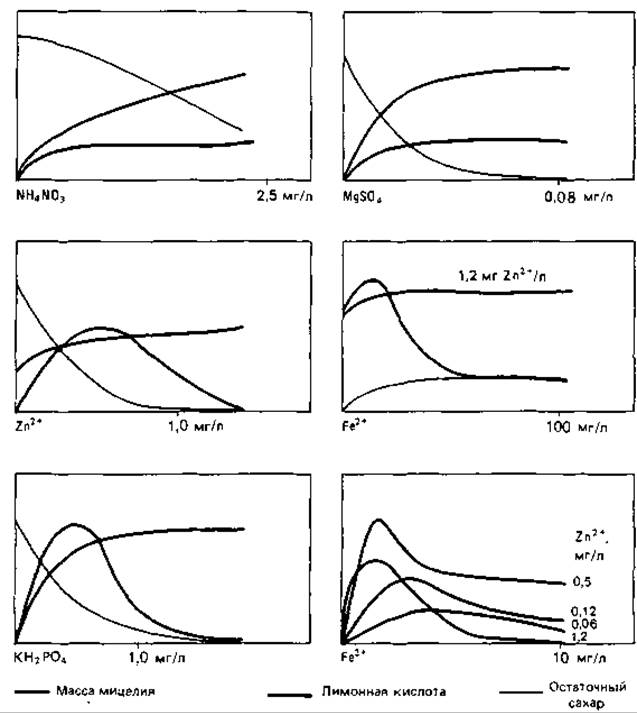
Рис. 10.1. Зависимость роста гриба Aspergillus niger и образования им лимонной кислоты от состава питательной среды. Полная среда содержит следующие компоненты (в г/т): глюкоза-140; азот-1,05; КН2РO4 - 2,5; MgSO4 ∙ 7Н2О - 0,5; железо-0,01; цинк-0,0025; pH 3,8. (Shu Р., Johnson M.J., J. Bacteriol., 56 [1948], 577.)
Повышенное выделение лимонной кислоты при недостатке железа объясняется скорее всего тем, что железо выступает в роли кофактора аконитазы, медь же действует по отношению к нему как антагонист. На этом основан новый технический прием, повышающий выход нужного продукта: даже в присутствии небольших количеств ионов железа в растворе мелассы (10 мг на 1 л) можно получить максимальный выход лимонной кислоты, добавив к среде избыток ионов меди (150 мг на 1 л).
Итаконовую кислоту образуют лишь немногие штаммы Aspergillus itaconicus и A. terreus. Этот процесс тоже происходит при pH среды около 2,0.
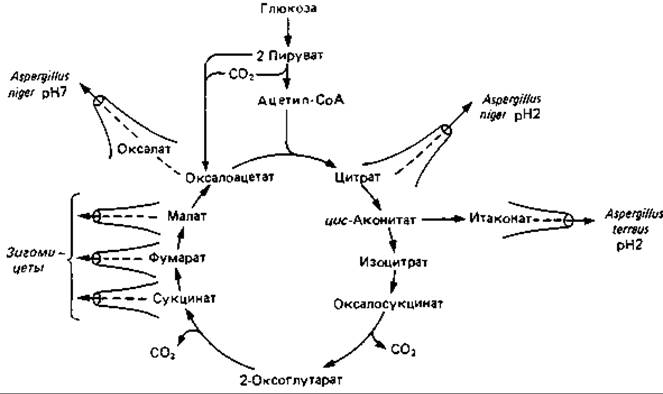
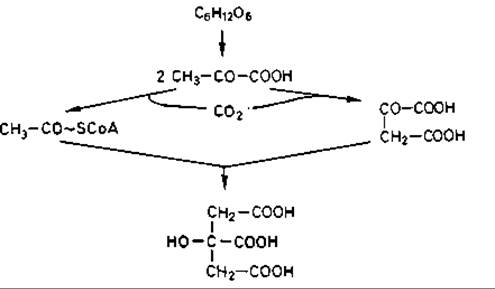
Рис. 10.2. Пути образования органических кислот у грибов.
Химизм образования кислот у грибов. Не подлежит сомнению, что в образовании различных кислот из глюкозы участвуют реакции цикла трикарбоновых кислот («цикла лимонной кислоты»). Есть основания предполагать, что яблочная, фумаровая, янтарная и лимонная кислоты образуются так, как это описано для цикла трикарбоновых кислот, а затем непосредственно выделяются в среду (рис. 10.2).
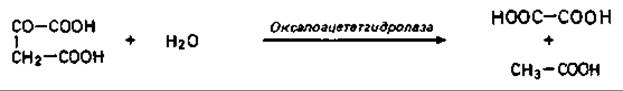
Щавелевая кислота образуется в результате гидролиза щавелевоуксусной кислоты под действием оксалоацетатгидролазы:
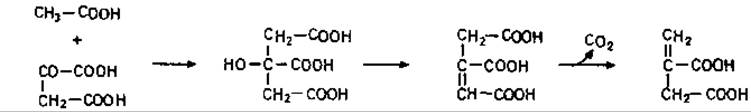
Предшественником итаконовой кислоты служит цис-аконитовая кислота. Во время декарбоксилирования происходит перемещение электронов в углеродном скелете, и при этом двойная связь переходит из положения 2,3 в положение 3,4:
Цикл трикарбоновых кислот выполняет в первую очередь катаболическую функцию. Однако наряду с этим он служит центральным «распределителем», поставляющим предшественники для синтеза многих клеточных компонентов. Если на каком-либо участке промежуточные продукты удаляются из цикла, то на долю других реакций выпадает задача обеспечить цикл оксалоацетатом (щавелевоуксусной кислотой). Мы уже упоминали две анаплеротические реакции (см. рис. 7.7 и с. 251): 1) превращение изоцитрата через глиоксилат и ацетил-СоА в малат и сукцинат и 2) карбоксилирование пирувата с образованием оксало-ацетата. Из этих двух реакций более важна вторая. Глиоксилатный цикл нужен в первую очередь для использования ацетата, высших жирных кислот и углеводов, а также других субстратов, при распаде которых в качестве промежуточного продукта образуется ацетил-СоА. Глюкоза часто подавляет синтез ключевых ферментов глиоксилатного цикла (изоцитратлиазы и малатсинтазы).
Если бы лимонная кислота синтезировалась только из ацетил-СоА, то 1 моль глюкозы давал бы лишь 2/3 моля кислоты; это означает, что из 100 г глюкозы могло бы образоваться только 71,1 г лимонной кислоты. Между тем ее выход иногда достигает 75-87 г. Исследования показали, однако, что происходит фиксация больших количеств СО2. В опытах с 14СО2 метка обнаруживалась в 6-м углеродном атоме лимонной кислоты. Превращение глюкозы в лимонную кислоту протекает по следующей схеме:
10.2.2 Образование аминокислот бактериями
В 1957 году Киносита открыл Corynebacterium glutamicum и тем самым положил начало новой эпохе в промышленном использовании процессов неполного окисления. Эту бактерию, выделяющую L-глутаминовую кислоту, удалось выявить с помощью простого способа отбора - биоавтографического метода. Большое количество почвенных бактерий переносили методом отпечатков (разд. 15.2.1) на различные питательные среды, оставляли на некоторое время для роста, а затем убивали УФ-облучением. После этого чашки заливали агаризованной средой, содержавшей суспензию клеток штамма, нуждающегося в глутаминовой кислоте. Рост такой индикаторной бактерии указывал, какие из выросших ранее колоний выделяли глутаминовую кислоту.
L-Глутаминовая кислота образуется только в строго аэробных условиях. При выращивании культуры в ферментерах емкостью 50 м3 в среде, содержащей 10% глюкозы и мочевину в качестве источника азота, за 40 ч при 30°С накапливается около 50 г L-глутамата на 1 л. что соответствует выходу 0,6 моля глутамата на 1 моль использованной глюкозы.
Катаболизм глюкозы идет, очевидно, по фруктозобисфосфатному пути и затем через цитрат и 2-оксоглутарат приводит к образованию L- глутамата. Щавелевоуксусную кислоту поставляет не глиоксилатный цикл, а процесс карбоксилирования пирувата, как и в случае образования лимонной кислоты у Aspergillus niger. При добавлении к среде 14СО2 метка обнаруживается в дальнейшем почти исключительно в а- карбоксильной группе глутаминовой кислоты. Выделение этой аминокислоты зависит, очевидно, от накопления 20-оксоглутарата из-за отсутствия 2-оксоглутаратдегидрогеназы. Если в среде нет ионов аммония, выделяется 2-оксоглутаровая кислота. С целью промышленного получения глутаминовой кислоты в качестве субстрата вместо глюкозы в последнее время стали использовать ацетат.

Штаммы Corynebacterium glutamicum и Brevibacterium divaricatum, выделяющие L-глутаминовую кислоту, нуждаются в биотине. Концентрация биотина в среде имеет решающее значение для накопления этой кислоты. Оптимальное содержание биотина составляет 2,5 мкг на 1 л среды. При более низких концентрациях рост бактерий оказывается слишком слабым; более высокие концентрации биотина стимулируют рост, однако уменьшают выход глутаминовой кислоты (рис. 10.3).
Для получения других аминокислот можно использовать ауксотрофных мутантов Corynebacterium glutamicum. Мутанты, нуждающиеся в гомосерине, при подходящих условиях выделяют до 20 г L-лизина на 1 л среды. Другие мутанты С. glutamicum, а также представители семейств Enterobacteriaceae и Pseudomonadaceae служат продуцентами L- гомосерина, L-валина, L-изолейцина, L-триптофана, L-тирозина и других аминокислот.
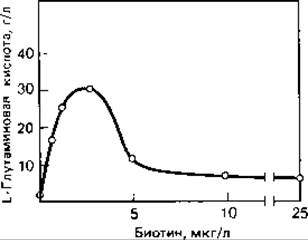
Рис. 10.3. Зависимость между образованием L-глутаминовой кислоты у Corynebacterium glutamicum и содержанием биотина в среде. (Huang Н. Т., Progr. indust. Microbiol., 5 [1964], 57.)
В Японии разработаны методы получения инозиновой и гуаниловой кислот с помощью микроорганизмов. Эти 5'-нуклеотиды используются как приправы для улучшения вкуса пищевых продуктов.