Общая микробиология - Шлегель Г. 1987
Фототрофные бактерии и фотосинтез
Первичные процессы фотосинтеза
Под фотосинтезом понимают происходящее в клетках фототрофных организмов преобразование световой энергии в биохимически доступную энергию (АТР) и восстановительную силу [NAD(P)H2], а также связанный с этим синтез клеточных компонентов. Фотосинтетическое фосфорилирование и фотосинтетическое восстановление пиридиннуклеотида - это процессы, ведущие к образованию первых стабильных продуктов фотосинтеза.
К такому пониманию пришли в результате экспериментальных и теоретических исследований, основанных главным образом на сравнении фотосинтеза у фототрофных бактерий и у зеленых растений. После того как Виноградский (1888) установил, что для некоторых бактерий источником энергии при ассимиляции СO2 отнюдь не всегда служит свет, а Энгельман (1883-1888) на основании своих физиологических исследований отнес пурпурные бактерии к фототрофным
организмам, Будер (1919) показал, что эта группа бактерий обладает новым, не известным ранее типом метаболизма. Серные и несерные пурпурные бактерии ассимилируют СO2 или органические вещества на свету. Однако такого рода фотосинтез существенно отличается от фотосинтеза высших растений: 1) вода здесь не может служить донором водорода, и поэтому такой фотосинтез не сопровождается выделением O2; 2) бактерии используют в качестве доноров водорода не воду, a H2S или органические вещества.
Количественные исследования, проведенные на пурпурных серобактериях (ван Ниль, 1931). позволили вывести уравнение ассимиляции:
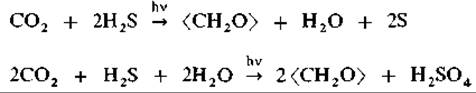
Если сравнить первое из этих уравнений с уравнением, описывающим фотосинтез у зеленых растений, можно заметить удивительную аналогию:
У Chromatium
![]()
У зеленых растений
![]()
Эта аналогия позволяет заключить, что в бактериальном фотосинтезе роль воды выполняет сероводород. Выведенное отсюда общее уравнение фотосинтеза
![]()
позволило выдвинуть гипотезу, согласно которой в основе всякого фотосинтеза лежит один и тот же первичный процесс, а разные типы фотосинтеза отличаются друг от друга только природой донора водорода (вода, сероводород или органические вещества). Этот общий первичный процесс видели сначала в фотолизе воды (Н2O + hv → [Н] + [ОН]) - в разложении ее на восстановительный и окислительный компоненты. Считали, что бактерии нуждаются в экзогенном доноре водорода Н2А, с помощью которого они восстанавливают окислительный компонент до воды, тогда как зеленые растения приобрели способность отщеплять от окислительного компонента кислород (4[ОН] → 2Н2O + O2). Сейчас от этой концепции, рассматривающей разложение воды как первичный процесс фотосинтеза, пришлось отказаться, однако идея о переносе восстановительных эквивалентов с помощью энергии света сохраняется и в современной теории фотосинтеза.
Первыми стабильными продуктами фотосинтеза являются АТР и восстановительная сила. Эти продукты можно обнаружить как в интактных клетках и выделенных из них хлоропластах (у зеленых растений), так и в суспензиях фотосинтетических мембранных везикул из пурпурных бактерий. Фиксация СO2 не обязательно сопряжена со световой реакцией. Она может происходить и как «темновая реакция», не зависящая от пигментсодержащих структур, при наличии АТР и NAD(P)H2. Эти два процесса разделены и в пространстве: фотосинтез происходит в мембранах и на их поверхности, а фиксация СO2 - в цитоплазме или в строме хлоропластов. Как уже говорилось, оксигенный фотосинтез цианобактерий и растений отличается от аноксигенного фотосинтеза анаэробных фототрофных бактерий используемым донором водорода. Для того чтобы донором могла служить вода, необходимо последовательное осуществление двух фотореакций. Для использования же доноров с более отрицательным окислительно-восстановительным потенциалом достаточно одной-единственной фотореакции. Так как первичные процессы при оксигенном фотосинтезе изучены лучше, чем при аноксигенном, их мы и рассмотрим в первую очередь.
12.2.1 Оксигенный фотосинтез
Первичные процессы фотосинтеза протекают в тилакоидах - плоских замкнутых мембранных пузырьках, содержащихся в клетках цианобактерий и в хлоропластах водорослей и высших растений.
Тилакоидные мембраны и светособирающие пигменты (пигменты антенн). Тилакоидная мембрана содержит в себе пигментные молекулы (хлорофилл а, хлорофилл b и каротиноиды), переносчики электронов и ферменты. Подавляющее большинство молекул хлорофилла (5= 99,5%), а также дополнительные пигменты (каротиноиды, фикобили- протеины) ответственны за поглощение света и распределение энергии; они образуют систему антенны. Лишь незначительная часть хлорофилла а выполняет роль фотохимического реакционного центра, в котором протекает собственно фотохимическая окислительно-восстановительная реакция. Пигменты антенн (светособирающие пигменты) улавливают свет и передают энергию хлорофиллу реакционного центра (Каротиноид → Каротиноид*; Хлорофилл + Каротиноид* → Хлорофилл* + Каротиноид). Каротиноиды выполняют также защитную функцию: при очень ярком солнечном освещении они отдают избыточную энергию в окружающую среду и тем самым защищают молекулы хлорофилла от фотоокисления. Система светособирающих пигментов и реакционный центр объединены в так называемую фотосинтетическую единицу.
Фотореакции. Фотореакции относятся к первичным процессам любого фотосинтеза. Местом, где протекают эти фотохимические окислительно-восстановительные реакции, являются реакционные центры. Реакционный центр состоит из ряда компонентов, наиболее важные из которых - первичный донор электронов (особый комплекс из хлорофилла и белка) и первичный акцептор электронов. Эти два компонента представляют собой окислительно-восстановительные системы. Система донора (Р/Р+) обладает положительным, а система акцептора (Х/Х-) - отрицательным потенциалом. Под воздействием энергии света происходит перенос одного электрона:
![]()
Вместо этого можно написать
![]()
Следовательно, первую фотореакцию можно представить следующим образом:
![]()
Аналогичным образом можно представить и фотореакцию у пурпурных бактерий:
![]()
Таким образом, в результате фотореакции донор теряет один электрон - возникает «дырка» (электронный дефект). Такие «дырки» должны заполняться электронами, которые могут поступать сюда по одному из двух путей - по пути нециклического или циклического переноса электронов. При нециклическом переносе электроны поступают от экзогенного внешнего донора: в случае второй фотореакции - от молекул воды, в случае первой реакции - из электрон-транспортной цепи, связывающей обе фотосистемы между собой. При циклическом переносе электроны возвращаются от восстановленного акцептора (X-) к окисленному донору. Фотохимическая окислительно-восстановительная реакция, в ходе которой Р окисляется, а X восстанавливается, представлена на следующей схеме:
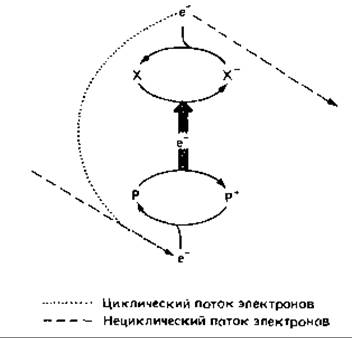
Циклический перенос электронов приводит к изменению заряда мембраны, а нециклический перенос - кроме того, и к восстановлению NADP.
Две фотореакции в двух пигментных системах (фотосистемах). При оксигенном фотосинтезе работают две пигментные системы, включенные последовательно (рис. 12.14). Пигментную систему, возбуждаемую более длинноволновым светом (λ < 730 нм), называют фотосистемой I, а возбуждаемую более коротковолновым светом (λ < 700 нм) - фотосистемой II. Фотохимически активный реакционный центр фотосистемы I содержит Хл аI (Р700), играющий роль первичного донора электронов в первой фотореакции. Световая энергия, поглощаемая светособирающими пигментами фотосистемы I, передается в реакционный центр и переводит в возбужденное состояние Хл аI. Это приводит к окислению Хл aI, т. е. к отдаче им одного электрона. Хл аI превращается при этом в Хл аI. Другими словами, в результате отдачи электрона в реакционном центре образуется «дырка», или «электронная вакансия». Эта «дырка» тотчас же заполняется другим электроном, поступающим по специальному электрон-транспортному пути. Акцептором отданного электрона, по-видимому, служит железосерный белок («X»), Он обладает еще более отрицательным окислительно-восстановительным потенциалом, чем — 420 мВ, возможно — 530 мВ. Этот акцептор в свою очередь отдает электрон ферредоксину, а с восстановленного ферредоксина восстановительная сила может передаваться на NADP или другие акцепторы. Наряду с этим возможен и циклический перенос электрона, при котором электрон от «X» передается через пластохинон, цитохромы и пластоцианин обратно к хлорофиллу а+I реакционного центра.
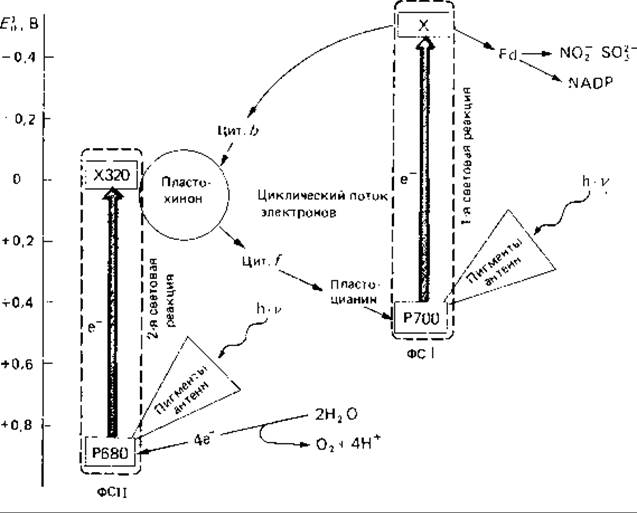
Рис. 12.14. Фотосинтетический перенос электронов («Z-схема»). По вертикали-окислительно-восстановительный потенциал). Р700-Хл aI. донор электронов фотосистемы I (ФС I); Р680-Хл аII донор электронов фотосистемы II (ФС II); X 320-акцептор электронов ФС II; Х-акцептор электронов ФС I. белок, содержащий железо и серу; Fd - ферредоксин; Цит - цитохром. Фотохимические реакционные центры заключены в красные рамки. (Объяснение в тексте.)
Реакционный центр фотосистемы II содержит Хл аІІ (Р680), который служит первичным донором электронов во второй фотореакции. Получив энергию, поглощенную светособирающими пигментами фотосистемы II, этот хлорофилл переходит в возбужденное состояние. Возбуждение Хл аII ведет к эмиссии одного электрона, являющегося слабым восстановителем (Е'0≈ О В). Этот электрон принимает молекула особого пластохинона (Х320), который при этом восстанавливается до семи- хинона. Донором электронов для фотосистемы II служит вода. «Дырка», образовавшаяся в Хл а+II в результате потери электрона, заполняется одним из электронов, освобождающихся при образовании O2 из воды (2Н2О → О2 + 4Н+ 4е-). Разложение воды происходит при участии марганца.
Две описанные выше пигментные системы связаны между собой электрон-транспортной цепью, важным звеном которой является пластохинон. Подобно убихинону в дыхательной цепи, пластохинон в фотосинтетической электрон-транспортной цепи находится в большом избытке и выполняет функцию накопителя (депо) электронов. Этот накопитель может вмещать не менее 10 электронов (на 1 молекулу Хл аII), поступающих от Х320. Окисление пластохинона осуществляет фотосистема I, т. е. электроны «накопителя» расходуются на заполнение «дырок» в Хл a+I . От пластохинона электроны передаются цитохрому f (мембраносвязанному цитохрому типа с), затем пластоцианину (растворимый медьсодержащий белок) и, наконец, хлорофиллу а+I . Таким образом, пластохинон выполняет важную функцию накопления и дальнейшей передачи электронов, поступающих из нескольких (как минимум десяти) электрон-транспортных цепей.
Основные пути транспорта электронов в ходе первичных процессов фотосинтеза показаны на рис. 12.14. Это известная Z-схема - результат исследований, в которых использовались методы импульсной спектрофотометрии, а также искусственные доноры и акцепторы электронов и специфические ингибиторы. Она дает представление об окислительновосстановительных потенциалах пигментов и переносчиков электронов и о последовательности их окисления и восстановления, но ничего не говорит о локализации этих компонентов в мембране.
Локализация пигментов и переносчиков электронов в мембране. Некоторые сведения по этому вопросу были получены при исследовании функций тилакоидов в присутствии антител, а также липофильных или гидрофильных искусственных окислительно-восстановительных систем. Иммунные антитела, полученные против отдельных очищенных компонентов фотосинтетической электрон-транспортной системы, не в состоянии проникать сквозь мембрану и реагируют поэтому только с теми компонентами, которые расположены на наружной поверхности тилакоидов. Например, антитела к ферредоксину или к ферредоксин-NADP-редуктазе эффективно подавляют функцию фотосистемы I; значит, эти два компонента находятся на внешней поверхности тилакоидов. В то же время поверхность, на которой расположены доноры электронов, недоступна для антител. Хотя данные о структурной организации фотосистемы II еще весьма противоречивы, уже можно привести гипотетическую схему (рис. 12.15). Эту схему пространственной ориентации направленного фотосинтетического транспорта электронов внутри тилакоидной мембраны следует отличать от схемы на рис. 12.14, где компоненты расположены по вертикали в соответствии с их окислительновосстановительными потенциалами. Схема на рис. 12.15 наглядно показывает, что электроны, освобождающиеся в результате расщепления воды, переносятся из внутреннего пространства тилакоидов в строму.
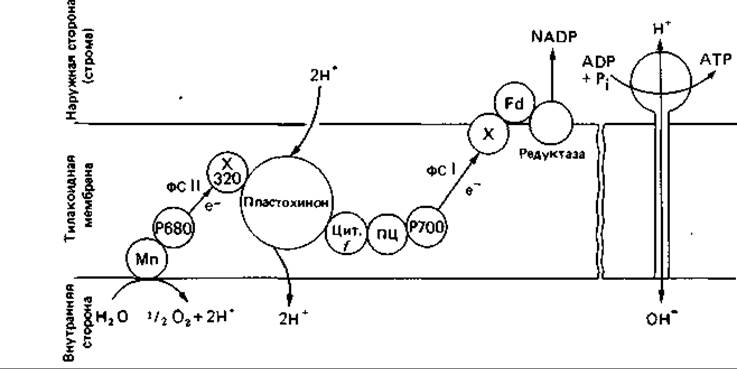
Рис. 12.15. Схема пространственной ориентации электрон-транспортной системы внутри тилакоидной мембраны. Компоненты расположены на мембране и в ее толще таким образом, что происходит направленный перенос электронов через мембрану. Мn - марганцевый комплекс; ПЦ - пластоцианин; Цит. f - цитохром f; Fd - ферредоксин; X - белок, содержащий железо и серу. (См. также рис. 12.14.)
Направленный транспорт электронов и создание протонного градиента.
Представления о локализации компонентов фотосинтетической электрон-транспортной цепи согласуются с данными физиологических наблюдений и измерений. Если суспензию тилакоидов или разрушенных хлоропластов подвергнуть воздействию света, то pH суспензионной среды возрастает, а после выключения света снова понижается. Свет вызывает передвижение протонов внутрь тилакоидов (рис. 12.16). Таким образом, световая энергия может использоваться для создания градиента протонов на тилакоидной мембране. Еще раньше было известно, что повышение pH в суспензии тилакоидов с 4 до 8 (в темноте) приводит к синтезу АТР. Подобного рода эксперименты легли в основу гипотезы о хемиосмотическом механизме преобразования энергии. Более детальные исследования показали, что перенос одного электрона через обе фотосистемы сопровождается поступлением двух протонов во внутреннее пространство тилакоида. Как сейчас полагают, две фотосистемы вместе со связывающей их электрон-транспортной цепью обеспечивают направленный поток электронов от воды (с внутренней стороны тилакоидной мембраны) к NADP (с внешней стороны). Таким образом, фотореакции ведут к восстановлению NADP и образованию заряда на мембране. Иными словами, световые реакции выступают в роли протонного насоса, который работает за счет энергии света и создает положительный заряд внутри тилакоида; в результате мембрана аккумулирует энергию в форме протонного потенциала, и эта энергия используется для синтеза АТР. Протонный потенциал связывает фотосинтетический транспорт электронов с фосфорилированием таким же образом, как он связывает с фосфорилированием транспорт электронов при дыхании (см. стр. 245).
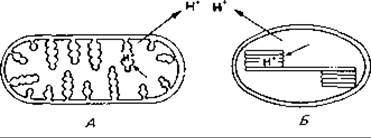
Рис. 12.16. Перенос протонов в клетках и органеллах за счет энергии света. A. Rhodobacter (Rhodopseudomonas) sphaeroides. Б. Хлоропласт. (Объяснение в тексте.)
12.2.2 Аноксигенный фотосинтез
Фотосинтетический транспорт электронов у анаэробных фототрофных бактерий во многих отношениях отличается от только что описанного. В аноксигенном фотосинтезе участвует только одна световая реакция; она поддерживает циклический транспорт электронов. Электроны, покидающие цикл для восстановления NAD, не являются продуктом разложения воды. Фотосинтез зависит от наличия в среде восстановленных субстратов и не сопровождается выделением О2. Собственно фотореакция хотя и аналогична первой фотореакции у зеленых растений, однако у некоторых бактерий она приводит, вероятно, лишь к созданию протонного потенциала и тем самым к запасанию энергии (АТР), но не к восстановлению NAD. Таким образом, нециклический перенос электронов (от донора электронов к пиридиннуклеотиду) здесь отсутствует. По-видимому, NADH2 образуется в результате какой-то темновой реакции в ходе обратного транспорта электронов, протекающего с затратой энергии.
Следует, однако, заметить, что у фототрофных бактерий между отдельными группами существуют гораздо большие различия в составе пигментов и механизмах фотосинтеза, чем у зеленых растений. В последующем изложении мы вначале не будем касаться зеленых бактерий.
Фотореакция у пурпурных бактерий. Как уже говорилось, у пурпурных бактерий пигменты и компоненты электрон-транспортной системы тоже находятся в мембранах. Пигментный комплекс фотохимического реакционного центра удается отделить от пигментов антенны.

Рис. 12.17. Схема фотосинтетического переноса электронов у Rhodospirillales и Chlorobiales (по вертикали - окислительно-восстановительный потенциал.) Цит - цитохром; Fd - ферредоксин; УХ - убихинон; Р870 или Р840-Бхл а [донор электронов реакционного центра (РЦ)]; X - акцептор электронов РЦ. Фотохимический реакционный центр заключен в красную рамку. (Объяснение в тексте.)
Энергия, поглощенная пигментами антенны (бактериохлорофиллом и каротиноидами) передается реакционным центрам. Изолированные реакционные центры состоят из белкового комплекса, содержащего Бхл а, бактериофеофитин, каротиноиды, убихинон и железосерный белок (FeS-белок). Пигмент реакционного центра обозначают Р870 - по длине волны, при которой максимально снижается поглощение под действием света. На свету Р870 окисляется в Р870+. Окислительно-восстановительный потенциал этого донора электронов лежит между + 450 и + 490 мВ. Первичным акцептором электронов, вероятно, служит комплекс убихинона с FeS-белком. Окислительно-восстановительный потенциал этого комплекса должен быть близок к — 100 мВ. Поэтому кажется маловероятным, что электроны, возбуждаемые при световой реакции у пурпурных бактерий, способны восстанавливать NAD. Скорее, они возвращаются через убихинон, цитохромы b и с2 и, возможно, FeS-белки назад к Р870+ (рис. 12.17). Необходимые же для восстановления NAD электроны, видимо, покидают путь циклического транспорта. Они переносятся на NAD в результате обратного транспорта, протекающего с затратой АТР. Это существенное отличие от в остальном аналогичной первой фотореакции при оксигенном фотосинтезе. Для пополнения цикла электронами пурпурные бактерии нуждаются во внешних донорах электронов. Пурпурные серобактерии могут использовать с этой целью сероводород, серу или тиосульфат; органические соединения (малат, сукцинат и др.) и молекулярный водород служат донорами электронов для обеих групп пурпурных бактерий.
Как показали многочисленные эксперименты, и у пурпурных бактерий фотосинтетический перенос электронов приводит к созданию про тонного градиента. Интактные клетки реагируют на воздействие света выделением в среду протонов, приводящим к закислению среды. В суспензии пузырьков из фотосинтетических мембран (хроматофоров) свет вызывает перенос протонов, направленный внутрь. Таким образом, мембраны хроматофоров и тилакоидов имеют такую же полярность, как и субмитохондриальные пузырьки. Это будет понятно, если учесть, что все эти мембраны образуются путем впячивания внутрь и разрастания плазматической мембраны или же внутренней мембраны хлоропласта. Хотя точная локализация отдельных компонентов в мембране еще не установлена, можно думать, что переносчики водорода и электронов расположены и в мембране анаэробных фототрофных бактерий таким образом, что происходит разделение зарядов. В хроматофорах электроны транспортируются наружу, а протоны - внутрь. Создающийся протонный потенциал и служит движущей силой фотосинтетического фосфорилирования.
Фотореакция у зеленых бактерий. Механизмы фотореакции у зеленых бактерий еще не полностью выяснены. Есть указания на то, что первичный акцептор электронов, участвующий в световой реакции, у зеленых серобактерий обладает потенциалом около — 500 мВ (у пурпурных бактерий-всего лишь — 100 мВ!). При столь большом отрицательном потенциале становится возможным прямое использование электронов от первичного акцептора для восстановления ферредоксина и пиридиннуклеотида (рис. 12.17). Таким образом, восстановительную силу Chlorobiaceae, возможно, получают не путем обратного транспорта электронов, требующего затрат энергии. Такая независимость от обратного транспорта электронов была бы важной отличительной чертой фотосинтеза у зеленых бактерий по сравнению с пурпурными. Тогда фотореакция у Chlorobiaceae не уступала бы по своей эффективности первой фотореакции цианобактерий. С эволюционной точки зрения фотосинтез зеленых бактерий мог бы быть связующим звеном между фотосинтезом пурпурных бактерий и фотосинтезом цианобактерий и растений1.
Заключение. В процессе фотосинтеза происходит превращение энергии света в биохимическую энергию. Первичное действие света состоит в том, что в фотохимических реакционных центрах электроны донора переносятся на акцептор в термодинамически невыгодном направлении. По крайней мере часть электронов возвращается по электрон-транспортной цепи к реакционным центрам. Благодаря особому расположению компонентов электрон-транспортной системы в мембране это сопровождается направленным переносом протонов и созданием протонного потенциала. Таким образом, аппарат фотосинтеза - это прежде всего протонный насос, приводимый в действие светом. Протонный потенциал обеспечивает возможность преобразования энергии путем фосформирования. Синтез АТР происходит с помощью тех же в своей основе механизмов, что и в мембранах аэробных бактерий или митохондрий. Что же касается преобразования энергии света в биохимически полезную энергию (АТР), то здесь нет принципиального различия между фототрофными бактериями и зелеными растениями. У пурпурных бактерий роль фотосинтеза, по-видимому, исчерпывается этим преобразованием. У цианобактерий и зеленых растений можно видеть дальнейший этап эволюции фотосинтеза. У них благодаря последовательному включению двух фотореакций энергетический уровень электронов в ходе первой реакции удается поднять настолько, что становится возможным восстановление ферредоксина и NADP. Вторая фотореакция позволяет использовать в качестве источника электронов воду. В результате такой комбинации наряду с запасанием энергии происходит восстановление NADP и выделение O2.
1 У Chloroflexaceae механизм первичных процессов фотосинтеза, видимо, такой же, как у пурпурных бактерий. - Прим. ред.
Процесс фотосинтеза представляет собой химическую реакцию, наиболее часто совершающуюся на нашей планете. Ему мы обязаны как непрерывным синтезом нового органического материала, так и существованием таких видов ископаемого топлива, как уголь, нефть и природный газ. Поэтому те огромные усилия, которые потребовались для раскрытия тайны фотосинтеза, можно считать вполне оправданными. Однако многие проблемы еще не решены. Поэтому наряду с экспериментально доказанными фактами в описанную выше модель фотосинтеза был включен ряд гипотез, для проверки которых нужны дальнейшие настойчивые исследования.