Общая микробиология - Шлегель Г. 1987
Разложение природных веществ
Белки
Азот органических соединений - это прежде всего белковый азот. Подобно другим высокомолекулярным соединениям, белки сначала расщепляются внеклеточными протеазами на фрагменты, способные проникнуть в клетку, - полипептиды, олигопептиды и отчасти аминокислоты. Пептиды поступают в клетки и гидролизуются внутриклеточными протеазами до аминокислот. Последние либо используются клеткой как таковые для синтеза белка, либо подвергаются превращениям, в результате которых они в конечном счете дезаминируются и после этого вовлекаются в промежуточный обмен (рис. 14.14).
Продукты неполного переваривания белков первоначально называли пептонами. В настоящее время это название, недостаточно определенное по смыслу, сохранилось только для обозначения того продукта, который применяют для приготовления питательных бактериальных сред. Его получают, обрабатывая белки ферментом пепсином (при этом разрывается только часть пептидных связей). Пептон состоит примерно на 30% (по весу) из свободных аминокислот; остальное составляют ди- и трипептиды, а также водорастворимые, уже не осаждаемые нагреванием или кислотой полипептиды.
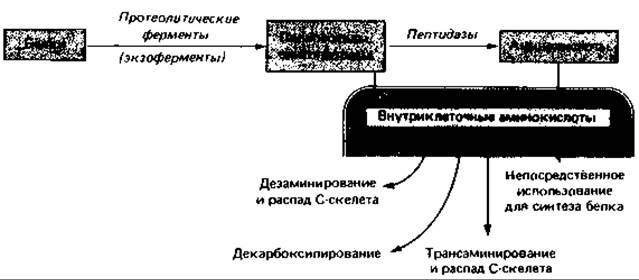
Рис. 14.14. Распад белков вне и внутри бактериальной клетки и возможные дальнейшие превращения аминокислот.
Распад белков в почве сопровождается образованием аммиака. Поэтому говорят о минерализации азота, или аммонификации. В разложении белков участвуют многочисленные грибы и бактерии, в том числе Bacillus cereus var. mycoides, псевдомонады, Proteus vulgaris и другие.
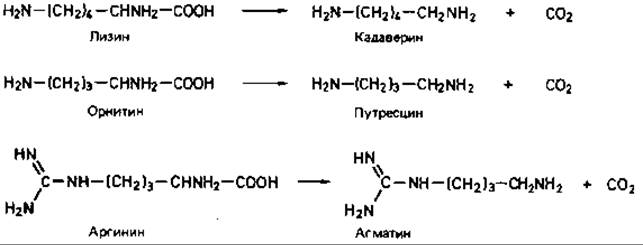
Первой реакцией, затрагивающей аминокислоты, может быть декарбоксилирование или дезаминирование. Декарбоксилазы образуются главным образом в кислой среде. В результате декарбоксилирования аминокислот образуются СО2 и первичные амины (называемые также «биогенными аминами»). Из них наиболее известны кадаверин, путресцин и агматин (ранее их называли птомаинами или трупными ядами); они образуются соответственно из лизина, орнитина и аргинина. Первичные амины обнаруживаются при обычных гнилостных процессах в кишечнике и при других анаэробных процессах распада белковых веществ.
Под дезаминированием понимают отщепление аммиака от аминокислоты. В зависимости от судьбы углеродного скелета аминокислоты различают окислительное дезаминирование, гидролитическое дезаминирование и дезаминирование, приводящее к образованию ненасыщенных соединений.
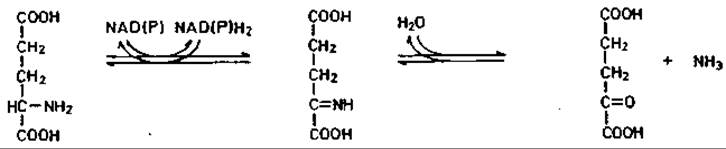
Окислительное дезаминирование-наиболее распространенный тип распада аминокислот. Глутаминовая кислота дезаминируется глутаматдегидрогеназой до 2-оксоглутаровой кислоты. Реакция обратима и поэтому играет важнейшую роль в обмене аминокислот. Равновесие в сильной степени сдвинуто в сторону образования глутаминовой кислоты:
Примером дезаминирования, приводящего к образованию ненасыщенного соединения, служит дезаминирование аспарагиновой кислоты в фумаровую:
![]()
Эта реакция, катализируемая аспартазой, тоже обратима.
Гидролитическим дезаминированием является, например, гидролиз мочевины. Большое число бактерий способно использовать мочевину в качестве источника азота. Мочевина расщепляется уреазой:
![]()
У большинства бактерий синтез уреазы подавляется ионами аммония. Благодаря этому количество образующегося и выделяющегося в культуральную жидкость аммиака не превышает того, что требуется для синтеза белков. Лишь у немногих бактерий, известных своей способностью разлагать мочевину (Bacillus pasteurii, Sporosarcina ureae, Proteus vulgaris и др.), уреаза представляет собой конститутивный фермент; для ее образования не требуется индукции мочевиной, и аммиак не подавляет ее синтеза. Эти бактерии могут, таким образом, расщеплять всю имеющуюся мочевину (например, в конюшнях) до аммиака. В результате pH среды сдвигается до тех значений (pH 9-10), к которым эти бактерии приспособлены.
При трансаминировании аминогруппа аминокислоты переносится на 2-оксокислоту:
![]()
Путем трансаминирования образуются аминокислоты, которые не могут быть синтезированы путем прямого аминирования аммиаком; с трансаминированием связано также расщепление некоторых аминокислот.
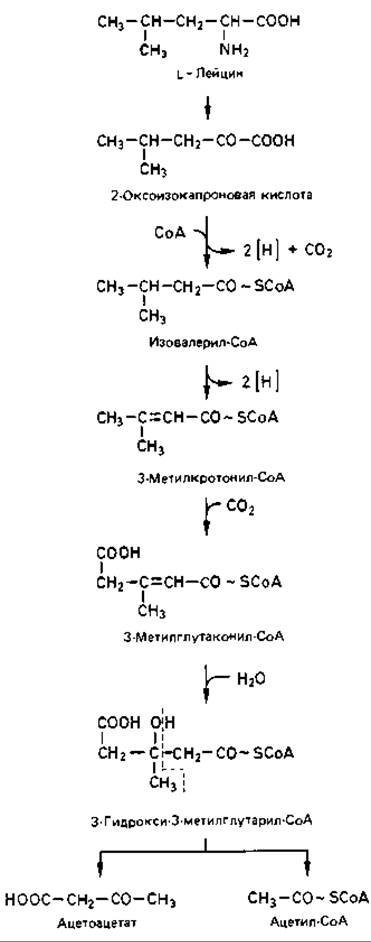
Рис. 14.15. Путь расщепления лейцина. Сначала L-лейцин в результате трансаминирования превращается в 2-оксокислоту. Эта 2-оксокислота подвергается окислительному декарбоксилированию с образованием СоА-производного. Дегидрирование приводит к образованию 3-метилкротонил-СоА. В результате биотин-зависимого карбоксилирования и последующего присоединения воды образуется 3-гидрокси-3-метилглутарил-СоА. Продукты его расщепления - ацетоацетат и ацетил-СоА. Они подвергаются дальнейшим превращениям по обычному пути. На примере распада лейцина видно, что реакции карбоксилирования могут быть и этапами катаболических процессов. Если содержание СО2 в среде падает ниже определенной пороговой величины, рост многих микроорганизмов прекращается.
В реакциях декарбоксилирования и трансаминирования (см. рис. 14.15) участвует пиридоксальфосфат.
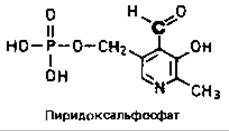
Этот кофермент, участвующий в обмене аминокислот, родствен пиридоксолу, известному также как адермин или витамин В6. Роль реакционноспособной группы в молекуле пиридоксальфосфата играет альдегидная группа. При взаимодействии этой группы с аминогруппой аминокислоты образуется шиффово основание. В процессе трансаминирования аминогруппа остается связанной с пиридоксальфосфатом, а углеродный скелет аминокислоты отщепляется в виде 2-оксокислоты. Пиродоксальфосфат регенерируется затем в результате реакции с соответствующей оксокислотой. При декарбоксилировании от шиффова основания отщепляется СО2.
Дальнейшая судьба углеродного скелета у разных аминокислот различна. Лишь немногие продукты дезаминирования (пировиноградная, 2-оксоглутаровая, щавелевоуксусная кислоты) являются одновременно промежуточными продуктами центральных путей катаболизма. Другие углеродные скелеты через специальные катаболические пути вовлекаются в промежуточный обмен. Мы не ставили здесь задачу охарактеризовать все известные пути распада. В качестве типичного примера на рис. 14.15 представлен путь расщепления лейцина. Особого внимания заслуживает здесь 3-гидрокси-3-метилглутарил-СоА - важный промежуточный продукт в синтезе стероидов и каротиноидов.