РОСТ И КУЛЬТИВИРОВАНИЕ БИООБЪЕКТОВ - В. М. Самыгин - 2016
ГЛАВА 11. КУЛЬТИВИРОВАНИЕ РАСТИТЕЛЬНЫХ КЛЕТОК
В 1922 году В. Роббинс и Котте независимо друг от друга показали возможность культивирования на синтетических питательных средах клеток меристемы корня томатов и кукурузы. Эти опыты положили начало применению метода культивирования изолированных клеток и органов растений. В 30-60-е годы ХХ века благодаря работам большого числа ученых (Ф. Уайт, Р. Готре и других) число видов растений, клетки и ткани которых выращивали in vitro, превысило 150.
Были описаны составы питательных сред, определены потребности культур в витаминах и стимуляторах роста, разработаны методы получения и выращивания больших масс клеточных суспензий, а также культивирования отдельной, выделенной из суспензии клетки. С использованием изолированных протопластов были разработаны методы гибридизации соматических клеток путем слияния протопластов с помощью полиэтиленгликоля и введения в них вирусных РНК, клеточных органелл, клеток бактерий. С помощью метода культуры меристем были получены безвирусные экономически важные растения с высоким коэффициентом размножения.
В настоящее время активно продолжается разработка методов глубинного культивирования клеток, слияния изолированных протопластов и т. д. Такие исследования привели к появлению более продуктивных и приспособленных к условиям культивирования клеточных штаммов, используемых для создания новых форм и сортов сельскохозяйственных, лекарственных, декоративных и других растений.
11.1. Методы создания клеточных культур растений
Основным типом культивируемой растительной клетки является каллусная. Каллусная клетка, в результате деления которой возникает каллусная ткань, представляет один из типов клеточной дифференцировки, присущей высшему растению. Для растения каллус является тканью, возникающей при исключительных обстоятельствах (обычно при травмах) и функционирующей непродолжительное время. Эта ткань защищает травмированное место, накапливает питательные вещества для анатомической регенерации или генерации утраченного органа. Значительно реже культивируют клетки опухолей растений различного происхождения. Культуры опухолевых клеток независимо от способа культивирования на уровне морфологии мало отличаются от культур каллусных клеток. Важным физиологическим отличием между ними является гормононезависимость опухолевых клеток, позволяющая им делиться и расти на питательных средах без добавок фитогормонов или их аналогов. Однако опухолевые клетки лишены способности давать начало нормально организованным структурам.
Для получения культивируемых каллусных клеток in vitro фрагменты тканей разных органов высших растений (экспланты) помещают на искусственную питательную среду в пробирки, колбы, чашки Петри. Процесс получения первичного каллуса и поддержание пересадочной культуры требует строго стерильных условий. Клетки специализированных тканей, эксплантированных на питательную среду, должны дедифференцироваться, то есть потерять структуры, характерные для их специфической функции в растении, и вернуться к состоянию делящейся клетки. Часто эксплант, используемый для получения каллуса, включает ткани, клетки которых различно дифференцированы.
В готовящейся к делению клетке стимулируется синтез всех типов РНК, исчезают тканеспецифические белки-антигены и появляются белки, специфичные для делящихся клеток и каллусной ткани. Это свидетельствует об изменении активности генов и белкового аппарата клеток при де- дифференцировке.
Образование каллуса не во всех случаях связано с травматическим воздействием. Каллус может возникнуть в результате пролиферации внутренних тканей экспланта без связи с поверхностью среза. Растущий каллус разрывает слои ткани и развивается на поверхности. Первичный каллус, возникший на эксплантах через 4-6 недель (в зависимости от скорости роста клеток), переносится на свежую питательную среду (субкультивируется). Различно дифференцированные клетки (в том числе и меристематические) переходят in vitro к сложному процессу дедифференциации, теряют присущую им структурную организацию и специфические функции и индуцируются к делению, образуя первичный каллус. В процессе субкультивирования формируется штамм, характеризующийся индивидуальными генетическими и физиологическими особенностями.
Основными компонентами питательных сред для культуры клеток и тканей растений являются минеральные соли (макро- и микроэлементы), источник углеродного питания (обычно сахароза или глюкоза), витамины, регуляторы роста. Иногда в состав питательных сред включают комплексные органические добавки (гидролизат казеина или смесь аминокислот, дрожжевой экстракт, экстракты из разных органов растений).
11.2. Методы выращивания культуры каллусных тканей
11.2.1. Поверхностное культивирование
Культура каллусных тканей выращивается поверхностным способом на полужидкой агаризованной среде (концентрация агара - 0,6-1 %), среде с применением других желирующих полимеров либо на мостиках из фильтровальной бумаги или дисках из пенополиуретана, погруженных в жидкую питательную среду. Каллусная ткань, выращиваемая поверхностным способом, представляет собой аморфную массу тонкостенных паренхимных клеток, не имеющую строго определенной анатомической структуры. Цвет массы может быть белым, желтоватым, зеленым или красным; пигментированным полностью или зонально. Как правило, в длительной пересадочной культуре каллусные ткани теряют пигментацию и становятся более рыхлыми. Каллусные клетки, выращиваемые поверхностным способом, часто применяют для сохранения в растущем состоянии коллекций разных штаммов, линий, мутантов, для регенерации растений, из них также получают суспензии клеток, культивируемых в жидкой питательной среде.
11.2.2. Суспензионное культивирование
Культуры клеток растений, выращиваемые в жидкой питательной среде, обычно называют суспензионными (глубинными) культурами. Существуют определенные проблемы получения культуры, состоящей преимущественно из отдельных клеток или небольших их агрегатов. Для решения этих проблем используют методы получения клеточной суспензии применительно к растительным клеткам.
Выращивание клеточных суспензий в жидкой питательной среде имеет ряд преимуществ перед выращиванием каллусных клеток поверхностным способом. Суспензионные культуры удобнее для проведения биохимических и молекулярно-биологических экспериментов - изучения индукции ферментов и связи их с событиями клеточного цикла, экспрессии и репрессии определенных генов, изолирования и характеристик мутантов.
Суспензионную культуру можно получить из фрагментов органа растения (диски паренхимы и др.), хотя этот путь более трудоемкий и требует большего времени. Клетки экспланта должны при этом образовывать первичный каллус, и только после этого поверхностные каллусные клетки, попавшие в жидкую среду и размножившиеся в ней, дадут начало линии, способной расти в суспензии. Обычно для получения культуры клеток используется культура каллусной ткани. Для получения культуры клеток берется наиболее жизнеспособная (пролиферирующая) часть каллусной ткани, а ее количество в расчете на единицу объема питательной среды должно быть в 15-20 раз больше, чем при серийном культивировании на агаре. При этом может использоваться питательная среда того же состава, что и для поверхностного культивирования.
Образование первичной суспензии растительных клеток может быть результатом трех процессов:
- распада каллусной ткани на клетки и небольшие клеточные агрегаты в момент внесения в жидкую питательную среду;
- отделения клеток и клеточных агрегатов с поверхности кусочков ткани в течение первых субкультивирований;
- деления и роста клеток и распада разрастающихся клеточных агрегатов на более мелкие агрегаты и клетки.
Первичную суспензию перед субкультивированием разделяют на фракции по скорости седиментации, используя специальный цилиндр (берут верхнюю фракцию), либо фильтруют через 1-2 слоя марли, нейлоновые или металлические сита, чтобы избавиться от крупных плотных кусков каллусной ткани, остатков экспланта и очень крупных агрегатов.
Для глубинного культивирования растительных клеток применяют методы, разработанные для микробиологических целей. Используют закрытые или открытые системы в периодическом или проточном режимах. Однако при глубинном выращивании растительных клеток принцип турбидостата практически не применяется. Одной из причин этого является разрушения части клеток при отводе их к оптическому прибору. Выращивание суспензии клеток растений в установках непрерывного культивирования по принципу хемостата применяется как для изучения метаболизма клеток, стабильно поддерживающихся в разных фазах клеточного цикла, так и при промышленном выращивании клеточной биомассы с целью получения экономически важных продуктов.
Наиболее изученным и распространенным режимом глубинного культивирования клеточных суспензий в настоящее время является закрытая периодическая система. В этом случае для аэрации и перемешивания суспензии используют роллеры, качалки (обычно круговые), ферментеры с механическими и магнитными мешалками или ферментеры барботажного типа, где аэрация и перемешивание осуществляется воздушным потоком. Критериями роста в цикле выращивания служит увеличение числа клеток, их сырой и сухой массы. Модельная ростовая кривая имеет типичную S-образную форму, на которой различают: I - лаг-фазу; II - экспоненциальную фазу; III - фазу линейного роста; IV -замедленного роста; V - стационарную фаза; VI - фазу отмирания (рис. 11).
Рис. 11. Кривая роста клеточных суспензий в закрытой периодической системе
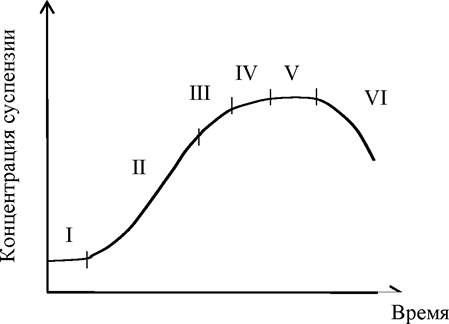
В латентной фазе (лаг-фазе) видимого роста инокулята не наблюдается. При этом наблюдается высокая интенсивность дыхания, максимальные значения энергетического уровня, интенсивный синтез ДНК, РНК, белков и других компонентов клетки, но низкий митотический уровень. Длительность фазы зависит от количества и физиологического состояния инокулята и условий культивирования. Экспоненциальная фаза характеризуется максимальными скоростью роста и величинами митотической активности, а также преобладанием мелких клеток меристематического типа. На протяжении линейной фазы скорость роста постоянна. Фаза замедленного роста связана с субстратным лимитированием и ингибированием продуктами обмена. Для стационарной фазы характерна малая скорость деградации клеток, которая уравновешивается делением клеток. В фазе отмирания клеток удельная скорость роста принимает отрицательное значение.
Форма реальных ростовых кривых может значительно отличаться продолжительностью фаз от модельной. Процессы ростового цикла зависят от вида растения, количества внесенного материала и условий культивирования (состав питательной среды, температура, начальное значение рН, состав газовой фазы, скорость перемешивания). Первичный и вторичный метаболизм культивируемых клеток растений видоспецифичен, зависит от типа дифференцировки исходных клеток растения и регулируется условиями выращивания. Генетическая изменчивость клеток как следствие их культивирования вне организма приводит к возникновению из первичной каллусной ткани генетически и фенотипически различающихся линий клеток. Это позволяет отобрать или экспериментально создать линии, сохраняющие биосинтетические системы, характерные для исходного растения, и линии, синтезирующие принципиально новые вещества.
11.3. Культивирование отдельных клеток
Источником отдельных клеток являются клеточные суспензии в жидкой питательной среде, мацерация (мацерация - размягчаю; разъединение клеток в результате растворения межклеточного вещества) тканей растений, изолированные протопласты после восстановления ими клеточной стенки. Причем изолированные протопласты являются идеальными отдельными клетками.
Культивирование отдельных клеток позволяет получать клоны и исследовать генетическую и физиологическую стабильность или изменчивость при выращивании клонового материала. Отдельные клетки важны для клоновой селекции мутантных, гибридных, трансформированных линий. Обычно в эти клетки вводят маркерные гены или создают маркерные признаки для обеспечения селективных условий отбора.
Мацерированные клетки ткани растения являются хорошей моделью для сравнительного изучения физиологических процессов в ткани и отдельной клетке. Вместе с тем при культивировании этих клеток на среде, стимулирующей деление клеток, они дифференцируются и образуют колонии каллусных клеток. Для получения отдельных мацерированных клеток используют специальные мацерирующие ферментативные препараты.
Отдельные клетки также могут быть получены из суспензий с использованием микроманипулятора, проточного цитофлуюориметра или путем последовательных разбавлений.
Индукция делений отдельных клеток возможна при применении очень богатой питательной среды, причем объем среды должен быть минимальным. Однако даже при соблюдении всех этих условий процент разделившихся клеток остается очень низким. Более эффективны методы «кормящего слоя» или «ткани-няньки». Для создания «кормящего слоя» берут суспензию клеток того же вида растения. Клеточная суспензия должна находиться в ранней стадии ростового цикла. Каллусная культура, служащая «тканью-нянькой», также должна быть в стадии активного роста. При достижении колонией, выросшей из отдельной клетки, размера 0,5-1 мм, она может быть перенесена для дальнейшего выращивания на агаризованную питательную среду непосредственно либо на фильтр, помещенный на поверхность питательного агара. Использование «кормящего слоя», «ткани- няньки» или минимального объема среды, в которую помещается отдельная клетка, связано с явлением, называемым «действие фактора кондиционирования». Несмотря на многочисленные попытки определить природу веществ, индуцирующих деление отдельной клетки и механизм действия фактора кондиционирования, данный вопрос окончательно не решен.
11.4. Протопласты растительных клеток
11.4.1. Методы выделения растительных протопластов
Протопласты растений - это ограниченные мембраной цитоплазматические образования, несущие внутриклеточные органоиды, характеризующиеся структурной целостностью и способностью осуществлять активный метаболизм и выполнять биосинтез и трансформацию энергии. Впервые выделение растительных протопластов было осуществлено в 1892 году Дж. Клеркером.
Наиболее простыми, хотя длительными и трудоемкими методами получения растительных протопластов являются механические. При этом фрагмент растительной ткани вносят в концентрированный раствор сахарозы, выдерживают до тех пор, пока протопласты не сожмутся и не отойдут от клеточных стенок, а затем аккуратно рассекают эпидермис, и протопласты выходят в среду. Однако при применении даже модифицированных механических методов можно получить только ограниченное число протопластов.
Принципиально отличный метод получения изолированных протопластов - энзиматический, при котором для удаления клеточной стенки используют ферменты. В сравнении с механическим методом ферментативное выделение протопластов имеет определенные преимущества. В этом случае сравнительно быстро и одновременно можно получать большое количество протопластов, которые не подвергнуты сильному осмотическому сжатию. При этом клетки становятся более интактными.
Для удаления клеточной стенки используются ферментные препараты трех типов: целлюлазы, гемицеллюлазы и пектиназы - чаще всего грибного или бактериального происхождения. В результате обработки тканей ферментными препаратами образуется смесь, содержащая протопласты, обломки разрушенных клеток и целые клетки. Чтобы отделить протопласты от примесей, суспензию фильтруют через нейлоновые фильтры, а затем подвергают центрифугированию в мягких условиях.
Источником получения протопластов, помимо фрагментов растительных тканей, являются клеточные суспензии и каллусные культуры. Выделение протопластов достаточно легко выполнимая и технически хорошо отработанная процедура, однако сложность заключается в получении жизнеспособных протопластов и их дальнейшем культивировании. Успех процесса зависит от многих факторов - состава и качества ферментов, рН среды, выбора осмотического раствора, состояния растительного материала, а также применяемых методов получения и культивирования протопластов. Для стабильного получения большого количества протопластов важны стандартные условия выращивания исходных растений или клеток, определение оптимального для выделения протопластов возраста растения или органа, температуры, освещения, питания. Для получения протопластов из суспензионных клеточных культур наилучшей является поздняя логарифмическая фаза роста, когда клеточные стенки лучше всего поддаются ферментативному разрушению, а протопласты наиболее жизнеспособны.
11.4.2. Культивирование растительных протопластов
Для культивирования протопластов можно использовать метод жидких капель, при котором суспензия протопластов (в виде капель в жидкой среде) помещается в пластиковые чашки Петри. Метод обеспечивает хороший газообмен и диффузию в раствор экскретируемых продуктов и позволяет добавлять свежий раствор в нужной концентрации. Однако в этом случае протопласты агрегируются в центре каждой капли и образуют значительное количество фенольных или других токсических соединений. Метод также неудобен, если требуется исследовать развитие индивидуальной колонии протопластов.
Другой распространенный метод - метод агаровой культуры, при котором определенный объем суспензии протопластов в жидкой питательной среде наливают в пластиковые чашки Петри, добавляют равный объем аналогичной среды, содержащей 1 % агар-агара, расплавленного и охлажденного до 45°С. Чашки заклеивают пленкой (парафильмом) и культивируют при 28°С. Протопласты фиксированы в одном положении и отдалены один от другого. Этот метод имеет важное преимущество, позволяя наблюдать все этапы развития конкретного протопласта: формирование клеточной стенки, деление клеток, рост и развитие растения. Недостаток этого метода заключается в том, что возможно некоторое повреждение протопластов при смешивании с теплым агар-агаром.
Одним из вариантов данной методики является использование «кормящих» протопластов или клеток, подвергнутых воздействию рентгеновского или гамма-излучения, которые смешиваются с жизнеспособными протопластами. Причем доза облучения выбирается такой, чтобы клетки утратили способность к клеточному делению, но поддерживали и стимулировали рост других клеток. Этот метод позволяет культивировать суспензию протопластов более низкой концентрации, чем та, что обычно необходима для их роста.
Похожим является метод совместных культур, используемый для трудно культивируемых протопластов. Такие протопласты культивируются совместно с протопластами, отличающимися быстрым ростом. Успех культивирования основан на активных веществах, которые выделяются быстрорастущими видами.
Удобным вариантом метода жидких капель является культивирование в малом объеме (до 1 мкл) единичных протопластов (микроизоляция). В микрокаплях соотношение объема клетки к объему питательной среды такое же, как в культуре плотностью около1000 кл/мл.
По питательным потребностям изолированные протопласты сходны с целыми клетками. Поэтому питательные среды подобны таковым для клеточных культур. Поскольку центральная проблема при культивировании растительных объектов на искусственных питательных средах - создание определенной буферной емкости смеси, то обычно используют сопряженные пары солей, в которые объединяют химически и физиологически кислые и щелочные соли. К основным сопряженным парам относятся соли, содержащие азот и фосфор. Среды содержат железо в хелатной форме и сахарозу как источник углерода. Для индукции деления протопластов эффективно добавлять в среду цитокинины. Температура культивирования является видоспецифичной и варьирует в широких пределах. Температурный режим должен строго выдерживаться, так как протопласты чувствительны даже к незначительным отклонениям от оптимальной температуры. Оптимальные значения освещенности могут варьировать от абсолютной темноты до яркого света. Существенным фактором культивирования является плотность засева протопластов. При низкой плотности протопласты часто не делятся, в то время как при очень высокой возникают затруднения на поздних этапах культивирования из-за появления в ростовой среде токсичных продуктов обмена. Оптимальная плотность протопластов в культуре составляет103 -105 кл/мл.
Таким образом, используя разнообразные методы, учитывая характерные особенности исходного материала и соблюдая все условия, можно осуществить культивирование растительных протопластов, добиваясь получения целого растения из единичных протопластов. Разработка техники культивирования растительных клеток, получения и культивирования растительных протопластов послужила основой для создания методов биологического конструирования растений с заданными свойствами.