Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Белки
Регуляция ферментативной активности
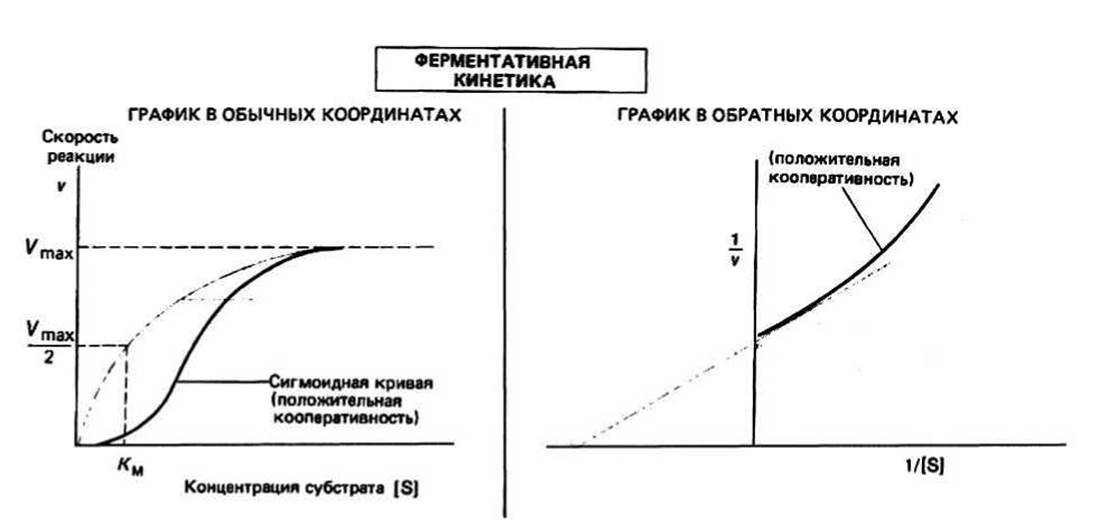
Рис. 13.1.
Кинетические свойства многих, но не всех ферментов можно объяснить в рамках модели Михаэлиса-Ментен. Согласно этой модели, субстрат S связывается с ферментом Е с константой скорости к1. Образующийся фермент-субстратный комплекс Е—S может либо диссоциировать на Е и S с константой скорости к2 либо с константой скорости к3 превратиться в продукт Р и свободный фермент:
![]()
В модели предполагается, что продукт не может обратно превращаться в субстрат, что справедливо для ранних стадий реакции, когда концентрация продукта низка. Скорость реакции v связана с концентрацией субстрата [S] следующим соотношением:
![]()
где Vmах - максимальная скорость реакции, достигающаяся в том случае, когда все молекулы фермента связаны с субстратом, а
![]()
KM, константа Михаэлиса, численно равна концентрации субстрата, при которой скорость реакции составляет половину максимальной величины. KM — это мера сродства данного субстрата к ферменту (в том случае, когда к3 « к2), которое в свою очередь отражает прочность связывания субстрата с активным центром. График зависимости v от [S] представляет собой гиперболу.
График Лайнуивера-Бэрка в двоимых обратных координатах. Существует альтернативный способ представления уравнения Михаэлиса-Ментен — с помощью графика двойных обратных координат, предложенного Лайнуивером и Бэрком. Перепишем уравнение в виде
![]()
Если построить зависимость 1/v от 1/[S], то мы получим прямую с наклоном KM/Vmax, отсекающую от оси 1/v отрезок длиной 1/Vmax. Использование такой формы записи уравнения Михаэлиса— Ментен позволяет легко определить значения величин Vmax, и КM Конкурентные и неконкурентные ингибиторы можно отличить друг от друга по тому, как в их присутствии изменяются кинетические свойства ферментной системы. Это легче всего проиллюстрировать с помощью графика Лайнуивера—Бэрка (рис. 13.2). Если поведение фермента подчиняется уравнению Михаэлиса-Ментен, то это свойство фермента будет сохраняться и в присутствии ингибитора — как первого, так и второго типа. Однако при добавлении конкурентного или неконкурентного ингибитора график в двойных обратных координатах будет изменяться, причем в зависимости от типа ингибитора характер изменений будет различным.

Рис. 13.2.
Конкурентные ингибиторы увеличивают Км реакции, но не влияют на Vmax. Роль ингибитора, поскольку он конкурирует за активный центр фермента, сводится фактически к разбавлению субстрата. Следовательно, для достижения скорости реакции, равной половине Vmax, требуется теперь большая концентрация субстрата (которая, как известно, численно равна Км). Так как путем увеличения количества субстрата можно нейтрализовать действие ингибитора, Vmax не меняется.
Неконкурентные ингибиторы понижают Vmax, но не влияют на Км. Поскольку ингибиторы этого типа не мешают связыванию субстрата с активным центром фермента, величина Км не меняется. Механизм ингибирования состоит в снижении скорости, с которой субстрат в составе фермент-субстратного комплекса превращается в продукт, поэтому при неконкурентном ингибировании уменьшается лишь величина Vmax
РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТА может осуществляться самыми разными путями, например с помощью активации зимогена (профермента), ковалентной модификации, ингибирования по типу отрицательной обратной связи, за счет кооперативных или аллостерических эффектов.
Зимоген — это неактивный предшественник фермента. Чтобы зимоген превратился в активный фермент, какая-то часть (или части) его полипептидной цепи должна быть отщеплена. Например, в семействе сериновых протеиназ химотрипсиноген и трипсиноген являются зимогенами соответственно химотрипсина и трипсина.
Ковалентной модификацией называется ковалентное присоединение или отщепление от фермента небольшой химической группы, регулирующее его активность. С помощью таких модификаций обычно либо полностью неактивная форма фермента становится активной, либо, наоборот, полностью активный фермент инактивируется. Например, гликогенсинтаза из клеток млекопитающих, превращающая глюкозу в гликоген, инактивируется после ковалентного присоединения фосфатной группы к боковой цепи одного из сериновых остатков и снова активируется при отщеплении фосфата.
Ингибирование по типу отрицательной обратной связи характерно для ферментных систем, в которых субстрат претерпевает несколько последовательных превращений, причем каждая реакция катализируется своим ферментом (см., например, ферменты Е1 - Е4 на рис. 13.3). Ингибирование имеет место, если конечный продукт Т блокирует одну из более ранних стадий в цепи реакций, а для этого продукт Т должен быть либо структурно похожим на Р (т. е. действовать как конкурентный ингибитор), либо связываться с какой-либо другой частью фермента, регулируя таким образом его активность (т. е. выступать в роли неконкурентного ингибитора).
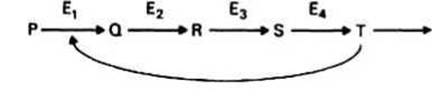
Рис 13.3
Кооперативные эффекты характерны для мультисубъединичных белков, в том числе и для ферментов. Если имеет место кооперативный эффект, то кинетические свойства фермента уже не описываются уравнением Михаэлиса-Ментен: график зависимости v от |S] в этом случае представляет собой S-образную кривую, а не гиперболу, а график Лайнуивера-Бэрка перестает быть прямой (рис. 13.1). При этом небольшое увеличение концентрации субстрата будет приводить к значительному возрастанию скорости реакции. Для объяснения этого эффекта были предложены различные модели, из которых наиболее известны модели Моно, Уаймена и Шанжё (симметричная модель), а также Кошланда, Немети и Филмера (последовательная модель).
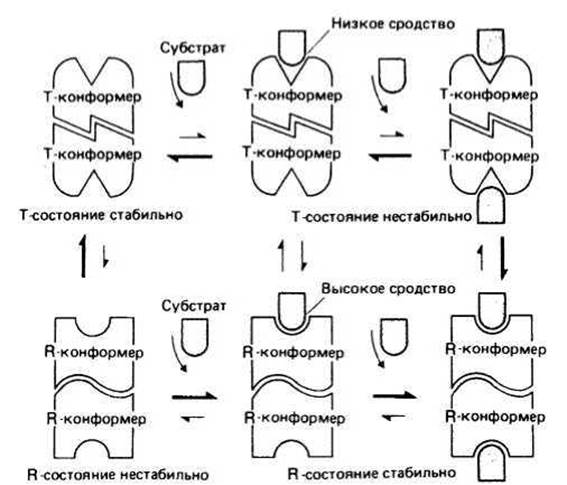
Рис. 13.4.
В симметричной модели предполагается, что каждый мультимерный ферментный комплекс может существовать по крайней мере в двух разных состояниях с неодинаковой четвертичной структурой, причем в каждом состоянии все субъединицы имеют одинаковую третичную структуру. В простейшей модели рассматриваются два состояния, находящиеся в равновесии друг с другом. В одном из них белок имеет высокое сродство к субстрату (R-состояние, от англ. relax — ослаблять), а в другом — низкое (Т-состояние, от англ. tense - напрягать). Добавленный субстрат будет предпочтительно связываться с R-конформерами фермента, а связывание его с Т-конформером приведет к возникновению напряжения в субъединицах фермента, что вызовет одновременный переход всех субъединиц в R-состояние (в котором напряжение отсутствует). При таком согласованном переходе сохраняется молекулярная симметрия каждой мультимерной молекулы. При дальнейшем добавлении субстрата все больше и больше молекул будет переходит из Т- в R-состояние. Такой сдвиг равновесия в присутствии субстрата представляет собой эффект положительной кооперативности. В результате этого эффекта график зависимости v от [S] будет иметь S-образную форму (см. предыдущую страницу).
В последовательной модели предполагается что, отдельные субъединицы мультимерной молекулы могут в одно и в то же время иметь разные третичные структуры. При этом связывание субстрата одной субъединицей может вызывать изменение третичной структуры соседней субъединицы (или соседних субъединиц) и в результате увеличивать (положительная кооперативность) или уменьшать (отрицательная кооперативность) их сродство к субстрату. Аллостерическая регуляция (от греч. аллос — другой и стереос — тело, пространство) представляет собой эффект, наблюдаемый в тех случаях, когда небольшие молекулы (эффекторы), связываясь с ферментом не в области активного центра, изменяют скорость реакции. Подобная регуляция может быть гомотропной, когда молекула субстрата, взаимодействуя с ферментом, изменяет его сродство к молекулам того же субстрата, и гетеротропной, когда сродство к субстрату изменяется при взаимодействии фермента с молекулой, не похожей на молекулы субстрата. Гомотропные и гетеротропные эффекторы могут быть активаторами или ингибиторами. Аллостерический активатор, действующий на фермент, описываемый симметричной моделью, будет связываться предпочтительно с R-KOH-формером, стабилизируя это состояние. В результате активатор будет увеличивать начальную концентрацию R-конформеров по сравнению с концентрацией Т-конформеров и, следовательно, увеличивать сродство фермента к своему субстрату (положительная кооперативность). Аллостерический ингибитор, наоборот, предпочтительно связывает и стабилизирует фермент, находящийся в Т-состоянии, вызывая таким образом уменьшение сродства фермента к своему субстрату (отрицательная кооперативность). В целом роль аллостерических эффекторов заключается в том, чтобы либо расширить (в случае ингибитора), либо сузить (в случае активатора) диапазон концентраций субстрата, в котором фермент способен увеличивать скорость реакции.