Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Белки
Эволюция белков
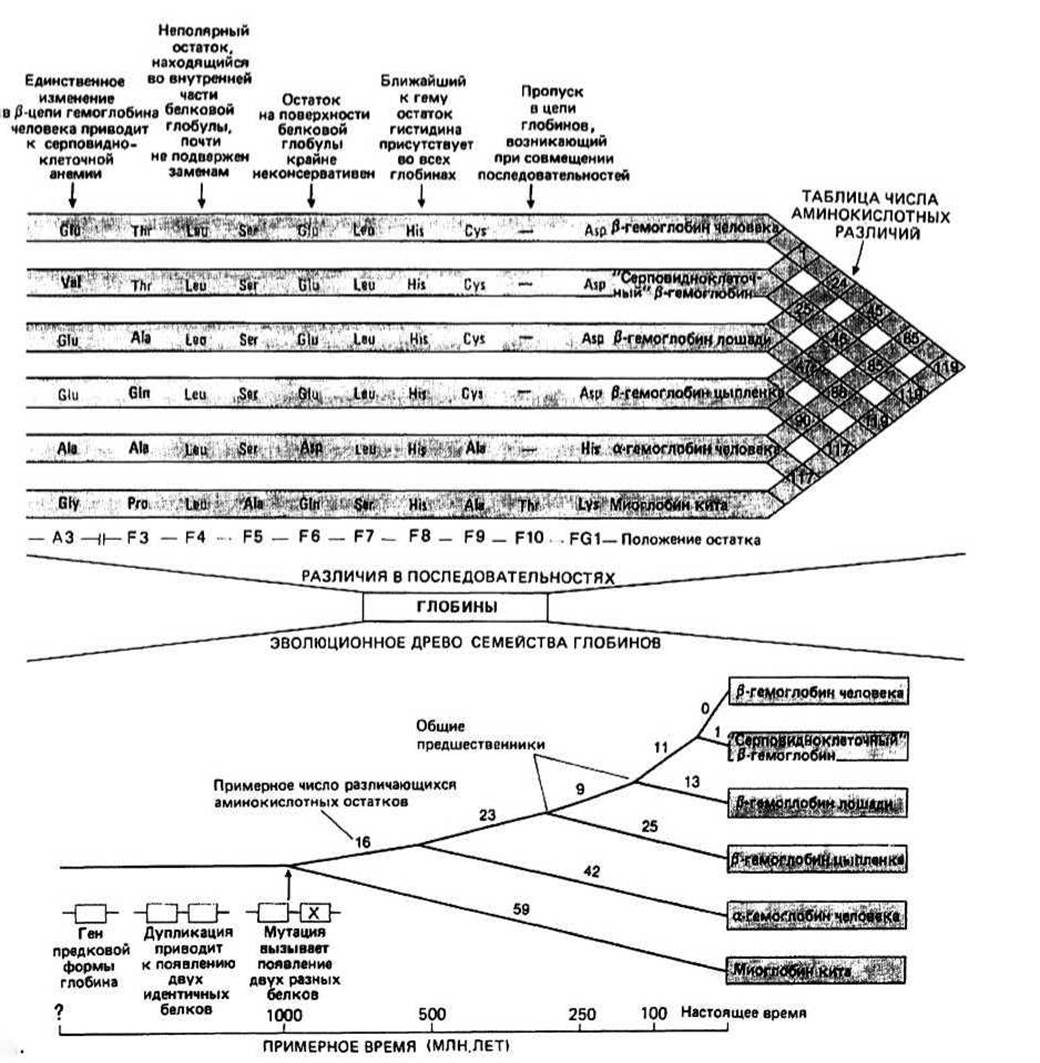
Рис. 16.1
Глобины — это группа белков, участвующих в транспорте кислорода. Они встречаются у высших эукариот, и на примере их эволюции будет рассмотрена эволюция белков вообще.
Известные аминокислотные последовательности разнообразных глобинов из многих видов можно совместить друг с другом. Для этого в некоторые последовательности иногда бывает необходимо включить пропуски, как, например, в положение F10 при совмещении последовательностей а- и (ß-цепей гемоглобина с последовательностью миоглобина.
Инвариантным называется такой остаток, который встречается в определенном положении любой из совмещаемых последовательностей. Инвариантность почти всегда является следствием того, что данный остаток играет особую функциональную или структурную роль. Так, во всех миоглобинах и гемоглобинах в положении F8 обнаруживается His, поскольку он должен образовать ковалентную связь с железом гема.
Термин замена означает изменение остатка в определенном положении одной последовательности, обнаруживаемое при совмещении ее с другой. При консервативных заменах сохраняются химические свойства боковых цепей; например, во всех глобинах остатки в положении F6 имеют полярные боковые цепи. Боковые цепи, находящиеся во внутренней части белковой глобулы, почти всегда неполярны, и эта неполярность сохраняется на протяжении всей эволюции белков. Остатки, расположенные на поверхности белков, подвергаются более частым и разнообразным заменам, поскольку в большинстве случаев на химические свойства их боковых цепей не налагается жестких ограничений.
Число различий в аминокислотных остатках для любой пары глобинов определяют, совмещая соответствующие последовательности, а результаты таких подсчетов для всего семейства глобинов могут быть представлены в виде таблицы. Для простоты часто считают, что каждый единичный пропуск эквивалентен одной замене. К примеру, при совмещении последовательностей миоглобина и а- и ß-цепей гемоглобина сравнивают 155 положений и найденное число различий заносят в таблицу (рис. 16.1).
Древо родственных связей для глобинов строится на основе математического анализа числа различий в аминокислотных остатках. В результате длина «пути» от белка из одного вида до общего предшественника (точка разветвления) и затем до белка из другого вида оказывается пропорциональной числу аминокислотных различий в сравниваемых последовательностях, которое, например, в случае пары р-цепь гемоглобина цыпленка/р-цепь гемоглобина лошади равно 47, а для пары р-цепь гемоглобина человека/р-цепь гемоглобина лошади составляет 24.
Мутацией называется любое изменение в нуклеотидной последовательности определенного гена (гл. 27). Наиболее часто происходят так называемые точковые мутации, связанные с изменением одного азотистого основания, что влечет за собой изменение типа аминокислотного остатка в одном положении полипептидной цепи. Другие мутации приводят к вставкам или удалению одного или более аминокислотных остатков. Особым типом мутации является удвоение гена, в результате чего в организме появляются две копии одного и того же гена. Согласно теории естественного отбора, в популяции фиксируются предпочтительно выгодные мутации, т. е. мутации, дающие организму какое-то преимущество.
Дивергентная эволюция белков семейства глобинов. Все глобины имеют сходные последовательности. Этот факт объясняется происхождением их от одного общего предка. Эволюция глобинов происходила, очевидно, по дивергентному пути с помощью мутаций. Число различий в аминокислотных последовательностях между любыми двумя белками непосредственно связано с числом мутаций, зафиксированных после того, как эти два белка разошлись от своего общего предка. Поэтому древо родственных связей служит схематическим изображением эволюционного процесса и является филогенетическим древом. Предковый глобин как полагают, представлял собой мономерный белок с включенной в него гемогруппой и уже обладал некоторой способностью переносить кислород. В результате удвоения гена появились две его идентичные копии, которые, последовательно подвергаясь мутациям, дали начало двум разным белкам. Поскольку между аа- и ß-цепями гемоглобина существует меньше различий, чем между каждым из этих полипептидов и миоглобином, предполагают, что первоначальное удвоение гена привело к возникновению примитивных миоглобина и гемоглобина, а разделение на а- и ß-цепи произошло позднее, после удвоения гена примитивного гемоглобина. Видообразование. С помощью целого ряда методов удается проследить пути развития различных биологических видов от их общего предка. Рассмотрим с этой точки зрения ту часть филогенетического древа глобинов, которая касается ß-цепей. Видно, что ß-цепи лошади и человека различаются меньше, чем ß-цепи цыпленка и человека. Это означает, что в эволюционном отношении человек находится ближе к лошади, чем к цыпленку. В общем случае эволюционные связи между видами, установленные на основе анализа ß-цепей, довольно хорошо согласуются с соответствующими данными классической биологической таксономии. Фактически число аминокислотных различий между двумя видами может служить мерой времени, прошедшего после дивергенции их об общего предка. Значения времени, оцененные подобным способом, находятся в неплохом соответствии с аналогичными результатами, полученными с помощью других методов, таких, например, как палеонтологическое датирование.
Скорость эволюции белков можно определить как время, за которое происходит накопление в среднем 1% различий в аминокислотных последовательностях между двумя белками, дивергировавшими от общего предка. Скорость эволюции белков в пределах одного семейства постоянна (прямые на рис. 16.2), однако она сильно варьирует для белков, принадлежащих к разным семействам, что, по-видимому, связано с разным давлением отбора. Гистон IV — это сильно основный белок, связанный с ДНК, и в сущности любое изменение его аминокислотной последовательности скорее всего нарушило бы его функцию и оказалось летальным для организма. Поэтому гистон IV эволюционирует очень медленно (1% изменений в последовательностях за 600 млн. лет). Прямо противоположным примером служат фибринопептиды — фрагменты цепи фибриногена, отщепляющиеся при превращении его в фибрин в процессе свертывания крови. Очевидно, что сохранение определенной последовательности в данном случае не столь важно, поэтому скорость эволюции фибринопептидов весьма высока (1% за 1 млн. лет). Цитохром с — белок, состоящий приблизительно из 105 аминокислотных остатков, — принимает участие в транспорте электронов, обнаруженном как у животных и растений, так и у бактерий. Вследствие своей широкой распространенности в природе цитохром с представляет собой прекрасную модель для изучения скорости эволюции белков. Скорости эволюции и цитохрома с, и глобинов занимают промежуточное положение между скоростями эволюции фибринопептидов и гистона IV. По сравнению с глобинами цитохром с эволюционирует медленнее, что говорит о более жестких ограничениях, налагаемых на структуру цитохрома с. Чтобы соотнести между собой временную шкалу, изображенную на рисунке, с той, которая используется в классической таксономии, нужно принять во внимание, что растения и животные дивергировали около 1200 млн. лет назад, а видообразование у млекопитающих происходило в последние 100 млн. лет.
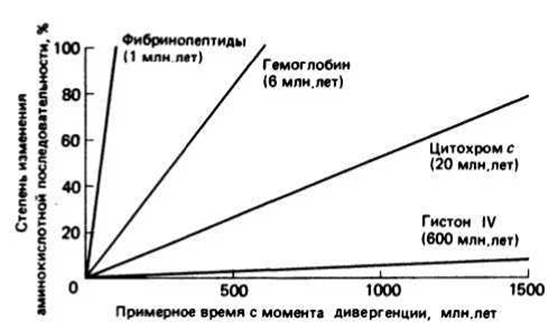
Рис. 16.2.
Серповидноклеточная анемия — заболевание, возникающее при замене остатка глутаминовой кислоты в шестом положении р-цепи гемоглобина на остаток валина. Это единственное изменение приводит к уменьшению растворимости дезоксигемоглобина и к появлению у него способности агрегировать с образованием длинных волокон. В результате эритроциты приобретают вытянутую форму, напоминающую серп. Деформированные таким образом, они могут закупоривать капилляры, нарушая нормальное кровообращение, либо легко подвергаться лизису, что и является непосредственной причиной наблюдаемой анемии. Замена Glu на Val не влияет на растворимость оксигемоглобина. Шестой остаток Р-цепи находится на поверхности тетрамерного гемоглобина. Вместо заряженной боковой цепи Glu серповидноклеточный гемоглобин несет в том же положении неполярную боковую цепь Val. В дезоксигемоглобине этот неполярный участок непосредственно контактирует с комплементарным неполярным участком, расположенным на поверхности другого тетрамерного гемоглобина, вызывая тем самым слипание молекул. Предполагают, что в оксигемоглобине комплементарный участок по каким-то причинам не может взаимодействовать с шестым Val, и поэтому агрегации не происходит.
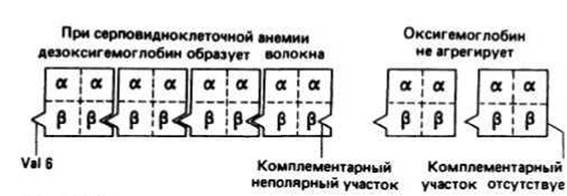
Рис. 16.3.
Пространственная структура а- и ß-цепей гемоглобина человека и миоглобина кита была определена с помощью рентгеноструктурного анализа. Оказалось, что, несмотря на большое число различий в аминокислотных остатках, для всех трех белков характерен одинаковый способ трехмерной укладки цепей, известный под названием «глобинового типа сворачивания» (гл. 15). Это связано с одинаковым функциональным назначением всех трех белков — обеспечить подходящее окружение для гема, удерживающего кислород. Таким образом, выполняемая функция налагает на пространственную структуру белков более строгие ограничения, чем на их аминокислотную последовательность, и первая эволюционирует медленнее, чем вторая. Это позволяет высказать предположение о наличии эволюционных связей между различными белками (или отдельными частями различных белков), имеющими похожие пространственные структуры, даже если у этих белков не обнаруживается сходства в последовательностях.