Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Углеводы и липиды
Биологические мембраны
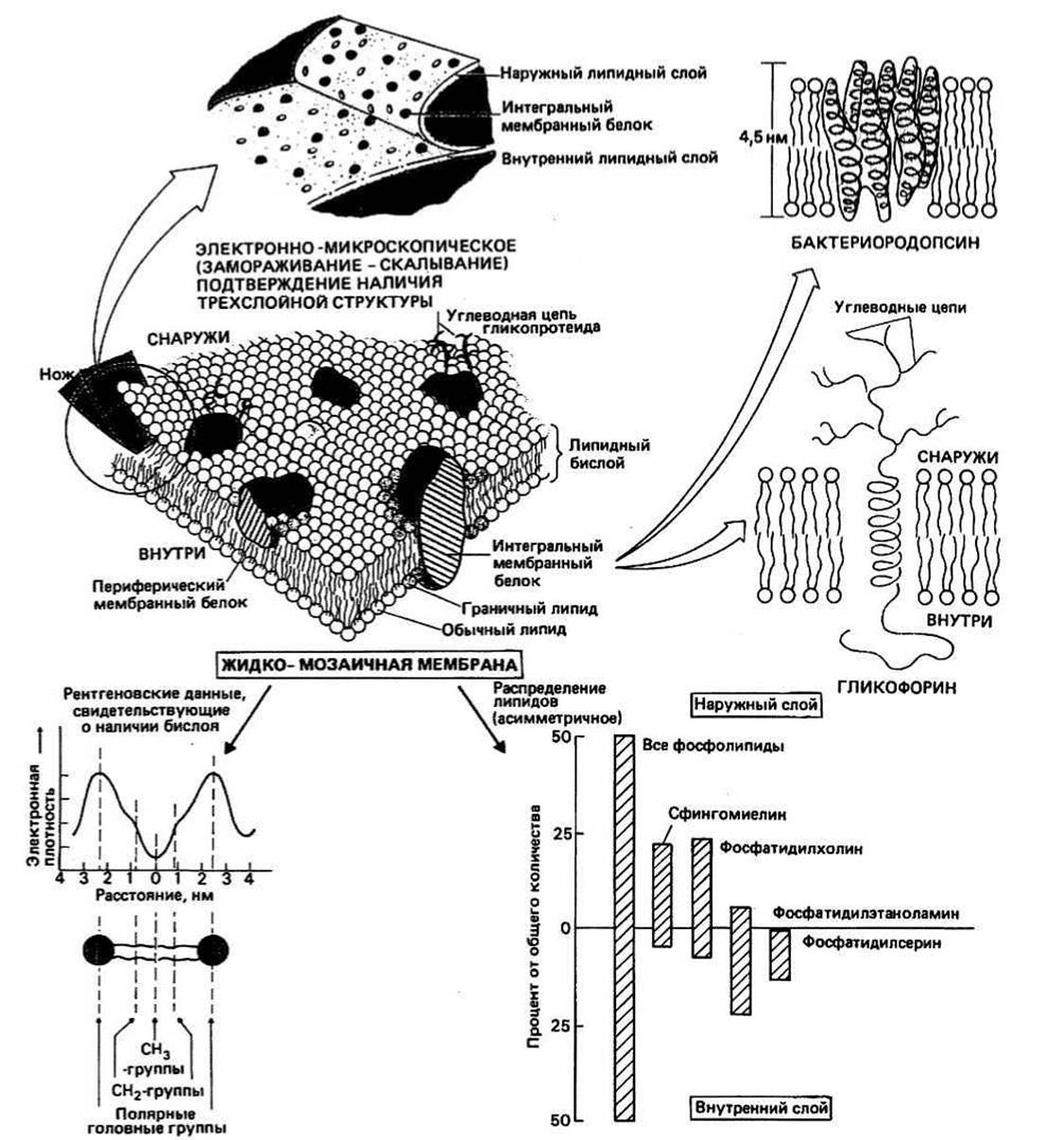
Рис. 34.1.
КЛЕТОЧНАЯ ИЛИ ПЛАЗМАТИЧЕСКАЯ МЕМБРАНА - это барьер, отделяющий цитоплазму всех клеток про- и эукариот от окружающей среды. Он состоит из липидов, белков и углеводов. Мембранами окружены некоторые внутриклеточные органеллы — митохондрии, хлоропласты, эндоплазматический ретикулум, аппарат Гольджи, лизосомы и ядро. Эти барьеры отделяют функциональные единицы органелл от других клеточных компонентов.
Липиды природных мембран в основном представлены фосфолипидами, у которых одна или две жирнокислотные цепи этерифицированы либо глицеролом, либо сфингозином, а к третьему атому углерода присоединена фосфатная группа, с которой в свою очередь связана полярная группа, например холин (см. гл. 32, 33). Одна из жирных кислот часто бывает ненасыщена, при этом двойная связь почти всегда находится в wс-конформации (гл. 32). Такие стереохимические свойства оказывают большое влияние на латеральную упаковку цепей в мембране; это иллюстрирует рис. 34.2, где представлены две возможные комбинации конформаций жирных кислот.
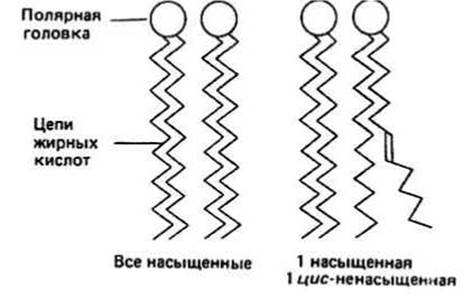
Рис. 34.2.
Липидный бислой — это структура, характерная д ля плазматических мембран всех живых клеток. Об этом свидетельствуют данные рентгеновской дифракции и электронной микроскопии. Толщина этого слоя составляет примерно 4—5 нм в зависимости от типов присутствующих в нем жирных кислот. Неполярные хвосты липидных молекул обращены друг к другу, а полярные головки остаются снаружи бислоя, образуя внутреннюю и наружную гидрофильные поверхности. Эта модель хорошо объясняет высокое трансмембранное электрическое сопротивление.
В клеточной мембране присутствуют белки. Впервые это предположение было высказано Даниэлли и Доусоном в 1935 г. для объяснения малого поверхностного натяжения клеточных мембран. Поскольку на границах раздела масло—вода должно возникать большое поверхностное натяжение, эти ученые постулировали, что гидрофобность жирных липидных компонентов должна компенсироваться каким-то гидрофильным белком. В 1959 г. на основании работ Робертсона, в которых он под электронным микроскопом наблюдал два электроноплотных слоя мембраны, разделенных менее плотной областью шириной около 3,5 нм, была сформулирована гипотеза элементарной мембраны. Наличие электроноплотных наружных слоев объяснялось тем, что с гидрофильными поверхностями, образованными липидными молекулами, связан белок. Однако против этой модели
свидетельствовали результаты электронно-микроскопических исследований препаратов мембран, полученных методом замораживания—скалывания; оказалось, что белковые молекулы располагаются не только на поверхности мембраны; есть и такие, которые пронизывают ее насквозь.
Жидкомозаичная модель структуры мембраны была предложена в 1971 г. Николсоном и Сингером. В соответствии с этой моделью, которая получила в настоящее время всеобщее признание, белки можно уподобить айсбергам, плавающим в липидном море. Существуют два типа мембранных белков: интегральные и периферические.
Интегральные белки пронизывают мембрану насквозь. Как и липиды, это амфипатические молекулы. У них есть центральное гидрофобное ядро, взаимодействующее с жирнокислотными цепями, и гидрофильные концы, контактирующие с клеточным содержимым и с окружением. Часто эти белки имеют углеводные цепи, присоединенные к той части молекулы, которая выступает во внеклеточную среду. Интегральные белки встраиваются в мембраны эндоплазматического ретикулума в процессе биосинтеза. По мере их перемещения от места синтеза к аппарату Гольджи и затем к плазматической мембране они могут гликозилироваться, превращаясь, таким образом, в гликопротеины (гл. 3).
Конформация интегральных белков определяется необходимостью выполнения условия, чтобы участки полипептидной цепи, проходящие через неполярные области липидной мембраны, содержали в основном только те полярные или заряженные группы, которые взаимодействуют с группами противоположной полярности (как в случае водородной связи). Следовательно, большинство боковых цепей расположенных здесь аминокислотных остатков должны быть гидрофобными. Исключением из данного правила может служить образование гидрофильного мембранного канала для прохождения ионов. Далее, полярные группы основной цепи (>NH и >СО) могут формировать внутрицепочечные водородные связи. В результате соответствующие участки полипептидной цепи часто образуют ос-спирали. Цепь бактериородопсина семь раз пересекает мембрану, при этом каждый раз образуется одна ос-спираль; эти ос-спирали соединяются последовательно короткими отрезками полипептидной цепи. Г ликофорин фиксируется в мембране с помощью единственной ос-спирали. Часть молекулы белка, выступающая с наружной стороны мембраны, бывает связана с углеводным «хвостом».
Периферические белки не пронизывают мембрану и связаны с ней менее прочно. Связывание осуществляется либо за счет гидрофобных взаимодействий с «хвостами» липидных молекул, либо благодаря электростатическому взаимодействию с их «головками», либо и тем, и другим путем. По своей структуре периферические белки напоминают водорастворимые глобулярные белки (гл. 10). Они могут быть связаны с любой поверхностью мембраны и часто удаляются с помощью слабых растворов детергентов или даже солевых растворов, как в случае цитохрома с — периферического белка, связанного с наружной поверхностью внутренней митохондральной мембраны.
Текучесть мембраны можно охарактеризовать скоростью латерального продольного движения липидных и белковых молекул. Эта скорость определяется жидкостными свойствами бислоя и факторами, ограничивающими подвижность, такими, как удерживание мембранных белков цито плазматически ми элементами. Скорость перемещения крупной молекулы в жидкой среде зависит от ее размеров и температуры среды. Эта скорость определяется коэффициентом диффузии который имеет размерность см2 ∙ с-1. Как правило, у крупного белка (мол. масса 105) в воде при 30 °С D составляет порядка 5 ∙ 10-7 см2 ∙ с-1. Измерения коэффициента диффузии мембранных белков с использованием метода флуоресцентной метки дали величину D ~ 10-9—10-11 см2 ∙ с-1. Таким образом, можно сделать вывод, что мембранные белки диффундируют в липидном бислое с такой скоростью, как если бы они находились в среде, имеющей вязкость жидкого масла.
Подвижность липидов в зависит от относительного содержания и типа присутствующих ненасыщенных жирных кислот. Углеводородная природа жирнокислотных цепей сообщает мембране свойства, характерные для масел, причем степень близости мембраны к маслам, или ее текучесть при данной температуре, зависит от того, насколько плотно упакованы цепи. В присутствии цис-ненасыщеннных жирных кислот силы сцепления между цепями слабее, чем в случае одних насыщенных жирных кислот, и липиды сохраняют высокую подвижность при низкой температуре. Когда силы сцепления становятся максимальными, образуется кристаллическая фаза. Если создать такие условия, чтобы эти силы были ослаблены и в то же время сохранялась упорядоченная структура, мембрана будет находится в жидкокристаллическом состоянии. Переход между этими двумя состояниями в мембранах большинства клеток осуществляется в температурном интервале от 15 до 40 °С в зависимости от липидного состава.
Граничными называются липиды, которые находятся так близко к белковым молекулам, что их подвижность становится меньше, чем у основной массы липидов. Фактически они как бы «привязаны» к поверхности белковой молекулы, и влияние на подвижность может распространяться на расстоянии до двух или трех диаметров липидной молекулы от белка.
Асимметрия — это свойство, присущее всем природным мембранам. Липидные молекулы, различающиеся в основном своими головными группами, распределены между двумя слоями бислоя асимметрично. Почему в мембранах клеток разных тканей распределение липидов столь различно — неизвестно. Однако липиды, содержащие углеводы, — гликолипиды — всегда встроены в наружную часть бислоя, так что их углеводная часть направлена во внеклеточную среду. На рис. 34.1 приведено типичное распределение липидов для мембран животных клеток, хотя здесь и не представлены холестерол и минорные липиды.

Рис. 34.3.