Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Клетки и молекулы за работой
Противоопухолевые антибиотики
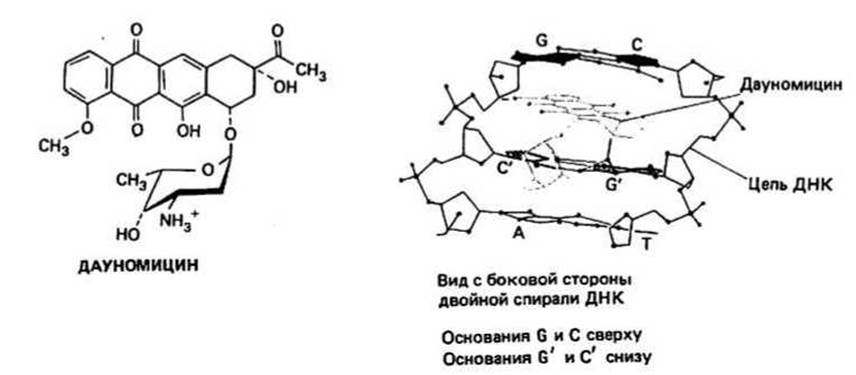
Рис. 43.1. Механизм действия встраивающегося в ДНК противоопухолевого антибиотика.
ПРОТИВООПУХОЛЕВЫЕ АНТИБИОТИКИ - группа веществ, используемых для лечения различных злокачественных заболеваний; многие из этих веществ являются природными и продуцируются различными видами актиномицетов (например, Streptomyces). Далеко не все такие вещества токсичны только для опухолевых клеток, однако благодаря тому, что они действуют, как правило, на механизм репликации, быстро делящиеся опухолевые клетки поражаются ими в большей степени, чем нормальные.
Митомицины - антибиотики, продуцируемые стрептомицетами, которые после ферментативной перестройки in vivo, по-видимому, алкилируют ДНК таким образом, что в ней образуются сшивки, мешающие репликации. То, что одни опухоли чувствительны к этим антибиотикам, а другие нет, объясняется, возможно, различиями в способности клеток разных опухолей репарировать поврежденную ДНК или нейтрализовать алкилирующие агенты.
Блеомицин — содержащий серу пептид сложной структуры, который, как предполагается, действует на опухолевые клетки, вызывая разрывы в ДНК. Результат действия этого антибиотика на различные опухолевые клетки также зависит от репарирующей активности последних (крайне высокой, между прочим, у нормальных клеток).
Агенты, которые способны встраиваться в ДНК, — третий класс противоопухолевых антибиотиков. Это обычно плоские, содержащие сконденсированные кольца молекулы, которые прочно связываются с ДНК, внедряясь между соседними парами оснований в двойной спирали; тем самым они снижают степень ее спирализации. Встраивание таких молекул в ДНК обычно полностью подавляет репликацию. Таков, например, актиномицин D, часто используемый экспериментаторами для прекращения синтеза ДНК в изучаемых клетках; он, однако, слишком токсичен для клинического применения.
Дауномицин - еще один из группы антибиотиков, действующих путем встраивания в двухцепочечную ДНК (см. рис. 43.1). Его четыре сконденсированных кольца, образующих почти плоскую структуру, способны поместиться между любыми парами оснований в двойной спирали, а аминосахар располагается в малом желобке спирали и фиксируется там водородными связями, возникающими между ДНК и кольцом, выступающим из основной плоскости конденсированной системы. Такая фиксация в структуре ДНК является, возможно, важным моментом в механизме действия дауномицина, ингибирующего активность как ДНК-, так и РНК-полимеразы. Рич и его коллеги высказали предположение, что когда РНК-полимераза на ДНК оказывается рядом со встроившимся антибиотиком, ее движение прекращается вследствие связывания с аминосахаром, однако точно механизм ингибирующего действия встраивающихся в ДНК агентов не известен. В будущем, возможно, удастся получить новые препараты рассматриваемого типа, способные направленно подавлять размножение вирусов и рост опухолей путем специфического связывания с теми нуклеотидными последовательностями в ДНК и РНК, которые принадлежат вирусу или характерны для трансформированных (т. е. опухолевых) клеток.
ИНТЕРФЕРОНЫ — белки, продуцируемые в организме многих позвоночных (в том числе и человека), обладающие противовирусным и (или) противоопухолевым действием. Интерфероны были открыты в конце пятидесятых годов двадцатого века Айзеком и Лин-денманом, показавшими, что в зараженных вирусом клетках может индуцироваться синтез одного или нескольких типов молекул, которые, будучи добавлены к клеткам, еще не имевшим контакта с вирусом, значительно снижают эффективность их последующего заражения. Это явление известно как интерференция, откуда и происходит название «интерферон». Интерфероны обладают также множеством других свойств. Значительный интерес вызывает, в частности, способность интерферонов подавлять размножение клеток, поскольку она делает их потенциальными противоопухолевыми агентами. Существуют три типа интерферонов: а, ß и у. То, какой именно интерферон будет синтезироваться зараженными клетками, зависит как от типа самих клеток, так и от типа индуктора, вызвавшего выработку интерферона. Образование а- и (ß-интерферонов может быть индуцировано у самых разных клеток некоторыми вирусами и бактериями, а также двухцепочечной РНК, тогда как у-интерферон вырабатывается лишь у ограниченного круга клеток в ответ на определенные митогены или антигенный материал, к которому клетки были предварительно сенсибилизированы. Механизм действия интерферонов активно исследуется. Уже известно, что они оказывают в клетке влияние на многие ферменты и аппарат синтеза белка, однако до детального понимания механизма вирусной интерференции еще довольно далеко.