Биологические мембраны - А. Н. Огурцов 2012
Структура и функции биомембран
Активный транспорт
АВС-транспортёры
Как отмечалось выше, все белки большого суперсемейства АВС-транспортёров (ATP-binding Cassette) состоят из двух трансмембранных (Т) и двух цитозольных АТФ-связывающих (А) доменов (рисунок 62(6)).
Каждый домен Т состоит из шести трансмембранных а-спиралей. Два домена Т формируют проход в мембране, через который транспортируемый метаболит (который часто называют субстратом) проходит сквозь мембрану и который определяет субстратную специфичность каждого АВС-транспортёра.
Строение доменов А на 30-40% аналогично во всех АВС-транспортёрах, что указывает на их общее эволюционное происхождение. Некоторые АВС-белки содержат также дополнительные экзоплазматические субстрат-связывающие или регуляторные субъединицы.
Плазматическая мембрана многих бактерий содержит многочисленные белки пермеазы, которые являются членами АВС-суперсемейства. Пермеазы используют энергию гидролиза АТФ для переноса специфических аминокислот, сахаров, витаминов и даже пептидов через мембрану в цитозоль клетки. Поскольку бактерии часто существуют в почве или водоёмах с низкой концентрацией питательных веществ, то АВС-транспортёры обеспечивают снабжение клетки даже против градиента концентрации.
Бактериальные пермеазы обычно являются индуцируемыми.
По определению индуцируемыми или адаптивными ферментами называются ферменты, скорость синтеза которых изменяется в зависимости от условий существования организма. Регуляция синтеза индуцируемых ферментов происходит на генетическом уровне под действием индукторов, которыми могут быть соответствующие субстраты и метаболиты, а также гормоны. Механизм индукции заключается в депрессировании генов, контролирующих синтез.
Типичным примером индуцируемого фермента является ß-галактозидаза (катализирует гидролитическое расщепление лактозы на составляющие моносахариды: галактозу и глюкозу), биосинтез которой в некоторых микроорганизмах происходит лишь тогда, когда единственным источником углерода в питательной среде является лактоза или её аналоги.
Те же ферменты, которые постоянно синтезируются организмом независимо от условий существования или наличия соответствующих субстратов, называются конститутивными ферментами.
Поскольку бактериальные пермеазы являются индуцируемыми белками, то их количество в плазматической мембране бактерии регулируется и концентрацией питательных веществ в окружающей среде, и метаболическими потребностями клетки.
У гистидиновой пермеазы Е. coli, типичного бактериального АВС- транспортёра, все четыре домена - два трансмембранных и два цитозольных АТФ-связывающих — являются отдельными субъединицами.
У грамотрицательных бактерий, таких, как Е. coli, наружная клеточная стенка содержит белковые поры - порины (рисунок 39), которые обеспечивают свободный вход малых молекул в периплазматическое пространство. Водорастворимые гистидин-связывающие белки, которые находятся в этом периплазматическом пространстве, связываются с прошедшим через порины гистидином, после чего такой комплекс может быть перемещён через плазматическую мембрану в цитозоль клетки субъединицами Т пермеазы, используя энергию гидролиза АТФ.
Мутантные штаммы Е. coli, которые являются дефектными по любому из генов, кодирующих субъединицы пермеазы, не способны транспортировать гистидин в цитозоль клетки, но они сохраняют способность транспорта других аминокислот, который осуществляется другими транспортными белками.
В настоящее время обнаружено более 50 ABC-транспортёров в клетках млекопитающих, переносящих малые молекулы через мембраны.
Первый ABC-насос был обнаружен при исследовании явления лекарственной резистентности опухолевых клеток к некоторым лекарственным препаратам с различной химической структурой.
Именно эти клетки демонстрировали высокий уровень экспрессии транспортных белков MDR1, обеспечивающих мультилекарственную резистентность (multidrug-resistance, MDR). Эти транспортёры за счёт энергии гидролиза АТФ выкачивают различные лекарственные препараты из цитозоля клетки в экзоплазматическое пространство. Ген Mdr1 значительно активизирован в клетках, обладающих мультилекарственной резистентностью, что приводит к гиперпродукции белков MDR1.
Большинство молекул лекарственных препаратов, которые выкачивает из цитозоля MDR1-транспортёр, являются малыми гидрофобными молекулами, действие которых заключается в блокировке различных клеточных функций, и которые попадают в цитозоль благодаря простой диффузии сквозь плазматическую мембрану без помощи специализированных транспортёров.
Два примера таких лекарственных препаратов: колхицин и винбластин (colchicine и vinblastine), которые блокируют ассемблирование микротрубочек. Стимулированное гидролизом АТФ удаление этих лекарственных препаратов MDR1-транспортёрами значительно снижает их концентрацию в цитозоле. В результате для уничтожения опухолевых клеток, которые экспрессируют белки MDR1, требуется намного большая концентрация лекарственных препаратов во внеклеточной среде, чем в случае отсутствия такой экспрессии. Факт принадлежности белков MDR1 к АТФазным насосам был доказан с использованием липосом, содержащих очищенный белок (рисунок 56). АТФазная активность этих липосом усиливалась пропорционально концентрации лекарственных препаратов, которые могли транспортировать белки MDR1.
Более 50 обнаруженных в клетках млекопитающих АВС-транспортёров экспрессируются преимущественно в клетках печени, кишечника и почек - там, где протекают интенсивные процессы выведения из организма токсических веществ и продуктов жизнедеятельности. Субстратами этих ABC-белков являются сахара, аминокислоты, холестерол, пептиды, белки, токсины и ксенобиотики.
Именно в этих органах белки MDR1 естественным образом осуществляют вывод различных токсинов, как чужеродных, так и образующихся в метаболических процессах, в желчь, мочу, или в люмен кишечника. В ходе эволюции MDR1 приобрели способность выводить молекулы лекарственных препаратов, чья структура подобна этим эндогенным токсинам. Те опухоли, которые образовались из таких видов MDR1-экспрессирующих клеток, такие как, например, гепатомы (рак печени), зачастую резистентны практически ко всем хемотерапевтическим агентам и, следовательно, трудно поддаются терапии, преимущественно потому, что в опухолевых клетках происходит гиперэкспрессия MDR1 и родственного ему белка MDR2.
Субстратами белка MDR1 являются преимущественно плоские отрицательно заряженные жирорастворимые молекулы, несущие один или более негативных зарядов. Поскольку наблюдается конкуренция между такими субстратами, то, видимо, все они присоединяются к одному и тому же центру связывания MDR1.
В отличие от бактериальных ABC-транспортёров все домены белка MDR1 являются частями одной полипептидной цепи с молекулярной массой 170 кДа.
Исследование трёхмерной структуры гомологичного АВС-транспортёра липидов Е. coli показало, что молекула транспортёра имеет V-образную форму с вершиной, погружённой в мембрану, и расположенными в цитозоле центрами связывания АТФ (рисунок 73).
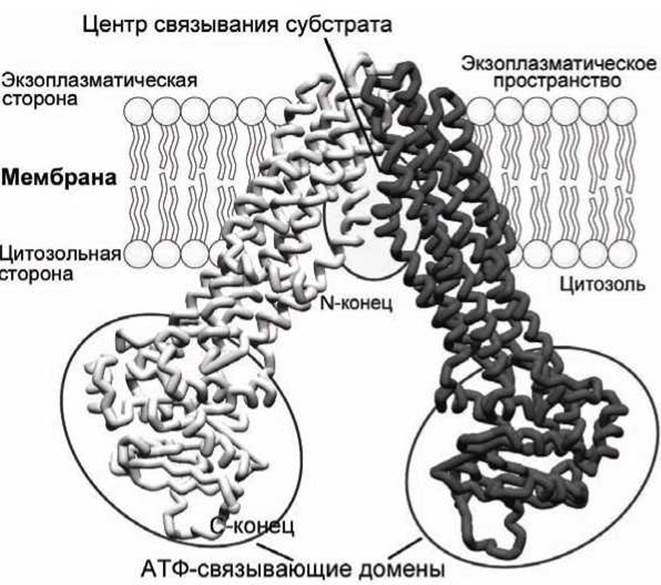
Рисунок 73 - Схема липидной флоппазы - ABC-транспортёра Е. coli
Хотя детальный механизм работы белка MDR1 и аналогичных ABC-транспортёров ещё не установлен, вероятнее всего, они функционируют по флоппазному механизму, представленному на рисунке 74.
В соответствии с этим механизмом транспортёр MDR1 перебрасывает ("flop") заряженную молекулу субстрата с цитозольной на эндоплазматическую сторону мембраны. Этот эндергонический процесс происходит за счёт энергии гидролиза АТФ, благодаря АТФазной активности белка.
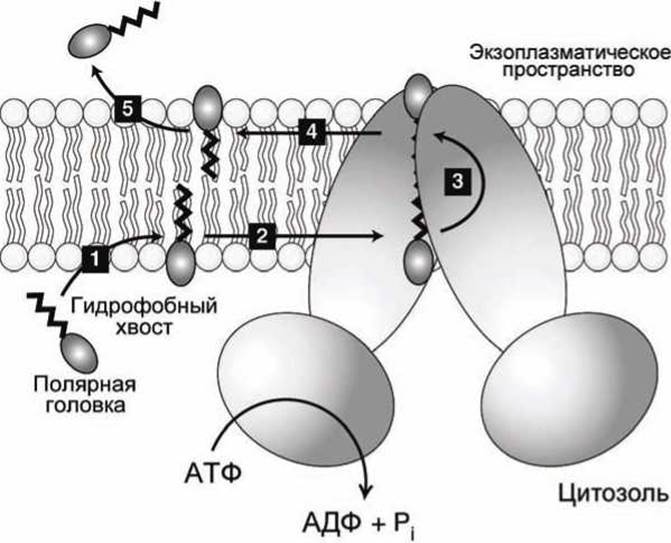
Рисунок 74 - Схема флоппазного механизма работы АВС-транспортёров
Свидетельства в пользу этой модели дали исследования гомологичного белка MDR2, который располагается на плазматической мембране клеток печени выстилающих желчные протоки.
MDR2 переносит фосфолипиды с цитозольной стороны мембраны на экзоплазматическую сторону по флип-флоп механизму, создавая тем самым избыток фосфолипидов в липидном монослое с экзоплазматической стороны мембраны. Эти липиды затем отделяются от мембраны и формируют значительную фракцию в составе желчи.
Весь процесе перемещения субстратов из цитозоля в экзоплазму ABC-транспортёрами типа MDR1 можно представить в виде пяти этапов (рисунок 74).
1. Гидрофобная часть субстрата (изображена черной зигзагообразной линией на рисунке 74) под действием гидрофобных сил самопроизвольно встраивается в цитозольный липидный монослой мембраны, а заряженная часть субстрата остаётся в контакте с цитозолем.
2. Субстрат диффундирует вдоль мембраны к белку MDR1 и связывается с ним.
3. Транспортёр за счёт энергии гидролиза АТФ перебрасывает заряженный субстрат на экзоплазматическую сторону мембраны.
4. На экзоплазматической стороне субстрат свободно диффундирует по липидному монослою.
5. В финале субстрат уходит в экзоплазматическое пространство.
Сам же механизм флип-флопа белка проиллюстрируем на примере бактериального BtuCD-транспортёра, который переносит витамин В12 через мембрану (рисунок 75).
Транспортёр имеет большой карман, который обычно открыт наружу клетки. Молекула витамина доставляется к транспортёру с помощью малого переносчика. Связывание АТФ с доменами транспортёра внутри клетки приводит к такому изменению конформации транспортёра, при котором открывается дно кармана, и молекула витамина может войти в клетку.
ABC-транспортёры имеют, образно говоря, форму бельевой прищепки, проходящей сквозь мембрану. АТФ-связывающие домены находятся в "ручках прищепки", а в транспортный механизм входит специальный карман на "зажимах прищепки". Этот карман имеет два входа с обеих сторон мембраны.
При флип-флопе зажим "прищепки" попеременно открывается и закрывается. В одном состоянии открыт вход в карман со стороны зажима, а противоположный вход со стороны "ручек" закрыт. В другом состоянии, наоборот, закрыт вход со стороны зажима, а открывается вход со стороны ручек "прищепки". Переход между двумя состояниями стимулируется гидролизом АТФ. Аналогичным образом различные АВС-транспортёры осуществляют трансмембранную транслокацию множества различных молекул таких, как аминокислоты, ионы, сахара, витамины, токсины и т. д.

Рисунок 75 - Схема работа бактериального BtuCD-транспортёра
В завершение необходимо отметить одну терминологическую особенность. В литературе часто различают флиппазы и флоппазы. При этом отмечается, что флиппазами (flippases, от английского flip, "перевёртывать") называют мембранные ферменты, переносящие молекулы фосфолипидов с внешнего (для плазматической мембраны) и люминального (в случае внутриклеточных органелл) слоя мембраны на цитозольный слой мембраны. А флоппазы переносят фосфолипиды, наоборот, с цитозольного слоя на внешний. В соответствии с этой терминологией ABC-переносчики являются флоппазами, а бактериальный BtuCD-транспортёр является флиппазой.
Контрольные вопросы и задания
1. Что называется активным транспортом вещества через биомембрану?
2. Перечислите четыре типа АТФ-насосов биомембран.
3. Какие белки-насосы относятся к АТФазам Р-типа?
4. Охарактеризуйте шесть этапов переноса ионов, сопряжённых с гидролизом АТФ, в Са2+-АТФазе.
5. Охарактеризуйте этапы переноса ионов, сопряжённых с гидролизом АТФ, в Na+/К+-АТФазе.
6. Какова биологическая функция мультибелкового комплекса F0F1?
7. Какие субъединицы входят в состав компонента F0 АТФ-синтазы?
8. Какие субъединицы входят в состав компонента F1 АТФ-синтазы?
9. Каким образом трансмембранный ток протонов через мотор F0 приводит к синтезу АТФ в комплексе F1 АТФ-синтазы?
10. Какие три конформации поочерёдно принимает каждая каталитическая субъединица ß цитозольного мотора F1 АТФ-синтазы?
11. Как фазы вращения ротора АТФ-синтазы связаны с каталитическим циклом синтеза АТФ?
12. Каким образом в мембранном моторе АТФ-синтазы реализуется процесс вращательной диффузии?
13. В люмене каких органелл обеспечивается повышенная кислотность вследствие работы АТФаз V-класса?
14. Какие два типа процессов должны сопровождать работу мембранных насосов V-класса для того, чтобы значительно повысить кислотность люмена данной органеллы?
15. Из каких доменов состоят АВС-транспортёры?
16. Какие ферменты называются индуцируемыми?
17. Какие ферменты называются конститутивными?
18. Какой ABC-транспортёр обеспечивает явление мультилекарственной резистентности раковых клеток?
19. В каких органах млекопитающих происходит преимущественная экспрессия АВС-транспортёров?
20. Охарактеризуйте этапы переноса субстратов АВС-транспортёрами, работающими по флоппазному механизму.
21. В чём сходство и различие функционирования флиппаз и флоппаз?