Биологические мембраны - А. Н. Огурцов 2012
Электрогенез биомембран
Внутриклеточная сигнализация
Ионы кальция
В синапсе между болевым рецептором и ассоциативным болевым нейроном (рисунок 137) в качестве нейротрансмиттера используется глутаминовая кислота (glutamate). Когда потенциал действия достигает проксимальной терминали аксона болевого рецептора, в пресинаптической части запускается механизм регуляторного экзоцитоза глутаминовой кислоты по механизму описанному выше (рисунок 125).
Деполяризация мембраны аксона с -70 мВ до +30 мВ открывает потенциалочувствительные кальциевые каналы в мембране, и концентрация ионов кальция увеличивается от 100 нМ/л (в спокойном состоянии) до 1мкМ/л, и синаптические везикулы выбрасывают своё содержимое в синаптическую щель. В случае синапса сенсорного нейрона с ассоциативным нейроном везикулы заполнены глутаматом натрия (sodium glutamate).
В данном случае, также как и в случае нейромышечного соединения (см. п. 16.4), ионы кальция выполняют функцию внутриклеточного месенджера - вещества, повышение концентрации которого в цитозоле стимулирует специфическую для данной клетки реакцию.
Концентрация кальция в цитозоле может возрастать не только в ответ на появление потенциала действия, но и в ответ на появление во внеклеточной среде сигнальных молекул, которые часто называют трансмиттерами.
Наличие таких молекул-трансмиттеров детектируется специфичными для данного типа молекул интегральными мембранными белками- рецепторами. Эти рецепторы, в ответ на присоединение специфического лиганда, запускают определённую метаболическую цепочку событий, результатом которой является высвобождение кальция из гладкого эндоплазматического ретикулума в цитозоль.
Например, в случае тромбоцитов крови такое высвобождение ионов Са2+ из эндоплазматического ретикулума в цитозоль тромбоцита стимулирует процесс свёртывания крови.
Кальций из эндоплазматического ретикулума выходит через инозитол-трисфосфат-регулируемые кальциевые каналы, а инозитол трисфосфат (ІР3) образуется ß-изоформой фермента фосфолипаза С (PLCß) при ферментативном гидролизе фосфолипида плазматической мембраны фосфатидилинозитол бисфосфат (РIР2).
Для тромбоцитов химическим сигналом, свидетельствующим о необходимости инициации процесса сворачивания крови, является появление в крови молекул АДФ (рисунок 139).
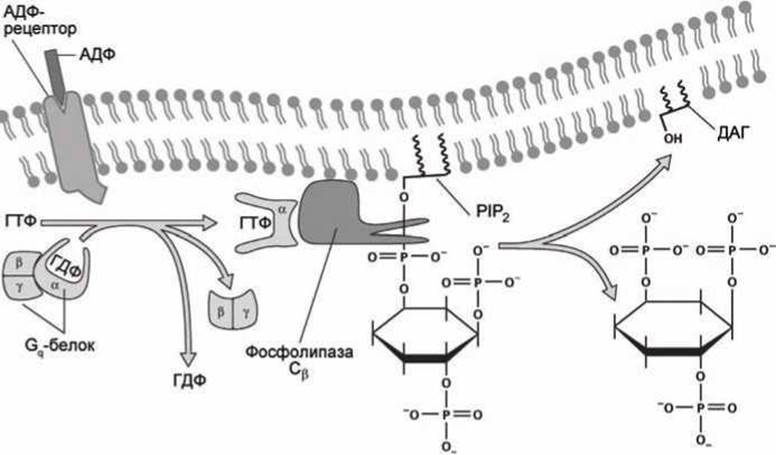
Рисунок 139 - Синтез инозитол трисфосфата в ответ на связывание АДФ с мембранным рецептором
Молекулы АДФ могут оказаться в крови только в результате механического повреждения клеток. Соединение АДФ с мембранным GPCR-рецептором на поверхности тромбоцита активизирует этот рецептор и он становится GEF-белком (Guanine nucleotide Exchange Factor (рисунок 79)) для тримерного белка Gq, который обладает ГТФазной активностью и в свою очередь активирует ß-изоформу фермента фосфолипаза С (точное название фермента — фосфоинозитид фосфолипаза С).
В отличие от ГТФазы Ran, которая управляет транспортом белков в ядро клетки (рисунок 80), тримерный белок Gq состоит из трёх субъединиц: ГТФазной субъединицы а и двух субъединиц ß и у, которые диссоциируют с субъединицы а, когда она связана с АТФ, и вновь объединяются в тримерный белок после гидролиза АТФ в АДФ.
Активированная форма фосфолипазы С как раз и катализирует указанную выше реакцию гидролиза фосфатидилинозитол бисфосфата (РIР2) с образованием инозитол трисфосфата (IР3) в цитозоле и диацилглицерола (ДАТ) в мембране.
Таким образом, в ответ на появление в экзоплазме молекул АДФ в цитоплазме увеличивается концентрация IР3, молекулы которого активируют инозитол-трисфосфат управляемые кальциевые каналы (inositol trisphosphat-gated calcium channels) (рисунок 140).
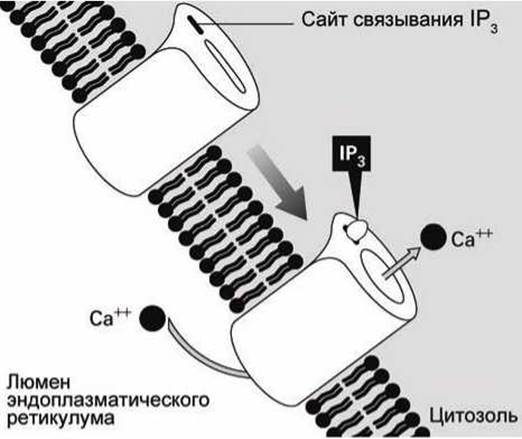
Рисунок 140 - Инозитол-трисфосфат-управляемый кальциевый канал
Рост концентрации ионов кальция в цитозоле тромбоцита приводит к изменению формы клетки, тромбоциты становятся "клейкими", они начинают слипаться друг с другом, формируется сгусток крови и начинается процесс сворачивания крови в месте повреждения кровеносного сосуда.
Комбинация компонентов сигнальной цепи, состоящая из фосфатидилинозитол бисфосфата РIР2, тримерного белка Gq, ß-изоформы фосфолипазы С (PLCß) и инозитол-трисфосфат-управляемых кальциевых каналов, присутствует практически во всех эукариотических клетках. Однако только те клетки, в плазматической мембране которых есть АДФ-рецепторы, демонстрируют рост цитозольной концентрации ионов кальция в ответ на появление АДФ. Другие клетки реагируют на появление других сигнальных молекул, для которых у них есть мембранные рецепторы. Обнаружено более сотни таких рецепторов.
Резкое повышение цитозольной концентрации ионов кальция является универсальным внутриклеточным сигналом, но какой из метаболических процессов будет запущен в ответ на этот сигнал, зависит от типа клетки. В секреторных клетках (например, слюнных желез или в терминалах аксонов) индуцируется секреция, а в мышечных клетках происходит сокращение саркомеров. Во всех случаях ионы кальция связываются с кальций-связывающими белками, и такие кальций-белковые комплексы активируют соответствующий процесс.
В клетках скелетных мышц кроме (1) мышечного сокращения, ионы кальция стимулируют также (2) гидролиз гликогена ферментом киназа гликоген-фосфорилазы, а также (3) стимулируют работу ферментов цикла Кребса в митохондриях, активируя синтез НАДФ и АТФ.
Многие клетки имеют специфические кальциевые каналы в мембране эндоплазматического ретикулума, которые называются рианодиновыми рецепторами. Первоначально такие каналы были обнаружены по их способности связывать растительный алкалоид рианодин вместо IР3.
В клетках скелетных мышц такие рианодиновые рецепторы физически соединены с потенциалочувствительными кальциевыми каналами плазматической мембраны (рисунок 141).
Когда потенциалочувствительный канал плазматической мембраны открывается, то открывается и рианодиновый рецептор мембраны эндоплазматического ретикулума, выпуская кальций в цитозоль клетки.
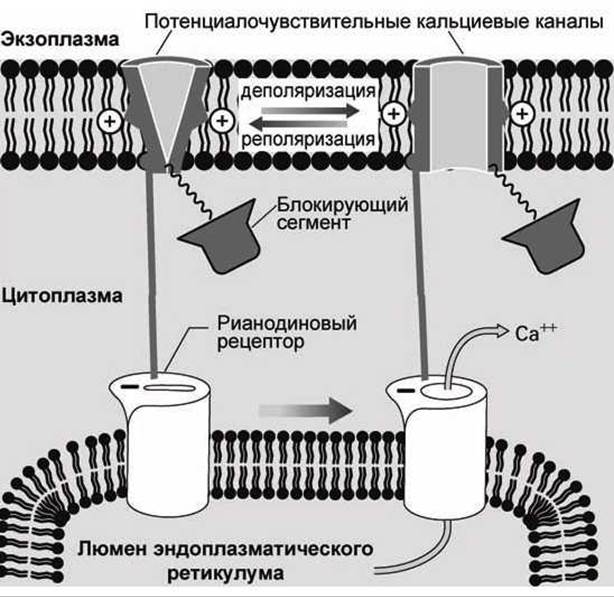
Рисунок 141 - Рианодиновые рецепторы клеток скелетных мышц
В клетках других типов такой механической связи между каналами наружной мембраны и рианодиновыми рецепторами эндоплазматического ретикулума не обнаружено, а оказалось, что эти рецепторы открываются, если концентрация кальция в цитозоле превысит критическое значение.
Например, в кардиомиоцитах (клетках сердечной мышцы) деполяризация плазматической мембраны приводит к тому, что открываются кальциевые каналы на плазматической мембране, и ионы кальция, вошедшие в клетку из внеклеточного пространства, связываются с кальций-связывающими центрами рианодиновых рецепторов мембраны эндоплазматического ретикулума. Это приводит к тому, что открываются также и каналы рианодиновых рецепторов, и кальций из гладкого эндоплазматического ретикулума выходит в цитозоль (рисунок 142).
После того как источник внешнего возбуждения исчезает, концентрация кальция в цитозоле возвращается к исходному (невозбуждённому) значению. Ионы кальция выкачиваются из цитозоля (1) Са2+-АТФазами (п. 7.2) и (2) 3-Nа+/1-Са2+-антипортёрами (п. 11.2).
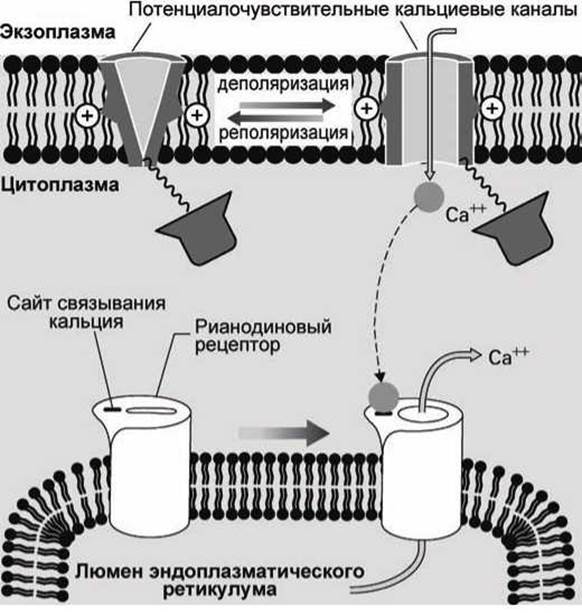
Рисунок 142 - Рианодиновые рецепторы кардиомиоцитов