ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ II. АНТИМИКРОБНЫЕ АГЕНТЫ
ГЛАВА 8. АНТИБИОТИКИ И СИНТЕТИЧЕСКИЕ ХИМИОТЕРАПЕВТИЧЕСКИЕ ПРЕПАРАТЫ
8.1 Антибиотики
Общие представления
Термин «антибиотический» впервые употребил в 1889 г. Поль Вюйемен, говоря об антагонистических взаимоотношениях растений и животных. В 1942 г. Ваксман определил антибиотик как «химическое вещество, произведенное микроорганизмами, которое способно угнетать рост или даже разрушать другие микроорганизмы в разбавленных растворах». Это вторичные метаболиты, которые необходимы их продуцентам для выживания в условиях конкуренции с другими микроорганизмами.
Помимо антимикробной активности они могут обладать другими фармакологическими свойствами: действовать как иммунодепрессанты, ингибиторы ферментов, противоопухолевые и цитотоксические средства, инсектициды и гербициды. К настоящему времени описано около 20000 антибиотических веществ, однако, в клинике используется не более 160 антибиотиков, из них 30% составляют природные продукты, 30% — полусинтетические и остальные — синтетические. Химический синтез часто бывает экономически более выгодным для получения аналогов природных соединений, чем биосинтез. Однако биосинтез незаменим для получения природных продуктов, предшественников полусинтетических антибиотиков и ферментов, необходимых для энзиматической трансформации природных или синтетических соединений. Постоянное появление микроорганизмов, устойчивых к антибиотикам, требует изыскания новых продуцентов и новых антимикробных препаратов.
Активность антибиотиков, т. е. способность подавлять рост микробной популяции определяется разнообразными методами (см. главу 9).
По спектру действия антибиотики подразделяют на противовирусные, антибактериальные, антифунгальные, антипротозойные. Некоторые из них обладают широким спектром действия, другие активны против определенных групп микроорганизмов, например, только против грамположительных бактерий. Антибиотики весьма разнообразны по структуре и механизму действия.
8.1.1 β-лактамные антибиотики
Пенициллины. Общее строение молекулы пенициллинов показано на рис. 43. Существуют природные и полусинтетические пенициллины. Природные (бензилпенициллин G, феноксиметилпенициллин или пенициллин V) синтезируются при ферментации Penicillium notatum и P. chrysogenum. Полусинтетические являются производными основы молекулы пенициллина — 6-ами- нопенициллановой кислоты (6-АПК), в которых боковая цепь представлена различными радикалами, введенными путем ацилирования 6-АПК. Они различаются по своей активности и другим свойствам (табл. 19). Так, в отличие от природного бензилпенициллина многие полусинтетические пенициллины не разрушаются в кислой среде желудка и могут быть использованы перорально. Такие производные бензилпенициллина, как безатин, бенетамин, прокаин медленно освобождают пенициллин, длительное время поддерживая его высокую концентрацию в крови, поэтому не требуют многократного введения в организм больного. Эфиры карбенициллина и ампициллина подвергаются ферментному гидролизу после абсорбции из слизистой оболочки кишечника и создают высокий уровень активного антибиотика в крови.
Рис. 43. Общее строение молекулы пенициллинов. Стрелкой показана связь, гидролизуемая β-лактамазой.
Некоторые полусинтетические пенициллины в отличие от бензилпенициллина устойчивы к действию микробной β-лактамазы (пенициллиназы) — фермента, инактивирующего пенициллин за счет разрыва β-лактамного кольца. Имеются препараты, активные как против грамположительных, так и грамотрицательных микроорганизмов, включая Pseudomonasaeruginosa (бактерия высокорезистентная ко многим антибактериальным агентам).
Таблица 19. Пенициллины
Пенициллин |
Эффективен при оральном применении |
Устойчив к β-лактамазе |
Активен против |
||
St. aureus |
Г- бактерий |
Г- бактерий, кроме P aeruginosa |
Pseudomonas aeruginosa |
||
Бензилпенициллин |
- |
- |
- |
- |
- |
Феноксиметилпенициллин |
+ |
- |
- |
- |
- |
Метициллин |
- |
+ |
+ |
- |
- |
Оксациллин |
+ |
+ |
+ |
- |
- |
Клоксациллин |
+ |
+ |
+ |
- |
- |
Флуклоксациллин |
+ |
+ |
+ |
- |
- |
Ампициллин |
+ |
- |
- |
+ |
- |
Амоксициллин |
+ |
- |
- |
+ |
- |
Карбенициллин |
- |
- |
+ |
+ |
+ |
Тикарциллин |
- |
- |
+ |
+ |
+ |
Карфециллин1 * |
+ |
- |
+ |
+ |
+ |
Инданил карбенициллин* |
+ |
- |
+ |
+ |
+ |
Пивампициллин2 ** |
+ |
- |
- |
+ |
- |
Талампициллин** |
+ |
- |
- |
+ |
- |
Бакампициллин** |
+ |
- |
- |
+ |
- |
Пиперациллин3 *** |
- |
- |
- |
+ |
+ |
Азлоциллин*** |
- |
- |
- |
+ |
+ |
Мезлоциллин*** |
- |
- |
- |
+ |
+ |
Мециллинам4**** |
- |
✵• |
- |
+ |
- |
Пивлюциллинам**** |
+ |
✵ |
- |
+ |
- |
* - эфиры карбенициллина;
** — эфиры ампициллина;
*** — замещенные ампициллины;
**** — 6-β-амидинопенициллины; •• — не действуют на Г+ бактерии.
Мециллинам, 6-β-амидинопенициллановые кислоты и их эфир пивмециллинам имеют необычный
спектр антибактериальной активности не действуют на грамположительные микроорганизмы, как классические пенициллины, а лишь на грамотрицательные.
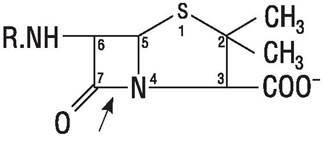
8.1.2 Цефалоспорины
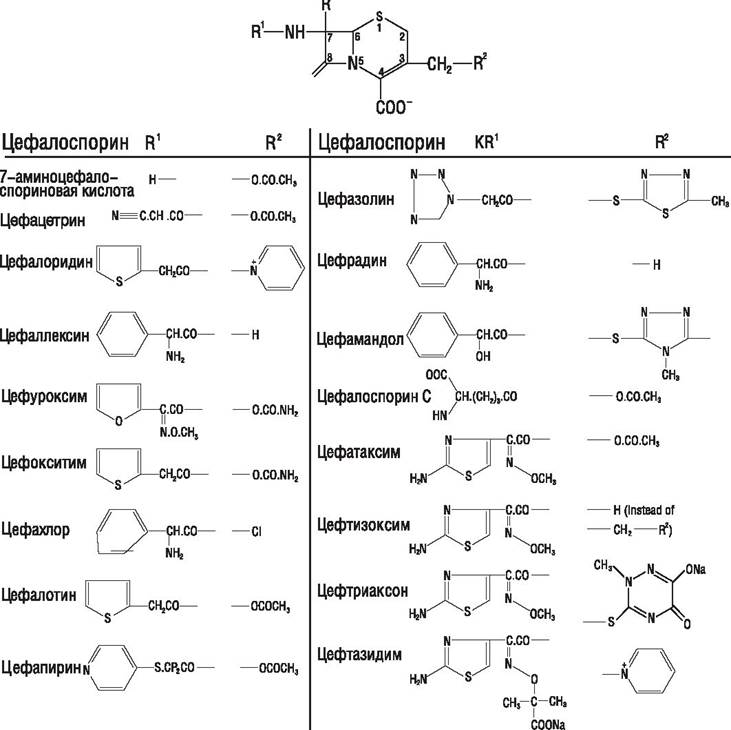
Цефалоспорины (цефемы), подобно пенициллинам, относят к группе Р-лактамных антибиотиков. Они имеют более широкий спектр действия по сравнению с пенициллинами и более устойчивы к β-лактамазам. Люди, страдающие аллергией к пенициллину, обычно не чувствительны к цефемам. Продуцентом природного антибиотика цефалоспорина С является гриб Аcremonium chrysogenum, первоначально названный Сephalosporium acremonium. На основе природного цефалоспорина получены многочисленные полусинтетические препараты (рис. 44).
Рис. 44. Структура цефалоспоринов.
Клавамы отличаются от пенициллинов (рис. 45) замещением серы в тиазолидиновом кольце пенициллина на кислород в оксазолидиновом кольце клавама и отсутствием боковой цепи в 6-м положении. Кла- вулановая кислота (рис. 45, А), продуцентом которой является Stгeptomyces clavuligeгus, обладает низкой антибактериальной активностью, но является сильным ингибитором стафилококковой β-лактамазы и большинства типов β-лактамаз, продуцируемых грамотрицательными бактериями, особенно с «пенициллиназной», но не «цефалоспориназной» активностью. В клинической практике используют аугментин — комбинированный препарат клавулановой кислоты с амоксициллином — полусинтетическим пенициллином, обладающим широким спектром действия, но чувствительным к β-лактамазе.
Рис. 45. Клавамы: А — клавулановая кислота; В — латамоксеф; С — карбапенемы; D — оливановые кислоты; Е — тиенамицин.
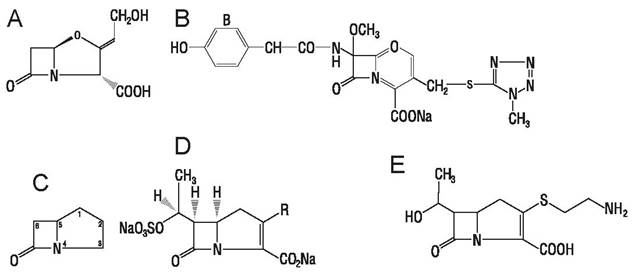
В 1-оксацефемах атом серы в дигидротиазиновом кольце цефалоспорина замещен кислородом. Такая молекула чувствительна к β-лактамазам, однако, введение 7-α-метоксигруппы (как у цефокситина), делает соединение более стабильным. К этой же группе принадлежит латамоксеф (рис. 45, В) — антибиотик широкого спектра, устойчивый к β-лактамазам.
Карбапенемы (рис. 45, С) являются аналогами пенициллинов или клавамов, у которых атом серы (пенициллинов) или кислорода (клавамов) замещен углеродом. К ним принадлежат оливановые кислоты (рис. 45, Б), продуцируемые Streptomyces olivaceus — антибиотики широкого спектра, сильные ингибиторы β-лактамаз, а также тиенамицин (рис. 45, Е), обладающий такими же свойствами, но нестабильный. Его производные N-формимидоилтиенамицин лишен этого недостатка.
Нокардицины (А — Д) продуцируются Nocardia sр., наиболее активен антибиотик широкого спектра нокардицин А (рис. 46, А).
Рис. 46. А — Нокардицин А; В — азтреонам; С — суль- фонпенициллановая кислота (Na соль); D — бромопенициллановая кислота (Na соль).
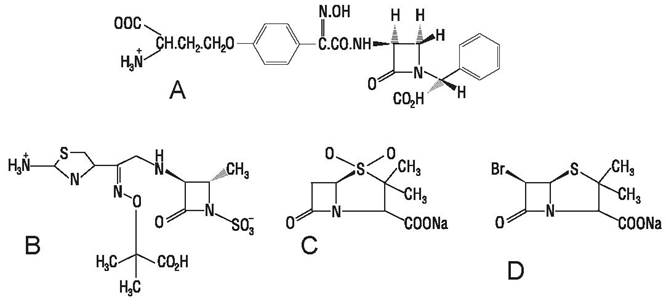
Монобактамы — это моноциклические β-лактамы, не содержащие тиазолидинового кольца, синтезируются различными штаммами бактерий. Из антибиотиков этой группы наиболее эффективным оказался азтреонам (рис. 46, В), действующий на многие грамотрицательные бактерии и устойчивый к β-лактамазам, однако, не обладающий активностью по отношению к бактероидам и грамотрицательным анаэробам.
Другие β-лактамы. Производные пенициллановой кислоты, например, сульфон- и бромопенициллановые кислоты (рис. 46, С, D, Е) являются ингибиторами некоторых типов β-лактамаз.
8.1.3 Тетрациклины
Тетрациклины продуцируются некоторыми видами стрептомицетов, а также получаются как полусинтетические препараты (рис. 47). Так хлортетрациклин образуется при ферментации Б. aureofaciens, из него путем каталитического гидрогенизирования получают тетрациклин и кломоциклин. Химическая модификация тетрациклина дает миноциклин. Окситетрациклин продуцируется S. rimosus, из него получают метациклин, гидрогенизация которого дает доксициклин. Мутант aureofaciens продуцирует метилхлортетрациклин. Тиатетрациклины, например, тиациклин, содержат атом серы в 6-м положении молекулы, активны против бактерий, устойчивых к тетрациклину. В настоящее время природные тетрациклины практически не применяются, их вытеснили полусинтетические препараты (доксициклин и миноциклин).
Рис. 47. Тетрациклины: 1 — окситетрациклин; 2 — хлортетрациклин; 3 — тетрациклин; 4 — деметилхлортетрациклин; 5 — доксициклин; 6 — метациклин; 7 — кломоциклин; 8 — миноциклин; 9 — тиациклин.
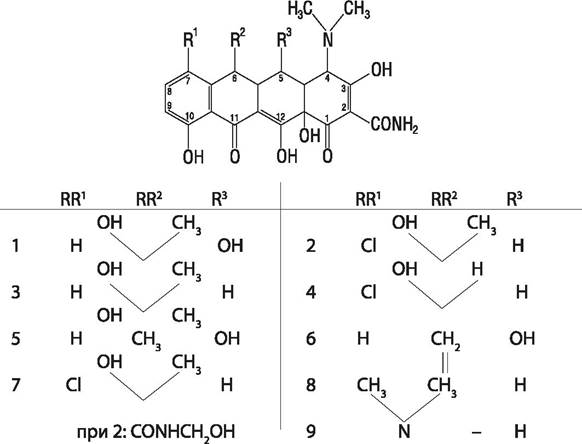
Тетрациклины — антибиотики широкого спектра. Резистентность к ним развивается относительно медленно. Однако, существует перекрестная резистентность, т. е. микроорганизм, устойчивый к одному из тетрациклинов, устойчив также ко всем членам этой группы.
Следствием употребления тетрациклинов может быть дисбактериоз, в том числе развитие кандидоза.
8.1.4 Рифапицины
Рифапицины в виде комплекса антибиотиков продуцирует Streptomyces mediterranei, из них наиболее перспективен рифампицин В, на основе которого создан полусинтетический аналог рифампицин (рис. 48).
Рис. 48. Рифампицин.
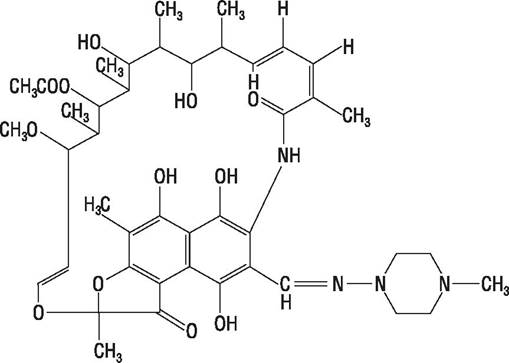
Рифампицин — антибиотик широкого спектра действия. Резистентность развивается довольно быстро, поэтому его рекомендуют использовать ограниченно, в основном при микобактериозах. Препарат плохо всасывается при приеме внутрь, поэтому применяется парентерально или местно.
8.1.5 Аминогликозидные антибиотики
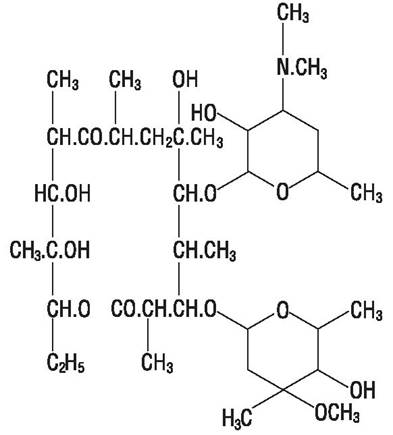
Аминогликозидные антибиотики - это большой класс соединений, образуемых некоторыми актиномицетами и бациллами. Аминогликозиды содержат в своей структуре аминосахара: дезоксистрептамин - в молекулах неомицина, фрамицетина, гентамицина, канамицина, тобрамицина, амикацина, нетилмицина, сизомицина и стрептидин в молекулах стрептомицина и дигидрострептомицина. Аминоциклитолстреп- томицин не имеет углеводного компонента (рис. 49). Это антибиотики широкого спектра действия. Стрептомицин и канамицин эффективны при туберкулезе. Аминогликозиды слабо действуют на стрептококки, не действуют на энтерококки, провиденции, бактероиды и другие анаэробы.
Рис. 49. Аминогликозидные антибиотики.
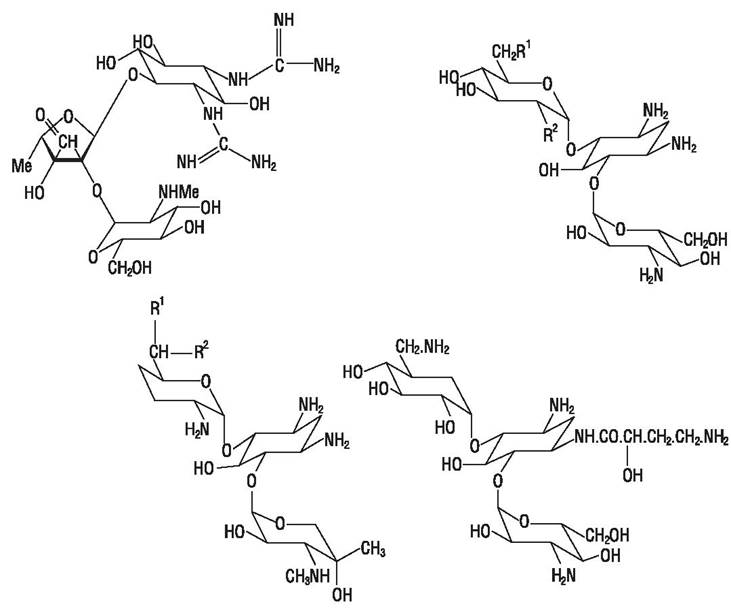
Модификация аминогликозидных антибиотиков позволяет получить препараты, устойчивые к инактивирующему действию ферментов резистентных штаммов микроорганизмов: 3-дезоксиканамицин (тобрамицин), амикацин, имеющий замещенный аминобутирил в аминогруппе 2-дезоксистрептамина, N-метилсизомицин (нетилмицин).
8.1.6 Макролиды
Молекулы макролидов содержат большие лактонные кольца, соединенные с аминосахарами гликозидными связями. Наиболее важные представители этой группы — это эритромицин, олеандомицин, триацетилолеандомицин и спирамицин. Эритромицин (рис. 50), продуцентом которого является Streptomyces erythreus, активен против грамположительных бактерий, нейссерий, Haemophilus influenzae и Legionella pneumophila, но не действует на энтеробактерии. Его активность увеличивается с повышением рН до 8,5, тиоцианит эритромицина более стабилен, чем свободное основание в кислой среде желудка и применяется орально, он длительно сохраняется в крови и более эффективно проникает в ткани, чем другие формы; in vivo гидролизуется до свободного основания.
Рис. 50. Эритромицин.
Staphylococcus aureus менее чувствителен к эритромицину, чем пневмококки или гемолитические стрептококки, и быстро образует резистентные формы. Поэтому этот антибиотик не следует применять длительное время.
Олеандомицин (продуцент S. antibioticus), его эфир (триацетилолеандомицин) и спиромицин имеют такой же спектр антибактериальной активности, как и эритромицин, но менее активен. Резистентность в клинической практике развивается медленно, однако, существует перекрестная резистентность к антибиотикам всей группы.
8.1.7 Полипептидные антибиотики
Полипептидные антибиотики представляют довольно разнообразную группу соединений, синтезируемых бациллами и актиномицетами. Они включают бацитрацин, активный против грамположительных и грамотрицательных кокков, но не бактерий; полимиксины, активные против многих грамотрицательных бактерий, исключая Serratia marcescens и Proteus spp.; капреомицин и виомицин, действующие на Mycobacterium tulerculosis.
Бацитрацин из-за высокой токсичности разрешен к применению только в случаях крайней необходимости.
Полимиксины обладают нефротоксичностью, в меньшей степени токсичны полимиксины В и Е (колистин). Для парентерального введения используют сульфометат натрия колистина. Натрия сульфомиксин — смесь сульфометилированного полимиксина В и натрия бисульфита менее токсичен, чем полимиксина В сульфат при сохранении его активности.
Катионные пептиды — новый класс антибиотиков, получаемых как из природных источников, так и химическим синтезом. В природе они присутствуют повсюду — у бактерий, грибов, растений, животных и человека.
У человека катионные пептиды (дефенсины) представлены группой пептидов, содержащих от 23 до 35 аминокислот; присутствуют в лейкоцитах и других тканях, активны против бактерий, простейших, грибов и вирусов, обладают хемотаксической активностью.
У растений это тионины, которые образуются в ответ на инфекцию, активны против некоторых бактерий и грибов.
У бактерий они выполняют функции бактериоцинов: колицин E. coli, низин Lactococcus lactis, субтиллин B. subtilis и др. Они менее активны по сравнению с другими антибиотиками, однако, действуют на устойчивые к другим антибиотикам штаммы, вызывают быструю гибель микроорганизмов, индуцируют развитие резистентности.
Катионные пептиды нейтрализуют отрицательный заряд липополисахаридов бактерий, связываются с ними, препятствуя их взаимодействию с клетками организма, предотвращая таким образом развитие эндотоксического шока у пациентов.
Катионные пептиды слабоиммуногенны, так как имеют общие антигены с макроорганизмом. Разрушаются пептидазами кишечника, поэтому не попадают в окружающую среду.
Низин получают при ферментации L. lactis или рекомбинантного штамма B. subtilis, используют для консервации пищевых продуктов, для лечения мастита у коров.
8.1.8 Другие антибактериальные антибиотики
Описанные ниже антибиотики (рис. 51) не могут быть отнесены ни к одной рассмотренной ранее группе.
Рис. 51. Антибиотики: А — хлорамфеникол; В — фузидиевая кислота; С — линкомицин; Д — клиндамицин.
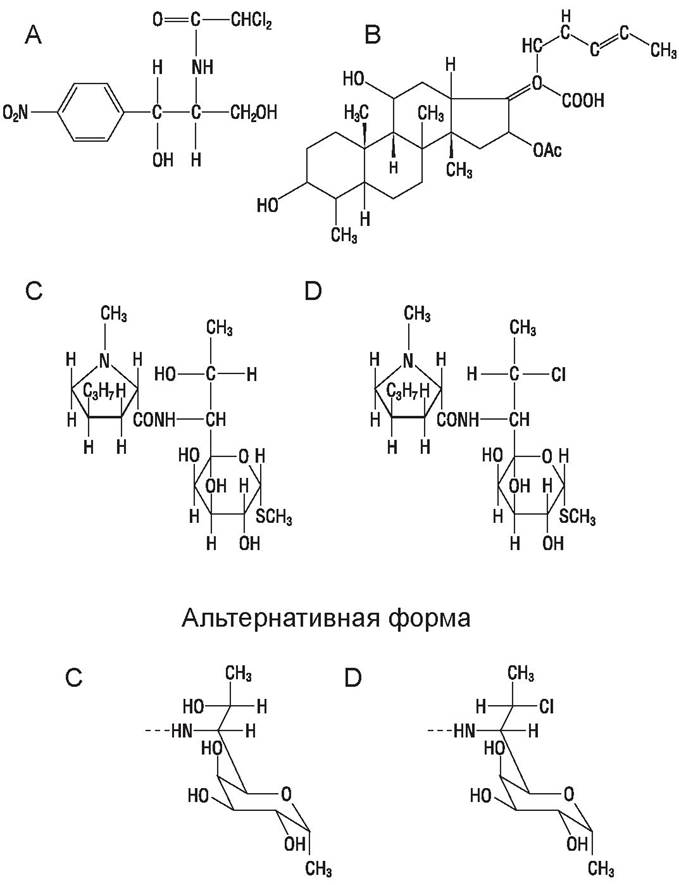
Хлорамфеникол (левомицетин), синтезируемый S. venezuelae, антибиотик широкого спектра, оказывает только бактериостатическое действие, активен против спирохет, риккетсий, хламидий. У части пациентов вызывает апластическую анемию, поэтому рекомендован к применению только при отсутствии альтернативных средств. Его фторированные производные активны против резистентных микроорганизмов.
Фузидиевая кислота, выделяется из культуры гриба Fusidium coccineum, используемая в форме натриевой соли, активна против грамположительных бактерий, особенно стафилококков, хотя стрептококки относительно устойчивы. Действует на полирезистентные штаммы стафилококков, однако, и к этому препарату могут появляться устойчивые формы бактерий.
Линкомицины. Линкомицин (продуцент S. lincolniensis) и его синтетический аналог клиндамицин по спектру активности сходны с макролидами, однако, не эффективны в отношении E. coli. Применение клиндамицина сопряжено с риском чрезмерного размножения в кишечнике Clostridium difficile — возбудителя диарейной инфекции. Возможна перекрестная резистентность между линкомицинами и эритромицином.
8.1.9 Антифунгальные антибиотики
В отличие от большого разнообразия антибактериальных антибиотиков, имеется лишь небольшое количество антифунгальных антибиотиков для системного применения (рис. 52).
Рис. 52. Антифунгальные антибиотики: А — гризеофульвин; В — нистатин; С — амфотерицин В (R=Н) и его метиловый эфир (R=СН3).
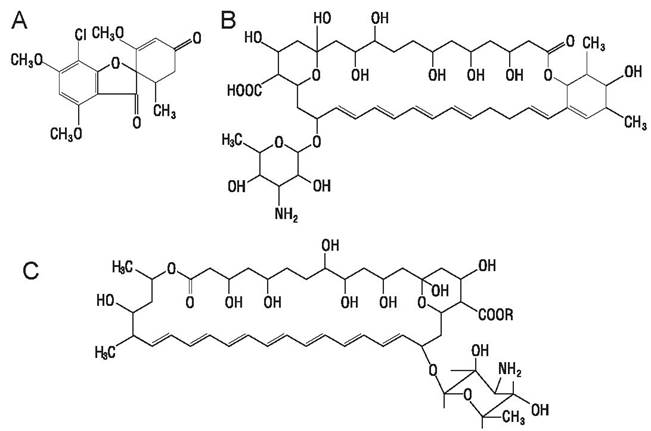
Гризеофульвин продуцируется Penicillium griseofulvum, активен против дерматофитов, не действует на Candida spp. и бактерии. Применяется орально в форме таблеток. Проникает в глубокие слои кожи и кератин волос, поэтому эффективен при терапии дерматомикозов.
Полиены. Полиеновые антибиотики продуцируются стрептомицетами, характеризуются наличием в своей структуре большого лактонного кольца и гидрофобной области, состоящей из последовательности от 4 до 7 конъюгированных двойных связей. Наиболее важные из них — амфотерицин В и нистатин.
Нистатин активен против Candida spp. и применяется при кандидозе ротовой полости и желудочно-кишечного тракта, поскольку плохо всасывается из кишечника и неэффективен при других формах кандидоза.
Амфотерицин В эффективен при системных микозах. Плохо всасывается из кишечника, поэтому его вводят внутривенно под строгим медицинским контролем, учитывая его нефротоксичность. Метиловый эфир амфотерицина менее токсичен с сохранением антифунгальной активности.
Эхинокандины — новый класс антибиотиков, представленный многочисленными продуктами ферментации Aspergillus nidulans и A. rugulosus и их полусинтетическими аналогами. Активны против грибов рода Candida, Aspergillus, Pneumocystis. Это семейство
циклических липопептидов, различающихся боковыми радикалами (остатками жирных кислот) у гексапептидного кольца. Считают, что в ближайшем будущем они найдут клиническое применение.
8.1.10 Синтетические химиотерапевтические препараты
Сульфонамиды — большая группа химиотерапевтических веществ (рис. 53), действуют на стрептококки, E. coli, Proteus mirabilis, обычно неактивны в отношении Pseudomonasaeruginosa, индолположи- тельных штаммов протея и Klebsiella spp. Резистентные штаммы появляются у Staphylococcus aureus, Haemophilus influenzae, Neisseria honorrhoea, N. meningitidis, E. coli, Proteus mirabilis и др.
Рис. 53. Сульфонамиды.
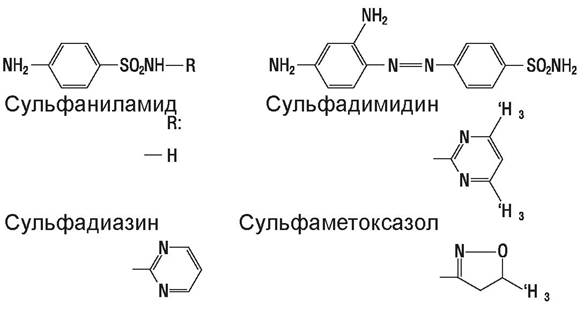
Сульфонамиды различаются по способности всасываться из желудочно-кишечного тракта, например, сульфадимидин и сульфадиазин всасываются быстро, тогда как сукцинилсульфатиазон и фталилсульфатиазол - очень плохо.
Их используют при лечении различных инфекционных заболеваний, вызванных грамположительными и грамотрицательными микроорганизмами.
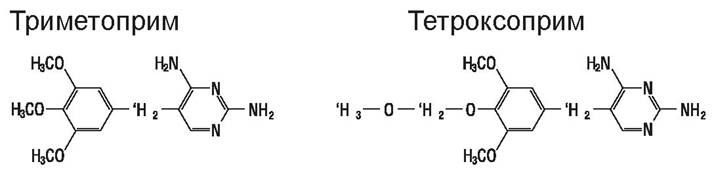
Производные диаминопиримидина (рис. 54) составляют группу веществ с противоопухолевой (метотрексат), антипротозойной (пириметамин) и антибактериальной (триметоприм, тетроксоприм) активностью. Последние обладают широким спектром действия, однако, к ним появляются резистентные формы бактерий.
Рис. 54. Диаминобензилпиримидины.
Производные изоникотиновой кислоты (изониазид, этионамид, протионамид) как и парааминосалициловая кислота (рис. 55) эффективны против микобактерий, применяются при туберкулезе. Этионамид менее активен, чем изониазид, однако действует на устойчивые к изониазиду штаммы бактерий. Протионамид по активности не отличается от этионамида, но лучше переносится больными.
Рис. 55. Парааминосалициловая кислота (А); производные изоникотиновой кислоты: изониазид (В), этионамид (С), протионамид (Д) и пиразинамид (Е).
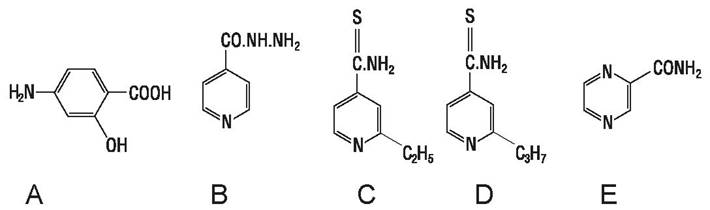
Пиразинкарбоновой кислоты амид — пиразинамид (рис. 55) действует на туберкулезные бактерии, устойчивые к другим противотуберкулезным препаратам.
Соединения нитрафурана. Синтезировано несколько сотен соединений нитрофурана, однако, терапевтическими свойствами обладают лишь немногие из них. При этом важное значение имеет наличие группы -СН=К— у С-2 и нитрогруппы у С-5, менее существенно наличие -СН=СН- у С-2. Биологическая активность утрачивается, если (а) редуцировано нитрокольцо, (б) гидролизована связь -СН=К— или (в) окислена связь -СН=СН-.
Нитрофураны действуют на широкий спектр микроорганизмов. Фуразолидон высокоэффективен против энтеробактерий и применяется при лечении диареи и желудочно-кишечных расстройств бактериальной этиологии. Нитрофурантион используют при инфекции мочевыводящих путей, поскольку препарат концентрируется в моче. Он наиболее активен при кислом значении рН. Нитрофуразон в основном используют местно при обработке ран и ожогов, а также некоторых типов заболеваний уха.
Хинолоны. Налидиксовая кислота применялась некоторое время для лечения инфекций мочевого тракта. В дальнейшем были синтезированы другие, более активные производные 4-хинолона: ципрофлоксацин, норфлоксацин, оксолиновая кислота, офлоксацин, циноксацин и др. (рис. 56).
Рис. 56. Хинолоны: А — норфлоксацин, В — налидиксовая кислота, С — циноксацин.
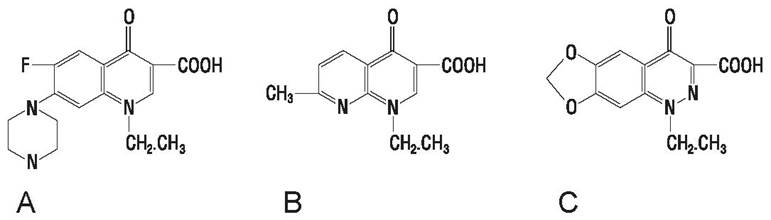
Налидиксовая кислота действует только на грамотрицательные бактерии, тогда как новые производные активны также против стафилококков, но не стрептококков. Норфлоксацин обладает широким спектром действия, концентрируется в моче при оральном применении, что делает его перспективным средством при лечении инфекций мочевыводящей системы.
Производные имидазола (рис. 57). Метронидазол угнетает рост патогенных простейших, например, Trichomonas vaginalis и Entamoeba histolyticum. При оральном применении высокоэффективен при урогенитальных инфекциях, вызванных T. vaginalis. Эффективен против анаэробных бактерий и факультативных анаэробов в анаэробных, но не аэробных условиях. Вводится орально или в форме суппозиториев.
Рис. 57. Производные имидазола: А — метронидазол, В — клотриазол, С — миконазол, Д — эконазол, Е — кетоконазол.
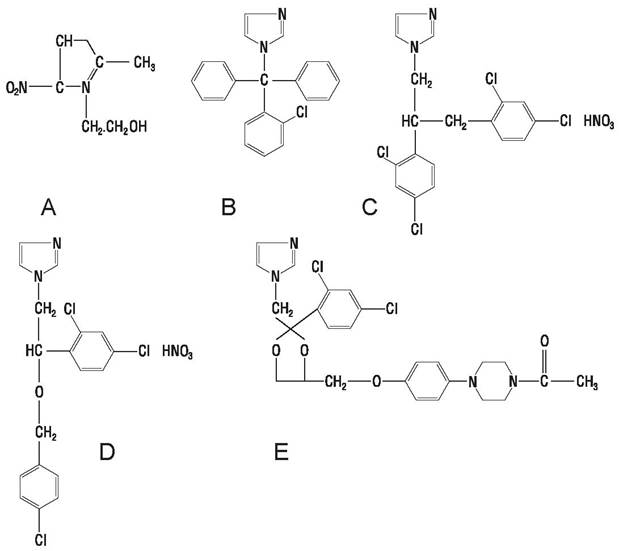
Клотримазол, миконазол, эконазол, кетоконазол активны против патогенных грибов и некоторых бактерий, применяются местно. Не отмечено развития резистентности in vitro или invivo.
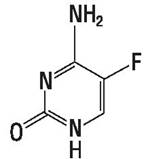
5-фторцитозин (рис. 58) с наибольшей активностью действует на дрожжевые грибы — Candida и Cryptococcus.
Рис. 58. 5-фторцитозин.