ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ II. АНТИМИКРОБНЫЕ АГЕНТЫ
ГЛАВА 10. ПОЛУЧЕНИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ МЕТОДАМИ ГЕНЕТИЧЕСКОЙ И КЛЕТОЧНОЙ ИНЖЕНЕРИИ
10.1 Рекомбинантые ДНК
Генетическая инженерия или технология рекомбинантной ДНК основана на конструировании фрагментов ДНК in vitro с последующим введением новых (рекомбинантных) генетических структур в живую клетку и их экспрессией. Техника генетической инженерии используется при исследовании строения генов организмов, разработке методов генной терапии, методов молекулярной диагностики. Технологию рекомбинантной ДНК используют для создания новых продуцентов антибиотиков, производящих антимикробные препараты с измененными свойствами. Генетическая инженерия дает возможность получать препараты крови от трансгенных животных, производить белки человека путем культивирования рекомбинантных штаммов микроорганизмов (табл. 20).
Таблица 20. Рекомбинантные белки - коммерческие и проходящие клинические испытания препараты
Белок |
Система экспрессии |
Показания к применению |
Инсулин |
E. coli |
Диабет |
Соматотропин |
E. coli |
Гипофизарная карликовость, остеопороз |
Интерферон α2 |
E. coli |
Лейкемия, профилактика простудных заболеваний |
Интерферон γ |
E. coli |
Опухолевые и вирусные заболевания |
Активатор тканевого плазминогена |
E. coli, дрожжи, клетки животных |
Тромбоз |
α1-антитрипсин |
E. coli, дрожжи |
Эмфазема |
Интерлейкин-2 |
E. coli, дрожжи, клетки животных |
Опухолевые заболевания |
Фактор некроза опухоли |
E. coli, клетки животных |
Опухолевые заболевания |
Сывороточный альбумин человека |
дрожжи |
Плазмозаместительная терапия |
Фактор VIII |
клетки животных |
Гемофилия |
Фактор IX |
то же |
Болезнь Кристмаса |
Эритропоетин |
то же |
Анемия |
Поверхностный антиген вируса гепатита В |
дрожжи, клетки животных |
Вакцинация |
10.2 Методы генетического конструирования микроорганизмов in vitro
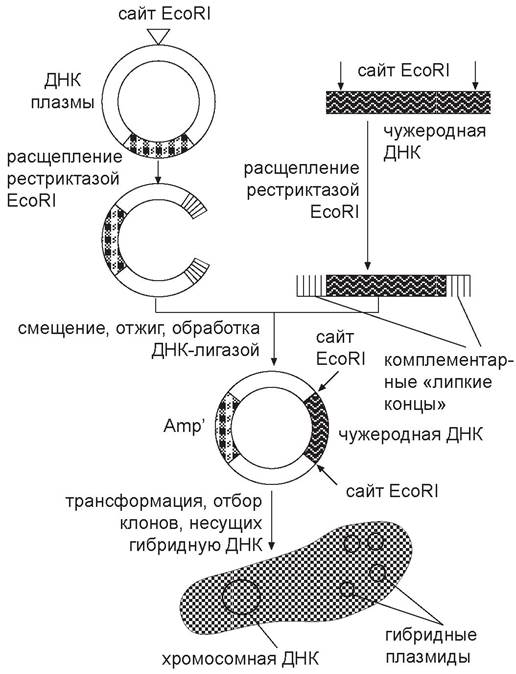
Типовой эксперимент в генетической инженерии состоит из следующих этапов: 1) получение фрагментов ДНК; 2) конструирование in vitro рекомбинантных молекул ДНК, состоящих из фрагментов, полученных на первом этапе, и векторов — небольших автономно реплицирующихся в клетке-реципиенте структур (плазмид, фагов, вирусов); 3) введение рекомбинантных ДНК в клетку-реципиент; 4) отбор клонов, несущих нужную рекомбинантную ДНК (рис. 62).
Рис. 62. Схема типового опыта по генной инженерии: Аmрг — устойчивость к ампицилину — генетический маркер плазмиды.
10.3 Источники ДНК для клонирования
Существуют три источника молекул ДНК, используемых в генетической инженерии: фрагменты генетического материала различных организмов; двунитевые ДНК, полученные на основе однонитевой ДНК, комплементарной мРНК (кДНК); ДНК, полученная путем химико-ферментативного синтеза. Получение кДНК необходимо для экспрессии в бактериях генов белков человека: гены эукариот содержат интроны, а в клетках бактерий отсутствует механизм, обеспечивающий сплайсинг, поэтому применяют специальные приемы для получения ДНК, состоящей из последовательностей нуклеотидов, соответствующих экзонам.
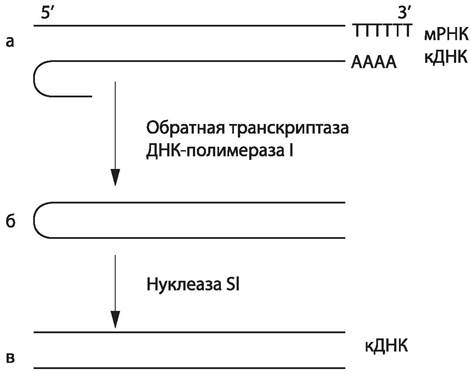
Для синтеза кДНК в качестве матрицы используют зрелую мРНК (не содержащую интронов), которую предварительно полиаденилируют (рис. 63). Далее ее отжигают с олиго-dТ, который служит затравкой при копировании нити обратной транскриптазой. Отжиг — это процесс реассоциации ДНК с образованием водородных связей между парами оснований. После обработки обратной транскриптазой мРНК удаляют щелочным гидролизом. Образовавшаяся кДНК имеет на 3'-конце шпилечную структуру, которая может служить затравкой при построении второй нити ДНК с помощью ДНК-полимеразы. Для удаления олиго-dT и однонитевой петли используют S1-нуклеазу, расщепляющую однонитевую ДНК.
Рис. 63. Схема синтеза двуцепочечной кДНК на мРНК.
10.4 Рестриктазы
Ферменты рестриктазы являются необходимым инструментом при манипулировании с генами. Это специфические эндонуклеазы, которые являются составной частью системы рестрикции — модификации прокариотических клеток. Эта система связана с защитой клеток от проникновения чужеродной ДНК. Система модификации осуществляет метилирование собственной ДНК немедленно после репликации. Чужеродную ДНК, проникающую в клетки, бактерии гидролизуют с помощью рестриктаз. Эти эндонуклеазы связываются с ДНК в определенных участках (сайты узнавания) и расщепляют ее на фрагменты (рестрикты). Собственную ДНК рестриктазы не разрушают, поскольку ее сайты узнавания метилированы. Системы рестрикции-модификации обнаружены у всех исследованных бактерий и у некоторых дрожжей.
Различают три основных класса рестриктаз. Все они узнают на двуспиральной ДНК строго определенные последовательности нуклеотидов. Однако рестриктазы класса I разрывают молекул ДНК в произвольных точках, а классов II и III — в строго определенных точках внутри сайтов узнавания или на фиксированном от них расстоянии. Ферменты классов I и III имеют сложную субъединичную структуру и обладают двумя типами активностей — метилирующей и эндонуклеазной. Ферменты II класса состоят из двух отдельных белков: рестрицирующей эндонуклеазы и модифицирующей метилазы. По этим причинам в генетической инженерии используют исключительно рестриктазы класса II.
Существует общепринятая номенклатура, в соответствии с которой рестриктазы и метилазы обозначаются, соответственно, буквами R и M. Название фермента складывается из первой буквы рода и двух первых букв вида бактерии, из которой он был выделен, например, Bacillus subtilis — Bsu, Escherichia coli — Eco. При необходимости дается типовая характеристика штамма, например, Hinc — фермент из Haemophilus influenzae, серотип C. Если в определенном штамме бактерии имеется несколько систем рестрикции, дается дополнительно цифровое обозначение. Если фермент закодирован в генах плазмиды или фага, к названию фермента добавляется название внехромосомного элемента: EcoRI, EcoPI — ферменты E. coli, кодируемые плазмидой RI и фагом PI, соответственно.
В табл. 21 приведена характеристика некоторых рестриктаз, используемых в генетической инженерии. Разрывы цепей ДНК могут происходить по оси симметрии, и тогда образуются фрагменты с тупыми концами (например, рестриктаза Ball), либо на некотором расстоянии от оси, и тогда образуются фрагменты с однонитевыми липкими 5' (рестриктазы EcoRI) или 3' (рестриктазы PstI) концами.
Таблица 21. Рестриктазы, используемые в генной инженерии.
Обознечение рестриктазы |
Последовательность, узнаваемая рестриктазой |
Обозначение рестриктазы |
Последовательность, узнаваемая рестриктазой |
1 |
2 |
3 |
4 |
EcoRl |
GААТТС СТТАА G |
Хhо l |
С ТСGАG GАGСТ С |
Нind III |
ААGСТТ ТТСGА А |
Нind II |
GРуС GРиС СРuG СруG |
В настоящее время выделено более 500 рестриктаз класса II, однако среди них имеются ферменты, которые узнают в ДНК одни и те же последовательности. Такие группы называют изошизомерами. Различают истинную изошизомерию, когда ферменты узнают одну и ту же последовательность нуклеотидов и разрывают ДНК в одних и тех же точках, и ложную, когда ферменты, узнавая один и тот же сайт на ДНК, производят разрывы в разных точках в пределах того же сайта.
Если предположить, что участки распознавания расположены в цепи ДНК случайно, то мишень для ферментов, узнающих сайт из четырех нуклеотидов, должна встречаться в среднем один раз через каждые 256 по (пар оснований), а для ферментов, узнающих лишь шесть нуклеотидов — через 4096 по. Очевидно, что, если сайт рестрикции окажется внутри гена, обработка рестриктазой приведет к его инактивации. Вероятность такого события очень велика при использовании мелкощепящих рестриктаз и значительна — при употреблении крупнощепящих (узнающих шестерки нуклеотидов). Поэтому для получения неповрежденного гена проводят обработку поочередно несколькими крупнощепящими рестриктазами, либо применяют прием недорестрикции, т. е. обработку в таких условиях, когда происходит расщепление лишь в одном сайте из нескольких возможных.
Особую ценность представляют рестриктазы, под действием которых образуются фрагменты с самокомплементарными липкими концами: они эффективно используются при конструировании рекомбинантных молекул.
10.5 Методы воссоединения фрагментов ДНК
Для соединения фрагментов ДНК, полученных после обработки рестриктазой, используют отжиг, в результате которого образуются водородные связи между комплементарными основаниями липких кон - цов, с последующей обработкой ДНК-лигазой. Лигаза катализирует образование фосфодиэфирной связи между соседними нуклеотидами. Наличие липких концов не является обязательным условием для воссоединения фрагментов ДНК-лигазой. Имеются ферменты, способные соединять полностью двунитевые фрагменты, однако эта реакция протекает лишь при высоких концентрациях ДНК и лигазы [27].
При объединении ДНК донора и вектора при отжиге и лигировании образуются не только гибридные молекулы, но и исходные векторы, что затрудняет дальнейшую работу по клонированию ДНК донора. Поэтому разработаны специальные методы, позволяющие направить процесс преимущественно на получение гибридных молекул. Один из них основан на ращеплении ДНК вектора несколькими рестриктазами, чтобы уменьшить вероятность самосборки вектора. Другой эффективный метод заключается в отщеплении концевых фосфатных групп от линейной ДНК вектора при действии щелочной фосфатазы. Образование лигазой кольцевых молекул ДНК в этом случае возможно только в присутствии фрагментов донорной ДНК, имеющих неповрежденные 5'-фосфатные группы. (рис. 64)
Рис. 64. Схема использования линкерных молекул для конструирования гибридных ДНК. [27].
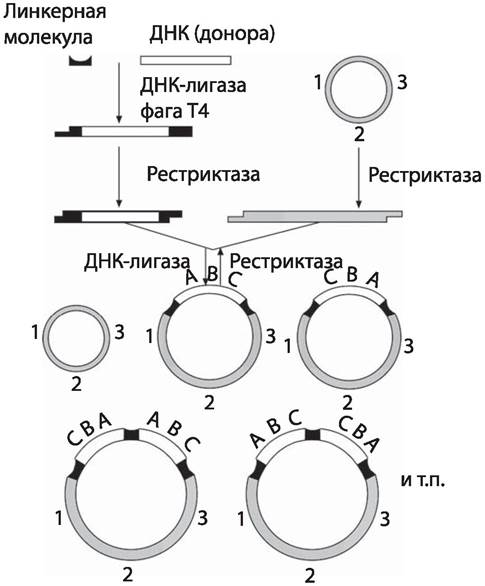
Идентичные взаимокомплементарные концы двух молекул ДНК, подлежащих объединению, могут быть получены при гидролизе этих молекул одной и той же рестриктазой. Однако часто возникает необходимость клонировать фрагменты ДНК, полученные расщеплением одной рестриктазой, в векторе, имеющем сайт расщепления для другой рестриктазы. Для этого существует метод, позволяющий рекомбинировать практически любые фрагменты ДНК. Он предусматривает использование линкеров — коротких синтетическихдвухцепочечных олигонуклеотидов, имеющих сайты узнавания для определенной рестриктазы. Линкеры пришивают с помощью лигазы по концам молекулы ДНК, подлежащей клонированию, и обрабатывают рестриктазой, в результате чего образуются липкие концы. Этой же рестриктазой гидролизуют молекулу вектора. В результате отжига и обработки лигазой получают рекомбинантные молекулы ДНК. Линкерная молекула может иметь больше, чем один сайт узнавания рестриктазой. Тогда ее называют полилинкером или адаптером. Применение таких молекул делает ре- стриктазно-лигазный метод рекомбинации ДНК универсальным, поскольку исходные фрагменты можно получить самыми различными способами.
Коннекторный метод воссоединения фрагментов основан на свойстве фермента — терминальной дезоксирибонуклеотидилтрансферазы — достраивать нуклеотидные последовательности к 3'-ОН- концам фрагментов ДНК. К концам одного из соединяемых фрагментов ДНК присоединяют однонитевой полинуклеотид, например, поли-А (dA), а к концам другого — комплементарный ему, например, поли-T (dT). Достроенные таким образом фрагменты смешивают и отжигают. Возможные бреши ликвидируют обработкой ДНК-полимеразой и лигазой, в результате чего получают ковалентно замкнутые кольцевые молекулы.
10.6 Векторы
Векторами называют молекулы ДНК, способные переносить в клетку-реципиент чужеродную ДНК и обеспечить ее экспрессию. В векторные молекулы с помощью ферментов встраивают определенные гены. Такие молекулярные гибриды называются химерами или рекомбинантными молекулами ДНК. Их вводят в реципиентные клетки, в результате чего происходит разделение молекул. Каждый из выделенных клонов содержит индивидуальную рекомбинантную ДНК. Эта процедура называется клонированием рекомбинантных молекул ДНК (клонированием генов).
Чтобы стабильно существовать в клетке, вектор должен быть репликоном (автономно реплицироваться в клетке). Вектор должен иметь один или несколько маркеров, позволяющих фенотипически определять его присутствие в клетке-реципиенте. Для обеспечения воссоединения с ДНК донора в векторной молекуле необходимо присутствие сайтов расщепления рестриктазами, которые должны локализоваться в области, не существенной для репликации вектора. Кроме того, важно, чтобы вектор допускал вставку донорной ДНК различной молекулярной массы и давал большое число копий на клетку, что облегчает выделение и очистку рекомбинантной ДНК. Лучше всего разработана система векторов для E. coli в качестве реципиента. Она включает следующие типы векторов: плазмиды, бактериофаг λ, космиды, фазмиды и бактериофаг М13.
Созданы векторы и для других микроорганизмов, в том числе важных для промышленности (Bacillus, Pseudomonas, Streptomyces и др.). Особенно удобны двурепликонные (челночные) гибридные векторы, системы репликации которых принадлежат плазмидам, имеющим разных хозяев. Они способны реплицироваться в различных клетках, например, в E. coli, дрожжей или животных. Это позволяет все предварительные операции по клонированию проводить в E. coli с последующим перенесением рекомбинантной ДНК в нужный объект.
10.6.1 Плазмиды
Плазмиды — это внехромосомные генетические элементы, которые существуют обычно в виде замкнутых кольцевых суперспиральных молекул ДНК (рис. 62). В качестве векторов используют чаще всего небольшие плазмиды размером 2-10 тпн. Плазмида содержит специальный участок инициации репликации (ori).
В качестве маркеров плазмида может содержать гены, определяющие устойчивость бактерии к антибиотикам. Вставка чужеродного (донорного) гена в маркерный ген приводит к инактивации последнего. Это позволяет отличить трансформированные клетки, получившие векторную плазмиду (утратившие устойчивость к антибиотику), от клеток, получивших рекомбинантную молекулу (сохранившие устойчивость). Этот прием называется инактивацией маркера в результате вставки.
Созданы векторы, позволяющие производить прямой отбор клонов, несущих гибридные молекулы. Для этого используют гены, ответственные за гибель клеток в определенных условиях или кодирующие синтез фермента, определяющего окраску колонии на селективной среде. Клонирование чужеродной ДНК в таком гене приводит к его инактивации, что проявляется в фенотипе.
Недостатком многих плазмид является снижение выхода рекомбинантов с ростом молекулярной массы вставки. Поэтому клонирование в плазмидах фрагментов ДНК, превышающих 10 тпо малоэффективно.
Плазмиды вводят в бактериальные клетки методом трансформации. В трансформации участвует одна из 1000-10000 молекул ДНК.
10.6.2 Векторы на основе бактериофага X
Геном фага λ представлен двуцепочечной ДНК, размером 48,5 тпн, которая упакована в головку фага в виде линейной молекулы с липкими концами длиной 12 по. В клетке хозяина (E. coli) липкие концы объединяются и ДНК замыкается в кольцо. Возможность создания векторов на основе фага λ связана с тем, что
гены центральной части несущественны для литического развития и могут быть замещены фрагментами чужеродной ДНК. Рекомбинантная ДНК может быть упакована в капсид invitro, поэтому ее вводят в клетку хозяина методом инфекции (трансдукции), что намного эффективнее трансформации (инфекционной становится каждая десятая молекула ДНК). В капсид пакуется ДНК определенного размера — не выше 53 и не ниже 38 тпо, поэтому фаговые векторы имеют верхний и нижний пределы размеров клонируемых фрагментов ДНК.
Векторы на основе фага X удобны для создания клонотек (банка генов), но не для тонких манипуляций с фрагментами ДНК. Для детального изучения и преобразования фрагменты ДНК переклонируют в плазмиды.
10.6.3 Космиды
Космиды — это плазмиды, несущие cos-участок (комплементарные липкие концы) ДНК фага X. Наличие cos-участка позволяет производить упаковку ДНК в головку фага in vitro, поэтому они могут быть введены в клетку путем инфекции, а не трансформации. В космидных векторах можно клонировать фрагменты чужеродной ДНК размером от 33 до 49 тпо. Космиды — векторы с наибольшей емкостью, поэтому они специально предназначены для клонирования больших фрагментов эукариотической ДНК и создания клонотек геномов.
10.6.4 Фазмиды
Фазмидами называют гибриды между фагами и плазмидами, способные развиваться как фаг и как плазмида. По клонирующей емкости фазмиды сравнимы с векторами на основе фага X и значительно уступают космидам. Однако регулируемая возможность развития по фаговому или плазмидному пути дает им ряд преимуществ, главное из которых — относительная простота комплементационного анализа и реорганизации фрагментов ДНК. Фазмиды дают возможность отказаться от переклонирования генов из фаговых в плазмидные векторы.
10.6.5 Векторы на основе бактериофагов, содержащих одноцепочечную ДНК
Лучшие векторы такого типа разработаны на основе фага М13. Фаговая частица содержит одноцепочечную ДНК длиной 6500 нуклеотидов. После проникновения в клетку хозяина ДНК превращается в двухцепочечную репликативную форму (РФ), которую выделяют из клеток и используют как вектор. В инфицированной клетке накапливается 100-200 копий РФ ДНК. После этого синтез становится асимметричным и синтезируется лишь одна нить ДНК, которая входит в состав зрелого фага. Фаг М13 не убивает клетку, а лишь замедляет ее развитие. Частицы зрелого фага непрерывно выделяются в среду и их титр может достигать 1012 в 1 мл.
Основное преимущество фага М13 как вектора заключается в том, что выделяемые клеткой частицы бактериофага содержат одноцепочечную ДНК, гомологичную одной из двух комплементарных цепей клонируемой ДНК. Такая ДНК может быть непосредственно использована для определения последовательности оснований ДНК (секвенирование).
10.6.6 Клетка-реципиент
Клетка-хозяин — это та среда, в которой может функционировать рекомбинантная молекула ДНК. В качестве реципиента рекомбинантной ДНК часто используют E. coli — микроорганизм, хорошо изученный и применяющийся в разнообразных исследованиях в области генетики и молекулярной биологии. Но для целей биотехнологии E. coli не представляется идеальным продуцентом по следующим причинам. E. coli входит в состав нормальной микробиоты человека, поэтому опасно заражение обслуживающего персонала рекомбинантным штаммом с нежелательными для человека свойствами. Помимо этого, E. coli чувствительна к фагам, образует пирогены и не выделяет продукты биосинтеза в культуральную среду, что затрудняет их очистку. Поэтому перспективны другие микроорганизмы — бациллы (Bac. subtilis, Bac. stearothermophilus, Bac. brevis), стрептомицеты, дрожжи (Saccharomyces cerevisiae). Используют также культуры клеток млекопитающих, которые дают продукты, аналогичные природным, что полезно при получении препаратов человеческого белка. Однако широкому применению подобных реципиентов препятствуют трудности их культивирования (медленный рост, высокая стоимость питательных сред, опасность бактериальной и вирусной контаминации).
10.7 Введение молекул ДНК в клетки
Система клонирования состоит из двух компонентов — вектора и реципиентных клеток. Реципиентные клетки служат для выделения из смеси нужного типа рекомбинантных молекул, для последующей идентификации клонируемых генов и получения генов или их продуктов. В качестве реципиентных используют пермиссивные клетки, т. е. клетки, обеспечивающие репликацию рекомбинантной ДНК.
Способ введения ДНК в клетки определяется природой вектора. Плазмидные векторы вводят путем трансформации, фаговые — путем трансфекции или трансдукции. Возможна также передача ДНК путем конъюгации.
Трансфекция — это процесс, при котором фаговая ДНК поступает в бактериальные клетки с последующим образованием вирусного потомства. Вирусные
клоны, полученные в результате трансфекции называются трансфектантами. Их выделяют из негативных колоний после высева реципиентных клеток на газон культуры, чувствительной к данному фагу.
Трансформация — это процесс генетической рекомбинации, при котором чужеродная ДНК поступает в клетку-реципиент. Генетически трансформированные клетки называют трансформантами. Клетки, способные адсорбировать и поглощать ДНК, называются компетентными. Количество компетентных клеток в популяции зависит от видовой принадлежности микроорганизма, условий его культивирования, стадии развития и т. п. Компетентные клетки отличаются изменением свойств клеточной оболочки, у них снижен поверхностный заряд, повышена чувствительность к осмотическому шоку. Последнее связано с тем, что у компетентных клеток частично обнажены участки цитоплазматической мембраны, которая принимает непосредственное участие в адсорбции и поглощении ДНК. Особая роль в этих процессах принадлежит мезосомам и трансформасомам — производным цитоплазматической мембраны, участвующим в переносе ДНК в цитоплазму.
Компетентность можно повысить или индуцировать ее у микроорганизмов, лишенных естественной компетентности, путем специальной обработки клеток. Широко применяется метод индукции компетентности у E. coli с помощью ионов кальция. Клетки выдерживают в присутствии 50 мМ Са2+ при 0°С с последующим кратковременным тепловым воздействием при 37 или 42°С. В этих условиях возникает состояние общей компетентности и возможность трансформации и трансфекции. Эффективно также совместное воздействие ионов Са2+ с Мg2+, Mn2+ и Rb+, индуцирующее компетентность у многих грамотрицательных и грамположительных бактерий. Клетки дрожжей и мицелиальных грибов становятся компетентными после обработки их солями лития. К физическим методам индукции компетентности относятся их глубокое замораживание (-196°С) и оттаивание (+42°С), а также электропорация. Суть последнего метода заключается в том, что кратковременное воздействие (5-20 мс) электрического поля высокой напряженности (1-15 кВ/см) на клеточную мембрану приводит к образованию в ней пор (электропробой), достаточных для проникновения ДНК в клетку.
Эффективно использование для трансформации и трансфекции протопластов и сферопластов.
10.8 Методы идентификации клонов, содержащих рекомбинантные молекулы
В большинстве экспериментов по молекулярному клонированию в результате действия рестриктаз получается сложная смесь фрагментов ДНК. Существуют специальные приемы, позволяющие отобрать клоны, содержащие рекомбинантные молекулы ДНК. Например, при использовании фазмид, дают урожай исключительно фаговые частицы, в головки которых пакуются рекомбинантные молекулы. При применении плазмид отбирают клоны с рекомбинантными ДНК по инактивации одного из маркеров вектора и т. д. Следующая, более трудная задача состоит в том, чтобы найти среди рекомбинантов клон, несущий нужный исследователю ген.
Методы скрининга рекомбинантных клонов могут быть основаны на изменении фенотипа клетки под влиянием вновь синтезированного продукта рекомбинантного гена, либо на свойствах самого продукта. Одним из таких приемов является тест на комплементацию, который применяется в том случае, когда клонируемый ген обеспечивает комплементацию мутаций генома клетки, например, ее переход из ауксотрофного в прототрофное состояние. При этом гибрид может быть обнаружен простым отбором на селективной среде.
Если продукт гена, т. е. белок, вырабатывается в достаточных количествах, возможен отбор нужного клона иммунологическим методом. Метод прямой радиоиммунологической детекции колоний заключается в следующем. Колонии клеток лизируют на поверхности агара, затем отпечатывают на поливиниловую пластинку, на которой адсорбированы антитела к белку искомого гена. Далее эту пластинку обрабатывают антителами, меченными I125. Так образуется комплекс белка-антигена с двумя молекулами антител, одна из которых присоединена к пластинке, а другая мечена йодом. Образование комплекса тестируется радиоавтографически. Метод очень чувствителен и дает положительный ответ при наличии в клетке всего одной или нескольких молекул белка.
При отсутствии экспрессии гена в клетках реципиента клоны могут быть идентифицированы по первичной структуре ДНК или по характеру белка, синтезированного в подходящей системе (ооциты лягушки, бесклеточные экстракты). Тестирование первичной структуры ДНК осуществляется гибридизацией с меченой мРНК.
Используя метод гибридизационной селекции, денатурируют плавлением клонированную ДНК, иммобилизуют ее на твердой поверхности и гибридизуют с мРНК. Дуплекс ДНК — РНК нагревают для освобождения мРНК, которую затем добавляют в бесклеточную белок синтезирующую систему или вводят в ооциты лягушки для трансляции. Продукты трансляции идентифицируют по биологической активности или иммунологическим методам.
Если известна первичная структура гена или кодируемого им белка, для скрининга клонов можно использовать синтетические олигонуклеотиды — зонды, комплементарные искомому гену. Зонды имеют радиоактивную метку, которая позволяет обнаружить их присутствие при связывании с искомым фрагментом ДНК.
10.9 Клеточная инженерия
Клеточная инженерия — это важный раздел новой биотехнологии, объектами манипулирования которой являются культуры клеток растений, животных, человека, а также клетки микроорганизмов. Культуры клеток высших организмов могут быть использованы для производства вакцин, моноклональных антител и других иммунологических препаратов, регуляторов роста при выведении новых сортов растений. Получение протопластов дает возможность конструировать генетически новые объекты путем клеточной гибридизации или вводить в них чужеродный генетический материал.
Протопласты — это структуры, которые образуются после полного удаления клеточной стенки. Неполное удаление клеточной стенки приводит к образованию сферопластов. В клеточной инженерии используют как протопласты, так и сферопласты. Однако в ряде случаев эксперименты со сферопластами оказываются менее эффективными, чем с протопластами.
Трансформация протопластов является универсальным способом введения молекул ДНК в клетки бактерий, актиномицетов, дрожжей и грибов.
С помощью слияния протопластов можно получать генетические рекомбинанты у тех видов микроорганизмов, которые в естественных условиях никогда не скрещиваются между собой. Таким образом возможно получение гибридных форм у микроорганизмов, имеющих важное значение для микробиологической промышленности, что создает предпосылки для их генетического изучения и расширяет возможность для селекционной работы. Метод слияния протопластов позволяет объединить в одном геноме мутации, положительно влияющие на продуктивность и полученные в разных селекционных линиях, в том числе и такие, которые трудно или даже невозможно индуцировать в одной и той же клетке, а также избавляться от вредных мутаций.
Метод слияния протопластов как способ генетического обмена отличается от конъюгации, трансдукции и трансформации, при которых в реципиентную клетку попадает лишь часть ДНК донора, тем, что при слиянии протопластов объединяются целые геномы и все компоненты цитоплазмы родительских клеток. Кроме того, в акте слияния могут участвовать более двух протопластов разных штаммов и в результате сразу получаются рекомбинанты, несущие признаки всех родителей.
Для получения протопластов у микроорганизмов (протопластирования) используют несколько методов. Одни из них основаны на подавлении синтеза клеточной стенки. Для бактерий используют вещества, нарушающие образование муреина: пенициллин, фосфомицин, высокие концентрации аминокислот глицина, метионина, треонина и др.; для дрожжей — 2-дезокси- глюкозу, аналог глюкозы, препятствующий образованию у них клеточной стенки.
Вторая группа методов включает ферментативный лизис клеточной стенки. Лизоцим, гидролизующий муреин, используют для получения протопластов у бактерий, часто в сочетании с другими ферментами (протеазами, липазами) и ЭDТА (этилендиаминтетраацетатом). Для протопластирования мицелиальных грибов и дрожжей применяют литические ферменты из актиномицетов, грибов или пищеварительный сок виноградной улитки — (геликазу), который содержит несколько десятков различных ферментов. Используют также смеси, состоящие из геликазы, целлюлазы, хитиназы, пектиназы и других ферментов.
Можно подвергать ферментной обработке клетки, выращенные на среде с ингибитором синтеза клеточной стенки.
Протопласты являются осмотически хрупкими структурами. Поэтому всю работу с протопластами проводят в гипертонических растворах с осмотическими стабилизаторами в концентрации 0,2-0,5 моль. Осмотическими стабилизаторами могут служить минеральные соли (KCl, NaCl, NH4 Cl, NaNO3), соли органических кислот (сукцинат натрия), многоатомные спирты (маннитол, сорбитол), углеводы (сахароза, рамноза, ксилоза и др.).
Образование и сохранение протопластов зависят от температуры, рН среды, концентрации литического фермента и времени инкубирования с ним, возраста и фазы роста протопластируемой культуры.
В генетическом аппарате протопластов содержится вся информация, необходимая для восстановления (регенерации) клеточной стенки и для возвращения их (реверсии) к клеточной форме с характерной морфологией. Процесс реверсии также зависит от состава среды, температуры, рН, присутствия витаминов, микроэлементов, белков-протекторов (желатин, белки сыворотки крови). Для регенерации клеточной стенки необходим контакт протопластов с каким-либо поддерживающим каркасом, поэтому регенерацию проводят не в жидких средах, а на питательном агаре.
Эффективным индуктором слияния протопластов является полиэтиленгликоль (ПЭГ). Поверхность клеток и протопластов заряжена отрицательно и окружена водным слоем. Действие ПЭГ заключается в снижении поверхностного заряда и удалении воды, что создает условия для тесного контакта и слипания мембран. В местах слипания происходит разрыв мембран и содержимое двух соседних протопластов объединяется. ПЭГ — универсальный агент, вызывающий слияние протопластов различных видов микроорганизмов и обеспечивающий их трансформацию и трансфекцию. Чаще всего применяют полимер со средней молекулярной массой 1000-600 Да в концентрации 30-50% (масса/объем). При этом осмотические стабилизаторы можно не использовать, поскольку их функцию выполняет сам ПЭГ. Слияние подавляется высокими концентрациями ионов Na+, K+, Cl-, NO3-и небольшими примесями EDTA. Слияние протопластов идет уже при 4°С и эффективность его увеличивается при повышении температуры до 30°С. Центрифугирование повышает частоту слияния.
В опыты по слиянию протопластов берут генетически маркированные штаммы, часто несущие мутации ауксотрофности и устойчивости к антибиотикам. Продукты слияния — фузанты (от англ. fusion — слияние) отбирают на селективных средах.
Протопластирование и регенерация протопластов могут приводить к утрате плазмид, хромосомным перестройкам и мутациям, среди которых могут быть и полезные.